膀胱癌患者的血清miR-1305和miR-145表达水平及其临床意义▲
2023-11-07王镭播岑壮顶
何 伟 胥 丰 王镭播 岑壮顶
(北京积水潭医院贵州医院外科,贵州省贵阳市 550014)
膀胱癌是常见的泌尿系统恶性肿瘤,2020年全球约有57万例膀胱癌新发病例,死亡病例约21万例[1]。目前膀胱癌的治疗手段包括膀胱肿瘤电切术或根治术、化疗、放疗等,但是该病复发率高,容易出现远处转移及局部浸润[2]。膀胱癌患者的病情发展比较隐匿,虽然早期可表现出血尿等临床症状,但疾病的早期诊断水平总体较低[3]。因此,探索膀胱癌的新型生物标志物及有效治疗靶点至关重要。miRNA已被证实与多种人类肿瘤的发生、发展密切相关[4]。miRNA在血清或血浆中具有较高的稳定性,是诊断肿瘤的潜在新型标志物。miR-1305在调节干细胞增殖、分化和迁移中发挥重要作用[5]。研究表明,过表达miR-1305可抑制非小细胞肺癌细胞增殖,并促进细胞凋亡[6]。miR-145是近年来研究较多的与肿瘤相关的miRNA,其在多种肿瘤中具有抑制癌细胞生长的作用,可作为抑癌基因参与癌症发生、发展的过程[7]。但是否可以通过血清miR-1305、miR-145表达水平来预测膀胱癌的发生及判断预后,目前的相关研究较少。因此,本研究主要分析膀胱癌患者的血清miR-1305、miR-145表达水平及其与患者临床病理特征、预后的关系,以及其在膀胱癌诊断中的应用价值。
1 资料与方法
1.1 临床资料 选取2017年1月至2019年1月在我院住院治疗的83例膀胱癌患者作为研究对象。纳入标准:(1)术后病理检查结果符合膀胱癌诊断标准[8];(2)首次确诊;(3)术前未接受手术、化疗、放疗;(4)患者及家属对本研究知情同意。排除标准:(1)合并尿路感染、尿路结石等泌尿系统疾病者;(2)伴有免疫性疾病或血液系统疾病者;(3)拒绝随访者;(4)伴有心、肝、肾功能严重损伤者;(5)一般资料不完整者。83例膀胱癌患者中,男性52例、女性31例;年龄38~80(62.41±6.23)岁,其中<60岁者42例,≥60岁者41例;肿瘤类型为肌层浸润型32例,非肌层浸润型51例;肿瘤位置位于膀胱体28例,膀胱底35例,三角区20例;肿瘤直径≤3 cm者46例,>3 cm者37例;肿瘤浸润未侵及浆膜层(浅层)38例,侵及浆膜层(深层)45例;肿瘤分期为Ⅰ+Ⅱ期38例,Ⅲ+Ⅳ期45例;发生淋巴结转移50例,未发生淋巴结转移33例;肿瘤高/中分化程度46例,肿瘤低分化程度37例。选取同期于本院进行体检的83例健康志愿者作为对照组,其中男性51例、女性32例,年龄38~80(62.61±6.33)岁。两组研究对象的性别分布及年龄差异无统计学意义(P>0.05),具有可比性。本研究经我院医学伦理委员会批准。
1.2 血清miR-1305、miR-145表达水平的检测 于患者入院后第2天清晨、健康志愿者体检当天,采集其空腹静脉血3 mL,经4 ℃、3 000 r/min离心10 min后分离血清,于-80 ℃保存。按照RNA提取试剂盒(北京盒子生工科技有限公司,货号:AKNA001-1)操作说明书,采用TRIzol法提取血清总RNA。采用反转录试剂盒(QIAGEN公司,货号:205311)将RNA反转录为cDNA后,以U6为内参基因,采用实时荧光定量PCR仪(Applied Biosystems公司,型号:ABI 7500)进行扩增。反应体系共20 μL,包括2×SYBR qPCR Green Master Mix(北京索莱宝科技有限公司,货号:SR1110)10 μL、PCR上下游引物(10 μmol/L)各0.5 μL、cDNA(50 ng/μL)2 μL,加ddH2O至20 μL。PCR反应条件:95 ℃预变性5 min;95 ℃变性 30 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环;72 ℃再延伸10 min。U6上游引物为5′-GCTGGACTCTAGGGTGCAAG-3′,下游引物为5′-GAGCATACCAGGTGGTAGTAG-3′;miR-1305上游引物为5′-ACAGGCCGGGACAAGTGCAATA-3′,下游引物为5′-GCTGTCAACGATACGCTACGTAACG-3′;miR-145上游引物为5′-GTCCAGTTTTCCCAGG-3′,下游引物为5′-GAGCAGGCTGGAGAA-3′。引物由生工生物工程(上海)股份有限公司合成。采用2-ΔΔCt法计算miR-1305、miR-145的相对表达水平。
1.3 随访 术后对所有患者进行随访,每月至少进行1次电话或微信随访,半年至少进行两次门诊随访,随访时间为3年。随访截止时间为2022年1月30日或患者出现因膀胱癌死亡时。
1.4 统计学分析 采用SPSS 25.0软件进行统计学分析。计数资料以例数(百分比)表示,组间比较采用χ2检验;计量资料以(x±s)表示,组间比较采用两独立样本t检验;采用受试者工作特征(receiver operating characteristic,ROC)曲线分析血清miR-1305、miR-145表达水平诊断膀胱癌的临床价值,采用Z检验比较不同指标之间的曲线下面积(area under the curve,AUC);采用Kaplan-Meier法进行生存分析,采有log-rank检验比较生存曲线之间的差异;采用多因素COX回归模型分析膀胱癌患者预后的影响因素。以P<0.05表示差异有统计学意义。
2 结 果
2.1 两组研究对象血清miR-1305、miR-145表达水平的比较 膀胱癌组的血清miR-1305、miR-145表达水平低于对照组(P<0.05),见表1。
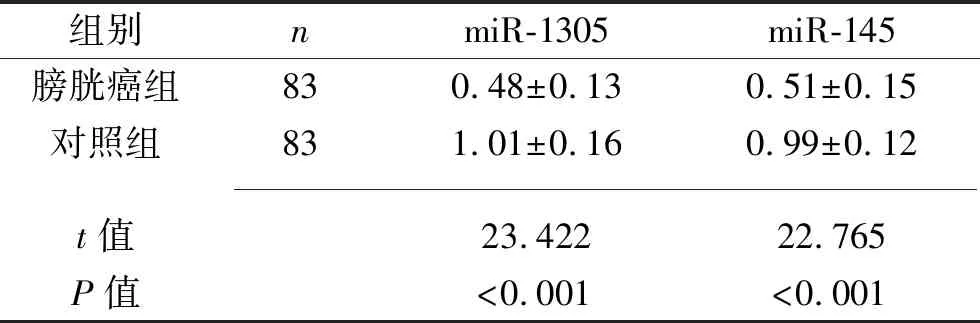
表1 两组研究对象血清miR-1305和miR-145相对表达水平的比较(x±s)
2.2 膀胱癌患者血清miR-1305、miR-145表达水平与其临床病理特征的关系 根据膀胱癌患者血清miR-1305、miR-145表达水平的中位值(分别为0.45、0.50),将其分为高表达患者(n=41)和低表达患者(n=42)。TNM分期为Ⅲ+Ⅳ期、发生淋巴结转移、分化程度为低分化的膀胱癌患者血清miR-1305、miR-145高表达的比例均分别低于TNM分期为Ⅰ+Ⅱ 期、未发生淋巴结转移、分化程度为中/高分化者,且肿瘤直径>3cm的膀胱癌患者血清miR-1305高表达的比例低于肿瘤直径≤3cm者(P<0.05),见表2。
2.3 血清miR-1305、miR-145表达水平与膀胱癌患者预后的关系 血清miR-1305高表达、低表达患者的3年生存率分别为87.80%、69.05%,血清miR-145高表达、低表达患者的3年生存率分别为90.24%、66.67%,血清miR-1305、miR-145高表达患者的3年生存率分别高于血清miR-1305、miR-145低表达患者(χ2=4.628,P=0.031;χ2=6.675,P=0.010),见图1、图2。

图1 不同血清miR-1305表达水平膀胱癌患者的生存曲线图
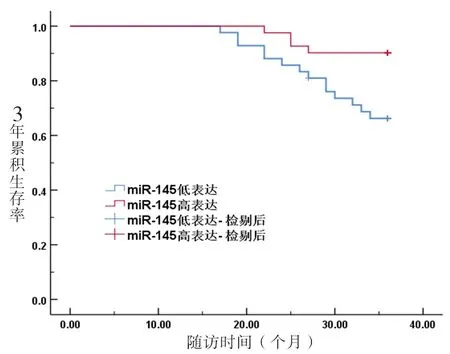
图2 不同血清miR-145表达水平膀胱癌患者的生存曲线图
2.4 膀胱癌患者预后影响因素的多因素COX回归分析 以膀胱癌患者术后3年内的预后为因变量(死亡=1,生存=0),以TNM分期(“Ⅰ+Ⅱ期”赋值“0”,“Ⅲ+Ⅳ期”赋值“1”)、淋巴结转移(“否”赋值“0”,“是”赋值“1”)、肿瘤分化程度(“中/高分化”赋值“0”,“低分化”赋值“1”)、血清miR-1305表达水平(“miR-1305低表达”赋值“0”,“miR-1305高表达”赋值“1”)、血清miR-145表达水平(“miR-145低表达”赋值“0”,“miR-145高表达”赋值“1”)为自变量,进行多因素COX回归分析。结果显示,TNM分期为Ⅲ+Ⅳ期、淋巴结转移是膀胱癌患者死亡的危险因素,血清miR-1305高表达、miR-145高表达是其保护因素(P<0.05),见表3。
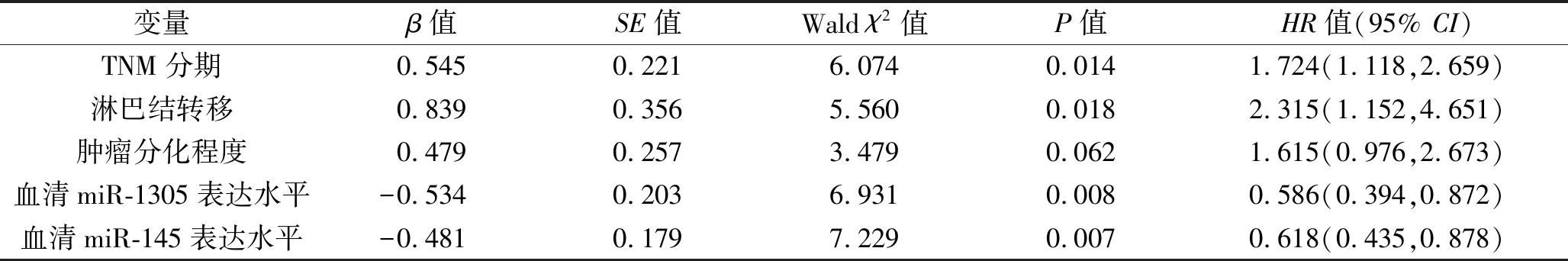
表3 多因素COX回归分析结果
2.5 血清miR-1305、miR-145表达水平对膀胱癌的诊断价值 血清miR-1305表达水平诊断膀胱癌的AUC为0.779,敏感度为93.98%,特异度为60.24%,最佳截断值为0.61;血清miR-145表达水平诊断膀胱癌的AUC为0.783,敏感度为68.67%,特异度为79.52%,最佳截断值为0.63;二者联合诊断(并联)的AUC为0.874,敏感度为90.36%,特异度为74.70%。二者联合诊断的AUC大于血清miR-1305、miR-145表达水平单独诊断(Z=2.810,P=0.005;Z=2.686,P=0.007),见图3。

图3 血清miR-1305、miR-145表达水平单独和联合诊断膀胱癌的ROC曲线图
3 讨 论
膀胱癌的主要类型为肌层浸润型膀胱癌和非肌层浸润型膀胱癌,其中非肌层浸润型膀胱癌患者容易出现远处转移,预后往往不佳[9]。随着医疗技术的进步,目前治疗膀胱癌的手段可在一定程度上延长患者的生存时间,但是由于膀胱癌的临床症状较为隐匿,早期诊断的难度较大。诊断膀胱癌的“金标准”为膀胱镜检联合病理检查,但是其侵入性给患者带来极大的痛苦与不适[10]。实验室尿检具有较高的特异度,但是其灵敏度极低,容易出现漏诊[11]。因此,寻找较高效能的血清标志物对膀胱癌的早期诊断及预后改善具有重要意义。
miRNA是一类保守非编码RNA,其通过调控下游靶基因广泛参与多种生物过程,包括细胞增殖、细胞分化、胚胎发育及应激反应等[12]。研究表明,miRNA可作为肿瘤抑制因子或促癌因子在调控癌症进展中发挥重要作用[13]。例如,有学者指出,miR-1305在非小细胞肺癌组织中的表达下调,miR-1305表达降低与患者预后不良显著相关,其通过靶向鼠双微体2基因来抑制非小细胞肺癌细胞的增殖[6]。He等[14]报告,宫颈鳞状细胞癌组织中miR-1305水平降低,其通过抑制淋巴特异性解旋酶抗体来抑制宫颈鳞状细胞癌细胞的增殖、迁移和侵袭。Su等[15]发现,环状RNA circRIP2可对miR-1305发挥海绵作用,从而使膀胱癌细胞中的转化生长因子β2水平升高,并激活磷酸化Smad3,进而加速膀胱癌进展。本研究结果显示,膀胱癌患者的血清miR-1305表达水平低于健康志愿者(P<0.05),这可能是因为miR-1305表达下调可促进转化生长因子的表达,使Smad3信号通路被激活,从而发挥促癌作用[15]。本研究结果还显示,TNM分期为Ⅲ+Ⅳ期、发生淋巴结转移、分化程度为低分化、肿瘤直径>3 cm的膀胱癌患者血清miR-1305高表达的比例分别低于TNM分期为Ⅰ+Ⅱ期、未发生淋巴结转移、分化程度为中/高分化、肿瘤直径≤3 cm者,且血清miR-1305高表达的膀胱癌患者3年生存率高于血清miR-1305低表达患者,血清miR-1305高表达是膀胱癌患者死亡的保护因素(P<0.05)。以上结果提示miR-1305在膀胱癌患者体内发挥抑癌作用,其表达下调可促进癌症进展,导致患者预后不良。
Michael等[16]首次报告miR-145在结直肠癌患者中的表达水平下调,参与结直肠癌的发生、发展。随后,不断有学者报告miR-145与其他癌症的关系。例如,Su等[17]发现,miR-145在食管癌细胞中的表达水平下调,其通过靶向RAR相关孤儿受体抑制食管癌细胞的增殖与迁移。王敬等[18]发现,miR-145可通过靶向葡萄糖转运蛋白1来调节蛋白激酶B信号通路,从而抑制乳腺癌细胞的迁移与增殖。本研究结果显示,膀胱癌患者的血清miR-145表达水平低于健康志愿者(P<0.05),这可能是因为miR-145可通过靶向作用下游基因来调控相关信号通路,从而抑制膀胱癌细胞的增殖、迁移。本研究结果还显示,TNM分期为Ⅲ+Ⅳ期、发生淋巴结转移、分化程度为低分化的膀胱癌患者血清miR-145高表达的比例分别低于TNM分期为Ⅰ+Ⅱ期、未发生淋巴结转移、分化程度为中/高分化者,且血清miR-145高表达的膀胱癌患者3年生存率高于血清miR-145低表达患者,血清miR-145高表达是膀胱癌患者死亡的保护因素(P<0.05)。以上结果说明miR-145也在膀胱癌患者体内发挥抑癌作用,且与患者的预后密切相关。
此外,本研究进一步分析了血清miR-1305、miR-145表达水平对膀胱癌的诊断价值,结果显示二者对膀胱癌均有一定的诊断价值,且二者联合诊断的效能优于二者单独诊断。由此可见,miR-1305、miR-145有望成为诊断膀胱癌的血清学标志物。
综上所述,膀胱癌患者血清中的miR-1305、miR-145表达水平下调,与患者临床病理特征及预后关系密切,二者联合检测对膀胱癌具有较高的诊断价值,有望成为诊断膀胱癌的新型血清学标志物。但二者具体的作用机制及相互之间存在的联系有待进一步研究。此外,本研究未分析治疗方案对患者预后造成的影响,在后续研究中可将其纳入研究内容以进一步验证本研究结论。
