MNNG和佛波酯诱导建立结肠癌的恶性转化细胞模型
2023-11-07袁利娟路建国刘沣涛段森森包国强
魏 刚 袁利娟 路建国 刘沣涛 段森森 包国强
(1 陕西中医药大学,陕西省咸阳市 712046; 2 空军军医大学第二附属医院普通外科, 陕西省西安市 710038)
结直肠癌是常见的消化道恶性肿瘤之一。2020年全球癌症数据显示,结直肠癌新发病例数占所有癌症新发病例数的10%,结直肠癌死亡病例数在癌症相关死亡病例数中占9.4%[1]。2020年我国结直肠癌新发病例共555 477例,在全球和我国所有癌症中分别位列第1、第2,死亡病例数共286 162例,在全球和我国分别位列第1、第5[2-3]。深入研究结直肠癌的发病机制对预防结直肠癌的发生及降低患者病死率尤为重要。目前有关结肠癌发病机制的研究主要以人结肠癌细胞系作为研究对象,或是采用结肠癌细胞系建立动物模型,而直接采用人正常结肠上皮细胞建立恶性转化细胞模型的相关研究报告较为罕见。本研究采用永生化的人正常结肠上皮细胞NCM460细胞作为实验细胞,经1-甲基-3-硝基-1-亚硝基胍(N-methyl-N′-nitro-N-nitrosoguanidine,MNNG)和佛波酯(phorbol 12-myristate 13-acetate,PMA)多代诱导处理,使其发生恶性转化,最终建立结肠癌的恶性转化细胞模型,旨在为进一步研究结肠癌的发病机制及治疗方法提供新思路和新方法。
1 材料与方法
1.1 主要试剂与仪器 NCM460细胞购自上海吉凯基因医学科技股份有限公司,MNNG购自Adamas-beta公司(货号:70-25-7),PMA购自Sigma-Aldrich Lab &Production Materials公司(货号:16561-29-8),神经钙黏附蛋白(neural-cadherin,N-cadherin)抗体(货号:bs-20623R)、转化生长因子β1(transforming growth factor beta 1,TGF-β1)抗体(货号:bs-0103R)、表皮生长因子受体(epidermal growth factor receptor,EGFR)单克隆抗体(货号:bsm-33140M)购自北京博奥森生物技术有限公司,β-actin抗体(货号:AF5003)、辣根过氧化物酶-羊抗兔二抗(货号:A0208)、RIPA裂解液(货号:P0013B)和二喹啉甲酸蛋白定量试剂盒(货号:P0012S)均购自上海碧云天生物技术有限公司,ECL化学发光液(货号:36222ES60)购自翌圣生物科技(上海)股份有限公司,酶标仪(型号:iMark)购自BIO-RAD公司。
1.2 实验方法
1.2.1 细胞培养:使用含1%青-链霉素(均为100 U/mL)和10%胎牛血清的DMEM,并置于37 ℃、5% CO2培养箱培养NCM460细胞。2~3 d传代一次,取处于对数生长期的细胞用于后续实验。
1.2.2 恶性转化细胞模型的建立:取对数生长期的NCM460细胞,过夜培养后,弃去培养液,用PBS洗涤细胞后加入含50 μg/mL MNNG的DMEM,于37 ℃、5% CO2条件下培养8 h,弃去培养液。用PBS洗去残留的MNNG后,加入含100 ng/mL PMA的DMEM,继续培养24 h,弃去培养液。用PBS洗去残留的PMA,然后更换为正常DMEM,于37 ℃、5% CO2条件下继续培养24 h,按照1 ∶2的比例进行传代。去除传代后细胞,按照上述培养方法,反复诱导培养,一直培养至30代。
1.2.3 恶性转化细胞模型的鉴定
1.2.3.1 MTT实验:取正常NCM460细胞、诱导后的第17代NCM460细胞(下文用NCM460-M-P17细胞表示)和诱导后的第30代NCM460细胞(下文用NCM460-M-P30细胞表示),用胰酶消化细胞,以1 000 r/min离心5 min后弃去上清液,用DMEM将细胞制成单细胞悬液,以每孔1×104个细胞接种于96孔板(每孔200 μL,设3个复孔),于37 ℃、5% CO2条件下分别培养24 h、48 h和72 h后,加入20 μL MTT溶液(5 mg/mL),继续培养4 h,弃去培养液,每孔加入150 μL二甲基亚砜,室温震荡10 min,用酶标仪检测490 nm波长处的吸光度值,采用GraphPad Prism 8.0绘制细胞增殖曲线。实验重复3次。
1.2.3.2 细胞克隆形成实验:取对数生长期的正常NCM460细胞、NCM460-M-P17细胞和NCM460-M-P30细胞,用胰酶消化细胞后,以1 000 r/min离心5 min,留取细胞沉淀。用DMEM将细胞制成单细胞悬液,按每孔200个细胞接种于6孔板(设3个复孔),将细胞置于37 ℃、5% CO2条件下培养14 d后终止培养。用PBS洗涤细胞3次后,用甲醇固定20 min,再用吉姆萨染液染色15 min,冲洗晾干后在显微镜下观察细胞团,计数细胞克隆形成数量。实验重复3次。
1.2.3.3 细胞划痕实验:取对数生长期的正常NCM460细胞、NCM460-M-P17细胞和NCM460-M-P30细胞,用胰酶消化细胞后,以1 000 r/min离心5 min,留取细胞沉淀,用DMEM将细胞制成单细胞悬液,按每孔200个细胞接种于6孔板(设3个复孔),将细胞置于37 ℃、5% CO2条件下培养。待细胞贴壁融合率达100%时,用20 μL枪头在细胞培养板底部垂直划痕,此时两条线之间的距离记为D0。用PBS洗涤细胞3次后,加入培养液继续培养48 h,然后在镜下观察细胞迁移情况。测量培养48 h后两条线之间的距离D48(细胞48 h迁移距离),计算细胞迁移率。细胞迁移率(%)=(D0-D48)/D0。实验重复3次。
1.2.4 Western blot 实验:取对数生长期的正常NCM460细胞、NCM460-M-P30细胞,用胰酶消化细胞后,以1 000 r/min离心5 min,留取细胞沉淀,加入含蛋白酶抑制剂的RIPA裂解液提取细胞蛋白,用二喹啉甲酸法对蛋白样品进行定量后,每孔上样20 μg蛋白样品进行SDS-PAGE,分离蛋白后采用湿转膜方法将蛋白转移至PVDF膜。用5%脱脂奶粉于4 ℃封闭12 h后,加入用TBST稀释的N-cadherin抗体(1 ∶1 000)、TGF-β1抗体(1 ∶1 000)、EGFR单克隆抗体(1 ∶1 000)及内参β-actin抗体(1 ∶1 000),4 ℃孵育过夜后,用TBST清洗,然后加入经TBST稀释的辣根过氧化物酶-羊抗兔二抗(1 ∶1 000),室温孵育90 min,用TBST清洗后加入发光液并立即进行显影。用ImageJ软件计算蛋白条带的灰度值,目的蛋白相对表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。实验重复4次。
1.3 统计学分析 采用SPSS 19.0软件进行统计分析。计量资料以(x±s)表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 3种细胞的形态学变化 镜下可见正常NCM460细胞呈单层生长,排列有序,形态为梭形,细胞结构清晰。与正常NCM460细胞比较,NCM460-M-P17细胞形态无明显变化,但细胞呈现团块生长的趋势;而NCM460-M-P30细胞的形态发生明显变化,细胞形态多样、大小不一,排列紊乱且紧密,呈团块状生长,无细胞间接触抑制或密度抑制,铺满培养瓶底后出现重叠生长现象,见图1。
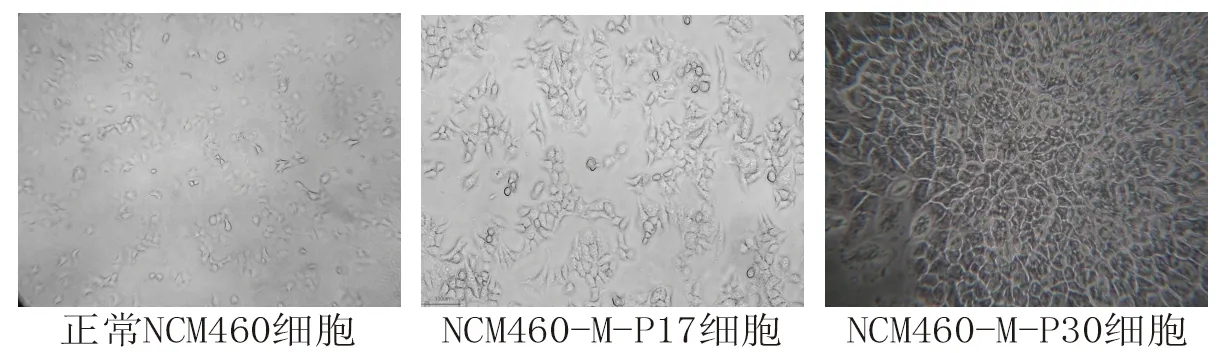
图1 3种细胞的形态学变化
2.2 3种细胞增殖能力的比较 培养24 h、48 h、72 h后,3种细胞的增殖能力差异具有统计学意义(P<0.05)。其中,与正常NCM460细胞比较,NCM460-M-P17细胞、NCM460-M-P30细胞的增殖能力增强,且NCM460-M-P30细胞的增殖能力强于NCM460-M-P17细胞(P<0.05),见表1。
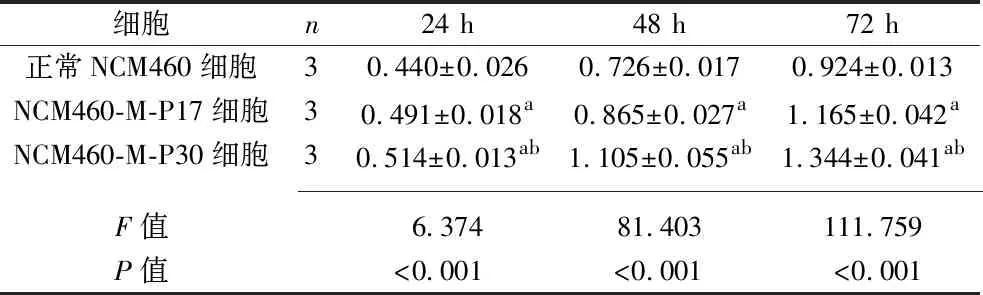
表1 培养24 h、48 h、72 h后3种细胞增殖能力的比较(x±s,吸光度值)
2.3 3种细胞克隆形成能力的比较 与正常NCM460细胞比较,NCM460-M-P17细胞、NCM460-M-P30细胞的克隆形成数量增多,且NCM460-M-P30细胞的克隆形成数量多于NCM460-M-P17细胞(P<0.05),见表2。大多数NCM460-M-P17细胞和NCM460-M-P30细胞的克隆团细胞数大于50个,见图2。
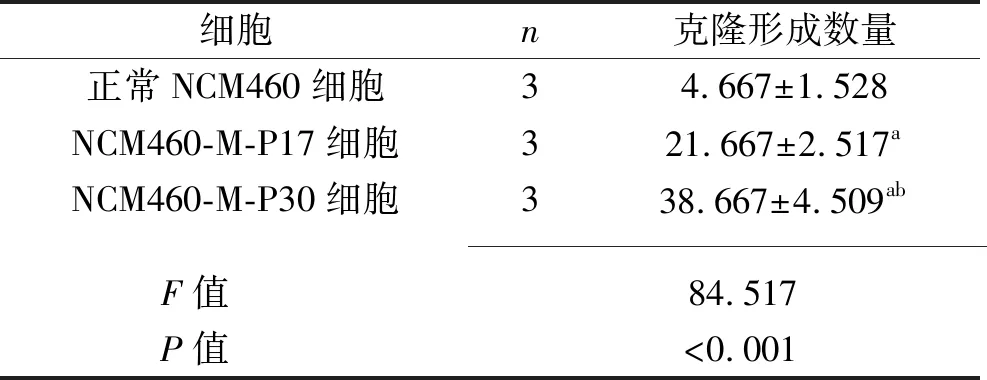
表2 3种细胞克隆形成数量的比较(x±s,个)
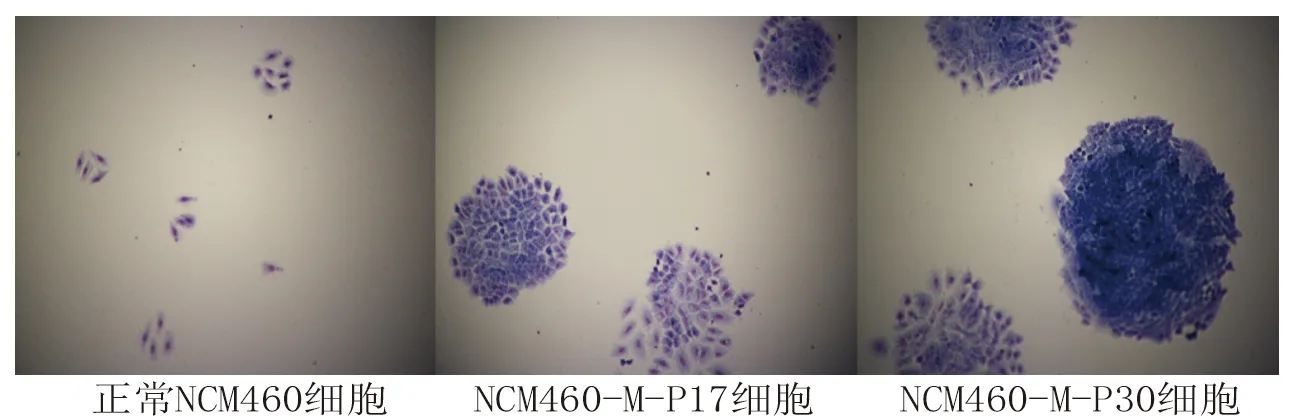
图2 吉姆萨染色观察细胞克隆形成情况(×10)
2.4 3种细胞迁移能力的比较 划痕48 h后,镜下可见NCM460-M-P17细胞、NCM460-M-P30细胞的划痕处有细胞生长,见图3。与正常NCM460细胞比较,NCM460-M-P17细胞、NCM460-M-P30细胞的48 h迁移距离增加、迁移率升高,且NCM460-M-P30细胞的48 h迁移距离和迁移率长于或高于NCM460-M-P17细胞(P<0.05),见表3。
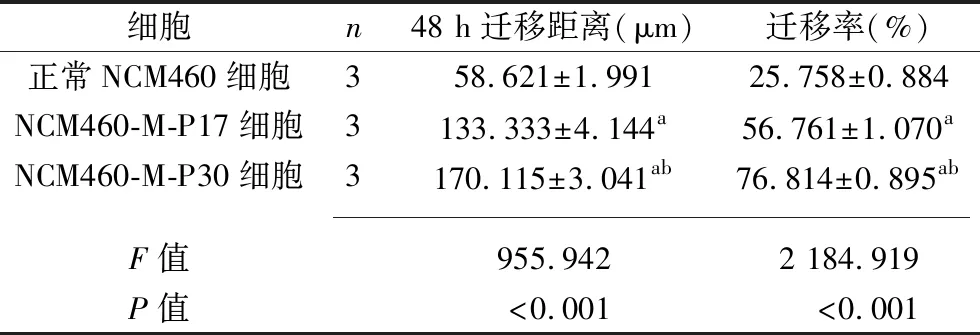
表3 3种细胞迁移情况的比较(x±s)

图3 3种细胞的迁移情况
2.5 正常NCM460细胞与NCM460-M-P30细胞中N-cadherin、EGFR、TGF-β1蛋白表达水平的比较 NCM460-M-P30细胞中N-cadherin、EGFR、TGF-β1的蛋白表达水平高于正常NCM460细胞(P<0.05),见图4和表4。
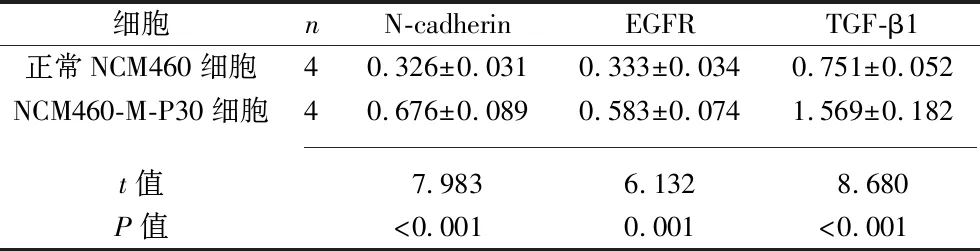
表4 正常NCM460细胞与NCM460-M-P30细胞中N-cadherin、EGFR、TGF-β1 蛋白相对表达水平的比较(x±s)
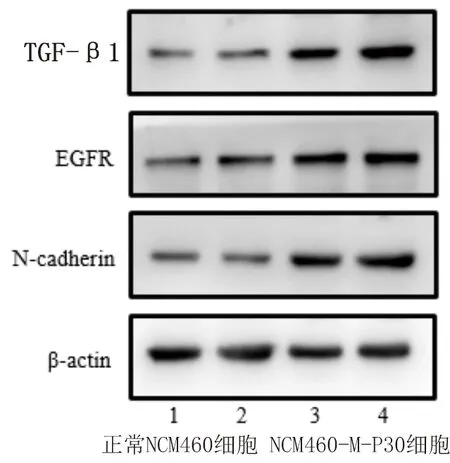
图4 TGF-β1、EGFR和N-cadherin的蛋白表达条带图
3 讨 论
恶性转化细胞模型是指运用外源性因素逐渐改变体外培养细胞的环境,导致在这种环境下生长的细胞发生恶性表型的改变,主要包括细胞形态、增殖速度、迁移能力及克隆形成能力等方面的改变。由于动物细胞与人类细胞存在种属差异,两组免疫机能也不同,所以动物和人类对致癌剂的耐受程度不同,在研究癌变过程中,如果采用动物细胞进行实验会导致研究结果存在差异。另外,一些促癌剂普遍存在于人类生活环境,考虑到促癌过程的长期性和可逆性,采用人类细胞深入研究促癌剂促癌的分子作用机制,对于人类肿瘤的发生机制研究及防治研究具有重要意义。结肠癌的发生、发展是一个多步骤、多阶段的复杂过程[4]。采用人类细胞进行体外培养及恶性转化实验探讨结肠癌的发生机制既能排除免疫系统的干扰,又能更深入地研究长期暴露于致癌物质的细胞在恶性转化过程中的各种生物学特征变化。
MNNG是一种人工合成的亚硝基化合物,是胃肠道肿瘤的化学致癌物。PMA是一种强促癌剂兼诱导分化剂[5]。本研究联合运用MNNG和PMA分阶段诱导NCM460细胞8 h和24 h后,再更换为正常培养基继续培养24 h,以减轻诱导剂对细胞的毒性损伤,提高细胞的存活率,保证细胞连续传代诱导的顺利实施。结果显示,经过30代连续诱导的NCM460细胞呈团块状生长,排列紊乱,无细胞间接触抑制,提示该细胞已表现出恶性转化细胞的特性[6]。
肿瘤细胞具有无限增殖的特性,本研究的MTT实验结果显示,经过多代连续诱导后,NCM460-M-P17细胞、NCM460-M-P30细胞的增殖能力均较正常NCM460细胞明显提高,且以NCM460-M-P30细胞的增殖能力最强(P<0.05),提示长期生长在含有低浓度MNNG和PMA环境中的NCM460细胞,其增殖能力会随促癌剂作用时间的延长而增强。
克隆形成能力是指细胞能够无限制地分裂并形成一个细胞团的能力。这种能力使得细胞能够形成肿瘤组织,促进肿瘤的进展。正常细胞由于生长受限,不能无限生长,而肿瘤细胞因失去接触抑制且具有单克隆生长能力,能够呈克隆样生长。因此,细胞在体外培养时形成的克隆样细胞团是细胞发生恶性转化的重要标志[7]。本研究中的克隆形成实验结果显示,经过MNNG和PMA多代诱导处理的NCM460细胞的克隆形成能力显著提高。这提示经促癌剂长期诱导的NCM460细胞对环境依赖性降低,适应能力、自主生存能力及克隆形成能力增强,具有恶性转化的趋势。
转移能力是肿瘤细胞的关键生物学特征之一,它可以使肿瘤细胞能够从原发病灶转移到其他组织或器官。这种转移过程是肿瘤进展和复发的重要原因之一,也是导致肿瘤治疗失败的主要因素。本研究的划痕实验结果显示,NCM460-M-P17细胞及NCM460-M-P30细胞的迁移能力较正常NCM460细胞提高(P<0.05),说明促癌剂可能会导致NCM460细胞迁移能力异常增强,进而使其具有肿瘤细胞的转移特性。
N-cadherin、TGF-β1、EGFR是最常见的与肿瘤侵袭和迁移有关的分子标志物。本研究结果显示,与正常NCM460细胞比较,NCM460-M-P30细胞中N-cadherin、TGF-β1和EGFR蛋白表达水平升高,这进一步从分子水平说明了促癌剂长期诱导NCM460细胞可使其发生恶性转化。
综上所述,经过MNNG和PMA促癌剂连续多代诱导处理后,NCM460细胞的生物学功能(增殖、克隆形成和迁移能力)发生明显改变,具备恶性细胞的生物学特征。该建模方法为深入研究结肠癌的发生和发展机制提供了新思路。但本研究未深入分析MNNG和PMA诱导NCM460细胞恶性转化的分子机制,也未进行体内转化细胞实验,今后需要进一步完善研究内容,以更好地探讨结肠癌发生的分子机制。
