缺氧易化快速起搏引起的心室肌细胞钙瞬变交替*
2012-03-17王礼春庄晓东董小变黄泽娜邝素娟刘晓颖廖新学
赵 斌, 王礼春, 庄晓东, 董小变, 黄泽娜, 邝素娟, 刘晓颖, 廖新学△
(1中山大学附属第一医院心血管内科,高血压血管病科,2广东省人民医院医学研究中心,广东广州510080)
尽管恶性心律失常是大多数心脏病患者的重要死因,但是诱导其发作的离子机制尚未完全阐明。心脏交替在临床上常表现为交替脉,是由于心脏收缩强弱交替出现而引起的[1-2],它是预测恶性心律失常及评估患者猝死风险的有效指标[3]。最近,在细胞电生理方面的研究结果提示,心脏收缩的这种强弱交替现象与单个心肌细胞的钙瞬变交替密切相关[4]。心肌细胞钙瞬变交替是指高频刺激、心肌缺血、糖代谢障碍以及酸中毒等病理状态下出现的细胞膜去极化,L型钙通道开放以及Ca2+内流增加,进而触发肌浆网大量释放Ca2+,从而形成了钙瞬变幅度在心肌细胞的每次搏动之间的交替变化[5-7]。因而,深入研究钙瞬变交替在心肌缺血诱导的恶性心律失常和心肌功能受损中的作用具有重要的现实意义和临床价值[8-10]。为此,我们分离成年SD大鼠的心室肌细胞,观察缺氧处理对心室肌细胞内钙瞬变交替的影响,并进一步检测钙瞬变交替在缺氧损伤心室肌细胞中的作用。
材料和方法
1 材料和试剂
II型胶原酶、牛血清白蛋白(bovine serum albumin,BSA)、HEPES和Joklik-modified MEM无钙培养基(无钙培养基)购自Sigma-Aldrich,Fluo-4/ AM购自Invitrogen,2-(2-甲氧基-4-硝苯基)-3-(4-硝苯基)-5-(2,4-二磺基苯)-2H-四唑单钠盐[2-(2-methoxy-4-nitrophenyl)-3-(4-nitrophenyl)-5-(2,4-disulfophenyl)-2H-tetrazolium,monosodium salt,WST-8]线粒体功能检测试剂盒购自日本同仁化学研究所。其它试剂均为国产分析纯。
2 SD大鼠单个心室肌细胞的分离与缺氧处理
取雄性、3月龄SD大鼠,体重约250 g。通过吸入高浓度的CO2使其麻醉,快速将心脏组织完整地取出,浸泡于0℃无钙培养基中。保留左冠状动脉,将其残端悬挂于Langendorff灌流系统中,逆行灌流。用37℃ 无钙培养基灌注3 min,以去除组织内残存的血液,接着用含有Ⅱ型胶原酶0.5g/L、BSA 1g/L和HEPES 10 mmol/L(pH 7.2)的无钙培养基,37℃灌流40 min。待心室肌组织变软,用眼科剪剪下心室组织,在15 mL离心管内用无钙培养基反复吹打,去除残留的组织块。静置10 min后,丢弃上清液,纯化心室肌细胞。活力正常的心室肌细胞常呈棒状,其数目约占总细胞数目的70%。将分离的心室肌细胞储存于37℃的无钙培养基中,备用。
心室肌细胞经缺氧处理2 h,同时设置含钙的Joklik-modified MEM培养基作为对照。缺氧液的成分为(mmol/L):NaCl 135、KCl 3.6、KH2PO41.2、MgSO41.2、HEPES 10和CaCl21.8,并将pH调节至6.5。临用前通入N2,以排除溶解的O2。
3 心室肌细胞的复钙和钙荧光负载处理
将分离的心室肌细胞逐渐梯度复钙,保持细胞外液中的Ca2+浓度在1.3 mmol/L左右。采用荧光探针Fluo-4/AM检测细胞内的Ca2+含量。在负载细胞时,取复钙好的细胞悬液2 mL,加入10 mol/L Fluo-4/AM,37℃避光孵育20 min,使其在细胞内充分水解,然后用含1.25 mmol/L Ca2+的 Joklikmodified MEM培养基洗涤3次,重悬后备用。分离的心室肌细胞要求在分离后8 h内使用。
4 心室肌细胞内钙瞬变的检测
按照本实验室建立的方法[12],用激光扫描共聚焦显微镜(Leica;型号:SP5)检测心室肌细胞内的钙瞬变(入射波长为488 nm,发射波长为525 nm)。将备好的心室肌细胞放到载物台上的灌流槽中,室温26℃的条件下,以含1.25 mmol/L Ca2+的 Joklikmodified MEM培养基缓慢持续灌流,保持流速在0.2 mL/min。将显微镜的视野限制在单个心室肌细胞上,先用平面扫描(xyt)的方式沿着细胞的长轴定下扫描线的具体位置,尽量避开细胞核,再用线扫描(xt pinhole 90 NA)的方式实时记录电压刺激(阈上刺激,平均强度为10 V,脉宽1 ms)时细胞内Ca2+的荧光强度与时间的关系,即钙瞬变。钙瞬变交替是指钙瞬变幅度大小交替出现,并相差达10%以上。电刺激频率按60、120、180、240和300 min-1逐渐递增,将出现钙瞬变交替的最低刺激频率定义为钙瞬变交替的阈频率。在200~300 min-1的范围内,以 2 min-1的幅度递增,进一步在不同的心室肌细胞检测出阈刺激。用激光共聚焦显微镜系统采集信号,信号强度以平均荧光强度(mean fluorescence intensity,MFI)表示,数据用该系统自带软件进行分析。
5 心室肌细胞线粒体脱氢酶活性的检测
线粒体脱氢酶活性是反映线粒体功能的重要指标,其可代谢WST-8生成黄色的物质。通过检测黄色物质的深浅可以间接反映线粒体的功能状态。将分离的心室肌细胞接种于多聚赖氨酸包被的96孔培养板中,细胞贴壁后,分别给予含钙的Joklikmodified MEM培养基、缺氧液、缺氧液+L-型钙通道阻滞剂以及单独L-型钙通道阻滞剂处理4 h。处理结束后,每孔加1∶10稀释的 WST-8溶液100 μL,轻摇,37°C孵育3 h,用酶标仪(λ=450 nm)记录各孔的吸光度(A)。将对照组心室肌细胞的线粒体脱氢酶活性设为100%。
6 统计学处理
结果
1 高频起搏诱导心室肌细胞出现钙瞬变交替
心室肌细胞被施予60~240 min-1起搏刺激时,细胞内Ca2+含量的荧光信号随刺激而出现变化,表现为钙瞬变现象(图1A、B和C)。当起搏刺激的频率进一步增加到300 min-1时,细胞内Ca2+含量的荧光信号除有钙瞬变现象以外,还表现出强弱交替的变化(图1D),即高频起搏刺激诱导心室肌细胞出现钙瞬变交替现象。

Figure 1.Effects of different frequencies of pacing stimuli on calcium transient in ventricular myocytes.A:60 min-1;B:180 min-1; C:240 min-1;D:300 min-1.MFI:mean fluorescence intensity.图1 不同频率的起搏刺激对心室肌细胞钙瞬变的影响
2 缺氧处理易化高频起搏刺激诱导的心室肌细胞钙瞬变交替
对正常培养的心肌细胞施予240 min-1的起搏刺激时,细胞内Ca2+含量的荧光信号随刺激规则性出现,无交替现象(图2A)。经缺氧处理0.25 h后,240 min-1的起搏刺激可使钙瞬变现象强弱交替出现(图2B)。此结果提示,在缺氧情况下,刺激更易诱发钙瞬变交替。进一步给心室肌细胞施予起搏频率递增2 min-1的刺激,结果显示,缺氧组的心室肌细胞出现钙瞬变交替的阈刺激频率显著低于正常对照组的心室肌细胞出现钙瞬变交替的阈刺激频率(P<0.05),见图2C。

Figure 2.Effect of hypoxia on calcium transient alternations induced by rapid pacing in ventricular myocytes.Normal ventricular myocytes(A)and hypoxia-stimulated ventricular myocytes(B)were paced at a frequency of 240 min-1and calcium transient was detected.C:normal ventricular myocytes and hypoxia-stimulated ventricular myocytes were paced with increasing frequencies from 200 min-1to 300 min-1and the threshold was measured.±s.n=6.*P<0.05 vs control.图2 缺氧处理对快速起搏诱导心室肌细胞钙瞬变交替的影响
3 轻度缺氧不改变心室肌细胞的显微结构
为了进一步明确在缺氧诱导心室肌细胞钙瞬变交替过程中是否存在细胞显微结构的异常,本研究观察了心室肌细胞的显微结构变化。正常心室肌细胞呈棒状,可见明显的横纹及横小管结构(图3A),而经缺氧处理2.5 h后,虽然此时高频起搏已经能诱导钙瞬变交替现象,但是心室肌细胞的显微结构并无明显的改变,即细胞仍呈棒状、细胞膜依然完整、横纹和横小管结构依然规则(图3B)。
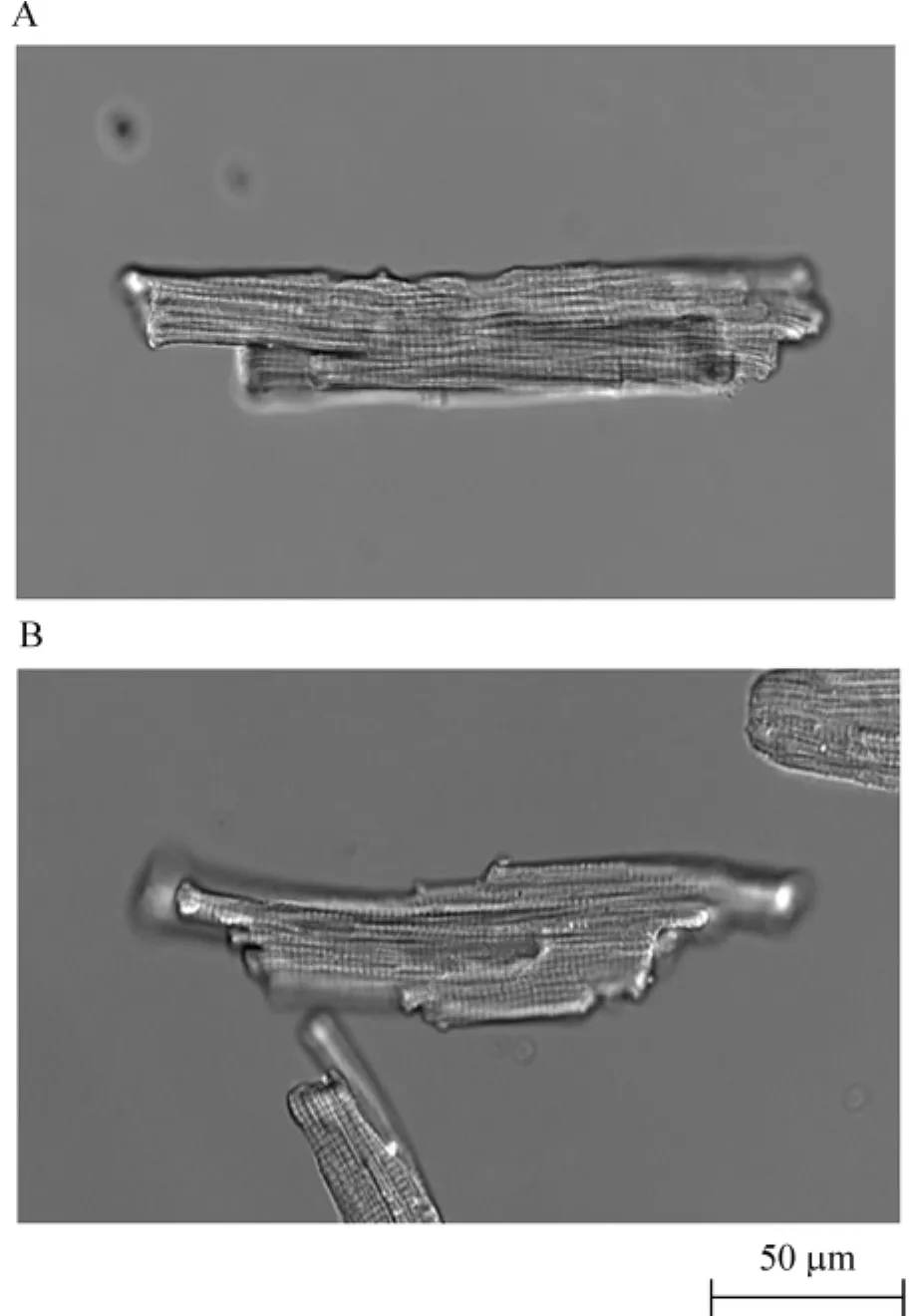
Figure 3.Effect of hypoxia on ultrastructure of ventricular myocytes.A:control group;B:hypoxia group.图3 缺氧处理对心室肌细胞显微结构的影响
4 持续的钙瞬变交替诱导线粒体功能受损
心室肌细胞经缺氧处理5 h后,线粒体的功能明显降低,表现为线粒体脱氢酶的相对活性减弱。应用维拉帕米(verapamil,VP)抑制L-型钙通道,结果显示,2.5 μmol/L VP在不影响线粒体功能的条件下,可明显对抗缺氧诱导的线粒体功能受损,使线粒体脱氢酶的相对活性部分恢复,见图4。
讨论
钙瞬变交替的现象最早是由 Lee等[11]在无意中将灌注心脏的灌流液关闭后发现的。近年来的研究表明,钙瞬变交替可发生于心肌细胞的高频起搏刺激、缺血/缺氧损伤以及酸中毒等病理生理条件下[8]。心室肌细胞的钙瞬变交替是交替脉的电生理基础,是恶性心律失常的重要预测指标。因而,深入阐明心肌缺血对快速起搏诱导的钙瞬变交替的影响,对于恶性心律失常的防治具有重要的临床意义。

Figure 4.Effect of L-type Ca2+channel blocker on the decreased activity of mitochondrial dehydrogenase induced by hypoxia in ventricular myocytes.The ventricular myocytes suffered from hypoxia in the presence or absence of 2.5 μmol/L verapmil(VP)for 5 h,and then the relative activity of mitochondrial dehydrogenase was measured.±s.n=4.**P<0.01 vs control group;#P<0.05 vs hypoxia group.图4 L-型钙通道阻滞剂对缺氧诱导的心室肌细胞线粒体脱氢酶活性降低的影响
心肌细胞胞浆内游离的 Ca2+交替通过影响Ca2+敏感的离子通道,如钠-钙交换体、L-型钙通道以及钙激活的氯通道等,引起动作电位时程(action potential duration,APD)的改变。由于这些钙敏感的离子通道对Ca2+的反应各异,有的是使APD延长,有的是使APD缩短,从而导致APD的交替性变化,进而诱导恶性心律失常的发生[4]。快速起搏和心肌缺血/缺氧均是钙瞬变交替的重要影响因素,因此本研究首先在成年SD大鼠心室肌细胞观察了快速起搏刺激对心室肌细胞钙瞬变交替的影响。结果显示,在正常培养基中,低频起搏可引起钙瞬变现象,即心室肌细胞胞浆中的Ca2+含量随着刺激而发生一致性改变。但是,当快速起搏的频率达到300 min-1时,心室肌细胞胞浆中的Ca2+含量的改变强弱交替出现,这说明单独快速起搏可诱导心室肌细胞的钙瞬变交替现象。这和本课题组前期在心房肌细胞上的研究结果类似[12]。
由于心肌缺血/缺氧也是引起恶性心律失常和心功能障碍的重要原因,因而,本研究接着观察了缺氧对快速起搏引起心室肌细胞钙瞬变交替的影响。研究发现,240 min-1的快速起搏刺激对正常培养的心室肌细胞的钙瞬变无明显影响,但是对缺氧的心室肌细胞可使其钙瞬变的幅度强弱交替出现,提示缺氧可使快速起搏的心室肌细胞更容易发生钙瞬变交替,即降低了快速起搏的刺激阈值。我们推测,临床上心肌缺血时,心律失常容易发生的原因可能部分与此有关。此时,我们又通过显微镜照相发现,缺氧并未使心肌细胞横纹及横小管形态发生明显改变,因而,认为钙瞬变交替的发生早于心肌细胞横纹及横小管形态结构的改变,即在未发生上述细胞形态改变时,胞内已经存在钙稳态的异常。
在缺血/缺氧的情况下,心室肌细胞的能量代谢障碍,线粒体功能也发生不同程度的受损。另外,缺血/缺氧还会引起心室肌细胞的Ca2+敏感离子通道(如L-型钙通道)功能和细胞内 Ca2+的水平变化[13]。有研究显示,选择性L-型钙通道阻滞剂VP可以抑制钙瞬变的发生,改善钙稳态失衡[14]。为此,本研究又观察了钙瞬变交替对缺氧引起的心室肌细胞线粒体功能的影响。研究结果显示,缺氧处理可明显降低心室肌细胞线粒体脱氢酶的活性,使其代谢WST-8产生黄色物质的能力减弱。而给予VP可以部分恢复心肌细胞线粒体的功能,此结果提示,钙瞬变交替可能介导了持续缺氧诱导的心室肌细胞线粒体功能受损和心功能障碍,Katra等[14]在豚鼠心脏上的研究支持本文的结果。
总之,本文在成年SD大鼠心室肌细胞观察到缺氧可以易化快速起搏刺激诱导的心室肌细胞钙瞬变交替,而钙瞬变交替又介导了持续缺氧诱导的线粒体功能受损。本文的研究结果为以缺氧为靶点的恶性心律失常和心功能障碍的防治提供了基础资料。
[1] Cutler MJ,Wan X,Laurita KR,et al.Targeted SERCA2a gene expression identifies molecular mechanism and therapeutic target for arrhythmogenic cardiac alternans[J].Circ Arrhythm Electrophysiol,2009,2(6):686-694.
[2] Diaz ME,O'Neill SC,Eisner DA.Sarcoplasmic reticulum calcium content fluctuation is the key to cardiac alternans[J].Circ Res,2004,94(5):650-656.
[3] Myles RC,Burton FL,Cobbe SM,et al.The link between repolarisation alternans and ventricular arrhythmia: does the cellular phenomenon extend to the clinical problem?[J].J Mol Cell Cardiol,2008,45(1):1-10.
[4] Clusin WT.Mechanisms of calcium transient and action potential alternans in cardiac cells and tissues[J].Am J Physiol Heart Circ Physiol,2008,294(1):H1-H10.
[5] Diaz ME,Eisner DA,O'Neill SC.Depressed ryanodine receptor activity increases variability and duration of the systolic Ca2+transient in rat ventricular myocytes[J].Circ Res,2002,91(7):585-593.
[6] Li Y,Diaz ME,Eisner DA,et al.The effects of membrane potential,SR Ca2+content and RyR responsiveness on systolic Ca2+alternans in rat ventricular myocytes[J].J Physiol,2009,587(Pt 6):1283-1292.
[7] Livshitz LM,Rudy Y.Regulation of Ca2+and electrical alternans in cardiac myocytes:role of CAMKII and repolarizing currents[J].Am J Physiol Heart Circ Physiol,2007,292(6):H2854-H2866.
[8] Kapur S,Wasserstrom JA,Kelly JE,et al.Acidosis and ischemia increase cellular Ca2+transient alternans and repolarization alternans susceptibility in the intact rat heart[J].Am J Physiol Heart Circ Physiol,2009,296(5): H1491-H1512.
[9] Bloomfield DM,Bigger JT,Steinman RC,et al.Microvolt T-wave alternans and the risk of death or sustained ventricular arrhythmias in patients with left ventricular dysfunction[J].J Am Coll Cardiol,2006,47(2):456-463.
[10] Lakireddy V,Baweja P,Syed A,et al.Contrasting effects of ischemia on the kinetics of membrane voltage and intracellular calcium transient underlie electrical alternans[J].Am J Physiol Heart Circ Physiol,2005,288 (1):H400-H407.
[11] Lee HC,Mohabir R,Smith N,et al.Effect of ischemia on calcium-dependent fluorescence transients in rabbit hearts containing indo 1.Correlation with monophasic action potentials and contraction[J].Circulation,1988,78 (4):1047-1059.
[12] 罗 端,邓春玉,于 涛,等.钙瞬变交替在房颤形成中的作用[J].中山大学学报:医学科学版,2011,32 (3):336-341.
[13] Picht E,DeSantiago J,Blatter LA,et al.Cardiac alternans do not rely on diastolic sarcoplasmic reticulum calcium content fluctuations[J].Circ Res,2006,99(7):740-748.
[14] Katra RP,Pruvot E,Laurita KR.Intracellular calcium handling heterogeneities in intact guinea pig hearts[J].Am J Physiol Heart Circ Physiol,2004,286(2):H648-H656.
