豚鼠乳鼠心房肌细胞体外培养的探讨*
2014-03-04佡剑非王晓萍
吴 蔚,佡剑非,王晓萍,邵 冰
(1.沈阳医学院附属第二医院心内科110002;2.中国医科大学盛京医院神经内科,沈阳110001)
自1960年Harary 等[1]首次对豚鼠乳鼠的心房肌细胞进行培养以来,心房肌细胞培养被广泛地应用于心血管疾病的研究,其原因在于体外培养的心房肌细胞能够保持其在体内原有的许多结构和功能,并具有自发性节律搏动,且心肌细胞的培养具有简便、定量、重复性好以及不受神经体液因素的影响等特点[2],进而在心血管疾病研究领域中起到了不可替代的作用。然而,由于心房肌细胞易受损伤、不易传代等特点,目前多数学者应用原代培养的心房肌细胞进行实验。那么,探索出合适的心房肌细胞培养方法,使得心房肌细胞达到理想的数量、存活率、纯化率和细胞活力,是体外培养心房肌细胞模型的关键。本实验参照了Simpson 等[3]心房肌细胞的培养方法并加以改进,探讨豚鼠乳鼠心房肌细胞培养的方法。
1 材料与方法
1.1 实验动物 选择出生1~2 d 的豚鼠的乳鼠,雌雄不限,由中国医科大学实验动物部提供。
1.2 仪器与试剂DMEM低糖培养液(美国Hyclone 公司),胎牛血清(美国Hyclone 公司),胰蛋白酶(天津灏洋试剂公司),Ⅱ型胶原酶(美国Gibco 公司),D-Hanks 液(自配),溴脱氧尿核苷(Brdu,美国Sigma 公司),双抗液(美国Sigma 公司),兔抗大鼠心房肌肌钙蛋白I(c TnI)抗体(美国Santa Cruz 公司),FITC 标记羊抗兔二抗(北京中杉试剂公司),超净工作台(江苏苏净集团仪器设备公司),二氧化碳培养箱(德国Heraeus 公司),倒置相差光学显微镜(日本Ol ympus 公司),离心机(ST-21 Sorvall,美 国),恒 温 振 荡 水 浴 箱(Grant OLS200,美国)。
1.3 方法
1.3.1 心房肌细胞的分离及培养 取1~2 d 的豚鼠乳鼠5只,无菌条件下开胸取出心脏,用预冷的D-Hanks 液洗涤1遍,然后用两把眼科弯镊子将心房分离下来,再用预冷的DHanks 液洗涤2 遍,剪成约1mm3碎块,加入4~5 倍体积的0.06%的胰酶并放入37 ℃恒温振荡水浴箱中,震荡(频率:75 r/min)消化心房肌组织7.5 min,第1 次消化后自然沉淀并弃上清液,并用D-Hanks液洗涤1遍,然后从第2次开始用0.08%Ⅱ型胶原酶消化,前后消化4 次,每次加入后吹打15 次左右,每次消化时间7.5 min,消化后再次吹打20 次左右,自然沉淀后,吸出每次分离的上清液加入等量含10%胎牛血清的DMEM低糖培养液,前2 次和后2 次各放入1 个15mL离心管中,经200 目滤网过滤,然后4 ℃850r/min 离心8 min,离心后弃掉上清液,各加入1.5 m L培养液,轻轻吹打制成细胞悬液,各吸入6 孔板中,再将其吹匀,各吸出0.5 m L放入另一孔中,然后将6 孔板放入CO2培养箱培养60min 后,采用差速贴壁分离技术,吸出细胞悬液,分别放入另3 个孔中,再放入CO2培养箱培养60 min 后,采用同样的方法再次分别放入另一个6 孔板的3 个孔中,前3d 滴入5-溴脱氧尿嘧啶核苷(Brdu)使其终浓度为0.1 mmol/L,并继续培养,24、48 h 都进行换液,以后隔日换液。
1.3.2 心房肌细胞数量及存活率的测定 两孔中各取40μL细胞悬液,并分别加入160μL 的0.4%台盼蓝液,混匀后再取适量混合液滴于细胞计数板上,随机取10 个低倍(10 ×)视野计数4 个大格中的细胞总数及未染成蓝色的活细胞数,计数10 次,取平均值。细胞存活率=活细胞数/细胞总数×100%。
1.3.3 心房肌细胞搏动频率及搏动率的观察 培养3 d 的心房肌细胞在倒置显微镜下先计数聚集成心房肌细胞簇的心房肌细胞的搏动频率,再随机在高倍(20 ×)视野中,计数600 个心房肌细胞中搏动心房肌细胞数,得出心房肌细胞搏动率(细胞搏动率=搏动细胞数/细胞总数×100%),随机观察培养4 d的心房肌细胞的形态变化及生长状况。
1.3.4 心房肌细胞纯度的鉴定 取培养72 h 的心房肌细胞进行纯度鉴定,用兔抗大鼠肌钙蛋白I 抗体作为一抗,山羊抗兔IgG作为二抗荧光蛋白,采用细胞免疫荧光法,用磷酸盐缓冲液(PBS)作为一抗的阴性对照。随机取10 个高倍(20 ×)视野计数阳性细胞及细胞总数。阳性细胞率=阳性细胞数/细胞总数×100%。
2 结 果
2.1 培养心房肌细胞的情况 本实验采用前2 次、后2 次和前后4 次消化后的细胞分别培养法,观察3 者对心房肌细胞产量、存活率、纯化率和活力的影响,实验结果显示采用上述方法中的后2 次消化培养的心房肌细胞总数、存活率和活力更为理想(图1、图2)。
2.2 培养心房肌细胞的形态变化 在两次差速贴壁后,在倒置显微镜下观察到心房肌细胞形态,最初为圆形或椭圆形,4 h后,开始有心房肌细胞贴壁生长,此时的形态为柱状梭形、长三角形、短三角形;12 h 后,细胞逐渐在瓶壁表面铺展,此时大多数心房肌细胞已经贴壁生长,此时可见少数单个细胞开始搏动,频率不一;24 h 后,能贴壁生长的心房肌细胞几乎都已经贴壁生长,细胞铺展状况更加明显,并伸出伪足,形态上多数细胞逐渐变成不规则的星形;1~2 d 后,伪足可相互接触交织成网,形成细胞单层或细胞簇,呈放射状排列的同心圆状,其搏动同步化,形成所谓功能性合体细胞(图3);至3 d 时,自发搏动频率和波动率都达高峰,计数培养10 次的平均搏动频率为每分钟116~119 次,平均搏动率为89%~92%;至5~6d 时搏动频率及波动率开始减少。
2.3 心房肌细胞纯度的鉴定24 孔板爬片培养4 d 的心房肌细胞,以兔抗大鼠肌钙蛋白I 抗体作为一抗,山羊抗兔IgG作为二抗荧光蛋白,用细胞免疫荧光法,可见细胞质染色呈绿色;细胞核呈蓝色,非心房肌细胞只有细胞核呈蓝色。结果显示几乎所有的细胞呈现阳性,说明此时培养的心房肌细胞较纯,见图1、图4。

图1 3组消化后的心房肌细胞存活率及培养4 d的纯化率和活力
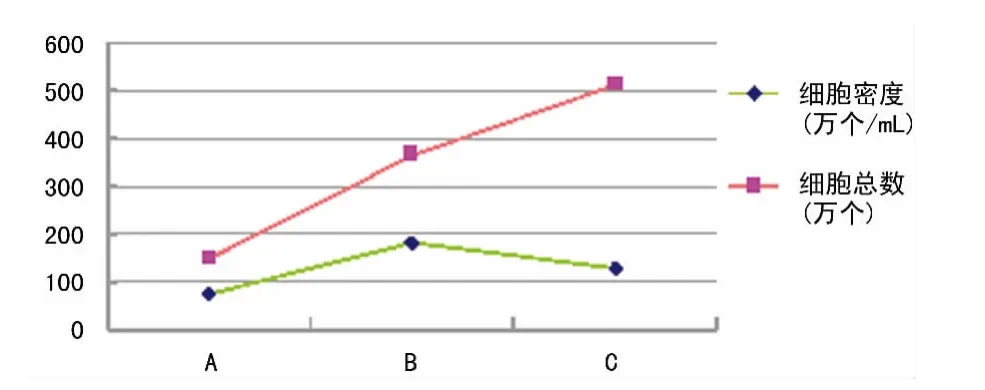
图2 3组消化后培养的心房肌细胞密度和总数

图3 3组消化后培养4d 的心房肌细胞(×200)

图4 3组消化后培养4d 的心房肌细胞、兔抗大鼠心房肌肌钙蛋白I、山羊抗兔IgG(×400)
3 讨 论
近年来生物起搏器(biological pacemaker)研究已成为缓慢性心律失常治疗领域的新热点,人们对心房肌细胞的研究越来越深入。心房肌细胞原代培养不受神经、体液等因素影响,在实验研究中具有举足轻重的作用。然而,由于心房肌细胞有易受损伤、不易传代等特点,所以如何控制大鼠心房肌细胞体外培养的影响因素,进而得到纯化好、存活率和活力高的心房肌细胞,是实验成功一个关键因素。
本实验利用酶分解法[4],即0.06%的胰蛋白酶消化1 次,再用0.08%Ⅱ型胶原酶重复消化4 次,并采用差异性贴壁技术及添加Brdu 纯化细胞的方法分离豚鼠乳鼠心房肌组织,以获得高产量、高活力的心房肌细胞。现对豚鼠乳鼠心房肌细胞体外培养的重要影响因素进行总结如下:
3.1 实验豚鼠的选择 许多学者研究发现成年大鼠心肌细胞为终末分化细胞,不具有分裂增殖能力,乳鼠在出生后3 d 内心肌细胞都有增殖能力,但大鼠出生后时间越短,其心肌细胞分离后存活率越高,越容易贴壁生长[5]。而豚鼠在出生后1~3 d 的心房肌细胞都有增殖能力,可用于心房肌细胞培养。有文献报道,以半日龄为好[6]。作者对出生半日到3 d 的乳鼠进行心房肌细胞培养,发现胎龄为1~2 d 最好,原因可能是:(1)对于1~3 d 的乳鼠,消化酶对细胞影响较大;(2)对于半日龄的乳鼠,心肌细胞对酶的反复消化耐受差,消化过程不好控制以致细胞的存活率和活力不理想,并且心脏小,细胞数量较少;(3)对于2~3 d 的乳鼠,心房肌细胞增殖和贴壁生长能力较1~2 d 的乳鼠差,消化后细胞的存活率和活力也不理想;(4)对于1~2 d 的乳鼠,消化过程好控制,消化后心房肌细胞数量也较多,且存活率较高,活力较好。
3.2 消化酶种类的选择 心房肌细胞能否培养成功的关键是减轻分离过程对细胞的损伤。有学者认为“单纯应用胰蛋白酶消化对细胞的存活率有极大的负面影响”[7]。分离心房肌细胞常用的消化液有胰蛋白酶(一般与依地酸二钠联合应用,可降低细胞损害)和胶原酶[8-9]。二者的目的是使组织块分散为单个细胞,利于细胞贴壁生长。无论是胰蛋白酶还是胶原酶,其浓度较低为好,本实验选用0.06%的胰蛋白酶(含EDTA)消化1 次,从第2 次开始用0.08%Ⅱ型胶原酶重复消化4 次,就是较好的例子。其原因是0.06%的胰蛋白酶不但对心房肌细胞损害小,而且分解组织间质蛋白的作用较胶原酶强,有利于达到第1 次弃上清液的消化目的,第2 次开始用0.08%Ⅱ型胶原酶,通过消化细胞间胶原蛋白来实现游离心房肌细胞的目的,这与胰蛋白酶消化的机制不同,而且作用温和,消化的时间长短容易控制,消化次数(与高浓度的消化酶相比,如果消化酶浓度大,需要短时间多次消化)较少。作者尝试过用0.125%胰酶进行短时间、多次消化,然而消化时间不易控制,效果不理想。总之,选用低浓度的,联合应用两种消化酶更适合心房肌细胞培养,这可能是今后心房肌细胞培养的共同趋势。
3.3 心房肌细胞纯化方法的选择 消化分离后通常存在两种细胞:心房肌细胞和成纤维细胞。成纤维细胞较心房肌细胞更容易贴壁且具有分裂增殖能力,如果处理不当,很容易成为优势细胞,对实验结果产生极大的影响。因此,在心房肌细胞培养中应尽可能地去除成纤维细胞,以达到较为纯化的心房肌细胞。本实验根据心肌细胞和成纤维细胞在培养皿表面贴壁生长的速度不同的特点,采用两次差速贴壁分离法[10-11](每次60 min)和加入Brdu[3,12]通过竞争取代胸腺嘧啶脱氧核苷,抑制DNA复制,进而抑制混杂于心房肌细胞中的少量成纤维细胞增生,并对心房肌细胞无毒性及抑制作用,可得到纯度为95.4%~96.2%的心房肌细胞。
综上所述,心房肌原代培养在心血管领域中具有重要的作用。那么,如何在心房肌细胞原代培养中获得达到实验要求的心房肌细胞数量、存活率、纯化率和活力是决定实验成败的关键。本研究介绍的利用低浓度酶消化原代培养心房肌细胞方法,细胞纯化率高、活力高、细胞数量较多、操作简便、重复性好,且最为值得关注的是实验操作的可控制性强,是一种较为理想的心房肌细胞原代培养方法,可广泛地用于建立病理生理模型,研究细胞电生理、蛋白及基因的表达,从而探索以基因治疗为基础的生物起搏器在治疗病态窦房结综合征中的新途径。
[1] Harary I,Farly B.In vitro studies of single isolated beating heart cells[J].Science,1960,131(3414):1674-1675.
[2] 郝亚荣,李建军.乳鼠心肌细胞的原代培养[J].心脏杂志,2001,13(6):473-475.
[3] Simpson P,Savion S.Differentiation of rat myocytes in single cell cultures with and without proliferating nonmyocardial cells.Cross-striations,ultrastructure,and chronotropic response to isoproterenol[J].Cirac Res,1982,50(1):101-106.
[4] Brand NJ,Lara-Pezzi E,Rosenthal N,et al.Analysis of cardiac myocyte biology in transgenic mice:a protocol for preparation of neonatal mouse cardiac myocyte cultures[J].Methods Mol Biol,2010,633(5):113-124.
[5] 谭玉珍,王海杰.生后不同时间乳鼠心肌细胞的形态结构和功能特征[J].解剖学报,2009,40(4):567-572.
[6] 刘霞,王常勇.新生大鼠心肌细胞的分离和培养[J].西北农林科技大学学报:自然科学版,2005,33(6):35-37.
[7] 郭军,鲍翠玉,林国生,等.新生大鼠心肌细胞培养方法的改进[J].心血管康复医学杂志,2006,15(6):538-540.
[8] 王佳南,张晓刚,汤为学,等.新生大鼠心肌细胞原代培养方法的改良[J].重庆医科 大 学学报,2009,34(5):600-603.
[9] Ramos-Mondrag ón R,Vega AV.Long-term modulation of Na+and K+channels by TGF-β1 in neonatal rat cardiac myocytes[J].Pflugers Arch,2011,461(2):235-247.
[10] 庞勇军,孙莉,谢文娟,等.新生大鼠心肌细胞分离、纯化及培养方法的改进[J].上海交通大学学报:医学版,2011,31(4):520-523.
[11] Bes S,Roussel P,Laubriet A,et al.Influence of deep hypothermia on the tolerance of the isolated cardiomyocyte to ischemia-reperfusion[J].J Mol Cell Cardiol,2001,33(11):1973-1988.
[12] Chiu CZ,Wang BW,Chung TH,et al.AngiotensinⅡand the ERK pathway mediate the induction of myocardin by hypoxia in cultured rat neonatal cardiomyocytes[J].Clin Sci(Lond),2010,119(7):273-282.
