芽孢杆菌35家族β-半乳糖苷酶的性质及其在合成低聚半乳糖中的应用
2023-11-06王建宇江正强闫巧娟
王建宇, 李 婷, 李 敬, 江正强, 闫巧娟,*
(1.中国农业大学 工学院/中国轻工业食品生物工程重点实验室, 北京 100083;2.中国农业大学 食品科学与营养工程学院, 北京 100083)
低聚半乳糖(galactooligosaccharides,GOS)为乳糖的非还原端半乳糖上连接不同数量(2~8个)的半乳糖,是一种功能性低聚糖,常作为健康食品原料广泛应用于食品等行业,多年来备受关注[1-2]。GOS除具有益生活性外,还有预防蛀牙和调节脂质代谢等功效[1,3]。GOS的安全性已得到广泛认可,如美国已将其作为公认安全的食品原料,我国也批准其为营养增强剂和新食品原料。GOS与人乳中的人乳寡糖在结构与功能上具有一定的相似性,可被人体内的肠道微生物特异性利用,已批准用于婴幼儿配方奶粉中[4]。
酶法合成GOS是目前研究最多的GOS合成方法,也是工业化生产GOS的方法[4]。β-半乳糖苷酶(EC3.2.1.23)是一种糖苷水解酶,既可以催化糖类化合物中非还原端β-半乳糖残基的水解,也能够以高浓度乳糖作为底物,通过转糖苷作用合成GOS。β-半乳糖苷酶合成GOS的过程为,β-半乳糖苷酶首先水解乳糖,然后利用其转糖基活性将半乳糖转移至不同的糖基受体上,从而形成GOS[1,5]。β-半乳糖苷酶广泛存在于动物、植物以及微生物中。微生物具有来源广、繁殖速度快以及生长周期短等优点,是β-半乳糖苷酶的主要来源[6]。工业化生产GOS所用的β-半乳糖苷酶多数来源于乳酸克鲁维酵母(Kluyveromyceslactis)、米曲霉(Aspergillusoryzae)以及环状芽孢杆菌等[1],但是大多数仍存在GOS产率低的问题[7]。因此,发掘酶学性质优良且转糖苷活性高的β-半乳糖苷酶至关重要。
芽孢杆菌来源的β-半乳糖苷酶性质优良,但是多数研究集中于β-半乳糖苷酶的水解活性[8-12]。另外,芽孢杆菌β-半乳糖苷酶也具有较好的GOS合成能力,如已有报道,芽孢杆菌[13]和巴伦葛兹类芽孢杆菌(Paenibacillusbarengoltzii)[14]β-半乳糖苷酶均能够合成GOS,产率分别为36%和47.9%,其中,多数GH35家族β-半乳糖苷酶合成GOS的产率较高,可达40%[15-17]。然而,迄今利用芽孢杆菌β-半乳糖苷酶合成GOS的报道仍旧较少,不足以满足工业化大量和高效生产GOS的需求。因此,从芽孢杆菌中发掘高效合成GOS的新型β-半乳糖苷酶可以为工业化生产GOS提供更多的选择。
本研究拟从芽孢杆菌基因组中发掘新的糖苷水解酶35家族β-半乳糖苷酶基因。将该基因在大肠杆菌中表达,研究重组酶的酶学性质,并利用该酶制备GOS,以期为GOS的酶法合成提供理论依据。
1 材料与方法
1.1 材料与试剂
大肠杆菌DH5α和大肠杆菌 BL21 (DE3),北京博迈德生物技术公司;限制性内切酶和T4DNA连接酶,美国NEB公司;TransStart FastpfuDNA 聚合酶和ExTaq DNA聚合酶,北京全式金生物技术有限公司;人工合成糖苷[oNP-β-galactopyranoside(β-oNPGal)、pNP-β-galactopyranoside(β-pNPGal)、pNP-β-fucopyranoside(pNP-Fuc)、pNP-β-glucopyranoside(β-pNPGlu)、pNP-β-mannopyranoside(β-pNPMan)、pNP-β-xylopyranoside(β-pNPXyl)、pNP-β-N-acetylglucosaminide(β-pNPGlcNAc)、pNP-α-galactopyranoside(α-pNPGal)和pNP-α-glucopyranoside(α-pNPGlu)],美国Sigma公司;标准品(乳糖、葡萄糖和半乳糖),上海源叶生物科技有限公司。其他试剂如无特殊说明均为分析纯。
1.2 仪器与设备
MyCycler型PCR自动扩增仪和Power Pac BasicTM型电泳仪,美国Bio-Rad公司;TU-1800PC型紫外可见分光光度计,北京普析通用仪器有限责任公司;JY92-Ⅱ型超声波细胞粉碎机,宁波新芝科技股份有限公司;KTA型蛋白纯化系统,美国GE公司;1260 Infinity型高效液相色谱仪,美国Agilent公司。
1.3 实验方法
1.3.1β-半乳糖苷酶基因的克隆与表达
芽孢杆菌来源的β-半乳糖苷酶基因(BABgal35A)序列从NCBI (https:∥www.ncbi.nlm.nih.gov/)上获得,由上海擎科生物科技有限公司合成。根据序列信息设计BABgal35A上游引物(5′-GAATTCATGTTAACGTTTAATGAAAAAT CATTTTT-3′)和下游引物(5′-GCGGCCGCTTATCCTAAAACGGGCGTATCAA-3′)。上下游引物分别包含NdeⅠ和BamH Ⅰ酶切位点(下划线表示),以合成的BABgal35A基因为模板进行PCR扩增。PCR反应条件为:94 ℃,5 min;94 ℃,30 s;54 ℃,30 s;72 ℃,1 min;34个循环;72 ℃,5 min。凝胶回收的PCR产物和pET-28a(+)载体(Invitrogen公司)用NdeⅠ和BamH Ⅰ双酶切,构建重组质粒并转入大肠杆菌DH5α中,筛选阳性克隆转化子和提取重组质粒pET-28a-BABgal35A。将重组质粒转化至大肠杆菌BL21 (DE3)中,于37 ℃培养 12 h。 挑取单菌落接种至15 mL含50 μg/mL卡那霉素的LB培养基中,37 ℃、200 r/min培养12 h作为种子液。种子液按体积分数为1%的接种量接种至300 mL含50 μg/mL卡那霉素的LB培养基中,培养菌体密度OD600达0.6~0.8后,加入终浓度为1 mmol/L的IPTG,在20 ℃、200 r/min条件下诱导培养12 h。
1.3.2β-半乳糖甘酶的纯化
发酵液经10 000 r/min离心3 min,收集菌体细胞并用缓冲液A(20 mmol/L Tris-HCl,500 mmol/L NaCl,20 mmol/L咪唑,pH值为8.0)悬浮细胞。悬浮液超声破壁后,10 000 r/min离心10 min,收集上清液即为粗酶液。粗酶液上样到预先用缓冲液A平衡的Ni-IDA(1 cm×10 cm)上,在蛋白纯化系统上用缓冲液A和缓冲液B(20 mmol/L Tris-HCl,500 mmol/L NaCl,200 mmol/L咪唑,pH值为8.0)以-1 mL/min的流速对目标蛋白进行 20~200 mmol/L梯度咪唑的线性洗脱。收集具有β-半乳糖苷酶活性的洗脱液,在磷酸盐缓冲液(20 mmol/L,pH值为8.0)中透析过夜,采用 SDS-PAGE 法分析蛋白纯度。将该蛋白重组酶命名为BABgal35A。
1.3.3BABgal35A酶活力和蛋白含量的测定
β-半乳糖苷酶的酶活力测定以225 μL 50 mmol/L 乙酸盐缓冲液(pH值为5.0)配制的5 mmol/L β-oNPGal为底物,加入25 μL稀释的酶液,55 ℃反应10 min。反应结束后,加入750 μL Na2CO3(2 mol/L)终止反应,测定OD410值。酶活力单位定义:在pH值为5.0和温度为55 ℃条件下,每分钟水解β-oNPGal产生1 μmoloNP所需酶量,为1个酶活力单位(U)。
蛋白含量参照Lowry法测定[18],以牛血清蛋白作为标准蛋白。
1.3.4BABgal35A的酶学性质的测定
1.3.4.1 最适pH值和酸碱稳定性的测定
利用不同pH值(3.0~9.0)的缓冲液(50 mmol/L)配制5 mmol/L的β-oNPGal,所用缓冲液包括柠檬酸盐缓冲液(pH值为3.0~6.0)、乙酸盐缓冲液(pH值为4.0~6.0)、MES 缓冲液(pH值为5.5~6.5)、磷酸盐缓冲液(pH值为6.0~8.0)和Tris-HCl 缓冲液(pH值为7.0~9.0)。按照标准方法测定不同pH值下的酶活力。以最高酶活力为100%,计算各pH值下的相对酶活。酸碱稳定性的测定:用不同pH值的缓冲液将酶液稀释,在40 ℃保温30 min,立即冰水浴30 min,按照标准方法测定残余酶活,以未处理的酶液酶活力为100%,分别计算各pH值下的相对酶活。
1.3.4.2 最适温度、热稳定性以及半衰期的测定
用50 mmol/L乙酸盐缓冲液(pH值为5.0)配制5 mmol/L的β-oNPGal,测定不同温度(20~75 ℃)下的酶活力。以最高酶活为100%,分别计算各温度下的相对酶活。热稳定性的测定:用50 mmol/L 乙酸盐缓冲液(pH值为5.0)稀释酶液并置于不同温度(20~55 ℃)下保温30 min,立即冰水浴30 min,按照标准方法测定残余酶活;以未处理的酶液酶活力为100%,分别计算不同温度下的相对酶活力。半衰期的测定:用50 mmol/L乙酸盐缓冲液(pH值为5.0)稀释酶液,分别在40、45、50 ℃下保温,在不同时间点取样后立即冰水浴30 min,在最适条件(55 ℃,pH值为5.0)下测定残余酶活;以未处理酶液的酶活力为100%,分别计算各温度处理后的相对酶活,酶活降低至50%所需的时间即为半衰期。
1.3.5BABgal35A的底物特异性与动力学参数的测定
1.3.5.1 底物特异性的测定
分别以人工合成糖苷(β-oNPGal、β-pNPGal、pNP-Fuc、β-pNPGlu、β-pNPMan、β-pNPXyl、β-pNPGlcNAc、α-pNPGal和α-pNPGlu)和乳糖为底物测定BABgal35A的底物特异性。人工合成糖苷的酶活按照标准方法测定。乳糖的测定参照葡萄糖氧化酶法,即用50 mmol/L乙酸盐缓冲液(pH值为5.0)配制质量浓度为50 g/L的乳糖并加入稀释的酶液,55 ℃反应10 min,葡萄糖的含量利用葡萄糖氧化酶试剂盒测定。酶活力单位定义:每分钟水解人工合成糖苷或乳糖产生1 μmoloNP/pNP或葡萄糖所需酶量为1个酶活力单位(U)。以β-oNPGal为底物时的酶活力为100%,计算不同底物下酶活力的相对值。
1.3.5.2 动力学参数的测定
用50 mmol/L pH值5.0 的乙酸盐缓冲液配制底物浓度为 0.4~4.0 mmol/L 的β-oNPGal,按照标准方法于55 ℃ 反应5 min后测定其酶活力,通过GraFit软件计算出米氏常数Km和最大反应速度Vmax。
1.3.6BABgal35A合成低聚半乳糖条件的优化
在50 mmol/L乙酸盐缓冲液(pH值为5.0)体系下,以乳糖为底物,研究底物浓度、加酶量、反应温度和时间4个因素对BABgal35A合成GOS能力的影响。选择质量浓度为300~500 g/L的乳糖,加入 2 U/mL 的酶液,35 ℃反应12 h后,沸水浴5 min。确定最适乳糖浓度后,其他条件不变,优化BABgal35A合成GOS的加酶量(1~10 U/mL)。反应温度的优化是在最优乳糖浓度和最适加酶量的条件下进行的,在不同温度(25~45 ℃)下反应12 h。利用 50 mmol/L 乙酸盐缓冲液(pH值为5.0)配制质量浓度为400 g/L的乳糖溶液,加入5 U/mL的BABgal35A,40 ℃反应24 h,分别在不同时间点取样,根据式(1)计算GOS产率。采用高效液相色谱法分析样品,检测条件参照文献[14]。
GOS产率 =(M-m)/M×100%。
(1)
式(1)中,M,初始乳糖质量浓度,g/L;m,不同时间点样品的乳糖、葡萄糖以及半乳糖的质量浓度之和,g/L。
1.4 数据处理
采用Origin 8.5进行数据统计和图片处理,所有实验均重复3次。
2 结果与讨论
2.1 BABgal35A的克隆与序列分析
芽孢杆菌来源的BABgal35A全长为1 740 bp,编码579个氨基酸。利用ExPASy ProtParam tool预测其分子质量和等电点,分别为66.6 kDa和4.99。NCBI-BLAST分析表明(图1),BABgal35A与环状芽孢杆菌来源的GH35家族β-半乳糖苷酶(Genbank no. 4MAD_A)[19]同源性最高,为 79.9%。其次,与候选菌门BRC1细菌HGW-BRC1-1(candidate division BRC1bacteriumHGW-BRC1-1, Genbank no. PKO20086.1)[20]、厚壁菌门细菌(Firmicutesbacterium, Genbank no. HHV43508.1)[21]以及梭菌目细菌(Clostridialesbacterium, Genbank no. HBG75975.1)[22]来源的β-半乳糖苷酶的同源性分别为56.3%、56.0%和55.4%。因此,BABgal35A可能是一个新型的GH35家族β-半乳糖苷酶。
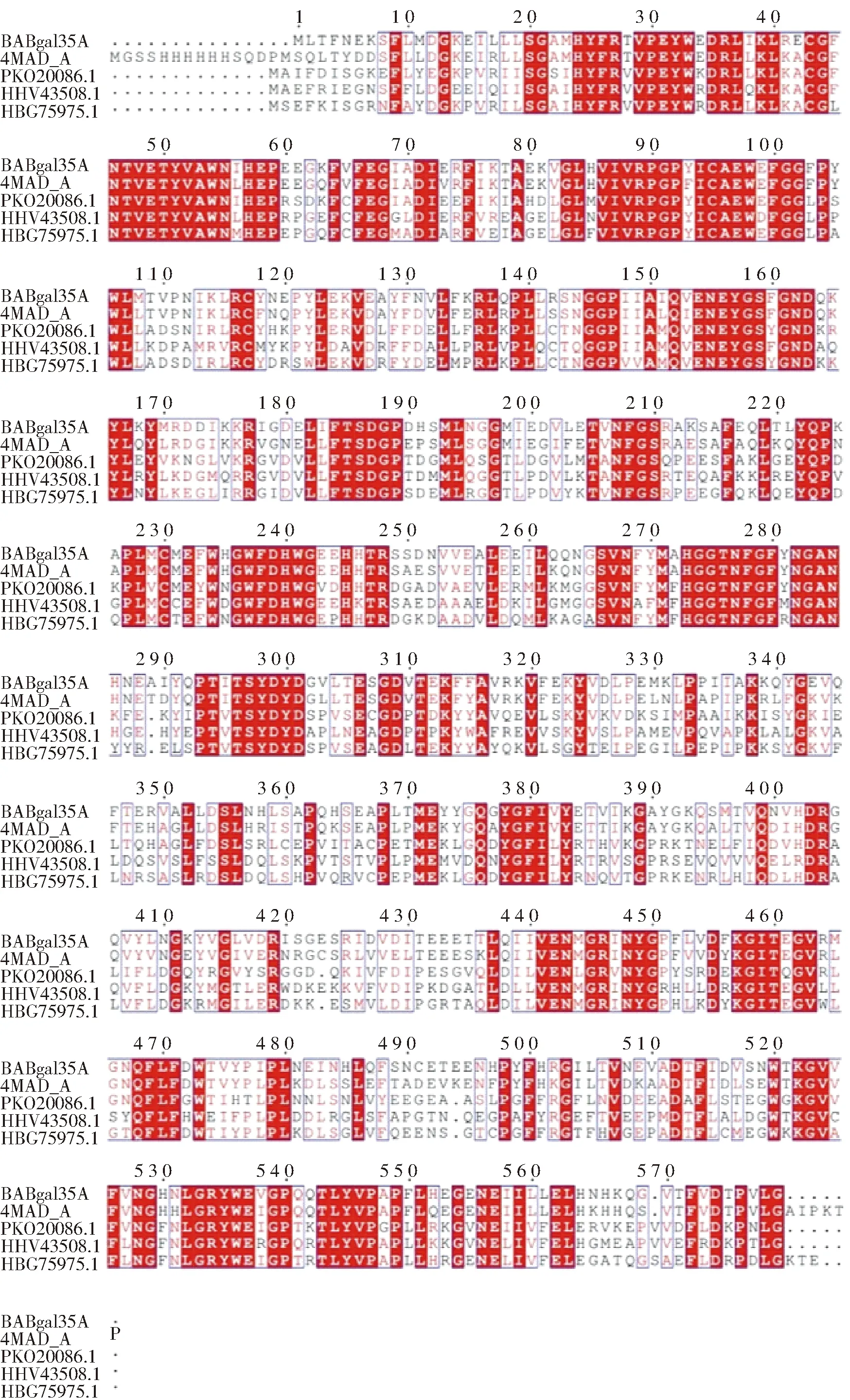
多重序列比对的序列分别为BABgal35A及环状芽孢杆菌(4MAD_A)、候选菌门BRC1细菌HGW-BRC1-1(PKO20086.1)、厚壁菌门细菌(HHV43508.1)和梭菌目细菌(HBG75975.1)来源的β-半乳糖苷酶的氨基酸序列。相同的残基在红色背景上显示为白色,保守残基在白色背景上显示为红色。图1 BABgal35A与其他β-半乳糖苷酶氨基酸序列的多重序列比对Fig.1 Multiple alignment of amino acid sequences of BABgal35A and other β-galactosidases
2.2 BABgal35A的表达和纯化分析
BABgal35A在大肠杆菌中可溶表达。粗酶液和经过Ni-IDA纯化后的酶液组成的SDS-PAGE电泳分析结果如图2。由图2可知,纯酶的分子质量约为60 kDa,与预测的分子质量接近。BABgal35A的纯化实验结果见表1。表1显示,酶活力的回收率为88.3%,纯化倍数为5.0。

表1 BABgal35A纯化结果
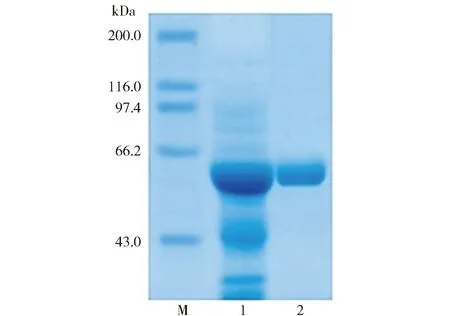
泳道M为高分子质量标准蛋白,泳道1为粗酶液,泳道2为纯酶。图2 BABgal35A的纯化电泳分析结果Fig.2 SDS-PAGE analysis of purified BABgal35A
目前已报道的β-半乳糖苷酶分子质量一般在50~180 kDa,BABgal35A的分子质量约为60 kDa,与蜜源芽孢杆菌来源的β-半乳糖苷酶(57 kDa)[23]同属于低分子质量的β-半乳糖苷酶。BABgal35A的分子质量低于大多数GH 35家族的β-半乳糖苷酶,如土壤宏基因组的Bgal_144-3(65.6 kDa)和Bgal_375(112 kDa)[24],以及产黄青霉菌(Penicilliumchrysogenum)31B来源的3个β-半乳糖苷酶[25](115、110、120 kDa)。
2.3 BABgal35A的酶学性质分析
BABgal35A的酶学性质研究结果见图3。BABgal35A的最适pH值为5.0[图3(a)],用不同缓冲液处理30 min后,该酶在pH值为4.5~8.0的缓冲液中仍能保持80%以上的酶活力[图3(b)]。该酶的最适温度为55 ℃[图3(c)],在20~45 ℃处理30 min,残余酶活力仍高于80%[图3(d)]。在不同温度下处理酶,测得该酶在40、45、50 ℃的半衰期分别为605、85、15 min[图3(e)]。
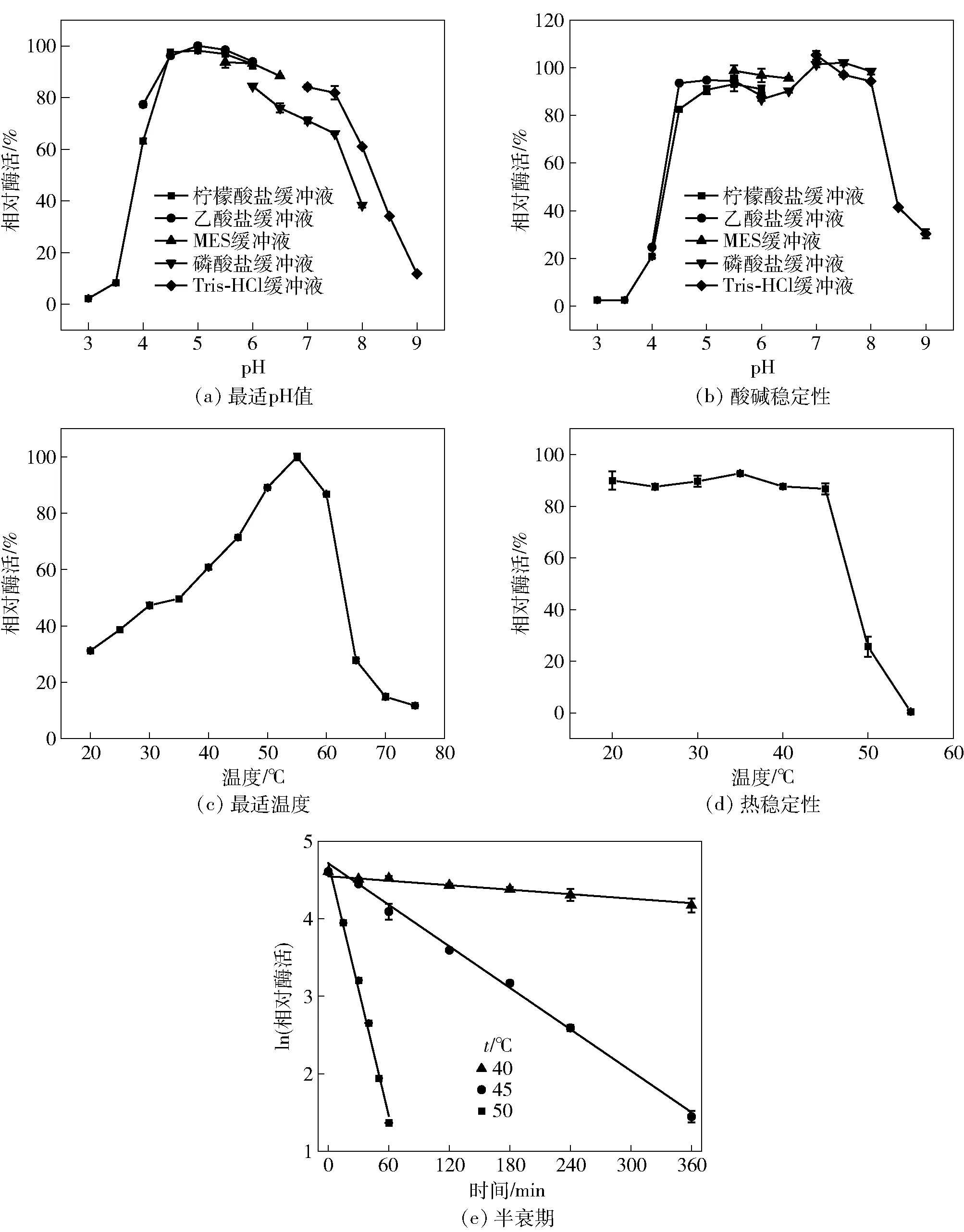
图3 BABgal35A的酶学性质Fig.3 Enzymatic properties of BABgal35A
大多数微生物来源的β-半乳糖苷酶最适pH值为3.0~8.5[6],其中,芽孢杆菌来源的β-半乳糖苷酶最适pH值多数在中性范围内(6.0~8.0)[8-13]。GH 35家族的β-半乳糖苷酶最适pH值大多在酸性范围内,本研究中,BABgal35A的最适pH值为5.0[图3(a)],与土壤宏基因组[24]和产黄青霉菌31B[25]来源GH35家族的Bgal_137和PcBGAL35B最适pH值相同,低于Bgal_144-3(pH值为6.0)和PcBGAL35C(pH值为5.5)的最适pH值。BABgal35A在pH值为4.5~8.0时,40 ℃处理30 min仍保持80%以上的酶活力[图3(b)],具有较宽的酸碱稳定范围,优于巴伦葛兹类芽孢杆菌(pH值为6.0~8.0)[14]、阿耶波多氏芽孢杆菌(pH值为5.0~7.0)[10]和米曲霉(pH值为5.0~7.5)[26]等来源的β-半乳糖苷酶。该酶最适温度为55 ℃[图3(c)],在20~45 ℃保持稳定[图3(d)]。已报道的β-半乳糖苷酶最适温度在20~105 ℃,BABgal35A的最适温度处于中等水平,比巴伦葛兹类芽孢杆菌(45 ℃)[14]来源的β-半乳糖苷酶要高,低于芽孢杆菌(60 ℃)[13]来源的β-半乳糖苷酶。不同来源的β-半乳糖苷酶的热稳定性差异较大,BABgal35A的热稳定性范围比米曲霉(<40 ℃)[26]和乳酸克鲁维酵母(<40 ℃)[27]来源的β-半乳糖苷酶宽,与巴伦葛兹类芽孢杆菌(<45 ℃)[14]来源的β-半乳糖苷酶相近。而蜜源芽孢杆菌[23]来源的β-半乳糖苷酶热稳定性更好,在70 ℃以下保持稳定。
BABgal35A的底物特异性分析结果见表2。在最适条件下,该酶对β-oNPGal的水解活性最高(100%),其余依次为β-pNPGal、pNP-Fuc和乳糖,对其他底物没有水解活性。BABgal35A对β-oNPGal的Km和Vmax值分别为1.14 mmol/L和21.53 μmol/(min·mg)。BABgal35A对3种人工底物具有水解活性,同时具有β-半乳糖苷酶和岩藻糖苷酶活性,相较于多数β-半乳糖苷酶具有优势。如巴伦葛兹类芽孢杆菌[18]和深海交替单胞菌ML52(deep-sea BacteriumAlteromonassp. ML52)[28]来源的β-半乳糖苷酶都只具有β-半乳糖苷酶活性而不具有岩藻糖苷酶活性。因此,BABgal35A具有广泛的底物特异性,应用前景广阔。
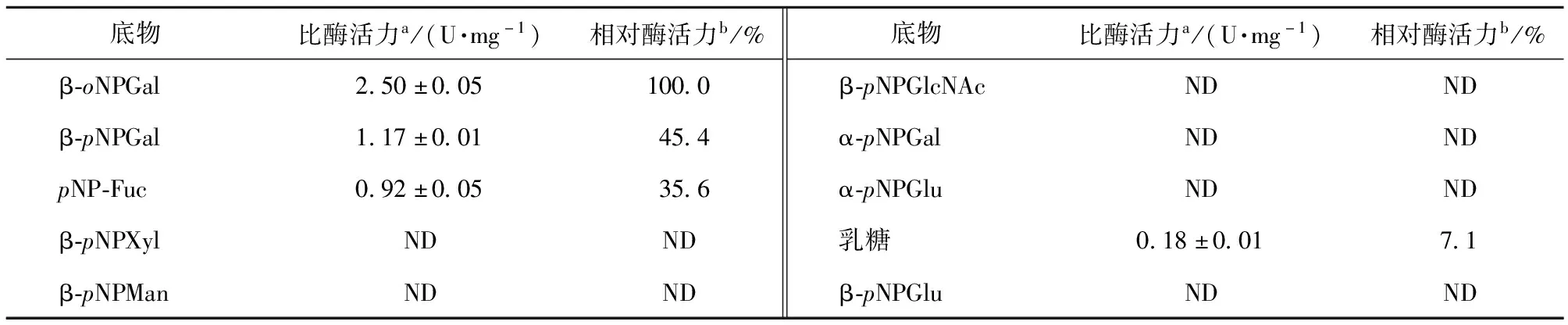
表2 BABgal35A的底物特异性
2.4 BABgal35A合成低聚半乳糖的优化结果
乳糖浓度、加酶量、反应温度以及时间对BABgal35A合成GOS产率的影响,实验结果如图4。当乳糖质量浓度为400 g/L时,GOS产率(26%)达到最高[图4(a)]。当底物质量浓度为400 g/L的乳糖时,GOS的产率随着加酶量的增加先快速增加而后出现明显下降,5 U/mL是BABgal35A合成GOS的最适加酶量[图4(b)]。温度显著影响GOS的产率,当温度从25 ℃提高到40 ℃时,GOS的产率呈上升趋势,而进一步提高温度,GOS的产率下降,因此,GOS的产率在40 ℃时达到最高,为34%[图4(c)]。在优化条件下,随着反应时间的增加,GOS产率明显增加,反应进行到12 h时达到最高,产率为34%,随着反应继续进行,GOS含量下降[图4(d)]。
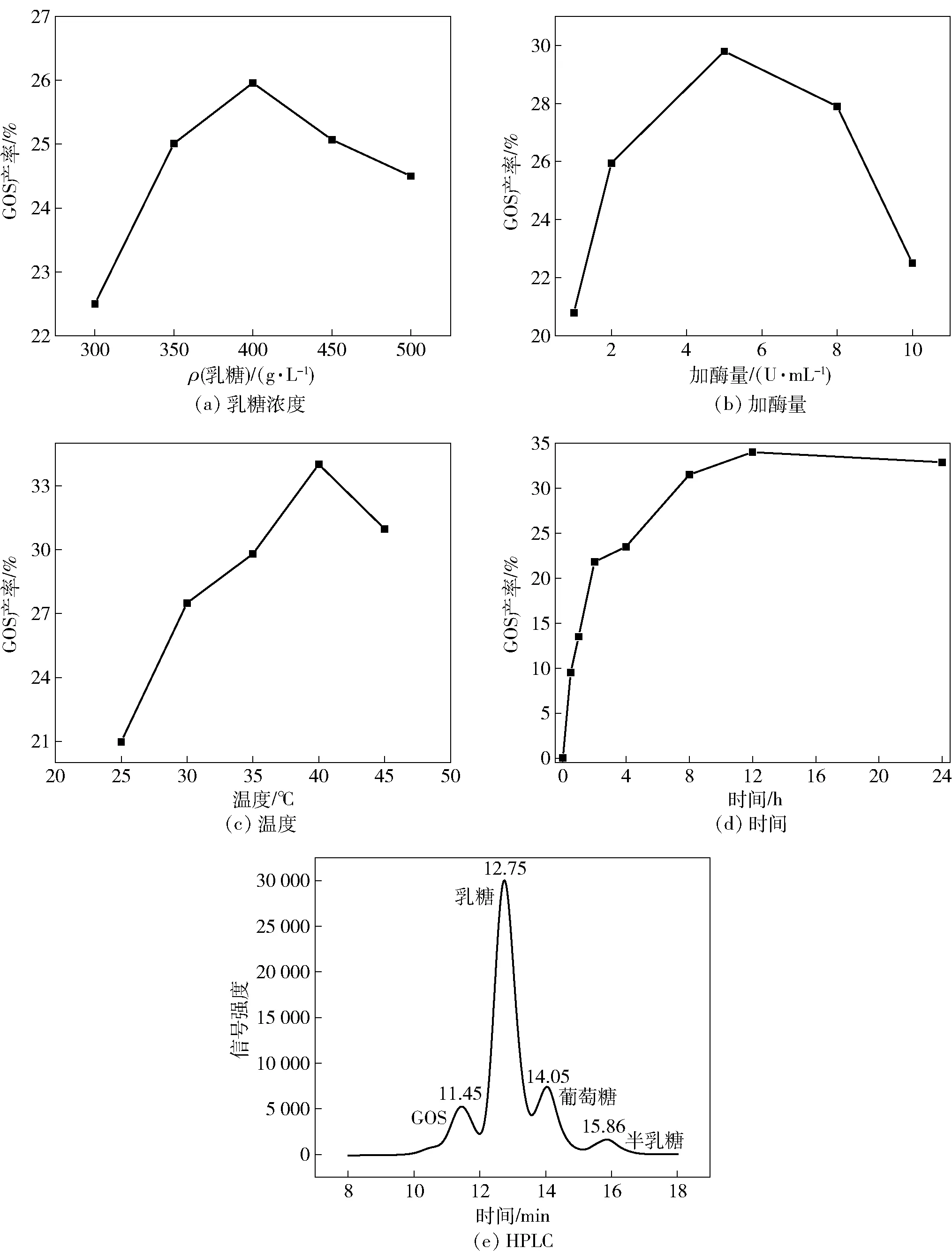
图(e)表示利用50 mmol/L乙酸盐缓冲液(pH值为5.0)配制质量浓度为400 g/L的乳糖溶液,加入5 U/mL的BABgal35A,40 ℃反应12 h后,产物的HPLC。图4 BABgal35A合成GOS的最适条件和HPLC分析结果Fig.4 Optimal conditions for synthesis of GOS by BABgal35A and results of HPLC
目前,已有多种β-半乳糖苷酶用于GOS的合成,产率通常在12%~50%[13-14,27,29-31]。Hsu等[30]对长双歧杆菌(Bifidobacteriumlongum)BCRC15708来源的β-半乳糖苷酶进行表达,以质量浓度为400 g/L的乳糖为底物,反应10 h后GOS产率达32.5%。Arreola等[31]利用短双歧杆菌(Bifidobacteriumbreve)DSM 20213来源的β-半乳糖苷酶合成GOS,产率最高为33%。本研究中,β-半乳糖苷酶(BABgal35A)利用乳糖为底物合成GOS的产率达34%[图4(d)],与长短两种双歧杆菌来源的β-半乳糖苷酶合成GOS的产率相近,处于较高水平。其产率高于乳酸克鲁维酵母(12.2%)和米曲霉(26.7%)来源的β-半乳糖苷酶[27,29],而低于巴伦葛兹类芽孢杆菌(47.9%)来源的β-半乳糖苷酶[14]。因此,芽孢杆菌来源的BABgal35A是一种高效合成GOS的β-半乳糖苷酶,可以作为GOS工业化生产的选择。
3 结 论
实现了一种芽孢杆菌来源的新型β-半乳糖苷酶基因(BABgal35A)在大肠杆菌中的可溶性表达,并对其酶学性质进行了表征。BABgal35A的最适pH值为5.0,温度为55 ℃,在pH值为4.5~8.0时具有良好的酸碱稳定性。BABgal35A具有广泛的底物特异性。在最适条件下,BABgal35A合成GOS的产率达34%,处于较高水平。本研究为酶法合成GOS提供了更多选择。此外,为进一步提高BABgal35A合成GOS的产率,可以对该酶进行分子改造,例如定向进化和理性设计等。
