固定化表面展示锰过氧化物酶对甲基橙的吸附特性
2023-10-19王艳君黄佳瑶陈少煌赵鹏飞
王艳君,黄佳瑶,陈少煌,赵鹏飞
(1.福建技术师范学院 食品与生物工程学院,福清 350300;2.食品软塑包装技术福建省高校工程研究中心,福清 350300)
印染废水来源及污染物成分十分复杂,具有水质变化大、有机物含量高、色度高(主要为含偶氮染料)等特点,直接排放危害人类健康和生态环境,同时造成水资源浪费。如何减少废水中偶氮染料的含量,同时有效控制其初级降解产物的危害,已成为印染废水处理的主要问题。现行的含偶氮染料的废水处理方法,包括物理法、化学法、生物法等。生物法具有耗能低、代谢彻底、环境友好等特点,是应用最为广泛的处理方法[1-2];但从目前的应用状况来看,投资和运行费用较高,有的操作复杂、后续处理程序繁琐而难以推广,尤其是对含有机物结构复杂、高浓度的偶氮染料废水的处理更具难度。随着染料产品种类日益繁多,并朝着抗光解、抗氧化、抗生物氧化方向发展,染料废水处理难度加大。废水中还含有卤化物、硝基物、苯胺、酚类,以及无机盐等原料、辅料及副产品,更增加了该类废水处理的难度。因此,寻求高效、低廉、简化的偶氮染料废水处理技术已成为化学、环境和生物学家共同努力的目标。
利用生物方法,主要有好氧法、厌氧法和以细菌、真菌、藻类、酶为基础的微生物修复技术,以微生物来减轻或消除偶氮染料废水的污染已有报道。如摩根菌(Morganellasp.)[3]、裂褶菌(Schizophyllumsp.)[4-5]、小球藻(Chlorellavulgaris)[6]等微生物均被考虑用作偶氮染料废水的生物处理剂。最初,国内外主要通过大规模的微生物筛选方法,从自然界中获得对偶氮染料具有吸附及降解功能的天然菌株,研究发现,在多种微生物细胞内普遍存在对偶氮染料具有降解功能的酶类,脱色原因均是染料被酶分解,特别是偶氮双键被打开[7]。在真菌中是以白腐真菌(Phanerochaetcchrysosporium)为主要的偶氮染料废水脱色降解菌[8-9],它的降解机理主要是在好氧条件下产生的胞外酶类,如木质素过氧化物酶(LiP)、漆酶(LaC)和锰依赖过氧化物酶(MnP),其中,MnP是主要的染料降解脱色的胞外酶[10-11],该酶具有高度的非特异性和强氧化性,对许多结构不同、稳定性高的有机物具有广谱的降解能力[12-13]。因而真菌在偶氮染料废水处理中具有极大的优势,但在实际应用过程中发现丝状真菌的生长速度较慢,且对周围环境的高盐、高碱等耐受性较差,酵母菌由于兼具细菌生长速度快和丝状真菌的高产胞外酶等优点,同时又可避免细菌不能将染料彻底降解的缺陷和丝状真菌生长缓慢的不足,在染料脱色方面具有巨大应用潜力。酵母菌是一大类群单细胞真菌,具有生长代谢速度快,可产生多种酶类、反应器设计容易,废水处理效率高、耐受高有机负荷和高盐环境,成为污水处理技术中很有前途的菌种资源。
酵母细胞表面展示技术的优势在于可将外源蛋白锚定于细胞表面,利用全细胞作为生物催化剂,可省去酶的纯化步骤,提高全细胞催化剂的反复利用率,该方法也被广泛用于蛋白质文库筛选[14]、疫苗研制[15]、生物催化剂[16]等领域,也在多种酶[17-18]的生物催化过程中发挥了重要作用。
本实验室已成功筛选到高产锰过氧化物酶的裂褶菌(Schizophyllumcommune),并获取锰过氧化物酶基因构建了酵母表面展示载体,本研究以此为基础,预期在偶氮染料的生物降解领域及构建全细胞偶氮染料催化剂发挥重要的作用。
1 材料与方法
1.1 材料
1.1.1 菌种与试剂
酵母菌株EBY100购自Invitrogen公司、酵母表面展示质粒pYD1-mnp为本实验室构建。
YNB培养基:葡萄糖2%、蛋白胨2%、酵母粉1%、琼脂粉2%。MD培养基:YNB 0.67%、葡萄糖2%、亮氨酸0.01%、琼脂粉2%。YNB-CAA培养基:YNB 0.67%、酸水解酪氨酸0.5%、半乳糖2%、琼脂粉2%。
变性鲑鱼精DNA:在-20 ℃下保存,使用时沸水浴中煮沸5 min。FITC标记山羊抗小鼠IgG(H+L)、HA抗体购自碧云天生物技术公司。
1.1.2 醋酸锂转化酵母细胞
吸取酵母细胞EBY100感受态100 μL,加入质粒DNA 1 μg、100 μg的鲑鱼精DNA混匀;吸取700 μL的1×LiAC/40%PEG-3350/1×TE液体与上述EBY100感受态混匀,于30 ℃水浴锅内孵育30 min后加入88 μL的DMSO,置于42 ℃水浴锅内孵育7 min,5 000 r/min离心30 s,取上清液20 μL,加入1 mL的1×TE离心30 s后取上清液加入50 μL的1×TE混匀后涂布于MD培养基上,30 ℃培养3~5 d;挑取单菌落接种至YNB-CAA液体培养基中,30 ℃、250 r/min培养过夜,提取酵母基因组为模板,以pYD1特异性引物(5′-AGTAACGTTTGTCAGTAATTGC-3′/5′-GTCGATTTTGTTACATCTACAC-3′)进行PCR扩增,获取阳性转化子保存备用。
1.1.3 诱导酵母转化子产酶
吸取10 μL EBY100/mnp转化子菌液于YNB-CAA诱导产酶培养基中,30 ℃,180~220 r/min下摇瓶培养144 h,每隔12 h取样一次,用于测定酶活性及后续SDS-PAGE试验。
1.2 方法
1.2.1 酶活的测定
(1)酵母转化子产MnP酶活测定。酶活性测定方法为2,6-二甲氧基苯酚(DMP)法,于469 nm处测定2,6-二甲氧基苯酚(2.6-DMP)的氧化量进行MnP的酶活计量[19]。测定体系为4 mL,其中0.1 mmol/L酒石酸钠缓冲液3.36 mL(pH 4.5),10 mmol/L MnSO4200 μL,10 mmol/L 2.6-DMP 200 μL,10 mmol/L H2O240 μL,酶液样品200 μL。30 ℃水浴5 min,以4 mL蒸馏水做对照,测定其吸光度在469 nm处3 min内单位时间的吸光度变化值。以上试剂浓度均为终浓度,DMP被氧化后的产物的消光系数ε=49 600(L/mol·cm)。
一个酶活单位定义为每分钟内生成1 mol产物所需的酶液。酶活的计算方法[20]:U=(106×ΔA×V总)/(V酶×ε×ΔT×L),其中,ΔA为单位时间内吸光度的变化值;V总为反应体系的总体积,各方法反应体系均为4 mL;V酶为参与反应酶液的体积;ε为不同消光系数;ΔT为单位时间,均为1 min;L为比色皿的直径,本实验所用比色皿直径为1 cm;1 mol和mmol之间的单位换算为103,L和mL之间的单位换算为103,故总乘以106。
(2)不同培养时间对酶活性的影响。诱导产酶的时间从第12小时至第144小时。每隔12 h取样一次,酶活性的测定方法同上。
(3)不同温度、pH对酶活性的影响。温度设定为20、30、40、50和60 ℃中水浴20 min,水浴后迅速冷却降温,测定锰过氧化物酶的酶活。pH值分别设定为3.0、3.5、4.0、4.5、5.0和5.5。
(4)产酶最适碳源选择及最佳碳源浓度测定。以不加半乳糖的液体产酶培养基(YNB-CAA培养基)为基础,设置葡萄糖、乳糖、半乳糖、蔗糖、麸皮、麦芽糖等6种不同碳源进行产酶活性测定。以上述测定结果获得的最适碳源为基础,分别加入0.008、0.012、0.016、0.020、0.024、0.028 g/mL的半乳糖,检测不同碳源浓度对产酶活性的影响。
(5)产酶最适氮源选择及最佳氮源浓度测定。以不加YNB的液体产酶培养基(YNB-CAA培养基)为基础,设置硝酸钾、硫酸铵、蛋白胨、YNB不同的氮源处理,筛选出最适氮源。以上述测定结果获得的最适氮源为基础,分别加入0.005 6、0.006 0、0.006 4、0.006 8、0.007 2和0.007 6 g/mL的YNB,检测不同氮源浓度对产酶活性的影响。
1.2.2 SDS-PAGE检测
制备SDS-PAGE分离胶浓度为 12%,浓缩胶浓度为5%,电泳缓冲液pH值为8.8。蛋白样品为前面每12 h测酶活时所保存的样品。
1.2.3 免疫荧光检测
制片封闭结束后添加一抗HA抗体(小鼠单抗),使用比例为1∶40,使用1%的BSA稀释,在玻片周围添加20~50 μL,4 ℃过夜,于0.01 mol/L PBS溶液中泡洗3次,每次5~10 min;添加二抗FITC标记山羊抗小鼠IgG(H+L),使用比例为1∶500,使用1%的BSA稀释,在玻片周围添加20~50 μL,室温避光放置30 min后于0.01 mol/L PBS中浸泡3次,每次5~10 min;置于免疫荧光显微镜下观察。
1.2.4 固定化酵母细胞及转化子
取6 g氯化钙,溶于300 mL去离子水中,配成含量为2%的溶液,放置到42 ℃的水浴锅中,用注射器(11#)将海藻酸钠-酵母菌混合液在一定高度下缓慢滴入氯化钙溶液中造粒后置于4 ℃冰箱中固定化1 h。过滤掉容器内的液体,用去离子水洗涤所得固体一次后,再次过滤备用。将海藻酸钠固定化酿酒酵母EBY100微球(简称SA-EBY100)和海藻酸钠固定化酿酒酵母EBY100-MnP微球(简称SA-EBY100-MnP)于4 ℃保存备用。
1.2.5 甲基橙吸附率
取一定量的固定化酵母和一定浓度的甲基橙溶液,在150 r/min下恒温振荡3 h使吸附平衡,分离后取上清液于464 nm 处测定吸光度,计算得到固定化酵母对甲基橙的吸附率和吸附量。
吸附率:η=[(A-B)/A)]×100%;其中,A为甲基橙的初始浓度,mol/L;B为吸附后的甲基橙浓度,mol/L。
平衡吸附量:Qe=[(Co-Ce) ×V]/m;其中,Qe为材料的平衡吸附量,mg/g;Ce为吸附平衡后溶液中甲基橙的浓度,mg/L;Co为初始甲基橙的浓度,mg/L;V为甲基橙溶液的体积,L;m为加入的吸附剂的质量,g。
(1)等温吸附试验。分别移取浓度为10、20、30、40和50 mg/L的甲基橙溶液25 mL,加入2.5 g固定化酵母细胞,调节pH值为5.0,在30 ℃下振荡3 h,测量甲基橙的平衡浓度Ce,计算平衡吸附量Qe,根据上述步骤,进行不同温度(20、25、30和35℃)下的吸附试验。线模型有Langmuir方程及Freundlich方程[19]。
Langmuir:Ce/Qe=Ce/Qm+1/(Qmb);Freundlich:lgQe=(1/n)lgCe+lgKF;其中,Qm为最大吸附饱和量,mg/g,Qe为溶液的平衡吸附量,mg/g,b为吸附强度,KF为吸附系数,1/n为吸附指数[19]。
(2)吸附动力学试验。分别称取2.5 g固定化酵母置于含100 mL不同浓度(10、30和50 mg/L)甲基橙溶液中,pH 5.0,在30 ℃、150 r/min下振荡吸附,每隔一定时间取样测定甲基橙浓度,计算不同时刻甲基橙吸附量。Qt=(Co-Ct)V/W,其中,Qt为t时刻的吸附容量,mg/g;Ct为t时刻的溶液中吸附质的质量浓度,mg/L;V为甲基橙溶液体积,mL;W为吸附剂用量,g。准一级方程:lg(Qe-Qt)=lgQe-k1t;准二级方程:t/Qt=1/k2Qe2+t/Qe,其中,Qe为吸附平衡量,mg/g,Qt为某时刻的吸附量,mg/g,K1为准一级方程的动力学常数,K2为准二级方程的动力学常数[21]。
2 结果与分析
2.1 锰过氧化物酶基因的酵母细胞表面展示
Mnp基因两端引入BamH I/EcoR I酶切位点,与pYD1载体双酶切后连接;正向插入pYD1载体。将构建成功的载体转化酿酒酵母EBY100,通过LiAc介导的方法进行转化,转化子可在筛选平板MD上生长,如图1所示,挑取转化子进行菌落PCR及酶切鉴定进一步确认mnp基因片段已按预期设计的形式正确转入EBY100。从而完成EBY100的表面展示。
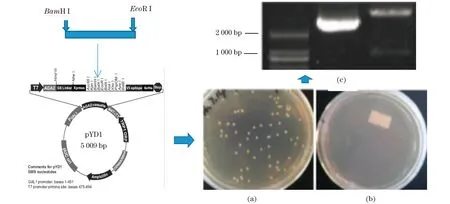
(a)转化子在MD平板上的筛选结果;(b)转化子在MM平板上的筛选结果;(c)转化子的酶切鉴定结果。
2.2 转化子产MnP的最佳时间
锰过氧化物酶的酶活性随培养时间变化,如图2所示,转化子所产锰过氧化物酶活性从第12小时到第60小时内随时间的增加而不断增大,而从第60小时后至第144小时锰过氧化物酶的活性随时间的增加而减少。在第60小时锰过氧化物酶的酶活性最高。

图2 EBY-MnP转化子产锰过氧化物酶随培养时间的变化
2.3 转化子产MnP的最适温度
酵母转化子所产锰过氧化物酶酶活在40 ℃酶活最高,结果如图3所示,在20~30 ℃范围内锰过氧化物酶活性呈上升趋势,而30 ℃后锰过氧化物酶活性增加的幅度变大,温度在40 ℃以后锰过氧化物酶的酶活开始下降,且锰过氧化物酶酶活下降的幅度大,到60 ℃检测不到该酶活性。
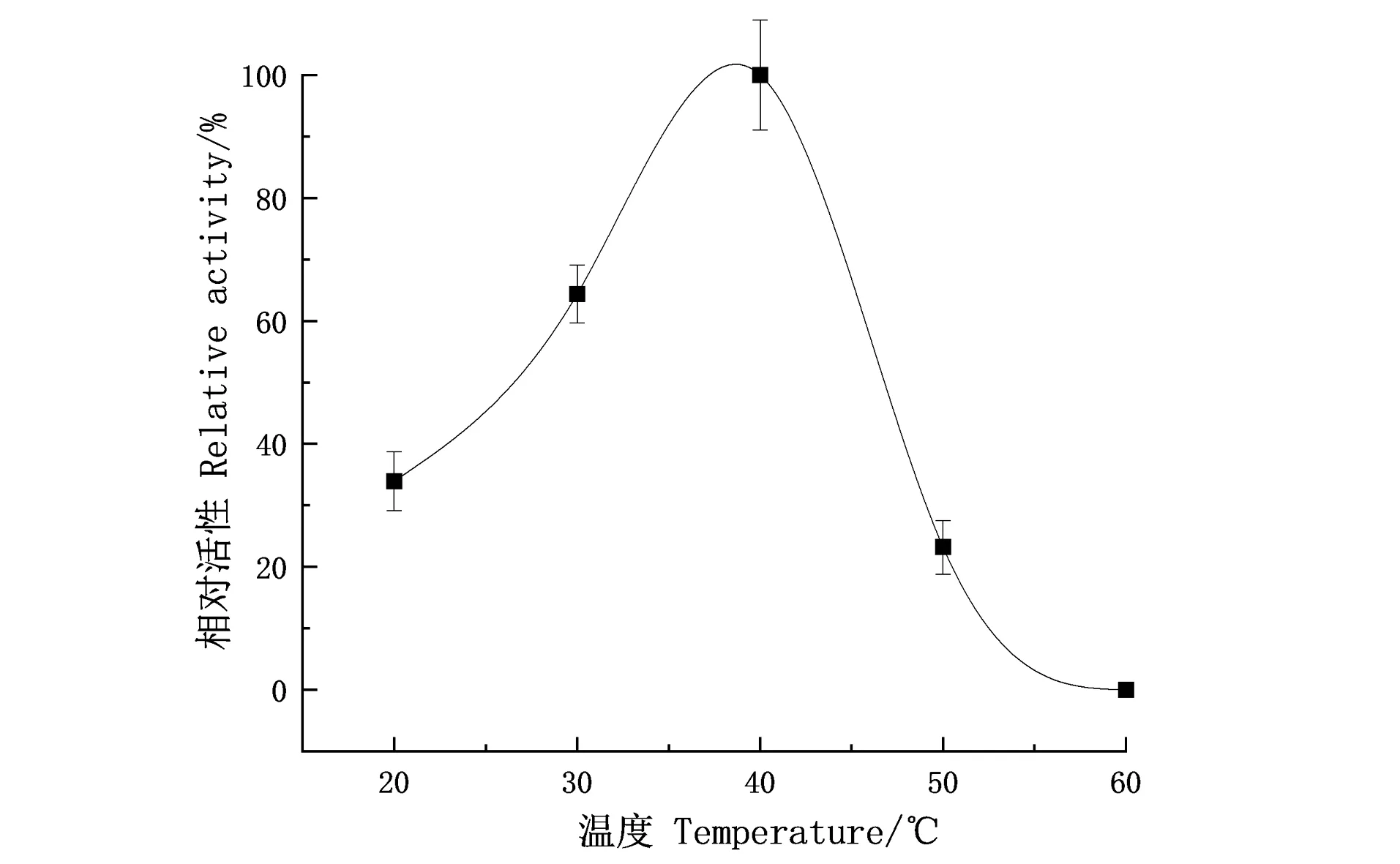
图3 温度对锰过氧化物酶活性的影响
2.4 pH对锰过氧化物酶活性的影响
测定酵母转化子产锰过氧化物酶在pH 3.5~4.5时逐渐升高,pH 4.5~5.5时逐渐降低,MnP活性在pH 3.5和5.5时呈现最低值,结果如图4所示,pH 4.5时MnP的活性最高,pH对锰过氧化物酶酶活性的影响较大。
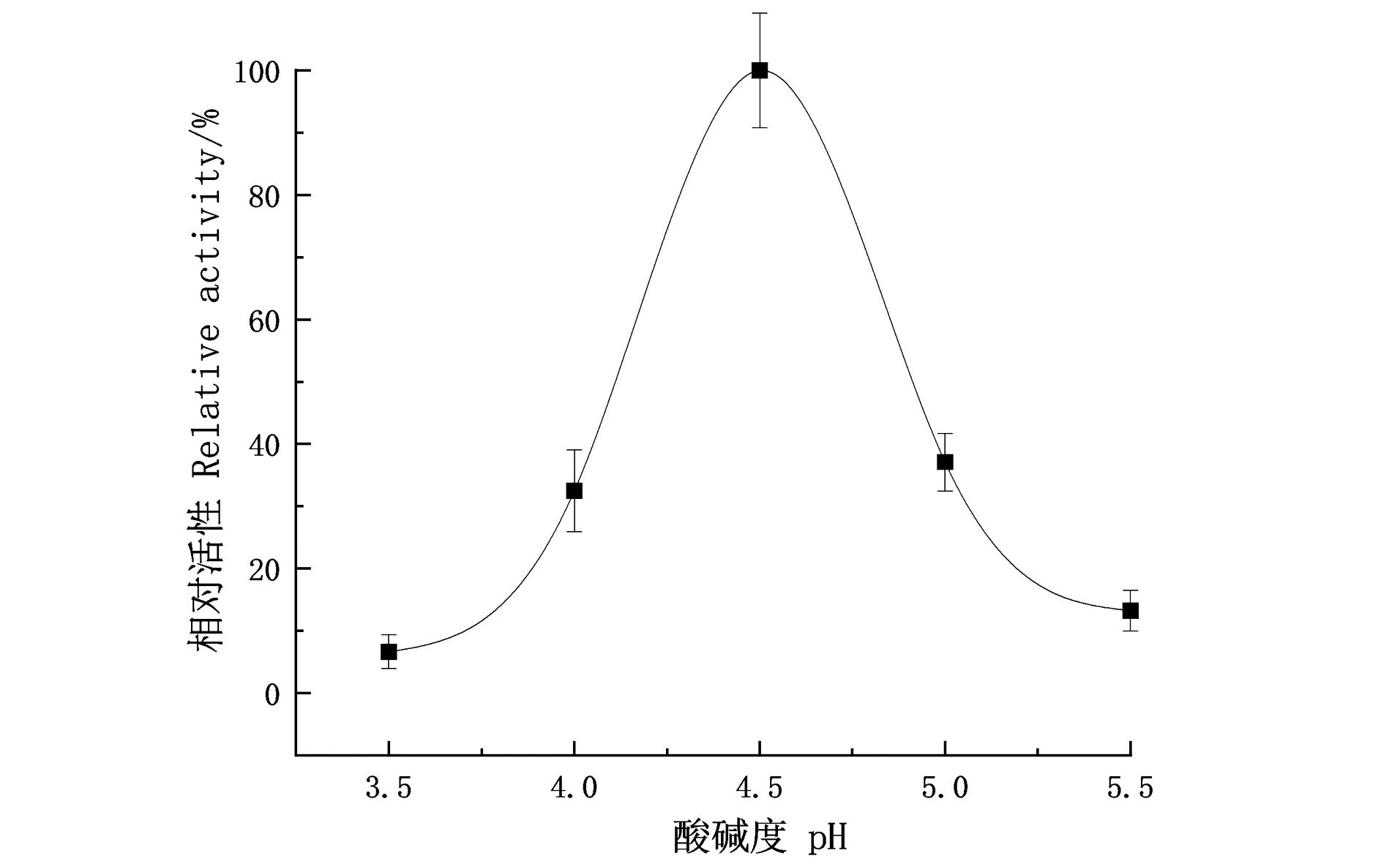
图4 pH对锰过氧化物酶活性的影响
2.5 转化子产MnP活性的碳源选择及最适浓度
分别选择不同碳源,测定转化子产锰过氧化物酶的活性,由图5可知,以麦芽糖、蔗糖为碳源时,EBY100-MnP转化子产MnP酶活性为0;以葡萄糖为碳源时,测得的MnP酶活性较低,仅为0.81 U;半乳糖、乳糖、麸皮均可使酵母转化子产MnP酶,半乳糖是EBY100-MnP转化子产MnP酶的最佳碳源。

图5 不同碳源对产MnP酶活性的影响
随着半乳糖浓度升高,酶活性随之升高,但在0.020~0.028 g/mL的半乳糖浓度下,酶活性随之降低,可见浓度过高的半乳糖会抑制转化子产锰过氧化物酶,因而选择最佳半乳糖浓度为0.020 g/mL(图6)。
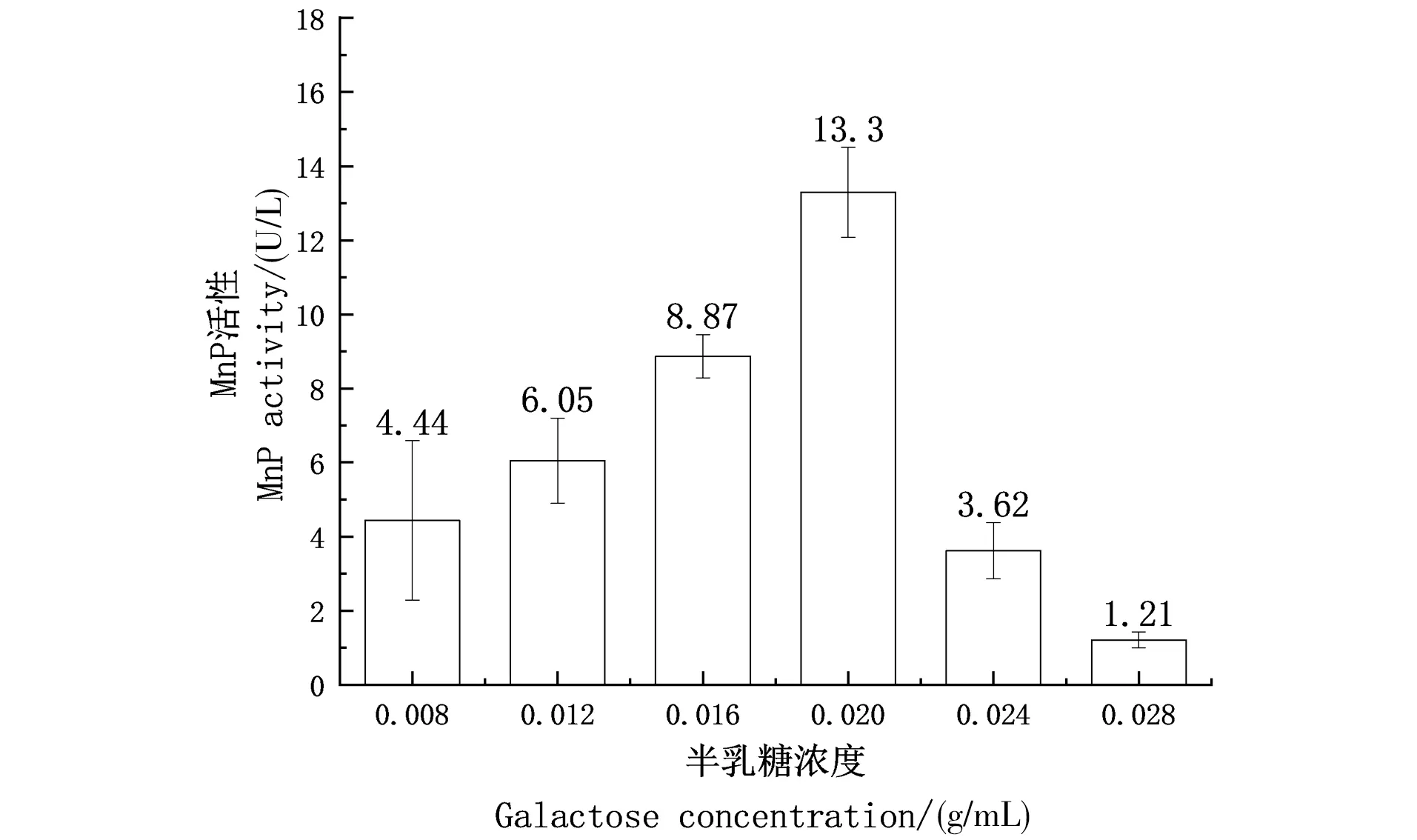
图6 半乳糖浓度对转化子产MnP酶活性的影响
2.6 转化子产MnP活性的氮源选择及最适浓度
分别选择不同氮源对转化子产锰过氧化物酶的活性进行测定,由图7可知,YNB、硫酸铵、硝酸钾、蛋白胨均可使转化子EBY100-MnP产MnP酶,其中YNB为最佳的氮源,测得锰过氧化物酶活性为11.70 U。当YNB浓度为0.007 2 g/mL时,酵母转化子(EBY100-MnP)产MnP酶酶活性最高(图8),最高值为13.71U,因此,后续试验选择最佳氮源YNB的添加量为0.007 2 g/mL。

图7 不同氮源对产MnP酶的影响

图8 YNB浓度对产MnP酶的影响
2.7 SDS-PAGE及免疫荧光检测
经软件预测锰过氧化物酶基因所表达的蛋白分子量约为30 ku,与图9所示SDS-PAGE电泳结果基本一致,并经过免疫荧光(图10)检测证明外源蛋白成功锚定于酵母细胞表面。
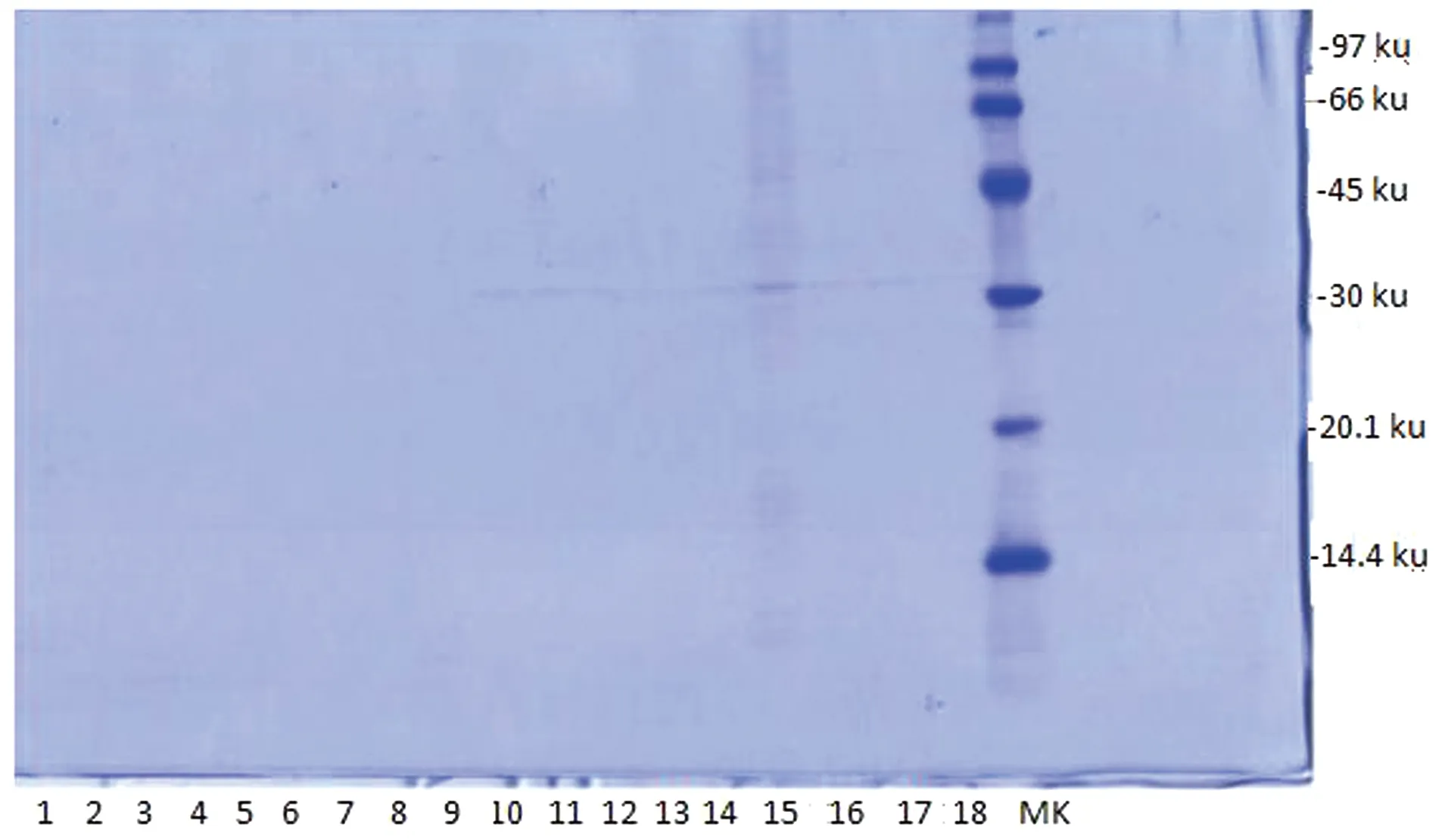
1~3:转化子培养12 h的粗酶液;4~6:24 h;7~9:36 h;10~12:48 h;13~15:60 h;16~18:72 h;MK:蛋白Marker(14.4~97 ku)。
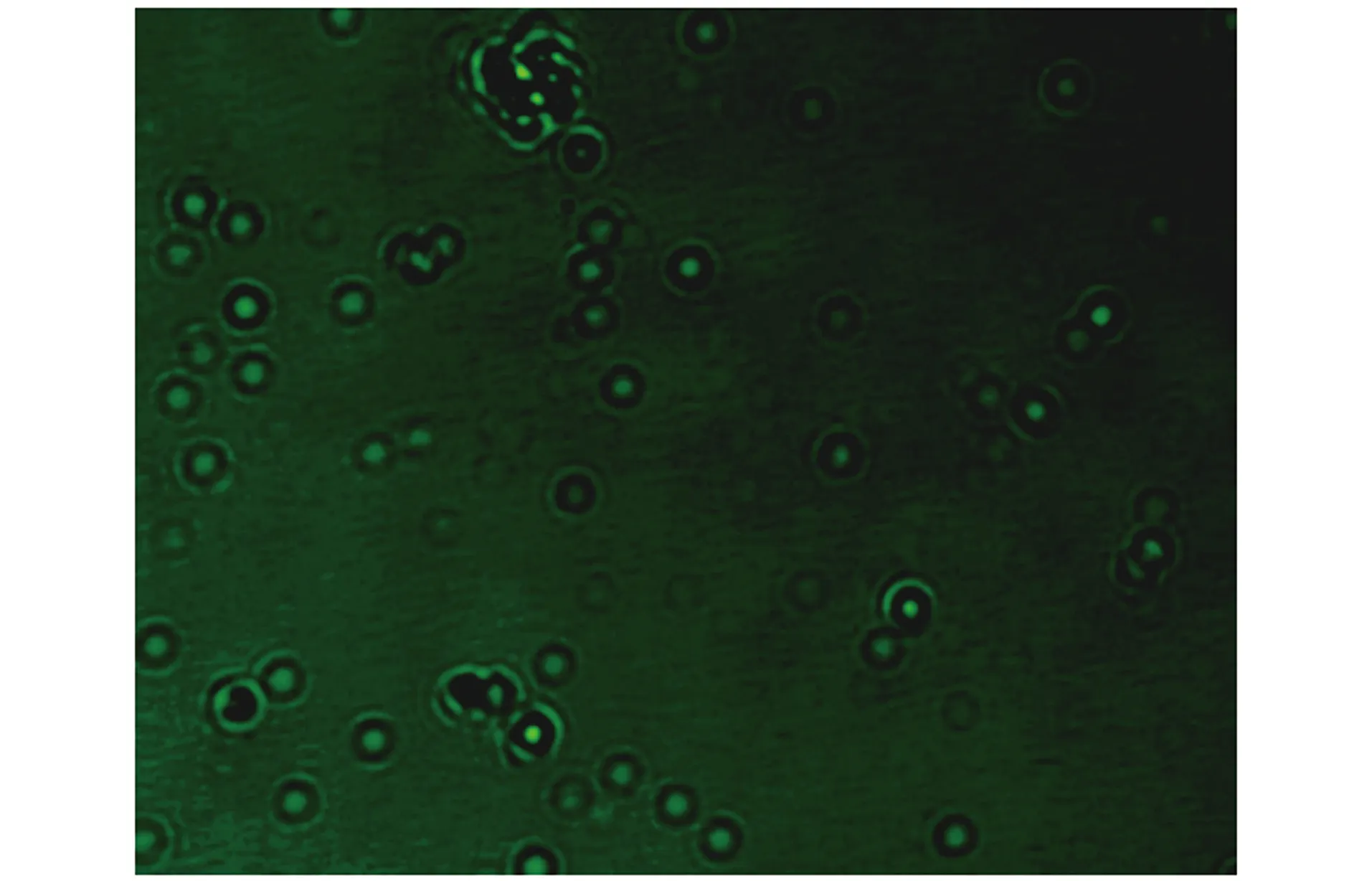
图10 酵母转化子的免疫荧光检测
2.8 吸附热力学
经过线性回归拟合(图11),在不同温度下,SA-EBY和SA-EBY-MnP对甲基橙的吸附实验数据与Freundlich等温吸附方程拟合效果更佳(表1),这表明吸附剂对甲基橙的吸附不仅仅是一个单组分的单层均匀吸附过程,还是固定化酵母吸附剂中各组分均有发挥一定的吸附作用。

表1 SA-EBY及SA-EBY-MnP对甲基橙的吸附等温线常数

(a)EBY-MnP对甲基橙的吸附等温线;(b) EBY对甲基橙的吸附等温线。
通常1/n在0~1,其值的大小体现吸附剂吸附能力的高低,1/n越小,表示吸附能力越好,1/n在0.1~0.5表示较好吸附,而1/n大于2时表示难吸附[22],由表1可知,两种吸附剂对刚果红都较易吸附。
2.9 吸附动力学
为了研究SA-EBY及SA-EBY-MnP对甲基橙的吸附机理,分别利用准一级动力学方程、准二级动力学方程(图12)对载体吸附甲基橙的实验数据进行了回归拟合[23]。准一级方程:lg(Qe-Qt)=lgQe-k1t;准二级方程:t/Qt=1/k2Qe2+t/Qe。比较两个方程拟合的相关系数(R2)可知(表2),准二级方程对溶液中甲基橙的吸附行为均有很好的描述(R2>0.99),准一级方程的拟合程度较差[19]。尽管准一级方程已经广泛应用于各种吸附过程,但由于在一级模型作图之前需要通过实验确定平衡吸附容量Qe,而实际吸附过程中,准确测得其平衡吸附量的可能性较小[22]。而准二级方程恰好能真实全面地反映甲基橙在载体上的吸附机理,包含了吸附过程,如外部液膜扩散、表面吸附和颗粒内扩散等[24]。

表2 SA-EBY及SA-EBY-MnP对甲基橙的吸附动力学参数
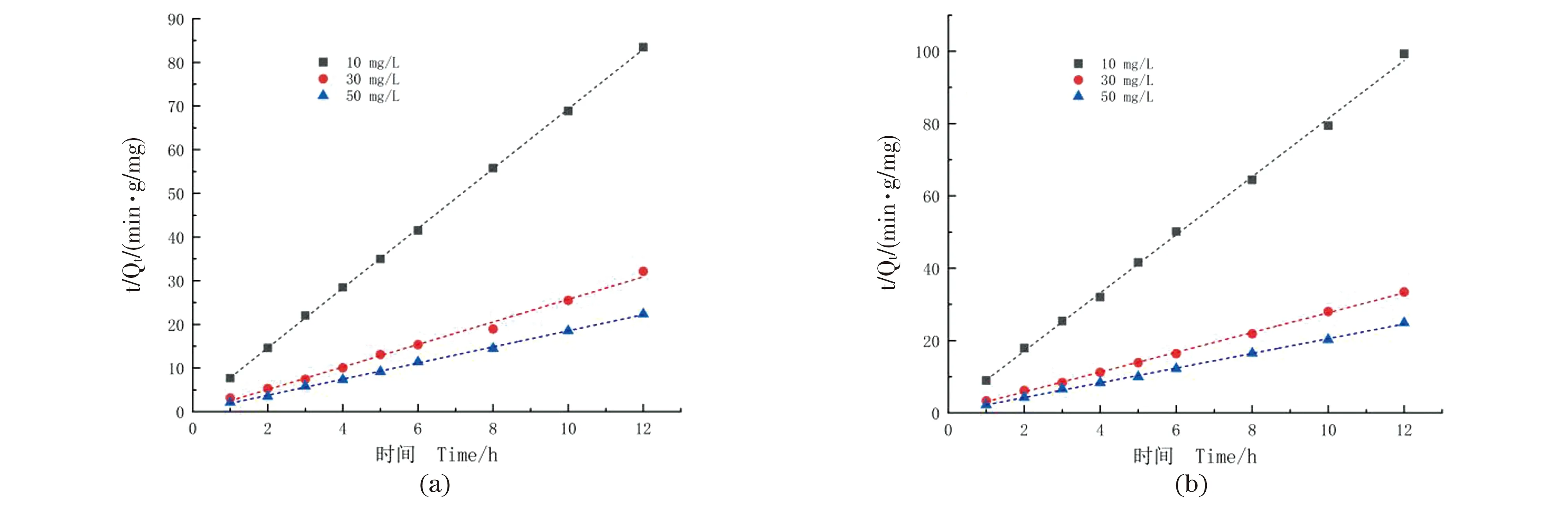
(a)EBY-MnP对甲基橙的吸附动力学;(b) EBY对甲基橙的吸附动力学。
SA-EBY及SA-EBY-MnP对甲基橙的吸附速率相似,SA-EBY-MnP的吸附率比SA-EBY高2.58%,吸附3 h后达到吸附平衡。
3 讨论
目前,国内外有关生物法在偶氮染料废水处理方面的应用较多,利用生物降解法有效缓解了偶氮染料降解过程中的二次污染问题,但生物材料的吸附效率及重复利用率,以及自身的稳定性也成为制约该技术应用的瓶颈,因此,研究生物吸附材料特性的重要性尤为突出。
以海藻酸钠固定化酿酒酵母EBY100和EBY100-MnP,形成生物吸附剂型复合载体对甲基橙进行吸附效果的测定,并分析各条件下吸附效果的最佳比例,为其作为生物吸附剂的开发应用提供参考依据。固定化酵母在酸性条件下的吸附效果明显优于在碱性条件下的吸附效果,在30 ℃的条件下,复合载体对溶液中甲基橙的吸附行为合乎Freundlich模型吸附等温式,不是一个单分子层均匀吸附过程[25],因此,酵母细胞和海藻酸钠均在吸附过程中发挥作用,复合载体SA-EBY100-MnP对甲基橙的吸附比复合载体SA-EBY100对甲基橙的吸附更容易。动力学研究表明,复合载体对溶液中甲基橙的吸附过程符合准二级动力学方程,说明复合载体对甲基橙的吸附动力学主要是受化学作用所控制,而不是受物质传输步骤所控制[25]。
细胞表面展示酶制备的全细胞催化剂已有很多成功的实例,Katahira等[26]将两种木聚糖水解酶展示于酿酒酵母细胞表面获得了能将木聚糖转化为木糖全细胞催化剂;Shibasaki等[27]将纤维素水解酶展示于酿酒酵母细胞表面,构建成直接利用纤维素的细胞株,如将羧甲基纤维素酶和β-葡糖苷酶共展示于酵母细胞表面,重组菌株能以纤维寡糖作为单一碳源的培养基中生长;Fujita等[28]将内切葡聚糖酶Ⅱ和β-葡糖苷酶共展示于酵母细胞表面,重组菌株能直接利用β-葡聚糖的培养基生成乙醇;Wang等[29]将有机磷降解酶和纤维素结合域(CBD)同时展示于E.coliXL-1-Blue细胞表面,构建了既能特异、牢固地吸附在纤维素上又能同步降解有机磷农药的工程菌株。
野生菌种对有机物染料的处理能力大多较弱,只能吸附分解掉少量的染料,而用固定化方式将微生物材料做成凝胶球,用来处理污染物则有着成本低廉、制备简单、效果显著、材料性质稳定、回收方便等优势。且该复合载体可多次使用,可持续性强,因此,利用海藻酸钠负载酿酒酵母制备的微球吸附甲基橙,探讨复合载体吸附甲基橙的最佳吸附条件,并将其应用到偶氮染料的生物吸附过程中具有一定的研究价值。
