组织蛋白酶D有助于SRBSDV在白背飞虱体内复制
2023-10-19付亚亭郭冬阳吴清发
付亚亭,郭冬阳,吴清发
(中国科学技术大学 生命科学学院,合肥 230027)
南方水稻黑条矮缩病毒(Southern rice black streaked dwarf virus,SRBSDV)属于斐济病毒属,是一种无包膜的二十面体病毒,其基因组由10个双链RNA片段组成[1-2]。SRBSDV由白背飞虱专一性传播,灰飞虱(Laodelphaxstriatellus)可以携带SRBSDV,但不能传播病毒,褐飞虱(Nilaparvatalugens)既不能携带病毒也不能传播病毒[3-4]。白背飞虱以持久增殖型方式传播SRBSDV[5],这意味着在白背飞虱取食带毒水稻后,病毒需克服白背飞虱的天然免疫屏障,完成从消化道入侵、组织扩增并最终回到唾液腺的巡回过程,才能进一步传播[6-7]。因此,研究SRBSDV在白背飞虱体内的侵染、复制、扩散等过程的机制,对发展有效手段来控制病毒传播至关重要。
病毒入侵细胞的一种主要方式是通过内吞作用进入细胞[8-9],在这种作用方式下,病毒与宿主细胞膜受体识别并形成受体-配体复合物,使膜受体分子构象发生改变,从而使受体-配体复合物向胞浆凹陷(凹陷侧富含网格蛋白),并最终与细胞膜脱离形成囊泡,囊泡与胞浆中的内体融合后,进一步与溶酶体融合,导致内容物被降解,病毒释放进入细胞质[10-11]。借助网格蛋白依赖型内吞途径进入宿主细胞的病毒有很多,如水疱性口炎病毒 (VSV) 和水稻矮缩病毒(RDV)等[12-15]。
组织蛋白酶D(CathD)是天冬氨酸型肽链内切酶,在细胞自噬和内吞通路中起着水解蛋白质的重要作用[16]。研究报道呼肠孤病毒进入小鼠成纤维细胞需要内体中天冬氨酸CathD,抑制CathD的活性可有效减少呼肠孤病毒的复制[17]。SRBSDV是呼肠孤病毒科成员,目前对SRBSDV通过内吞作用进入白背飞虱细胞后的释放机制尚不清楚。
1 材料与方法
1.1 材料
野生型白背飞虱在人工气候箱饲养,饲养条件为温度26 ℃,湿度60%,12 h光照12 h黑暗交替循环。水稻品种为籼稻TN1。携带SRBSDV的水稻病株为华南农业大学周国辉教授惠赠。
1.2 方法
1.2.1 白背飞虱显微注射
本实验所用到的双链RNA(dsRNA)由T7 transcription kit (TOYOBO,Japan)体外转录制备。用于合成CathD dsRNA的模板DNA引物是P1:T7-TGTTGCAGCTAAATTCGACG,P2:T7-AGGTCCGACAATGAGA-CTGG,用于合成GFP dsRNA的模板DNA引物是P1:T7-ACGTAAACGGCCACAAGTTC,P2:T7-TGTTCTGCTGGTAGTGGTCG。实验选择2~3龄的白背飞虱若虫用于注射dsRNA,注射部位为白背飞虱胸部中足以及后足之间的外侧表皮处。在显微注射时,首先用适量CO2麻醉飞虱;随后用毛笔将飞虱若虫在注射平板上排成一行,这样利于快速注射;设置显微注射仪(EPPENDORF)的参数为注射压强1 300 hPa,注射时间0.3 s,补偿压10 hPa;向每只白背飞虱若虫注射20~30 nL dsRNA。注射完成后将白背飞虱若虫分装在直径3 cm,高9.5 cm的小管中,管内装有在湿润的厨房用纸上生长的新鲜水稻苗,用尼龙网封住管口,每管若虫不超过30头。注射24 h后,收集5头白背飞虱,提取总RNA,用于下游的qRT-PCR等分子生物学实验。
1.2.2 白背飞虱获毒试验方法
显微注射CathD基因的dsRNA到2~3龄白背飞虱若虫体内,注射浓度5 μg/μL,注射体积20~30 nL,同期对照组白背飞虱注射GFP基因的dsRNA。注射完毕后将白背飞虱若虫转移至装有健康水稻苗的小管中观察,24 h后将实验组白背飞虱和对照组白背飞虱转移至携带SRBSDV病毒的水稻苗饲喂,48 h后将饲喂完毕的飞虱若虫转移至生长有健康水稻苗的组培罐中培养,每罐可容纳飞虱若虫不超过100头。在饲毒后潜伏期第4天、第8天和第12天分别收集各组白背飞虱20~30只,分别提取每只飞虱的总RNA,RT-PCR检测白背飞虱饲毒后的带毒比率,qRT-PCR检测白背飞虱在饲毒后潜伏期第4天的病毒带毒量(图1)。
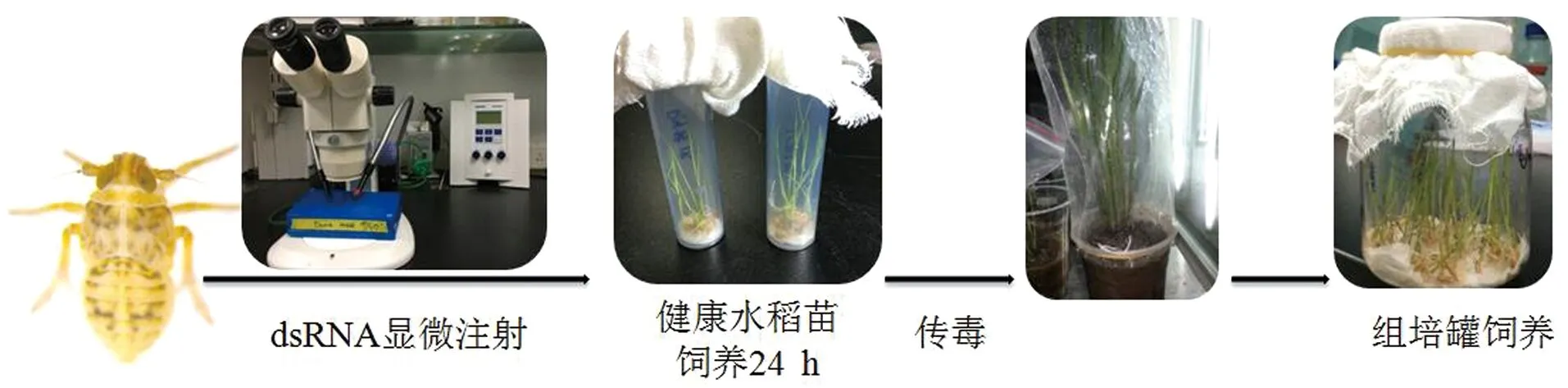
图1 白背飞虱获毒试验流程图
1.2.3 果蝇S2细胞dsRNA干扰以及病毒侵染实验
制备果蝇dmCathD基因的dsRNA方法同上。用于合成dmCathD的 dsRNA的模板DNA引物是P1:T7-TCACCTACTTGCCCGTTACC,P2:T7-CCGGACAGACAG-ATGGTCTT,用于合成Ago2和β-gal基因dsRNA的DNA模板引物参考文献[18-19]。果蝇S2细胞培养在加有体积分数分别为10%灭活血清和1%双抗的昆虫完全培养基(Sigma)中,待细胞生长到对数期,收集果蝇S2细胞悬液,1 400 r/min离心5 min后弃去上清液,使用不添加抗生素和血清的培养基将细胞重悬至细胞密度为1.5×106mL-1。将8 μg dsRNA使用250 μL无菌水稀释后加至12孔细胞培养板(CORNING),然后加入500 μL重悬的S2细胞轻轻混匀,25 ℃饥饿处理30 min后,每孔中加入1 mL的完全培养基,最后补加血清至终含量为10%。48 h后向每孔中加入稀释到105浓度的病毒200 μL,培养48 h后即可检测S2细胞的病毒复制情况。
2 结果与分析
2.1 dsRNA干扰后白背飞虱的存活曲线
通过注射dsRNA到白背飞虱体内敲低CathD基因表达水平,然后饲喂SRBSDV病毒后,观察到dsCathD组在潜伏期第4天已经有部分白背飞虱羽化为成虫,在潜伏期第8天已经全部长成成虫,与对照组白背飞虱相比无形态和发育异常。存活曲线显示,敲低CathD的白背飞虱在获毒后的生存率与对照组白背飞虱相比没有明显差异(log-rank检验),见图2。结果表明沉默表达CathD的白背飞虱在饲喂SRBSDV病毒后对白背飞虱的发育和生存没有明显影响。
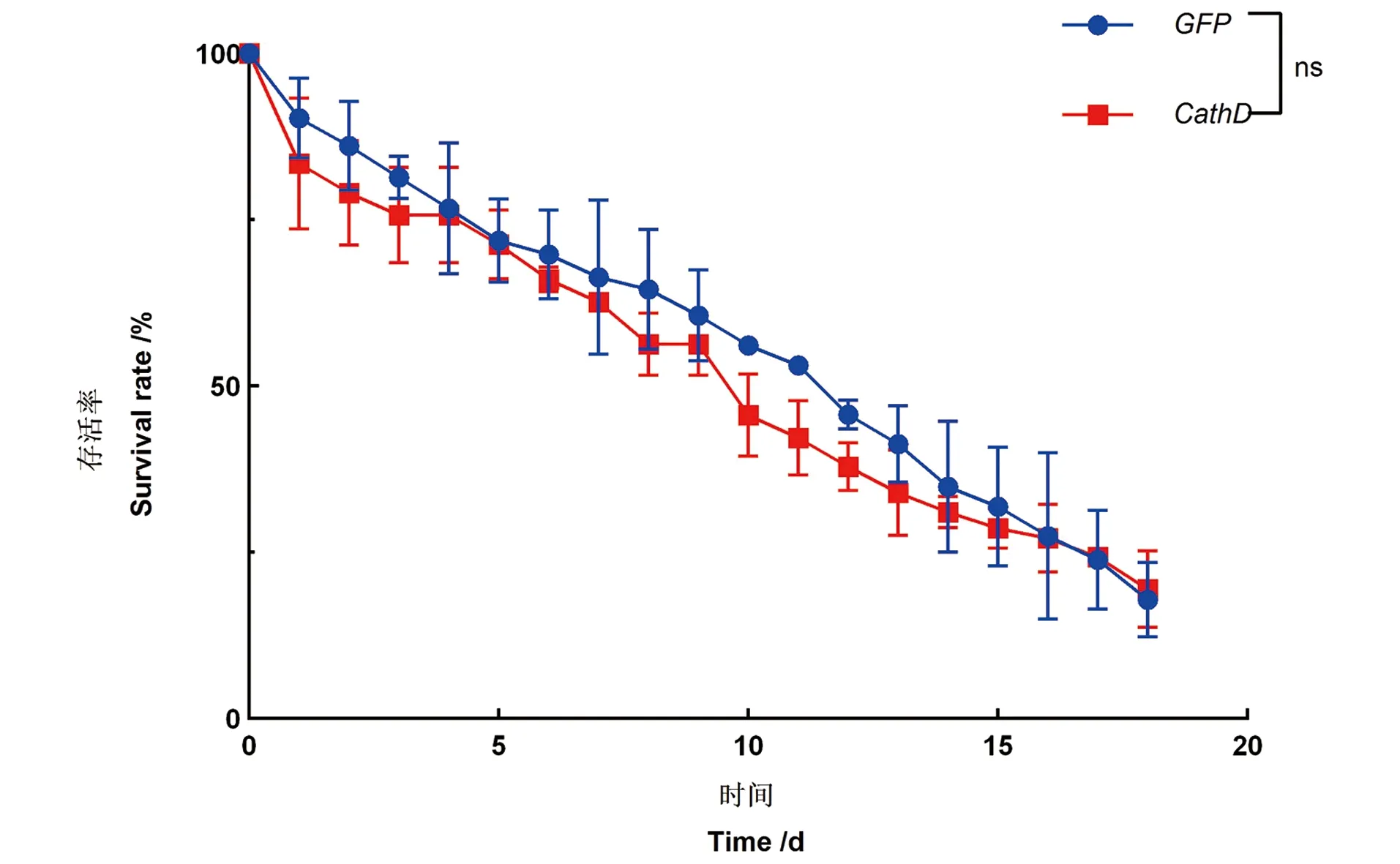
ns为差异不显著。
2.2 dsRNA干扰CathD基因后白背飞虱带毒率降低
注射dsRNA 24 h后提取5只白背飞虱的总RNA并进行qRT-PCR,结果显示CathD基因的mRNA表达水平下调至对照组的13.8%[图3(a)]。在带毒水稻苗饲毒2 d后,将实验组和对照组白背飞虱转移到健康苗培养,并在SRBSDV潜伏期第4天、第8天和第12天分别收集20~30只白背飞虱,提取单只试虫的总RNA。RT-PCR检测结果发现注射dsGFP的白背飞虱在第4天、第8天和第12天的带毒比率分别为80.9%、81.7%和79.2%,而注射dsCathD的白背飞虱在SRBSDV潜伏期的第4天、第8天和第12天的带毒比率分别为64.0%、69.2%和61.7%[图3(b)]。
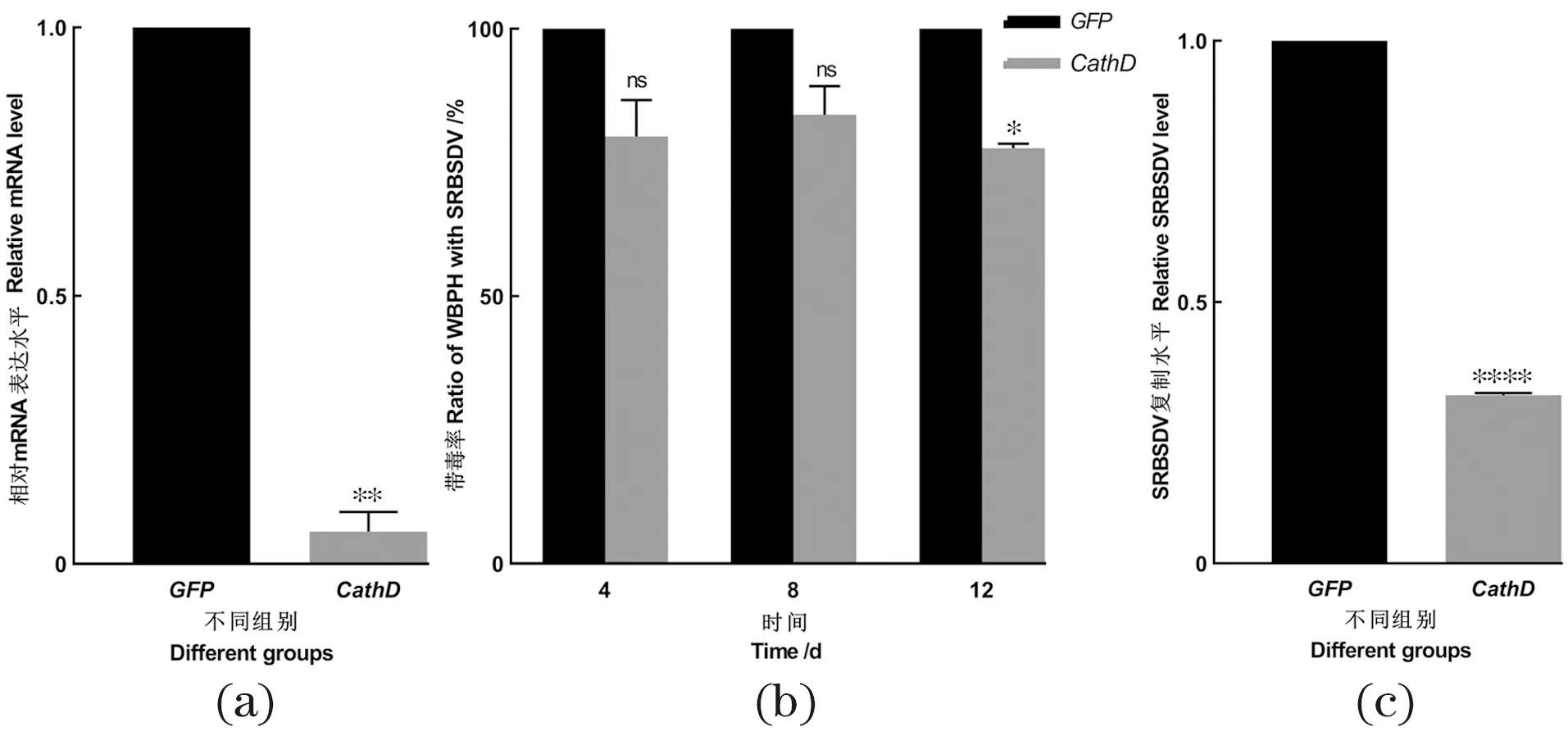
(a)白背飞虱显微注射dsRNA 24 h后CathD基因的干扰效率(以RP-L4为内参进行标准化处理);(b)沉默CathD的白背飞虱在饲毒后潜伏期第4天、第8天和第12天的带毒比率;(c)沉默CathD的白背飞虱在饲毒后潜伏期第4天的平均带毒量(以RP-L4为内参进行标准化处理)。(a)~(c)展示了两次独立实验的平均值和误差值,显著性分析结果由t检验获得(* 为P<0.05,** 为P<0.01,**** 为P<0.000 1,ns为差异不显著)。
2.3 dsRNA干扰CathD基因后白背飞虱带毒量降低
沉默表达CathD的白背飞虱在饲喂SRBSDV病毒后,通过qRT-PCR检测病毒在白背飞虱体内的复制水平,结果发现在SRBSDV潜伏期第4天的平均病毒复制量明显下调,dsCathD组的SRBSDV的RNA相较dsGFP组下调至32.2%[图3(c)],进一步证明CathD蛋白具有协助SRBSDV在白背飞虱体内复制的作用,我们猜测CathD蛋白可能是通过内吞作用机制协助病毒在白背飞虱体内的扩散增殖。
2.4 CathD在果蝇细胞中具有协助DCV病毒复制的作用
为了检测CathD蛋白帮助病毒复制的机制是否保守,选择在果蝇S2细胞水平上进行dsRNA敲除实验。RNAi通路是果蝇主要的抗病毒通路,Argonaute-2(Ago2)蛋白参与RNA诱导沉默复合体(RISC)的形成,RISC可以切割病毒RNA,断裂的病毒RNA被进一步降解,从而达到抑制病毒的作用。Ago2蛋白是已经鉴定的具有抗DCV病毒复制功能的蛋白[20-21],本研究选择Ago2蛋白作为阳性对照。结果显示,相较阴性对照dsβ-gal组,CathD基因和Ago2基因的mRNA表达水平分别下调至16.7%和31.4%[图4(a)],敲低果蝇S2细胞CathD基因的表达没有观察到对S2细胞形态和细胞增殖的任何影响。随后进行DCV的侵染,48 h后收集S2细胞提取总RNA开展qRT-RCR检测。实验结果显示,与阴性对照组dsβ-gal相比,敲低果蝇S2细胞中阳性对照Ago2基因后,DCV的mRNA水平上调约2.3倍,而敲低CathD基因后,DCV的mRNA水平下调至对照组的0.34倍,说明CathD在果蝇细胞中具有帮助DCV复制的作用,这和白背飞虱在成虫水平的实验结果一致[图4(b)]。
3 讨论与结论
许多病毒依赖內吞作用进入宿主细胞,如水疱性口炎病毒 (VSV) 和水稻矮缩病毒(RDV)等[12-14]。RDV病毒粒子的外壳蛋白P2从病毒粒子表面伸出,与昆虫介体细胞表面受体相接触,从而通过内吞作用进入宿主细胞[14,22]。SRBSDV与RDV都属于感染水稻的呼肠孤病毒,其病毒粒子也拥有类似突出状结构,这些结构对病毒粒子侵入宿主细胞具有十分重要的作用[23],但目前对SRBSDV通过内吞作用进入白背飞虱细胞内的释放机制尚不清楚。
CathD蛋白是溶酶体中的酸性蛋白水解酶。本研究证明敲低白背飞虱细胞内CathD基因的表达水平,会降低SRBSDV在白背飞虱体内的带毒率和带毒量,表明CathD蛋白有助SRBSDV从细胞内体/溶酶体中释放进入细胞质。已知果蝇DCV病毒是通过依赖网格蛋白介导的内吞作用进入果蝇细胞[24],研究结果表明敲低果蝇CathD基因的表达也会降低DCV在果蝇细胞的复制水平。这些结果表明CathD促进病毒从细胞内体/溶酶体中释放进入细胞质机制可能是保守的,可以作为防控SRBSDV病害的潜在靶标分子。我们计划进一步研究CathD蛋白在白背飞虱侵染SRBSDV时发挥作用的分子机制。
