活性氧介导非热大气压等离子体杀伤肺癌细胞的机制
2023-10-19周袁媛陈金武宋文成储焰南
周袁媛,刘 芳,陈金武,刘 磊,宋文成,3,5,储焰南,3
(1.安徽大学 物质科学与信息技术研究院,合肥 230601; 2.中国科学院合肥物质科学研究院 安徽省医学物理与技术重点实验室健康与医学技术研究所,合肥 230031; 3.中国科学院合肥肿瘤医院,合肥 230031;4.合肥师范学院 生物与食品工程学院,合肥 230061; 5.江苏高校放射医学协同创新中心,苏州 215123)
等离子体是除了固体、液体、气体外,物质的第4种状态。非热大气压等离子体(nonthermal atmospheric plasma,NAP),又称低温等离子体,是在标准大气压下产生的等离子体[1]。据报道NAP能够用于如癌症治疗、凝血、抗炎、消毒、抗菌、美学修复等[2-7],在癌症治疗领域,Fridman等[8]发现NAP能够抑制黑色素瘤的生长,进而将NAP技术首次引入体表癌症治疗的研究中。
肺癌是常见的癌症类型之一,几乎四分之一的癌症死亡是由肺癌导致。另外,肺癌预后极差,5年相对生存率在所有的癌症中最低(21%)[9]。常见的肺癌治疗方式有手术治疗、放疗、化疗等[10]。虽然每种类型的治疗手段都对肺癌发展起到了一定的抑制作用,但每种手段均存在不足。故急需发展其他更好的治疗手段。NAP作为一种新兴的治疗手段而引起了广泛的关注,Kim等[11]开创性地将NAP和内窥镜技术相结合,使NAP能够应用在肺癌等内部肿瘤的治疗中。
在之前的研究中,已经报道过NAP及其处理过的活化液对肺癌细胞株H460的杀灭作用[12-13],但围绕其产生的相关组分、作用的相关信号通路的研究尚未明确。因此,我们希望能够进一步探究NAP杀灭H460的机制,以期NAP技术未来能够广泛应用于临床治疗中。
1 材料与方法
1.1 材料
1.1.1 细胞培养
人大细胞肺癌H460细胞购自中国科学院上海细胞库,使用RPMI-1640培养基,加入10%胎牛血清和1%双抗(青霉素/链霉素)。细胞置于60 mm培养皿中生长,并放置于温度37 ℃、CO2体积分数为5%的恒温培养箱中培养。
1.1.2 试剂与仪器
培养基RPMI-1640购自美国GIBCO公司;胎牛血清购自上海Lonsera公司;PBS、胰酶、双抗和活性氧检测试剂盒购自上海生工生物工程股份有限公司;NAC、过氧化氢检测试剂盒、RIPA裂解液、BCA蛋白浓度测定试剂盒、5×上样缓冲液、SDS-PAGE凝胶配制试剂盒、Tris、SDS、甘氨酸和硝酸纤维素膜购自上海碧云天公司;MTT购自美国Sigma有限公司;线粒体膜电位检测试剂盒(M8650)购自北京索莱宝科技有限公司;脱脂奶粉和Tween-20购自兰杰柯科技有限公司;氯化钠购自西陇科学股份有限公司;一抗(ACTB兔多抗、AKT兔多抗、PI3K兔多抗、JNK兔多抗和STAT3兔多抗)、二抗(HRP标记的二抗)购自Cell Signaling Technology公司;ECL Plus试剂购自美国赛默飞世尔科技公司;氦气(99.999%)购自南京特种气体厂有限公司。
1.2 方法
1.2.1 NAP装置
实验所用氦气介质阻挡放电大气压NAP装置,见图 1(a),氦气纯度为99.999%,流量为1 L/min。实验时需要提前通气90 s,以确保排尽装置底部容纳凹槽内空气。容纳凹槽内能够放置60 mm培养皿,当电源接通时,该装置在有效电压3.78 kV、频率25 kHz的条件下产生NAP,当细胞贴壁且覆盖70%皿底面积时,使用NAP处理,放置于恒温培养箱中,孵育相应时间后,进行后续实验研究。
1.2.2 培养基中ROS的测定
含或不含细胞的培养基经过NAP作用0、15、30和45 s后,或者用NAC预处理1 h再用NAP处理45 s后,放置0 h(立即测)和4 h后,使用过氧化氢检测试剂盒检测培养基内过氧化氢水平,即培养基中ROS的含量。步骤如下:使用96孔板中每孔加入100 μL培养基,再加入100 μL过氧化氢检测试剂,每组设3个平行样本测量,溶液充分混匀后,室温放置30 min,于560 nm波长下测量吸光度,该值最后通过标准曲线计算出不同处理条件下培养基中过氧化氢的浓度。
1.2.3 细胞内ROS的测定
使用活性氧检测试剂盒检测胞内ROS含量。H460在经过NAP作用0和45 s,或者用NAC预处理1 h再用NAP处理45 s,孵育4 h后弃去培养皿中培养基,使用PBS清洗培养皿后加入1 mL DCFH-DA荧光探针,避光孵育20 min后,弃去培养皿中液体,再使用PBS清洗培养皿以确保未进入细胞内的探针影响检测结果。DCFH-DA可被细胞内各类活性氧成分氧化为DCF,发出绿色荧光,进而使用倒置荧光显微镜检测并拍照。
1.2.4 细胞增殖实验
使用MTT比色法[14]测量细胞增殖能力。H460在经过NAP处理0、15、30、45、60和75 s后,或用NAC预处理1 h再用NAP处理45 s后,于恒温培养箱中孵育24 h,弃去培养皿中培养基,分别在每培养皿中加入1.5 mL的0.5 mg/mL MTT试剂,放置4 h使MTT与胞内琥珀酸脱氢酶充分反应后,弃去皿内液体,加入等量二甲基亚砜(DMSO)溶解结晶紫,取200 μL溶液至96孔中,设置3个复孔,并在波长492 nm下测量每皿溶液的吸光度,细胞活力(Y)通过以下公式计算得到:
式中,ODA代表未处理(NAP处理0 s)组吸光度,ODB代表阴性对照(培养皿内无细胞)组吸光度,ODC代表实验组吸光度。
1.2.5 线粒体膜电位检测
使用线粒体膜电位检测试剂盒检测H460在经过NAP作用0和45 s,或用NAC预处理1 h再用NAP处理45 s后,线粒体膜电位的变化情况。具体操作如下:经处理的细胞在培养箱中孵育4 h后弃去培养基,用PBS清洗,再加入1 mL JC-1染色工作液,放入培养箱中孵育20 min,结束后吸除试剂,并使用JC-1染色缓冲液(1×)洗涤两次,放入荧光显微镜下观察。当线粒体膜电位下降时,JC-1从红色荧光转变为绿色荧光,进而测定线粒体膜电位。
1.2.6 Western Blot实验
H460细胞NAP处理后,收集于离心管中,使用预冷PBS清洗两次,弃上清液,加入200 μL RIPA裂解液重悬细胞,于冰上裂解20 min,4 ℃离心,收集上清液。BCA法蛋白定量后,加入上样缓冲液,在100 ℃煮20 min;之后每组取20 μL,于恒压100 V下进行电泳90 min,再将凝胶上的蛋白转移到NC膜上,用含5%脱脂牛奶的TBST封闭2 h,4 ℃下孵育一抗过夜,用TBST清洗后,加入HRP标记的二抗,室温下孵育40 min,再用TBST清洗,在条带上滴加ECL试剂,显影成像。另外,使用的一抗包括:ACTB(1∶10 000)、JNK(1∶2 000)、STAT3(1∶1 000)、AKT(1∶2 500)和PI3K(1∶2 500),用含1%脱脂牛奶的TBST稀释;使用的二抗按照1∶10 000,用TBST稀释。
1.2.7 统计学分析
分析数据至少进行了3次重复的独立实验(n=3),并以平均数±标准差表示。所有数据均采用单因素或双因素方差分析(ANOVA)确定。P<0.05为有统计学意义。
2 结果与分析
2.1 NAP装置相关参数
使用0、15、30、45、60和75 s的NAP处理H460后,立即测量培养基的pH和温度。随着NAP处理时间的增加,培养基的pH值在8.15附近,温度在22 ℃左右轻微波动,并没有显著变化,说明NAP杀灭细胞的条件较为温和,不会出现常见放疗温度过高导致的灼伤和pH值的变化等问题,见图 1(b)和1(c)。因此,该实验结果为NAP应用于临床肿瘤治疗的可行性提供了可靠的依据。
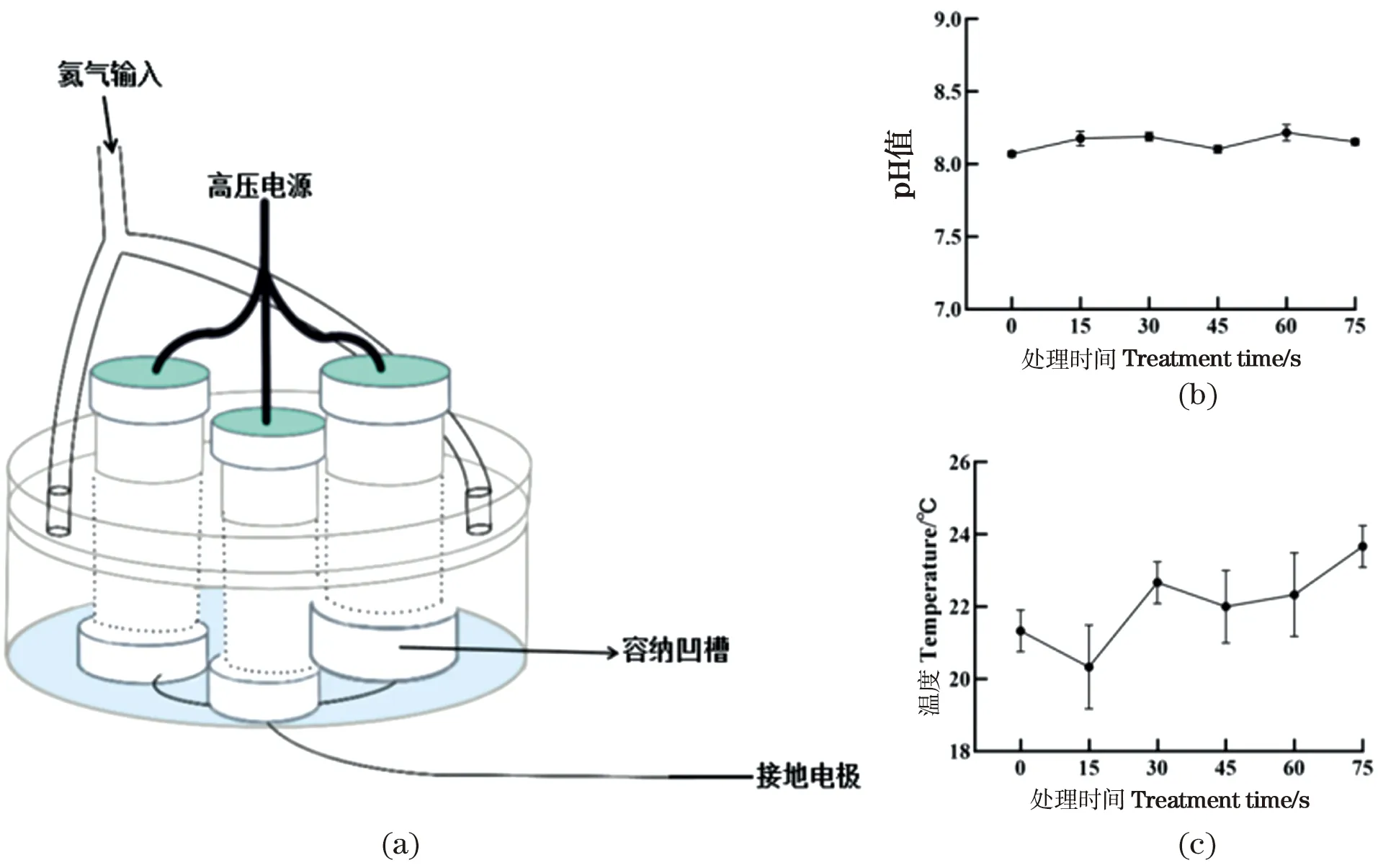
(a)氦气放电NAP示意图,不同时间NAP处理含H460细胞的培养基;(b)pH值随作用时间变化;(c)温度随作用时间变化。
2.2 NAP导致培养基中ROS含量增加
使用0、15、30、45、60和75 s的NAP处理含H460和不含H460的培养基,并在处理后立即或孵育4 h后,测量培养基中的ROS含量。与对照组(处理0 s)相比,随着NAP处理时间增加,含或不含有细胞的培养基中ROS的含量都显著增加,并且当孵育4 h后,含或不含有细胞的培养基中ROS的含量也同样增加,见图2。并且,在NAP作用后立刻检测培养基中ROS时,无论培养基中是否含有细胞,其ROS含量的变化情况差异不大(P=0.959 1),而当NAP作用后孵育4 h再检测,发现含有细胞的培养基中的ROS随作用时间增长而增长,但上升速度显著低于不含细胞的培养基(P<0.001)。Ma等[15]使用PAM(NAP作用20 min)处理含细胞的培养基0、2、4、6和12 h,发现随着时间的延长,含细胞的培养基中ROS含量显著下降,这可能是因为ROS进入细胞中,其含量与细胞内组分相互作用而降低。

NAP处理含或不含细胞的培养基 0、15、30、45、60和75 s,立即或者孵育4 h后检测培养基中的ROS含量。* 为P<0.005;** 为P<0.001;*** 为P<0.000 1。

(a)荧光显微镜检测细胞内ROS的变化情况;(b)荧光强度定量分析。培养基中加或不加入NAC 孵育1 h后,使用NAP处理细胞45 s。* 为P<0.005。

(a)处理细胞0、15、30、45、60和75 s;(b)不同浓度NAC处理细胞1 h,再用NAP处理细胞0和45 s。不同时间NAP处理肺癌细胞H460,24 h后进行MTT测定细胞活力的变化,NAP处理0 s设为对照。** 为P<0.001,*** 为P<0.000 1。
2.3 NAP导致细胞内ROS含量增加
为探究NAP对H460细胞内ROS的影响,使用NAP对H460细胞处理0或45 s,孵育4 h后,检测细胞内ROS的变化情况见图 3,NAP能够导致H460细胞中ROS的含量增加;但培养基中加入100 μmol/L ROS清除剂NAC,能够导致细胞内ROS含量下降。因此,我们认为NAP杀伤H460细胞与胞内ROS的上升有关。
2.4 NAP降低肺癌细胞H460的细胞活力
使用0、15、30、45、60和75 s的NAP处理H460,孵育24 h后测定细胞活力,见图 4(a),随着NAP作用时间的增加,H460的细胞活力显著下降,并且处理组与对照组(0 s)的细胞活力有显著性差异(P<0.001)。当NAP作用45 s后,细胞活力低于50%,因此,选择NAP作用45 s进行后续实验。为研究ROS对细胞活力的影响,向培养皿中加入不同浓度的NAC,孵育1 h后NAP处理细胞45 s。孵育24 h后进行MTT实验,见图 4(b),当培养基中NAC浓度为50 μmol/L时,细胞活力能够恢复到对照组的83.85%,而当培养基中NAC浓度增加到100 μmol/L时,细胞活力能够恢复到对照组的95.99%。由此可知,随着培养基中NAC含量的上升,NAP作用后H460细胞活力显著上升。因此,我们认为NAP抑制肺癌细胞H460的活力由ROS介导。
2.5 NAP导致细胞线粒体膜电位下降
为探究NAP对H460细胞线粒体膜电位的影响,对H460细胞用NAP处理0或45 s,孵育4 h后使用荧光探针JC-1进行实验,见图5。NAP能够导致H460细胞中红色荧光强度下降而绿色荧光强度上升,这表示线粒体膜电位下降。除此之外,当培养基中加入NAC时,JC-1的红/绿荧光比例上升。这些结果表明NAP激发了胞内ROS的上升,ROS又进一步导致细胞内线粒体膜电位去极化,细胞发生凋亡。如Xu等[16]证实NAP能够产生ROS,导致多发性骨髓瘤细胞的线粒体膜电位下降,进而诱导细胞产生线粒体途径的细胞凋亡。
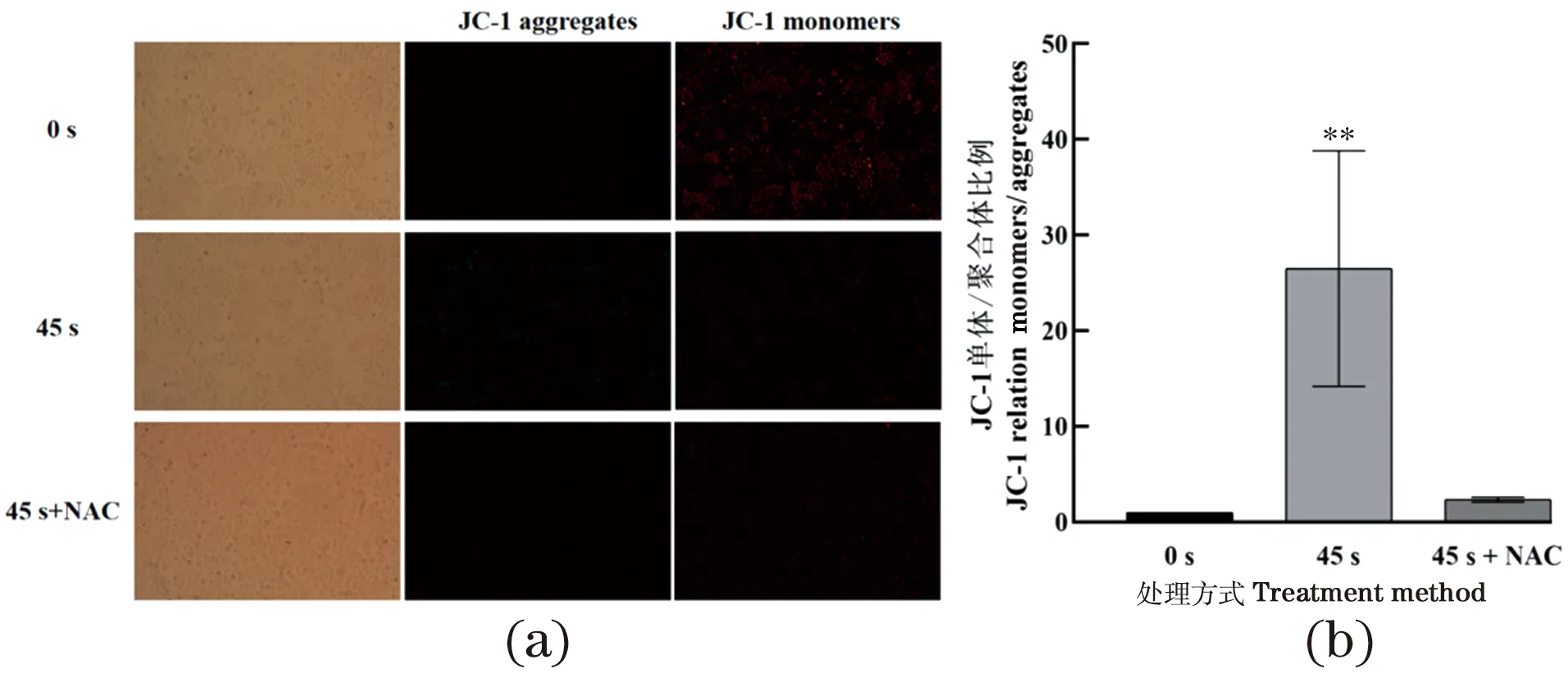
(a)荧光显微镜检测线粒体膜电位变化情况;(b)荧光强度定量分析。培养基中加或不加入NAC 孵育1 h后,使用NAP处理细胞45 s,JC-1染色。** 为P<0.001。
2.6 NAP抑制相关蛋白的表达诱导细胞死亡
PI3K、AKT、JNK、STAT3这4种蛋白能够参与调控细胞生长、代谢、增殖、迁移等重要生命活动。有研究表明沉默非小细胞肺癌H1299的基因TARBP2[17],能够下调JNK/STAT3/AKT通路的表达,进而减弱肺癌细胞的迁移与侵袭;并且白鲜碱[18]、厄洛替尼[19]等药物能够抑制PI3K/AKT信号通路的表达而起到抗癌的作用。Van Gils等[20]证明ROS能够抑制JNK/STAT3信号通路,导致细胞线粒体功能产生障碍,阻碍细胞存活。而Guo等[21]证明抑制STAT3表达后又能导致AKT表达的减少。AKT是一种蛋白激酶,可阻止细胞增殖并诱导凋亡。ROS能够抑制癌细胞中PI3K/AKT的表达,抑制细胞迁移和生长[22],又或者PI3K/AKT能够进一步导致抗凋亡蛋白Bcl-2表达降低,导致细胞发生凋亡[23]。因此为探究NAP对H460细胞相关蛋白表达情况的影响,使用NAP对H460处理0或45 s,进行Western Blot实验,蛋白表达情况见图6。研究发现NAP导致PI3K、AKT、JNK、STAT3的表达量显著降低,而在培养基中加入NAC能够消除NAP对上述蛋白表达量的影响。因此,实验结果表明NAP产生的ROS导致H460细胞死亡与下调PI3K/AKT和JNK/STAT3/AKT通路密切相关。
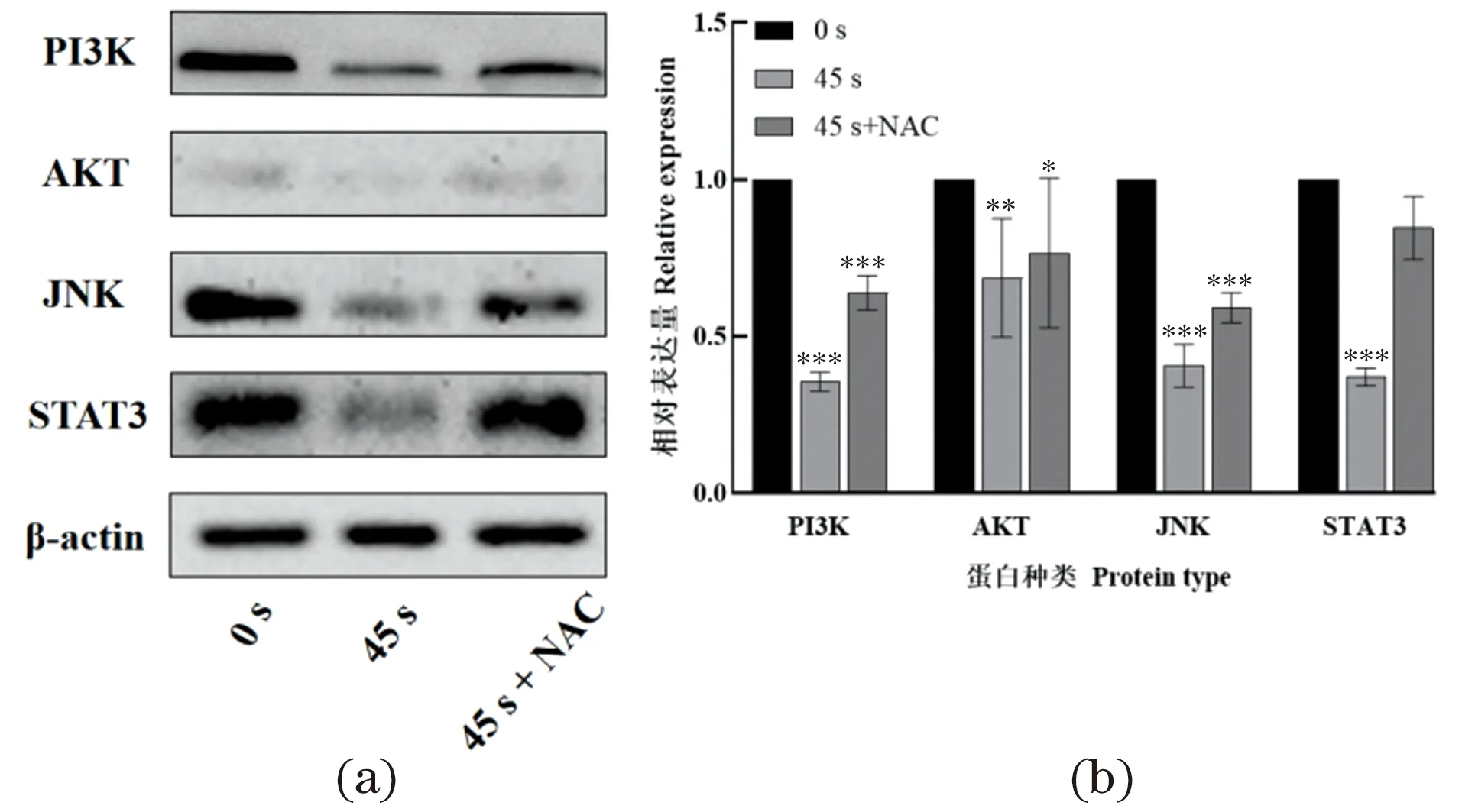
(a)PI3K、AKT、JNK、STAT3的表达;(b)蛋白强度定量分析。培养基中加或不加入NAC孵育1 h后,使用NAP处理细胞45 s,Western Blot检测。* 为P<0.05;** 为P<0.001;*** 为P<0.000 1。
3 讨论与结论

目前针对H460的研究主要集中在细胞死亡的现象中,如研究NAP对H460造成的细胞形态学变化[34]、细胞凋亡、肌动蛋白损伤[13]、DNA断裂[12]等现象,但是没有对其中ROS的作用以及涉及的相关蛋白表达变化进行研究。本研究从NAP处理H460细胞入手,通过检测NAP处理后培养基的温度和pH值变化,提示NAP在临床实用具有可行性,通过细胞活力实验,证明NAP作用时间越长,H460细胞活力越低,而加入NAC后细胞活力恢复;细胞内外ROS含量检测证明,随着NAP作用的上升,细胞内外ROS含量上升,当培养基中加入NAC后,胞内的ROS含量也随之下降;JC-1检测实验表明,NAP会造成H460线粒体膜电位下降,而在培养基中加入NAC后,线粒体膜电位会上升;Western Blot实验结果表明,NAP会下调PI3K、AKT、JNK、STAT3蛋白的表达,在培养基中加入NAC,上述蛋白表达量也上升。
因此,本研究表明NAP产生的ROS是其杀伤H460细胞的有效组分,它诱导肺癌细胞产生线粒体依赖的细胞凋亡,并且研究表明NAP导致的死亡与抑制PI3K/AKT和JNK/STAT3/AKT蛋白通路表达相关。将来的研究可以围绕NAP抑制肺癌细胞的迁移、侵袭通路进行。阐明NAP杀伤H460细胞相关蛋白信号通路的作用机制,对NAP未来更好地运用于临床具有重要意义。
