GS抑制剂调节自噬影响肝癌细胞放疗敏感性
2023-10-19钱俊超
何 媛,钱俊超,3
(1.中国科学院合肥物质科学研究院,合肥 230031; 2.中国科学技术大学研究生院科学岛分院,合肥 230026; 3.中国科学院合肥肿瘤医院,合肥 230031)
原发性肝癌是全球第六大最常见的癌症,也是2020年全球癌症死亡的第三大原因[1]。肝细胞癌(HCC)是一种由肝细胞癌变引起的原发性肝癌,约占原发性肝癌组织学类型的90%以上,是世界上发病率最高的癌症之一[2]。HCC的推荐治疗方案包括肿瘤切除或肝移植、肿瘤放疗、化疗、消融和栓塞等[3]。其中,放疗在肝癌治疗中的应用越来越多,因为电离辐射(IR)具有安全无创的特性[4-5]。放射治疗的新方式,如立体定向放疗(SBRT),可以在有效递送消融剂量的同时保留正常肝细胞,因此,接受放射治疗的HCC患者数量正在逐步增加[6]。虽然通过先进的照射技术,如借助呼吸门控强度调制和图像引导的放射治疗,可以在不损伤正常组织的情况下对肿瘤给予更适形的治疗和更高的辐射剂量[7],但由于肿瘤固有的放射抵抗性和周围正常肝脏的低辐射耐受性,放疗对HCC的治疗效率较低[8]。因此,迫切需要能增加肿瘤的放射敏感性和减少正常组织并发症的策略。
放射治疗中存活下来的癌细胞表现出放射抗性,能够促进肿瘤再生长和肿瘤复发。放疗抗性的原因主要是癌细胞激活补偿性存活信号,包括损伤修复信号、DNA 修复和自噬的诱导等[9]。自噬是一个分解代谢过程,在各种应激刺激下被证明可以促进肿瘤生长和进展,包括饥饿、缺氧、氧化还原应激、化疗药物和辐射等[10]。自噬还可以作为细胞重要的修复途径之一,通过这种途径细胞可以降解蛋白质和受损细胞器来回收营养物质从而继续生存[11]。此外,自噬抑制剂可通过诱导更明显和更长时间的DNA双链断裂(DSB)对某些肿瘤细胞起到放射增敏的作用[12]。
谷氨酰胺代谢增加是癌症的标志,许多研究强调了谷氨酰胺合成酶(GS)和谷氨酰胺在HCC发展中的关键作用[13]。GS是一种代谢酶,通过谷氨酸和氨合成谷氨酰胺,参与肝脏中氨的解毒作用,相关研究表明,抑制 GS 会降低细胞存活、增殖和肿瘤发生[14]。以往的研究表明,GS在部分HCC中过度表达且与HCC患者的转移预后密切相关[15],因此,靶向GS和相关通路可能为具有固有和获得性辐射抵抗的患者提供治疗益处。然而,GS在HCC的肿瘤发生和治疗反应中的作用仍不清晰,目前还没有批准用于临床试验的安全且特异性靶向 GS 的药物[16-17]。L-蛋氨酸亚砜亚胺(MSO)是一种特殊氨基酸,可作为谷氨酸类似物抑制多种谷氨酸代谢酶。在哺乳动物中,MSO是GS和γ-谷氨酰半胱氨酸合成酶的抑制剂,对GS有良好的且不可逆的抑制作用[16-18]。尽管在一些与HCC相关的研究中,MSO已被用作GS的抑制剂[19-21],但少有关于MSO或GS对HCC放疗敏感性影响的报道。因此,本研究探讨了GS活力对HCC细胞系HepG2体外放疗敏感性的作用。
1 材料与方法
1.1 材料
人肝癌细胞系HepG2购自Procell生命科学与技术公司(CL-0103);MSO(Sigma-Aldrich,M5379);基础培养基(MEM;Procell,PM150410);胎牛血清(Clark,FB25015);青霉素-链霉素溶液(Procell,PB180120);抗体(GS:Abcam;LC3:武汉赛维尔,GB11124) ;X射线辐照仪(PXI,Connecticut,USA;源-面距:40 cm);MDC染液(Solarbio,G0170);GS活力检测试剂盒(上海生工,D799578);TransZol Up Plus RNA 分离试剂(Transgen Biotech,ER501-01);HiScript®II Q Select RT SuperMix(+gDNA wiper)(Vazyme,R233); ChamQ Universal SYBR qPCR Master Mix(Vazyme,Q711);细胞活力检测试剂盒(CCK-8,上海生工,E606335),Bafilomycin A1(思科捷,SJ-MA0035)。
1.2 方法
1.2.1 细胞培养
人肝癌细胞系HepG2用基础培养基(MEM)辅以10%胎牛血清、1%青霉素-链霉素溶液,并在37 ℃、体积分数为5%的CO2空气中培养。实验时,GS抑制剂MSO以0.001 mol/L的浓度溶于培养基中使用。
1.2.2 蛋白免疫印迹
不同组别的细胞被清洗、收集和裂解。提取到的蛋白质用10%~12%的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,然后转移到处理好的聚偏氟乙烯(PVDF)膜上。用5%脱脂奶阻断1 h后,用GS抗体在4 ℃孵育过夜,以小鼠抗GAPDH蛋白作为内参蛋白。接下来,对膜进行清洗,在室温下孵育1 h。使用仪器显影得到的印迹,并通过Image J软件进行蛋白定量。
1.2.3 MDC染色
将对数生长期的HepG2细胞在12孔板(1×105个/孔)中培养至约60%融合,然后使用10 Gy的X射线照射,24 h后使用单丹磺酰(MDC)检测自噬小体的形成。即先吸走培养基,用PBS洗两次,然后在37 ℃的无血清条件下,用MDC染色40 min,用PBS冲洗掉多余的MDC,并立即在荧光显微镜下观察细胞自噬情况。
1.2.4 细胞活力测试
HepG2细胞被清洗、胰蛋白酶消化、计数并接种到96孔板中,密度为每孔3×103,设置5个重复孔。细胞贴壁后,在含有或不含MSO的培养基中培养6 h以上,使用X射线辐照仪以4.987 Gy/min的剂量率照射10 Gy的X射线。辐照后,细胞在37 ℃下培养72 h,用细胞活力检测试剂盒(CCK-8)检测细胞增殖。测量前2 h,在培养皿的每个孔中加入10 μL的CCK-8试剂。使用酶标仪在450 nm处测量细胞样品的光密度(OD),然后计算相对增殖率。
1.2.5 集落形成实验
参考文献[22]所述方法进行集落形成实验,即将细胞计数后,铺板到6孔板(1×103/孔),根据是否添加MSO、是否进行IR分成4组。菌落成长10~14 d,更换培养基的频率为每周2次,直到显微镜可以明显观察到菌落。菌落形成后吸走培养基用PBS洗涤2次,4%多聚甲醛固定30 min,再用PBS洗2次,使用1%结晶紫溶液染色15 min,用纯水洗净晾干。结果使用Image J软件对菌落的数量进行计数、量化。
1.2.6 GS活力测试
根据GS检测试剂盒的步骤,检测不同条件下细胞的GS活力。谷氨酰胺合成酶在ATP和Mg2+的存在下,催化铵离子和谷氨酸合成谷氨酰胺;谷氨酰胺进一步转化为γ-谷氨酰基异肟酸,在酸性条件下其与铁形成红色的络合物,该络合物在540 nm处有最大吸收峰,可在酶标仪下被检测到。
1.2.7 实时荧光定量PCR
使用TransZol Up Plus RNA Kit从5×106个不同组处理的HepG2细胞中提取总RNA,并根据试剂制造商的说明转录成cDNA。Q-PCR使用ChamQ Universal SYBR qPCR Master Mix在Roche LightCycler 96 Real-Time PCR系统上进行。在结果中,GS的相对mRNA表达水平通过GAPDH的表达水平来进行标准化处理。设计并使用GAPDH(F:5′-ACAACTTTGGTATCGTGGAAGG-3′; R:5′-GCCATCACGCCACAGTTTC-3′)和GS(F:5′-ATTTCAGATTGGACCTTGTG-3′; R:5′-GTGCCGCTTGCTTAGTT-3′)两种引物通过以下步骤用于PCR扩增:95 ℃预变性5 min;95 ℃变性10 s,60 ℃退火和延伸30 s,共40个循环。2-ΔΔCt法用于目标基因的相对定量。
1.2.8 数据分析
统计分析使用GraphPad Prism 9软件进行。采用非配对t检验比较两组之间的差异,多组之间的差异用单因素或双因素方差分析。每个数值以平均值±标准差表示。
2 结果与分析
2.1 GS抑制剂对HepG2细胞的影响
我们探索了GS抑制剂MSO这种药物对HepG2肝癌细胞系的作用,与以往的研究结果一致[23],MSO会引起细胞内的负反馈调节,如图1(b)~(d)所示,辐照后72 h,GS-mRNA水平以及蛋白表达均显著上升。但是,GS活力被MSO大幅抑制,具体如图1(a)所示。

(a)MSO显著降低细胞内GS活力;(b)MSO对GS-mRNA表达的影响;(c)MSO对GS蛋白表达的影响;(d)LC3-II/GAPDH灰度值分析。MSO以0.001 mol/L 的浓度溶于培养基中,处理时间均为72 h。* 为P<0.05;** 为P<0.01。Con:对照组;MSO:MSO处理组。
2.2 GS抑制剂提高HepG2细胞放疗敏感性
对辐照后72 h的HepG2细胞进行了CCK-8活力检测,结果如图2(a)所示,MSO单独作用不会影响细胞活力,但是会进一步加强IR引起的活力下降。此外,使用集落形成实验进一步确定MSO长期作用下对细胞增殖的影响,与CCK-8的结果一致,MSO可以在放疗后抑制HepG2细胞的增殖,但是在未辐照情况下对细胞增殖并未产生显著影响。
2.3 IR诱导HepG2细胞自噬
如图3所示,通过MDC自噬体染料的染色结果观察到,细胞内自噬体会在IR后明显增加,提示自噬的激活,而MSO的参与进一步增加了自噬的数量,表明自噬流受到MSO的影响。

10 Gy剂量单次辐照后24 h,使用MDC染料观察HepG2细胞在不同处理条件下的自噬形成情况,MSO的浓度为0.001 mol/L。(a)对照组;(b)MSO处理组;(c)辐照组;(d)辐照与MSO共同处理组;倍数:200×;标尺:100 μm。
2.4 GS抑制剂调节IR诱导的自噬
为确定MSO对自噬流的具体影响,对自噬相关蛋白的表达进行了测定。如图4所示,研究结果表明,MSO的参与会引起放射治疗后LC3蛋白含量的变化,尤其是与自噬流密切相关的LC3-II蛋白。IR后72 h,细胞内LC3-II的水平大幅下降,这可能与IR诱导的自噬流水平的上升以及后续自噬体的顺利降解有关。然而,MSO抑制GS活力之后,LC3-II蛋白大量堆积,提示自噬流可能被抑制。在辐照后48 h使用Bafilomycin A1 (Baf-A1)阻断自噬降解以确定辐照和MSO对自噬的影响,结果表明,Baf-A1使得IR后的LC3-II蛋白堆积而对IR+MSO共同作用组无明显影响,表明IR激活了自噬,而MSO抑制了IR诱导的自噬。
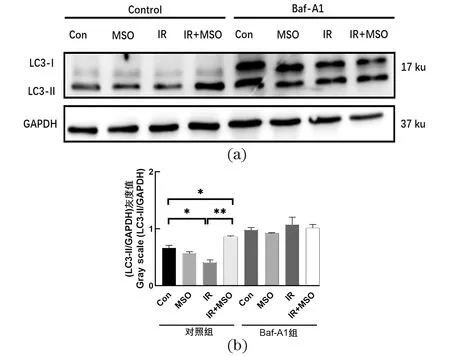
(a)10 Gy剂量单次辐照后72 h,Western Blot检测不同条件下自噬相关蛋白的表达情况;(b)LC3-II/GAPDH的灰度值分析。MSO浓度:0.001 mol/L;Baf-A1浓度:0.000 000 05 mol/L。ns为无显著差异;* 为P<0.05;** 为P<0.01。Con:对照组;MSO:MSO处理组;IR:辐照组;IR+MSO:辐照与MSO共同处理组。
3 讨论与结论
本研究使用MSO来抑制GS的活性,通过CCK-8和集落形成实验分别测试了HepG2细胞在放疗后短期和长期的增殖效率,分别使用MDC、Western Blot检测辐照后细胞内自噬水平。结果表明,放疗诱导自噬产生,并且GS活力抑制能够有效影响自噬调节从而提高HepG2细胞的放疗敏感性。这是首次对肝癌细胞放疗敏感性与其GS活性相关性的研究。
自噬起着多种病理生理作用,它有助于癌症细胞的生存和死亡,其在癌症中具有双重作用[24-25]。据报道,缺乏自噬相关蛋白Atg5或Atg7的小鼠会发展为肝癌[26]。然而,越来越多的证据表明,自噬对正常细胞中的早期致癌过程具有抑制作用,但在癌症细胞中,它有助于肿瘤生长、恶性转化和治疗抵抗[27]。在HCC相关研究中,FOXO3表达的抑制被证明可以通过加速自噬赋予HCC细胞对索拉菲尼的抵抗性[28],而自噬的抑制则会增强索拉非尼的敏感性[29]。
此外,自噬是具有放射抗性的癌细胞中一种保守的细胞生存策略,因为它在清除受损的细胞器和蛋白质方面发挥着关键作用,这对维持细胞内稳态和细胞健康至关重要[30]。多项研究结果表明,自噬的抑制可以进一步降低辐照后肿瘤的发生,例如膀胱癌[31]、结直肠癌[32]和前列腺癌[33]等。在食管癌症中,肝激酶B1通过AMP激活的蛋白激酶途径诱导的自噬亦被证明可以增强放射抗性[34]。此外,ATG5或Beclin 1 敲除的癌症细胞由于自噬抑制而表现出更强的放射敏感性[35]。并且最近研究表明,肝癌细胞放疗后的自噬通量会影响细胞的辐射抗性,GABARAP蛋白表达减少抑制了HCC细胞的自噬,并增强了其放射敏感性[36]。我们的结果也表明,放疗后HepG2细胞内的自噬水平会明显增加,这也与其放疗抗性密切相关。
谷氨酰胺合成酶 (GS) 是谷氨酰胺代谢中的一种关键酶,参与多种原核生物和真核生物的氮代谢、酸碱平衡和细胞信号转导[37]。谷氨酰胺合成酶在放射治疗中也发挥重要作用,有研究发现GS可以在辐照后促进肿瘤细胞的核苷酸代谢和随后的 DNA 损伤修复[38]。此外,GS在调节自噬方面也发挥重要作用,FOXO3介导的GS表达诱导自噬对细胞存活十分重要[39],且在肝癌细胞中β-catenin也可以调节GS的表达并引发一系列的代谢变化从而诱导自噬[40]。我们的研究结果也证实了放疗后GS对自噬的调节作用,GS活力的下降会抑制放疗诱导的自噬,也暗示MSO可以通过抑制放疗后肝癌细胞内GS介导的自噬水平升高来降低细胞的自我修复能力,从而降低细胞增殖能力。
总之,实验结果已经证实,HepG2细胞放疗后增殖能力与其自噬的诱导以及GS活力密切相关。由于细胞内负反馈调节,MSO虽然引起了GS-mRNA和蛋白表达的增加,但是其对GS活力的抑制能够有效抑制放疗后细胞自噬流的进行,从而提高HepG2细胞的放疗敏感性。
