线粒体蛋白HIGD1A调控细胞自噬增强HeLa细胞辐射抗性
2023-10-19赵喜朋赵国平
赵喜朋,赵国平
(1.安徽大学 物质科学与信息技术研究院,合肥 230601;2.中国科学院合肥物质科学研究院强磁场科学中心,合肥 230031)
细胞自噬(Autophagy)是一种通过溶酶体降解细胞内部功能失调的细胞组分的复杂过程,它在维持细胞稳态平衡、发育和分化过程中起关键作用[1]。自噬过程受到一系列自噬相关基因(ATG)的调控,这些ATG基因通常形成复合体参与调控自噬的各个过程。ULK1/2通过招募ATG13、FIP200和ATG101共同形成ULK复合体,该复合体是自噬的起始信号[2],ATG5-ATG12复合物与ATG16偶联以扩增自噬体膜[3],ATG4B与ATG7结合LC3I和磷脂酰乙醇胺(PE)形成的LC3II偶联到自噬膜上,然后招募一些自噬受体(如P62、NBR1)形成自噬体,最终自噬体与溶酶体结合,内容物被降解[4-6]。其中,LC3I到LC3II的转换以及P62蛋白的降解可以作为自噬发生的标志事件。自噬在肿瘤的发生和发展中具有双重作用。在肿瘤的起始阶段,一些基因的突变会抑制细胞自噬,例如:PI3K的突变、AKT或PTEN的缺失或沉默都会激活mTOR,从而抑制自噬[7-8]。在肿瘤发展的末期,自噬的激活可以促进多种肿瘤生长,以及增强肿瘤细胞对化疗药物和放射治疗的抗性[9-10]。在肿瘤治疗中,自噬抑制剂或诱导剂的使用已经克服了部分癌细胞的化疗耐药性或放疗抗性,表明自噬是癌症治疗的新靶点[11]。
HIGD1A是一种重要的线粒体蛋白,其作为细胞色素c氧化酶的一个亚基可以催化氧还原为水[12],在线粒体电子传递链复合物中起重要作用,过表达HIGD1A蛋白可以减少细胞对氧的消耗,但会触发线粒体ROS形成,导致AMPK调控的细胞抗氧化的激活[13]。作为重要的线粒体靶点,HIGD1A被报道在响应电离辐射之后,可以转位入核,参与同源重组修复[14]。同时有研究发现HIGD1A会抑制细胞色素c释放到细胞质,从而抑制细胞凋亡的发生[15]。许多研究表明细胞自噬与凋亡之间存在串扰[16],但是HIGD1A是否参与细胞自噬,以及是否通过细胞自噬调控肿瘤细胞的辐射敏感性尚未见报道。本研究利用HIGD1A敲低细胞系,在自噬诱导剂和电离辐射处理之后,通过检测细胞自噬标志蛋白LC3、P62的蛋白水平以及mCherry-GFP-LC3的荧光水平,探究线粒体蛋白HIGD1A通过调控自噬增强宫颈癌细胞(HeLa)辐射敏感性的机制,为临床上宫颈癌的治疗提供新思路。
1 材料与方法
1.1 材料
人宫颈癌细胞系HeLa(中国科学院上海细胞库);DMEM培养基(以色列 Biological Industries 公司);胎牛血清(以色列 Biological Industries 公司);青霉素-链霉素溶液(中国Biosharp公司);HIGD1A、LC3、P62、cleaved caspase-3、caspase-7抗体(武汉三鹰生物技术有限公司);β-actin 抗体(美国 Affinity Biosciences 公司);Ad-mCherry-GFP-LC3B(中国碧云天公司);CCK-8(中国陶术公司)。
1.2 方法
1.2.1 细胞培养
所用细胞系均以含10%胎牛血清和1%青霉素/链霉素的培养基培养,培养环境均为37 ℃,5% CO2。
1.2.2 蛋白质免疫印迹(Western Blot)
收集待检测的细胞,加入预冷的含蛋白酶抑制剂的RIPA裂解液,于冰上充分裂解细胞,4 ℃条件下12 000 r/min离心10 min,取上清液进行BCA定量。SDS-PAGE电泳分离、转膜、封闭后,孵育相应的抗体,4 ℃孵育过夜,TBST洗膜3次后,孵育对应二抗,TBST洗膜3次后在凝胶成像仪中进行蛋白检测。
1.2.3 构建稳转敲低HIGD1A的HeLa细胞系
委托苏州金唯智公司进行敲低HIGD1A的目标序列合成,目标序列为5′-CCATTCGTACCCGTTGGAATA-3′,并将目标序列退火后连接到pLKO.1载体上。使用三质粒转染系统(pLKO.1-HIGD1A/scramble shRNA、psPAX2、pMD2.G)转染293T细胞,48 h后收集病毒液并感染HeLa细胞,在病毒感染72 h后使用嘌呤霉素筛选稳转细胞系。其中scramble shRNA来自实验室保存,插入到pLKO.1载体上的序列为5′-GGGTGAACTCACGTCAGAA-3′。
1.2.4 荧光检测mCherry-GFP-LC3B
使用Ad-mCherry-GFP-LC3B腺病毒检测自噬进程,GFP在溶酶体酸性环境中会发生淬灭,所以红色荧光代表自噬溶酶体水平,完整的mCherry-GFP-LC3(黄色荧光斑点)仅代表自噬起始阶段的自噬体含量。细胞在感染病毒48 h后,重新消化接种于玻片上培养并进行相应的处理,在处理相应时间后进行荧光检测处理,使用PBS洗涤细胞3次,-20 ℃预冷的4%多聚甲醛固定30 min,PBS洗涤3次之后,将玻片面朝下置于载玻片上,于荧光显微镜下检测mCherry和GFP荧光水平。
1.2.5 CCK-8检测细胞活力
分别取对照细胞和敲低HIGD1A的HeLa细胞系接种于96孔板,待细胞贴壁后,使用雷帕霉素或者氯喹(CQ)预处理2 h,然后4 Gy剂量照射,培养48 h后,根据说明书,弃去原来的细胞培养基,加入含有CCK-8溶液的完全培养基,置细胞培养箱培养4 h,检测450 nm下的吸光度值。
1.2.6 统计学分析
实验数据使用Image J软件对Western Blot结果进行灰度分析。运用GraphPad Prism 9.0进行统计数据分析,实验数据用平均值±标准差表示统计分析结果,使用独立样本t检验进行数据分析并确定P值,P<0.05说明两组间具有显著性差异。
2 结果与分析
2.1 构建HIGD1A稳转敲低细胞系
使用慢病毒介导的RNA干扰技术,构建HIGD1A稳定敲低的HeLa细胞系,并利用Western Blot对敲低效率进行检测。实验结果显示,敲低细胞系的HIGD1A蛋白表达水平显著降低,敲低组HIGD1A的蛋白表达量相对于对照组降低至40%(P<0.000 1,n≥3),见图1。
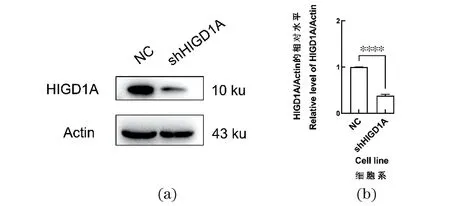
(a)Western Blot检测HeLa细胞中HIGD1A的蛋白表达水平;(b)Western Blot结果的灰度值分析。**** 为P<0.000 1。
2.2 HIGD1A参与饥饿诱导的细胞自噬
为探究HIGD1A蛋白是否参与细胞自噬,采用饥饿处理的方式诱导细胞自噬,使用EBSS处理对照细胞和HIGD1A敲低细胞。通过Western Blot检测LC3和P62的表达水平,与对照组细胞相比,LC3Ⅱ蛋白表达无显著性变化,敲低HIGD1A促进P62蛋白的积累;在EBSS处理4 h后,两组细胞中LC3Ⅱ蛋白表达无显著性差异,敲低HIGD1A抑制了P62蛋白的降解;同时使用EBSS和CQ处理细胞后,如图2(a)~(c),与对照组细胞相比,HIGD1A敲低细胞中P62没有显著变化,但LC3Ⅱ蛋白的表达量显著降低(P<0.000 1,n≥3),表明敲低HIGD1A抑制EBSS诱导的自噬。使用外源表达的mCherry-GFP-LC3B在荧光水平进行进一步验证自噬的变化。结果如图2(d)~(f)显示,与对照组细胞相比,同时使用EBSS处理细胞后,HIGD1A敲低细胞中的红色荧光(自噬溶酶体)表达水平显著下降(P<0.001,n≥3)。黄色荧光(自噬体)的表达水平也显著下降(P<0.000 1,n≥3)。表明HIGD1A敲低阻断了细胞自噬的过程。以上结果表明,HIGD1A参与饥饿诱导的细胞自噬,且敲低HIGD1A抑制EBSS诱导的细胞自噬水平。
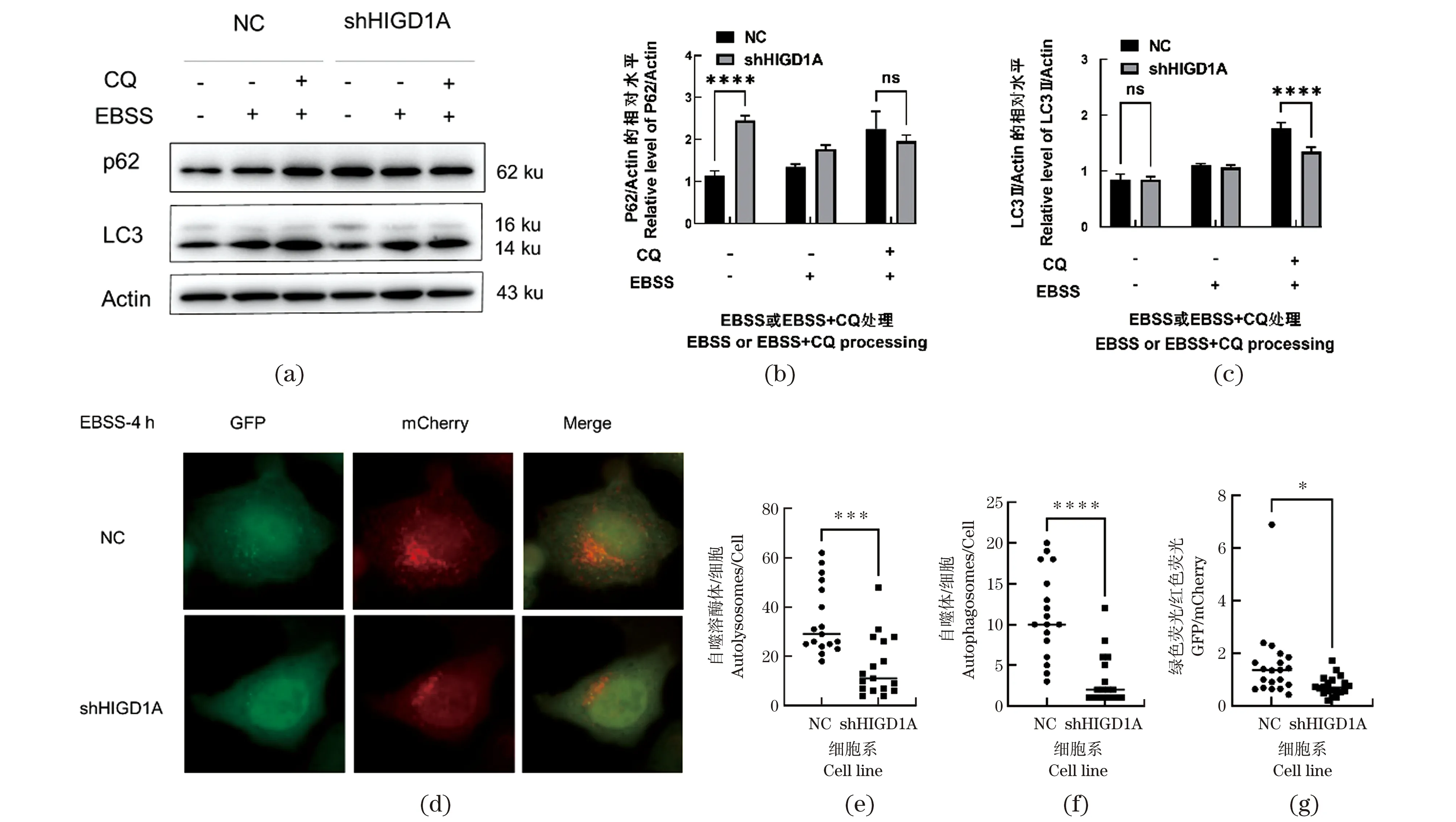
(a)对照细胞和HIGD1A敲低细胞在单独EBSS或EBSS和CQ(10 μmol/L)同时处理4 h后,Western Blot检测P62、LC3的蛋白表达水平;(b)和(c)Western Blot结果的灰度值分析;(d)在腺病毒Ad-mCherry-GFP-LC3B感染细胞48 h后,使用EBSS处理细胞4 h,荧光检测mCherry-GFP-LC3B的表达水平;(e)~(g)对(d)中结果mCherry(自噬溶酶体)和GFP+mCherry(自噬体)计数,计算GFP/mCherry比值,并统计。ns为P>0.05,* 为P<0.05,*** 为P<0.001,**** 为P<0.000 1。
2.3 HIGD1A参与电离辐射诱导的细胞自噬
为探究HIGD1A是否参与电离辐射(IR)诱导的自噬反应,使用γ射线(4 Gy)照射对照组和HIGD1A敲低细胞。Western Blot检测结果显示,HIGD1A敲低促进P62蛋白的积累,但LC3Ⅱ蛋白表达量无显著变化;在IR处理4 h后,两组细胞中LC3Ⅱ蛋白表达无显著性差异,HIGD1A敲低抑制了P62蛋白的降解;在CQ联合IR处理细胞后,与对照细胞相比,敲低HIGD1A对P62的积累没有显著影响,但显著降低LC3Ⅱ的表达水平(P<0.01,n≥3),见图3(a)~(c)。使用Ad-mCherry-GFP-LC3B重组腺病毒对细胞自噬流进行检测,结果与EBSS诱导自噬相似,与对照组细胞相比,使用IR处理细胞后,敲低HIGD1A抑制细胞自噬溶酶体和自噬体的生成(P<0.01,n≥3),见图3(d)~(g)。以上结果表明,HIGD1A响应电离辐射诱导的自噬,且敲低HIGD1A抑制电离辐射诱导的自噬。
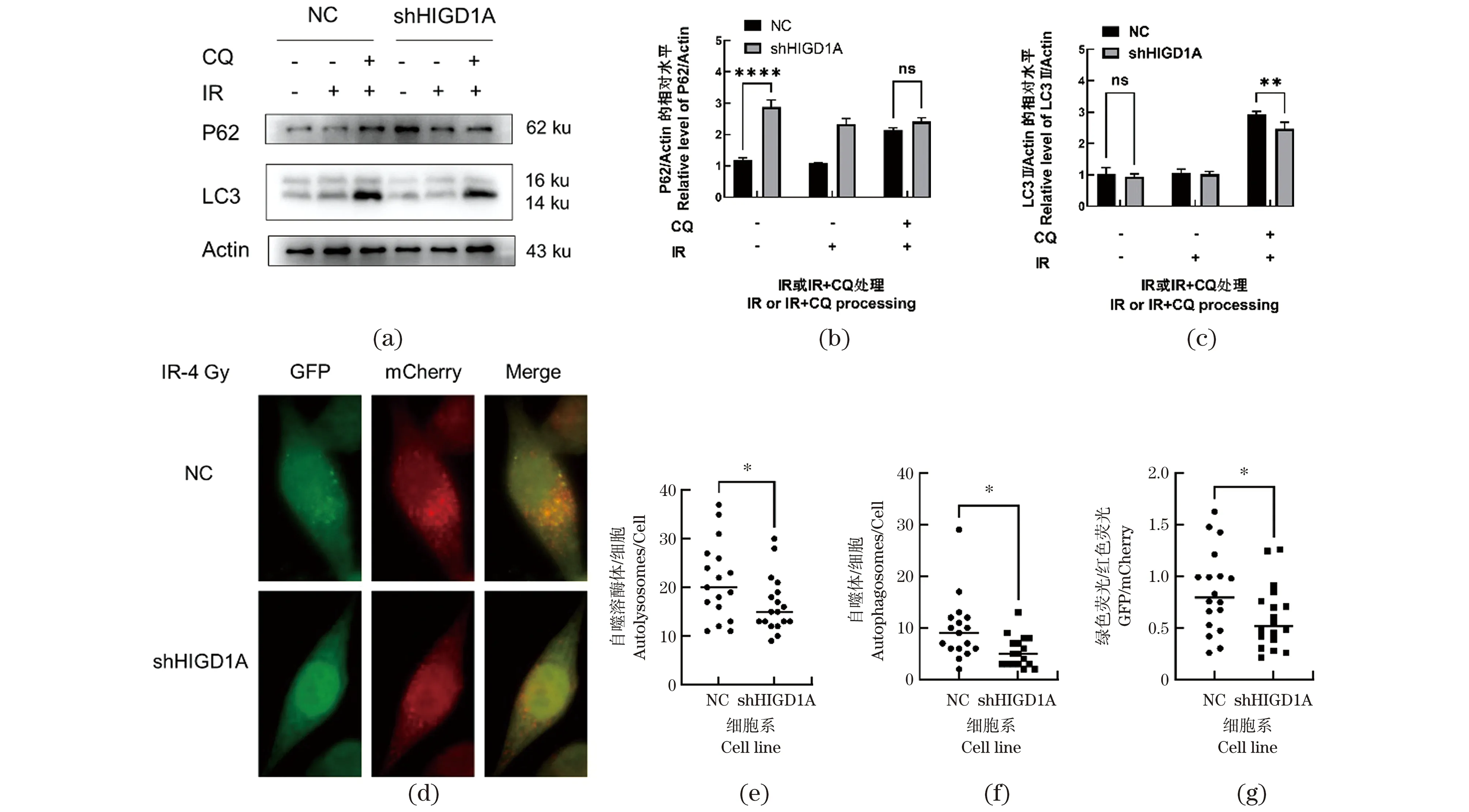
(a)在CQ(10 μmol/L)预处理对照细胞和HIGD1A敲低细胞2 h后,使用4 Gy剂量γ射线处理细胞,4 h后Western Blot检测P62、LC3的蛋白表达水平;(b)和(c)Western Blot结果的灰度值分析;(d)在腺病毒Ad-mCherry-GFP-LC3B感染细胞48 h后,使用4 Gy剂量γ射线处理细胞,4 h后荧光检测mCherry-GFP-LC3B的表达水平;(e)~(g)对(d)中结果mCherry(自噬溶酶体)和GFP+mCherry(自噬体)计数,计算GFP/mCherry比值,并统计。ns为P>0.05,* 为P<0.05,** 为P<0.01,**** 为P<0.000 1。
2.4 敲低HIGD1A联合自噬抑制剂增强肿瘤细胞的辐射敏感性
根据以上结果,我们推测敲低HIGD1A联合自噬抑制剂可以增强肿瘤细胞对电离辐射的敏感性。通过CCK-8对细胞活力进行检测发现,使用CQ预处理之后进行电离辐射处理,敲低HIGD1A组较对照组细胞活力有显著下降(P<0.01,n≥3);雷帕霉素预处理后进行电离辐射处理的结果显示,雷帕霉素处理后HIGD1A敲低细胞系的细胞活力较对照细胞无明显变化(P<0.01,n≥3),见图4。以上结果表明,敲低HIGD1A联合CQ能够进一步抑制辐射诱导的自噬增强肿瘤细胞的辐射敏感性。
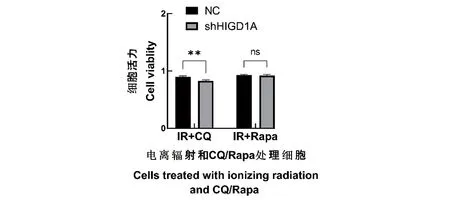
在用CQ(10 μmol/L)/雷帕霉素(100 nmol/L)预处理对照细胞和HIGD1A敲低细胞2 h后,使用4 Gy剂量γ射线辐照细胞,48 h后使用CCK-8处理细胞4 h,测定450 nm下的吸光度值,对数据分析并统计细胞活力。ns 为P>0.05,** 为P<0.01。
2.5 HIGD1A参与细胞自噬并抑制细胞凋亡
细胞自噬与细胞凋亡关系密切[16],以往的研究表明HIGD1A能够降低细胞凋亡水平[15],本文推测HIGD1A可能通过调控凋亡参与自噬途径。接下来,通过Western Blot检测凋亡相关蛋白caspase-7和cleaved caspase-3的表达水平评估细胞的凋亡水平。结果显示,敲低HIGD1A细胞中caspase-7和cleaved caspase-3的表达水平升高,见图5(a);雷帕霉素处理后的对照细胞中caspase-7以及cleaved caspase-3表达水平下降(P<0.05,n≥3),但雷帕霉素的使用对HIGD1A敲低细胞系中caspase-7和cleaved caspase-3的表达水平没有显著影响,见图5(b)~(d),说明敲低HIGD1A使细胞维持在较高的凋亡水平。以上结果表明,HIGD1A可能通过调节细胞凋亡参与细胞自噬途径。
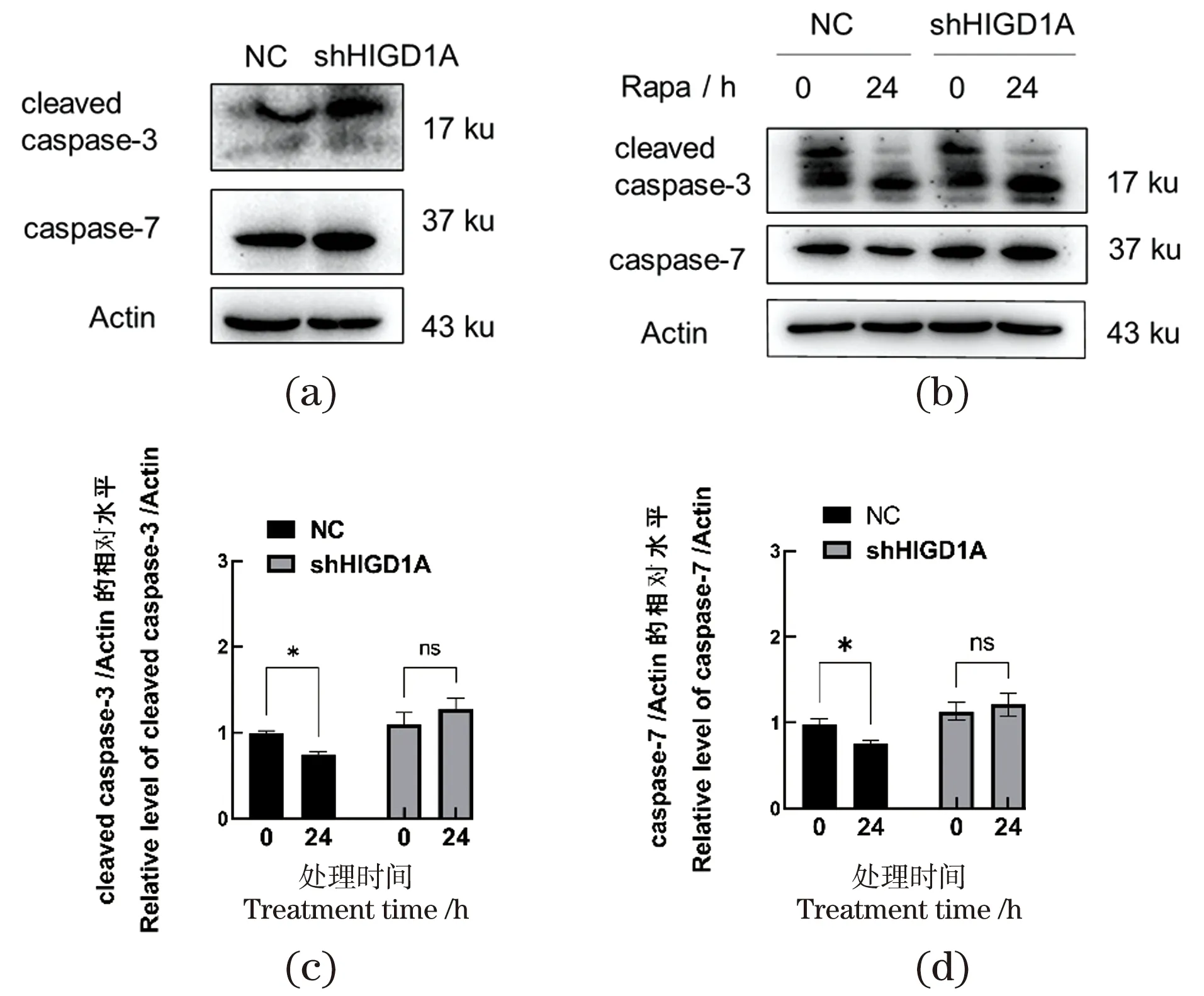
(a)Western Blot检测cleaved caspase-3、caspase-7的蛋白表达水平;(b)使用雷帕霉素(100 nmol/L)处理对照细胞和HIGD1A敲低细胞24 h后,Western Blot检测cleaved caspase-3、caspase-7的蛋白表达水平;(c)和(d)Western Blot结果的灰度值分析。ns为P>0.05,* 为P<0.05。
3 讨论与结论
放射治疗是临床上治疗恶性肿瘤的重要手段,如何提高肿瘤细胞的放射敏感性是临床治疗过程中面临的重要问题。HIGD1A被报道可以参与DNA同源重组修复调控肿瘤细胞的辐射敏感性[14],但HIGD1A在自噬中的作用尚不明确。本研究使用自噬诱导剂EBSS和电离辐射处理细胞,通过检测自噬标志蛋白LC3和P62的表达水平、mCherry-GFP-LC3B融合蛋白的荧光表达水平,并结合CCK-8实验,以及检测caspase-7和cleaved caspase-3的表达水平,发现HIGD1A响应电离辐射处理之后的自噬,敲低HIGD1A联合辐射能够进一步抑制细胞自噬的发生,增强Hela细胞的辐射敏感性。
细胞自噬发生过程中LC3蛋白会从LC3I转换为膜结合的LC3II,P62蛋白作为自噬受体将自噬底物和LC3II连接,然后通过自噬溶酶体降解,所以LC3II和P62常作为检测自噬的标志蛋白[17]。本研究发现,同时使用CQ和EBSS或电离辐射处理细胞后,敲低HIGD1A抑制了LC3II的生成,但P62的降解并没有被抑制,可能P62不介导HIGD1A调控的自噬。自噬在放疗后具有维持肿瘤细胞存活的功能,并最终导致肿瘤细胞的辐射抗性和恶性肿瘤复发,使用自噬抑制剂(如氯喹)阻断自噬活性可以使肿瘤细胞对辐射敏感[18-19],表明自噬信号是肿瘤治疗中的重要靶点。本研究对细胞活力的检测发现,敲低HIGD1A并使用自噬抑制剂进一步抑制自噬降解可以增强HeLa细胞的辐射敏感性,表明HIGD1A参与细胞遭受应激后的保护性自噬。自噬与凋亡之间存在复杂的交互调控[16],本文发现敲低HIGD1A提高了细胞的凋亡水平,结合敲低HIGD1A自噬水平下降,表明HIGD1A可能通过调节细胞凋亡参与细胞自噬。
综上所述,本研究初步阐明HIGD1A蛋白参与细胞自噬并且通过细胞自噬调控肿瘤辐射敏感性的作用。本次实验将细胞自噬诱导剂和抑制剂与肿瘤放疗相结合,这些数据可能为临床治疗提供相关支持。
