直接多重TaqMan qPCR方法快速鉴定褐飞虱属3种飞虱
2023-05-18罗举杨素文贝文勇余军伟唐健刘淑华
罗举 杨素文 贝文勇 余军伟 唐健 刘淑华,*
直接多重TaqMan qPCR方法快速鉴定褐飞虱属3种飞虱
罗举1杨素文2贝文勇3余军伟4唐健1刘淑华1,*
(1中国水稻研究所,杭州 311401;2湖南省邵东市牛马司镇农业综合服务中心,湖南 邵阳 422803;3广西昭平县植保植检站,广西 贺州 546800;4杭州优思达生物技术有限公司,杭州 310015;*通信联系人, email: liushuhua@caas.cn)
【目的】褐飞虱()是水稻重大害虫,灯光诱捕一直是褐飞虱监测的重要方法。然而,褐飞虱的两个同属近似种伪褐飞虱()和拟褐飞虱()也具有扑灯行为,常被误判为褐飞虱。针对测报灯下褐飞虱属近似种形态鉴定费时费力、专业技能要求高,伪褐飞虱和拟褐飞虱常被误判为褐飞虱这一问题,拟建立一种褐飞虱属3种飞虱的快速分类鉴定方法。【方法】以条形码基因为靶标,筛选褐飞虱属通用引物及物种特异性探针,建立并优化直接多重Taqman qPCR检测体系(Direct Multiplex TaqMan quantitative PCR, dmTqPCR),并分析其特异性、灵敏度及实用性。【结果】本研究建立的3种飞虱dmTqPCR检测方法特异性强,可准确区分褐飞虱、伪褐飞虱和拟褐飞虱;灵敏度高,检出限可达10拷贝/反应;大样本检测结果表明,382个样本从样本获取到结果输出的整个过程可在3 h内完成,检出率及准确率均为100%。【结论】本研究建立的褐飞虱属近似种的dmTqPCR鉴定方法可以用于褐飞虱、伪褐飞虱和拟褐飞虱的快速分类鉴定,有利于灯下褐飞虱的精准测报。
褐飞虱;伪褐飞虱;拟褐飞虱;ITS1;直接多重Taqman qPCR
褐飞虱[Stål]是我国及东南亚水稻重大害虫,也是我国农业农村部公告(第333号)公布的一类农作物10种(类)虫害之一。褐飞虱属于半翅目(Hemiptera)飞虱科(Delphacidae)褐飞虱属(Distant),全世界范围共记录褐飞虱属18个种,我国所处的东洋区有8种,其中褐飞虱、伪褐飞虱[China]和拟褐飞虱[]是我国稻田灯下常见的三种同属近似种[1-3]。伪褐飞虱和拟褐飞虱并不取食水稻,而是以禾本科的游草和秕谷草为最适宜寄主[4]。然而,3种飞虱具有广泛的共同分布区域,发生季节也有交叉(4月―10月),且都具有扑灯习性。不同地点测报灯下,伪褐飞虱、拟褐飞虱的发生比例可分别高达46.8%和39.3%[5, 6]。褐飞虱、拟褐飞虱和伪褐飞虱形态、体色和外部特征均非常相似,肉眼难以区分,需专业人员借助显微镜才能鉴定[7](图1)。显微镜下先看体形和体色分出雌雄,再看颜面分出拟褐飞虱,最后看外生殖器区分出褐飞虱和伪褐飞虱[8]。人工进行鉴定耗时费力,对专业技能要求高。目前市场上基于RGB(red, green, blue)图像识别原理的智能虫情测报灯对伪褐飞虱、拟褐飞虱的鉴定更是无能为力,伪褐飞虱及拟褐飞虱均作为褐飞虱进行统计,严重影响了测报的准确性。因此,亟需研发快速鉴定手段,弥补形态学鉴定及图像识别技术的局限,达到快速准确监测的目的。针对褐飞虱属昆虫,崔亚丽[9]曾利用核糖体间隔区基因(internal transcribed spacer, ITS)设计引物,初步建立了基于电泳的3种飞虱的多重PCR检测技术(需PCR仪+电泳仪),由于是以纯基因组DNA为模板,具有耗时长、操作复杂等缺点。Liu等[10]在此基础上,重新设计引物建立了3种飞虱的直接多重PCR检测方法,该方法以加水研磨的虫体粗组织液为模板,不需要提取DNA,将检测时间大大缩短。罗举等[11]建立了基于重组聚合酶扩增(recombinase polymerase amplification, RPA)和侧流层析试纸条(lateral flow dipstick, LFD)的褐飞虱快速鉴定技术,可在不借助任何仪器的情况下在12 min内完成检测。这些技术虽都能准确鉴定物种,且对分类专业技能无要求,但都存在一定的不足。崔亚丽[9]与Liu等[10]的方法将PCR扩增与电泳检测环节分开,时效性欠佳;罗举等[11]的方法虽然检测速度很快,但只能区分褐飞虱与非褐飞虱,不能检测伪褐飞虱与拟褐飞虱。尽管已有多种褐飞虱属昆虫的分子鉴定方法,但在时效性及检测通量上还都存在一定的不足。本研究以褐飞虱属3种飞虱为对象,借鉴医学领域的等位基因分型思路,设计褐飞虱属通用引物及物种特异性探针,以加水研磨的虫体粗组织液为检测模板,建立一种快速、简便的直接多重TaqMan实时荧光定量PCR检测方法。升级现有的灯下飞虱速检技术,解决灯下褐飞虱鉴定耗时、费力、专业技能要求高的难题,促进我国褐飞虱精准测报事业发展,为褐飞虱的精准绿色防控提供技术支撑。
1 材料与方法
1.1 昆虫样本准备
2021年度收集的广西昭平、湖南邵东和浙江富阳的测报灯下褐飞虱、伪褐飞虱、拟褐飞虱、白背飞虱()、稗飞虱()、烟翅白背飞虱()、灰飞虱()、廖飞虱()、短头飞虱()和黑边梅塔飞虱()的干虫样本,经形态鉴定后,单头分装保存于1.5 mL的离心管中。
1.2 主要仪器与试剂
荧光定量PCR仪(Quantstudio 3,美国赛默飞世尔科技有限公司);研磨仪(LC-TG-48,上海力辰邦西仪器科技有限公司);TaqMan通用PCR预混液(A30865,美国赛默飞世尔科技有限公司);Taq酶试剂盒(KME-101,日本东洋纺生物科技有限公司);T载体(CB501,北京擎科生物科技有限公司);质粒小提试剂盒(32917KA1,Axygen)。
1.3 引物与探针的设计
参考Liu等[10]报道的核糖体DNA内转录间隔区1(internal transcribed spacer-1, ITS1)序列,在3种飞虱的保守序列部位设计属内通用扩增引物ITS1-F/ITS1-R,褐飞虱、伪褐飞虱和拟褐飞虱的目标片段长度分别为132 bp(base pair)、159 bp和160 bp;在差异序列部位设计物种特异性Taqman MGB探针Nl-ITS1-P、Nm-ITS1-P和Nb-ITS1-P,并分别标记FAM、VIC和ROX荧光素。不同物种的差异碱基序列最好位于探针的中间1/3处,有利于提高探针的特异性。引物和探针均由生工生物工程(上海)股份有限公司合成,引物探针序列及位置见表1和图1。
1.4 dmTqPCR的特异性分析
以单核苷酸多态性(single nucleotide polymorphism, SNP)分型原理进行昆虫近似种鉴定,通用引物要确保在所检测的多种目标昆虫中都能有效扩增,特异性探针则只能与靶标昆虫的扩增片段进行结合。以褐飞虱、伪褐飞虱、拟褐飞虱、白背飞虱、稗飞虱、烟翅白背飞虱、灰飞虱、廖飞虱、短头飞虱和黑边梅塔飞虱的粗组织液为模板,首先以普通PCR及凝胶电泳检测法进行扩增引物ITS1-F/R的特异性验证,再次参照说明书进行dmTqPCR检测,分析多重检测体系的特异性。多重反应体系包括2×Taq PathTMproAmpTMMaster 5 μL,ITS1-F/R(10 μmol/L)各0.2 μL,10 μmol /L的Nl-P、Nm-P和Nb-P探针各0.2 μL,DNA模板2.0 μL,ddH2O 2.0 μL。反应条件如下:95℃预变性,5 min;95℃变性10 s,60℃20 s,共40个循环。
1.5 dmTqPCR的灵敏度分析
以褐飞虱、伪褐飞虱、拟褐飞虱的基因组DNA作为模板,应用引物对ITS1-F/R进行PCR扩增,凝胶回收PCR产物,连接T载体,转化大肠杆菌感受态细胞,筛选阳性菌落,抽提质粒并进行测序鉴定。鉴定正确的重组质粒作为阳性标准品,分别命名为Nl-ITS1、Nm-ITS1和Nb-ITS1。将3种重组质粒标准品Nl-ITS1、Nm-ITS1、Nb-ITS1混合后10倍等比稀释,取终浓度为1×100~1×107拷贝/μL的质粒混合物作为模板,按上述多重Taqman qPCR体系进行灵敏度检测。质粒标准拷贝数计算公式为:
DNA拷贝数(copies/μL)=质粒浓度(ng/μL)×6.02×105/660×质粒碱基数(bp)。
1.6 dmTqPCR的实用性评价
使用所建立的多重Taqman qPCR检测体系对2021年度在广西昭平、湖南邵东和浙江富阳地区采集的382个飞虱样本粗组织液进行测试(单头飞虱用500 μL H2O研磨)(表2),以3种飞虱质粒的混合液为阳性对照(1×105拷贝/μL),无菌水为阴性对照。测试结果与专家形态学鉴定结果比较,验证方法的准确性。另外,准确计算了从样本获得到结果输出的总时长,评价其适用性。

Nl―褐飞虱;Nm―伪褐飞虱;Nb―拟褐飞虱。下划线序列代表引物位置,蓝色背景为探针位置。
Fig. 1. Multiple alignment of ITS1 genes fromand its two sibling species.

表2 样本收集地点
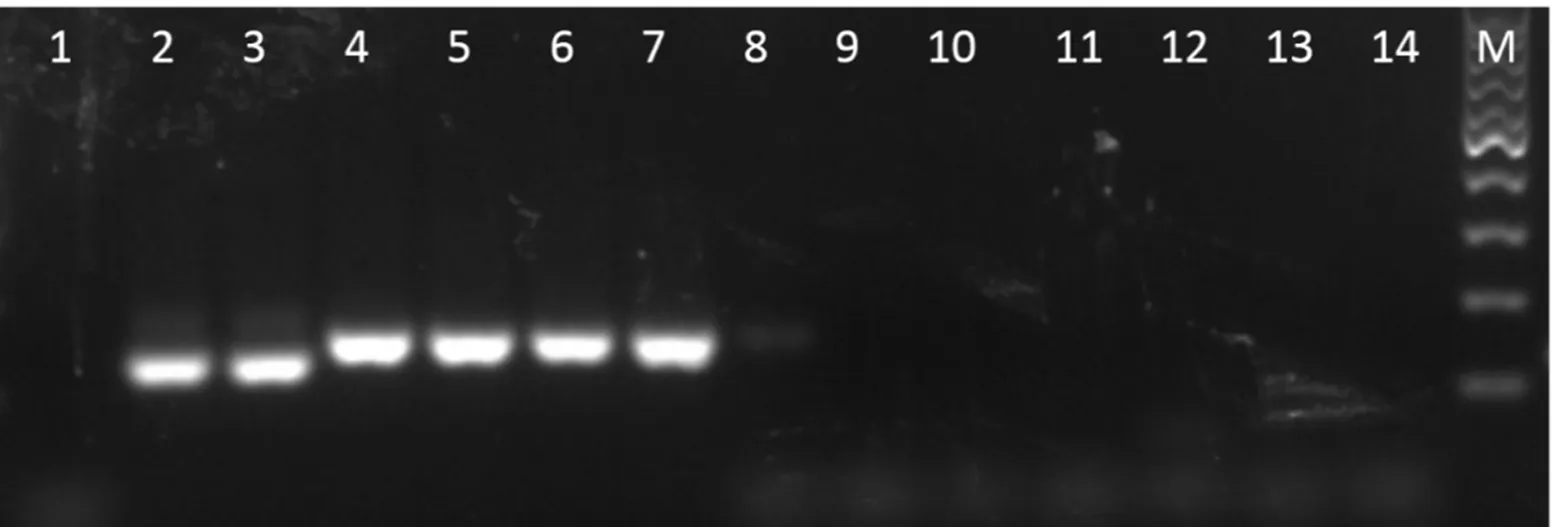
1―水;2~3―褐飞虱;4~5―伪褐飞虱;6~7―拟褐飞虱;8―白背飞虱;9―灰飞虱;10―烟翅白背飞虱;11―稗飞虱;12―廖飞虱;13―短头飞虱;14―黑边梅塔飞虱;M―100 bp DNA标准品
Fig. 2. Specificity analysis of the inter-speies general primes ITS1-F/R.

Nl―褐飞虱;Nm―伪褐飞虱;Nb―拟褐飞虱。
Fig. 3. Specificity analysis of the direct multiplex TaqMan qPCR assay.
2 结果与分析
2.1 dmTqPCR检测特异性
引物特异性分析结果表明,ITS1-F/R引物在褐飞虱、伪褐飞虱和拟褐飞虱中都能扩增出单一明亮条带(100~200 bp),而白背飞虱、灰飞虱、烟翅白背飞虱、稗飞虱、廖飞虱、短头飞虱和黑边梅塔飞虱均无明显扩增条带(图2)。直接参照说明书的体系与条件进行多重检测,结果表明褐飞虱探针Nl-P和伪褐飞虱探针Nm-P都很特异,在非目标飞虱中均无任何扩增;而拟褐飞虱探针Nb-P特异性稍差,在褐飞虱和伪褐飞虱中都有轻微扩增,但并不影响结果(图3)。多组分图显示(图3),只有褐飞虱、伪褐飞虱和拟褐飞虱显示出良好的“S”形扩增曲线,而非靶标飞虱和空白对照均无明显扩增,说明所建立的dmTqPCR体系可以用于3种飞虱的定性鉴定。
2.2 dmTqPCR检测灵敏性
利用所建立的dmTqPCR体系对不同浓度的3种飞虱的重组质粒混合液进行测定,结果表明该体系对褐飞虱、伪褐飞虱和拟褐飞虱的检出限(Limit of detection, LOD)均为10拷贝(图4)。由建立的标准曲线可知,该多重体系对褐飞虱、伪褐飞虱和拟褐飞虱基因的扩增效率分别为97.61%,96.20%和97.13%,决定系数2分别为0.998、0.999和0.998,建立方程=−3.381+38.310、=−3.417+37.40和=−3.393+38.343(其中代表值,代表拷贝数对数值)。
2.3 dmTqPCR检测实用性
为评估所建立的dmTqPCR检测体系的实际应用效果,对2021年度3个不同省份站点收集的共382头飞虱盲样进行检测,以3种飞虱质粒的混合液为阳性对照(1×105拷贝/μL),无菌水为阴性对照。结果表明,褐飞虱、伪褐飞虱和拟褐飞虱样本分别为189头、121头和72头,与人工鉴定结果完全一致,检出率与准确率均为100%(部分结果如表3)。本研究中,利用高通量组织研磨仪制备样本粗组织液5~10 min,试剂配制及加样约50 min,上机检测约40 min,382个样本从样本获取到结果输出的整个过程可在3 h内完成。
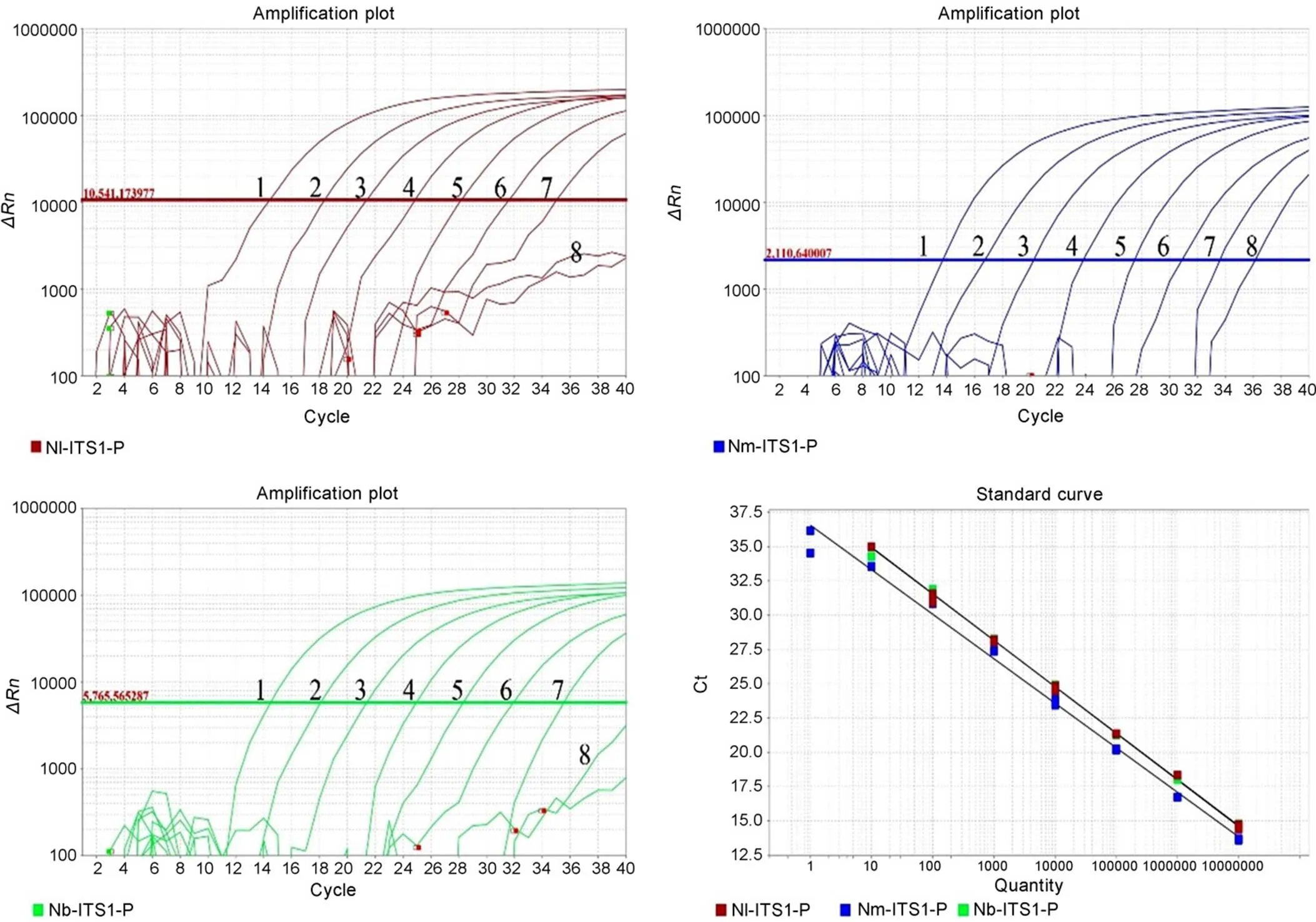
1~8分别代表1.0×107、1.0×106、1.0×105、1.0×104、1.0×103、1.0×102、1.0×101、1.0×100拷贝/μL。
Fig. 4. Sensitivity analysis of the direct multiplex TaqMan qPCR assay.

表3 直接多重TaqMan qPCR检测体系对382个样本检测的部分结果
Nl―褐飞虱;Nm―伪褐飞虱;Nb―拟褐飞虱;Pc―阳性对照;Nc―阴性对照。
Nl,; Nm,; Nb,; Pc, Positive control; Nc, Negative control.
3 讨论
褐飞虱是水稻重大害虫,测报灯下褐飞虱的数量动态是目前褐飞虱虫情测报的关键依据之一[12]。然而,市场上的所有诱虫灯都不具有诱虫特异性,诱捕靶标害虫的同时也会诱捕大量非靶标昆虫。自罗举等[5]报道我国灯下存在高比例的伪褐飞虱和拟褐飞虱以来,褐飞虱及其近似种的正确区分及快速鉴定引起了人们的高度重视。崔亚丽[9]及Liu等[10]建立的基于多重PCR和直接多重PCR的褐飞虱及其近似种鉴定方法都依赖于变温PCR仪和电泳仪等精密仪器,不利于在基层植保站推广应用。罗举等[11]建立的基于恒温PCR的褐飞虱快速鉴定方法,虽摆脱了对精密仪器的依赖,但并不能鉴定伪褐飞虱和拟褐飞虱。因此,本研究建立了基于Taqman qPCR的褐飞虱属3种飞虱的多重快速检测方法,可同步快速准确区分褐飞虱、伪褐飞虱和拟褐飞虱。该方法灵敏度高,对3种飞虱的最低检测线均可达到10拷贝/反应;具有较好的抗干扰性,可直接以粗组织液为模板,节约了DNA提取时间与试剂成本;检测迅速,382个样本的检测可在3 h内完成;大样本检测结果表明,该方法对3种飞虱的检出率及准确率均为100%;该方法由于实现了DNA扩增与DNA检测的同步进行,较Liu等[10]的直接多重PCR检测方法大大提高了检测效率,实用性更强。
核酸检测技术因快速、准确、操作简便,广泛用于近似昆虫的分类鉴定,也常用于检疫性及农业害虫的快速检测。例如,黄丽莉等[13]利用线粒体细胞色素C氧化酶Ⅰ(cytochrome coxidase Ⅰ, COⅠ)基因作为分子标记实现了对茶园5种蓟马的分类鉴定;张磊等[14]利用变温PCR扩增与测序技术建立了草地贪夜蛾()的分子鉴定方法;吴霞等[15]和李茵等[16]利用TaqMan qPCR技术建立了茶黄蓟马()与西花蓟马()的快速检测方法。核酸检测技术主要包括样本核酸制备、扩增和检测三个模块,若要实现快速准确检测,达到易推广的要求,需对这三个模块分别进行优化。样本核酸制备是核酸检测的第一步,传统的昆虫核酸检测技术多是以纯DNA为模板,而本方法是以粗组织液为模板,节省了DNA提取时间,时效性更强。核酸扩增是核酸检测的主体环节,在变温PCR扩增技术成熟发展的基础上,恒温PCR扩增也逐步应用于昆虫的快速分类鉴定,如RPA技术[17]和环介导等温扩增技术(Loop-mediated isothermal amplification, LAMP)[18-22]。LAMP方法一般需要4~6条引物,不适用于多重检测体系的构建;RPA方法虽然只需要2条引物,但引物一般要求30~35 bp,较长引物容易形成二级结构,多重体系构建难度大。因此,本文仍然选择了变温PCR扩增技术进行DNA扩增,这有利于褐飞虱属3种飞虱多重快速检测体系的构建。对于核酸检测模块,一般可分为终点法和实时法,常用的终点法有Sanger测序和凝胶电泳,实时法即荧光定量法。荧光定量法因将核酸扩增及核酸检测环节同步进行,因此在时效性方面更佳。Taqman探针法也是实时荧光定量方法的一种,可以实现单核苷酸的差异检测,也常用于昆虫近似种的分类鉴定。徐浪等[23]建立了新菠萝灰粉蚧()和菠萝灰粉蚧()的双重检测技术,Aguirre等[24]建立了白缘象甲()和南美果树象甲()的双重检测技术。综合考虑,本研究选择了Taqman qPCR技术进行褐飞虱属3种飞虱的多种检测体系构建。构建单管多重检测体系最重要是要关注引物/探针的互作效应,有些单重检测验证良好的引物/探针并不能直接用作多重检测。本研究中巧妙的利用了SNP分型原理,选用一对通用引物和三条物种特异性引物进行多重体系构建,因只涉及5条短核苷酸序列,且三个探针的序列大部分相同,所以多重检测体系相对容易构建。建立多重Taqman定量体系,MGB探针最好不要超过2个,由于本研究只是进行定性检测,虽然3条探针均是以MGB作为淬灭集团,但仍能正确区分3种飞虱。从表3可知,不同种类昆虫及同种昆虫间值差异较大,这是由于所选用的ITS1是核糖体多拷贝基因导致的,如进行定量检测体系的构建,最好是选择细胞核单拷贝基因。
目前,昆虫学领域的单管多重核酸检测技术最多可达到3重,应用潜力仍然受限。厦门大学的李庆阁团队报道了一种“MeltArray”的荧光PCR新技术,可以实现单个荧光通道检测12个靶标,常规荧光定量PCR仪的4个通道可以检测多达48个靶标[25]。MeltArray技术为昆虫的快速分类鉴定展现了很好的发展愿景,理论上可以实现对任何近似昆虫种类的快速检测。目前,用于昆虫鉴定的多重检测技术,多是基于多对引物建立的体系[23],而本研究是借鉴了SNP分型原理,利用一对褐飞虱属通用扩增引物和三个物种特异性探针鉴定,这成功规避了单管中多条引物的抑制互作效应,相同思路的方法在其他昆虫中也有所报道[26]。需要注意的是,虽然多种分子检测技术可用于昆虫的快速分类鉴定,然而都是单头定性鉴定技术,当面对大量样本时,需要逐一分拣检测,效率低且成本高。因此,怎样将核酸检测技术从单头定性鉴定升级为多头定量检测,将是未来重点的发展方向,也是解决诱虫灯下三种近似种快速精准监测的主要出路。
综上所述,本研究建立了褐飞虱属3种飞虱的直接多重Taqman qPCR检测方法,实现了褐飞虱、伪褐飞虱和拟褐飞虱的快速准确鉴定,可为褐飞虱的精准绿色防控提供技术支撑。不足之处是,本技术仍需精密仪器介入,不利于现场即时检测及在基层大范围推广。未来有必要研发基于恒温PCR的3种飞虱直接多重检测技术及基于“昆虫汤”的褐飞虱属3种飞虱的精准定量技术。
[1] 丁锦华, 褐飞虱属分类及其种类的研究 [J]. 南京农业大学学报, 1981(1): 78-85.
Ding J H. Taxonomic study of Nilaparvata (Hemiptera: Delphacidae) [J]., 1981(1): 78-85. (in Chinese)
[2] 程遐年, 吴进才, 马飞. 褐飞虱研究与防治 [M]. 北京: 中国农业出版社, 2002.
Cheng X N, Wu J C, Ma F. Research and Management of[M]. Beijing: China Agricultural Press, 2002. (in Chinese)
[3] Guo L Z, Liang A P, Jiang G M. Four new species and a new record of Delphacidae (Hemiptera) from China[J]., 2005, 39: 161-174.
[4] 崔亚丽, 何佳春, 罗举, 赖凤香, 傅强. 褐飞虱近似种伪褐飞虱和拟褐飞虱的寄主植物[J]. 中国水稻科学, 2013, 27(1): 105-110.
Cui Y L, He J C, Luo J, Lai F X, Fu Q. Host plants ofChina and(Muir), two sibling species of(Stål) [J]., 2013, 27(1): 105-110. (in Chinese with English abstract)
[5] 罗举, 傅强, 陆志坚, 吴彩谦, 李一波, 段德康, 刘玉坤, 张志涛. 测报灯下褐飞虱及其两种近似种的数量动态[J]. 中国水稻科学, 2010, 24(3): 315-319.
Luo J, Fu Q, Lu Z J , Wu C Q, Li Y B, Duan D K, Liu Y K, Zhang Z T. Population dynamics ofand its two sibling species under black light trap [J]., 2010, 24(3): 315-319. (in Chinese)
[6] 蒋天梅, 虞根聪, 赖朝晖, 蒋晔. 象山县测报灯下褐飞虱及其近似种的数量动态 [J]. 中国植保导刊, 2018, 38(7): 43-45.
Jiang T M, Yu G C, Lai C H, Jiang Y. Population dynamics ofand its two sibling species under light trap in Xiangshan[J]., 2018, 38(7): 43-45. (in Chinese)
[7] 丁锦华,胡春林,傅强,何佳春,谢茂成. 中国稻区常见飞虱原色图鉴[M]. 杭州: 浙江科学技术出版社, 2012.
Ding J H, Hu C L, Fu Q, He J C, Xie M C. Primary Color Atlas of Common Planthoppers in Rice Areas of China [M]. Hangzhou: Zhejiang Science and Technology Press, 2012. (in Chinese)
[8] 芮金富, 周建平, 石磊. 褐飞虱与拟褐飞虱和伪褐飞虱的识别[J]. 现代农业科技, 2011(5): 191.
Rui J F, Zhou J P, Shi L. Morphological identification offrom its two sibling species,and[J]., 2011(5): 191. (in Chinese)
[9] 崔亚丽. 褐飞虱及其两近似种的生物学及分子标记的研究 [D]. 北京:中国农业科学院, 2012: 26-39.
Cui Y L. Studies on the biological characteristics and molecular markers for(Stål) and its two sibling speciesChina and(Muir) [D]. Beijing:, 2012: 26-39. (in Chinese)
[10] Liu S H, Luo J, Liu R, Zhang C G, Duan D K, Chen H M, Bei W Y, Tang J. Identification ofand its two sibling species (and) by direct multiplex PCR [J]., 2018, 111(6): 2869-2875.
[11] 罗举, 唐健, 王爱英, 杨保军, 刘淑华. 基于重组酶介导扩增-侧流层析试纸条的褐飞虱快速鉴定方法[J]. 中国水稻科学, 2022, 36(3): 96-104.
Luo J, Tang J, Wang A Y, Yang B J, Liu S H. A rapid detection assay ofbased on recombinase aided amplification-lateral flow dipstick technology[J]., 2022, 36(1): 96-104. (in Chinese with English abstract)
[12] 中华人民共和国国家质量监督检验检疫总局/中国国家标准化管理委员会: 稻飞虱测报调查规范. GB/T 15794—2009[S]. 北京: 中国标准出版社, 2009.
General Administration of Quality Supervision, Inspection and Quarantine/ Standardization Adminis- tration of the People's Republic of China: Standard for Survey of Rice Planthopper: GB/T 15794—2009[S]. Beijing: China Standard Press, 2009. (in Chinese)
[13] 黄丽莉, 阙海勇, 车飞. 茶园茶黄蓟马及其近似种的DNA条形码鉴定 [J]. 植物检疫, 2014, 28(6): 68-72.
Huang L L, Que H Y, Che F.Molecular identification ofand related species through DNA barcoding in tea garden[J]., 2014, 28(6): 68-72. (in Chinese)
[14] 张磊, 靳明辉, 张丹丹, 姜玉英, 刘杰, 吴孔明, 萧玉涛. 入侵云南草地贪夜蛾的分子鉴定 [J]. 植物保护, 2019, 45(2): 19-24.
Zhang L, Jin M H, Zhang D D, Jiang Y Y, Liu J, Wu K M, Xiao Y T. Molecular identification of invasive fall armywormin Yunnan Province [J]., 2019, 45(2): 19-24. (in Chinese)
[15] 吴霞, 张桂芬, 万方浩. 基于TaqMan实时荧光定量PCR技术的西花蓟马快速检测[J]. 应用昆虫学报, 2011, 48(3): 497-503.
Wu X, Zhang G F, Wan F H. TaqMan real-time fluorescent quantitative PCR for identification of[J]., 2011, 48(3): 497-503. (in Chinese with English abstract)
[16] 李茵, 刘英, 双巧云, 彭徽, 黄丽莉. TaqMan实时荧光定量PCR检测茶黄蓟马[J]. 植物检疫, 2021, 35(6): 43-47.
Li Y, Liu Y, Shuang Q Y, Peng H, Huang L L. TaqMan real-time fluorescent quantitative PCR for identification ofHoods[J]., 2021, 35(6): 43-47. (in Chinese)
[17] 唐慧骥, 党志浩, 郭长宁, 王晓晶, 苗小星, 郭保生, 徐超. 应用重组酶介导核酸扩增技术快速鉴定新菠萝灰粉蚧[J]. 植物检疫, 2019, 33(2): 37-42.
Tang H J, Dang Z H, Guo C N, Wang X J, Miao X X, Guo B S, Xu C. Rapid detection forby recombinase-aid amplification[J]., 2019, 33(2): 37-42. (in Chinese)
[18] Agarwal A, Cunningham J P, Valenzuela I, Blacket M J. A diagnostic LAMP assay for the destructive grapevine insect pest, phylloxera ()[J].2020, 10: 21229.
[19] Agarwal A, Rako L, Schutze M K, Starkie M L, Tay W T, Rodoni B C, Blacket M J. A diagnostic LAMP assay for rapid identification of an invasive plant pest, fall armyworm(Lepidoptera: Noctuidae)[J]., 2022, 12: 1116
[20] Lu C C, Dai T T, Zhang H F, Zeng D D, Wang Y C, Yang W F, Zheng X B. A novel LAMP assay using hot water in vacuum insulated bottle for rapid detection of the soybean red crown rot pathogen[J]., 2022, 51: 251-259.
[21] Ponting S, Tomkies V, Stainton K. Rapid identification of the invasive Small hive beetle () using LAMP[J]., 2021, 77(3): 1476-1481.
[22] Nam H Y, Kwon M, Kim H J, Kim J. Development of a species diagnostic molecular tool for an invasive pest,, Using LAMP[J]., 2020, 11(11): 817.
[23] 徐浪, 林伟, 黄蓬英, 张伟锋, 卢小雨, 汪莹, 郑耘, 焦懿, 娄定风, 余道坚. 应用TaqMan MGB探针快速检测新菠萝灰粉蚧和菠萝灰粉蚧[J]. 植物检疫, 2016, 30(4): 38-41.
Xu L, Lin W, Huang P Y, Zhang W F, Lu X Y, Zhen Y, Jiao Y, Lou D F, Yu D J. Rapid detection ofand(Hemiptera: Diaspididae) using TaqMan MGB probe[J]., 2016, 30(4): 38-41. (in Chinese)
[24] Aguirre C, Sanchez E, Olivares N, Hinrichsen P. Multiplex TaqMan real-time PCR assay for sensitive detection of two weevil species(Coleoptera: Curculionidae)[J]., 2021, 114(1): 90-99.
[25] Huang Q Y, Chen D M, Du C, Liu Q Q, Lin S, Liang L L, Xu Y, Liao Y Q, Li Q G. Highly multiplex PCR assays by coupling the 5'-flap endonuclease activity of Taq DNA polymerase and molecular beacon reporters[J]., 2022, 119(9): 1-11.
[26] 姚晶, 郭晓军, 王甦, 王昱超, 罗晨, 张帆, 李绍清. 利用TaqMan等位基因技术鉴定烟粉虱MEAM1和MED隐种 [J]. 昆虫学报. 2013, 56(1): 98-103.
Yao J, Guo X J, Wang S, Wang Y C, Luo C, Zhang F, Li S Q. Discrimination of cryptic species MEAM1 and MED of Bemisia tabaci (Hemiptera: Aleyrodidae) by using TaqMan allele-selective PCR[J]., 2013, 56 (1): 98-103. (in Chinese with English abstract)
Direct Multiplex TaqMan qPCR Assay for Rapid Detection of Three Sibling Species fromDistant
LUO Ju1, YANG Suwen2, BEI Wenyong3, YU Junwei4, TANG Jian1, LIU Shuhua1,*
(1China National Rice Research Institute, Hangzhou 311401, China;2Agricultural Comprehensive Service Center, Niumashi Town, Shaodong City, Hunan Province, Shaoyang 422803, China;3Plant Protection and Inspection Station of Zhaoping County, Guangxi Zhuang Autonomous Region, Hezhou 546800, China;4Hangzhou Ustar Biotechnology Co., Ltd., Hangzhou 310015, China;*Corresponding author, email: liushuhua@caas.cn)
【Objective】is a destructive insect pest on rice, and light trapping has always been an important monitoring method. However, its two sibling species,and, can also be trapped by light and are easily mistaken as. Morphological identification ofand its sibling species is time-consuming and labor-intensive, with the requirement for expertise and experience. To address this problem for identification ofand its two sibling species, the present study is aimed to develop a rapid and accurate identification method.【Method】At first, design and select the interspecies general primes and species-specific probes based on the barcoding gene. Then, establish and optimize the Direct Multiple Taqman qPCR assay (dmTqPCR). Finally, analyze and evaluate the specificity, sensitivity and practicability.【Results】The dmTqPCR assay developed in the present study has high specificity and high sensitivity, which could accurately identify,andandthe LOD (limit of detection) are up to 10 copies/reaction.The entire detection process for 382 specimens, including the crude tissue liquid preparation, amplification and detection, can be completed in 180 min with an accuracy of 100%.【Conclusion】The established dmTqPCR assay is suitable for rapid and accurate identification of,and,and it is expected to promote the development of precision prediction and forecasting of.
;;; ITS1; direct multiple Taqman qPCR
10.16819/j.1001-7216.2023.220903
2022-09-06;
2022-11-12。
浙江省自然科学基金资助项目(LGN21C140002);十四五重点研发计划资助项目(2021YFD1401100);水稻生物学国家重点实验室开放课题(20210303);中央级公益性科研院所基本科研业务费专项(CPSIBRF-CNRRI-202123)。
