牙周炎患者血清及龈沟液NLRP3 mRNA,IL-18,IL-1β 的变化及临床意义
2023-10-18陶培冯晓伟赵燕霞
陶培,冯晓伟,赵燕霞
(1.郑州大学第一附属医院大学路口腔综合科,河南 郑州 450002;2.郑州大学第一附属医院口腔修复科,河南 郑州 450002)
慢性牙周炎是由口腔中细菌等致病微生物堆积形成牙菌斑,进而侵犯牙周组织,导致牙周袋形成,引起结缔组织附着降低,出现牙齿松动的一组口腔疾病。在慢性牙周炎发病过程中,炎症因子起着关键作用,在病变早期,其主要存在于龈沟液中,随着牙菌斑的聚集越来越多,导致牙石不断增多,对牙周组织的炎症刺激越来越严重,最终诱发牙周炎[1]。因此,炎症因子是导致牙周炎发病的重要病变因子。已有研究报道,NLRP3 炎症小体是在慢性牙周炎发病过程中起着关键作用的一种特殊的糖基化细胞分裂素[2],白介素(IL)-18、IL-1β 等作为典型的炎症因子大量存在于牙周炎患者龈沟液中[3]。为进一步了解炎症因子在慢性牙周炎发病及病情发展中的作用,本研究分析了慢性牙周炎患者血清及龈沟液中NLRP3 mRNA、IL-18、IL--1β 水平,现总结如下。
1 资料与方法
1.1 一般资料 分别选取2020 年6 月至2021 年6月收治的慢性牙周炎患者200 例及健康者100 例为观察组及对照组。纳入标准:(1)观察组均符合慢性牙周炎诊断标准[4],对照组均无牙周病变(2)天然牙≥16 颗,磨牙≥4 颗;(4)自愿参加研究。排除标准:(1)近3 个月内患有感染性疾病;(2)合并心脑血管疾病;(3)合并严重肝肾功能不全;(4)存在口腔黏膜病变;两组一般资料,见表1。
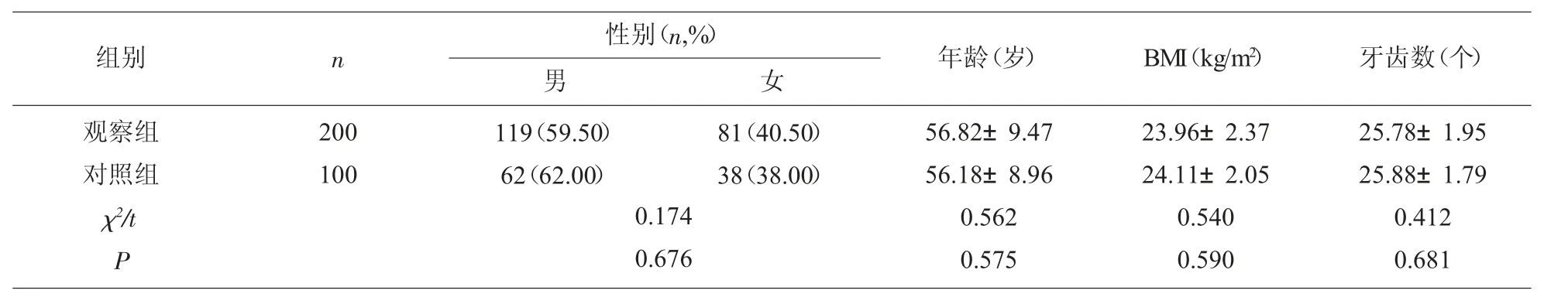
表1 两组一般资料比较
1.2 方法
1.2.1 样本采集方法 血液样本:两组均于入组后第二天采集空腹静脉血10 mL;龈沟液样品:所有入组者均选择3 颗相同位置的牙齿,从其龈沟液中取样,具体方法:先将牙龈表面菌斑彻底清除干净,然后把滤纸条缓慢放进牙周袋内,放置大约30 s,取出后放入EP 管内低温保存。如果取出滤纸条发现上面存在血迹,则应重新取样。检测方法:样本取出解冻,加入磷酸盐缓冲液(浓度10 mM;pH 值7.2~7.4),离心处理取上清液检测。
1.2.2 检测方法 采用RT-PCR 检测NLRP3 mRNA 表达情况。采用ELISA 法检测IL-18、IL--1β水平。
1.2.3 牙周指数 采用专用探针检测菌斑指数(PLI)、附着丧失水平(AL)、龈沟出血指数(BI)、牙周袋探诊深度(PD)。
1.3 统计学方法 使用SPSS 19.0 软件进行统计分析。计数资料采用χ2检验,计量资料采用t 检验。采用Pearson 相关分析各炎症因子与牙周指数的相关性。采用ROC 曲线分析各炎症因子指标诊断牙周炎的效能。P<0.05 为差异有统计学意义。
2 结果
2.1 血清炎症因子水平比较 观察组血清炎症因子水平均高于对照组(P<0.05),见表2。
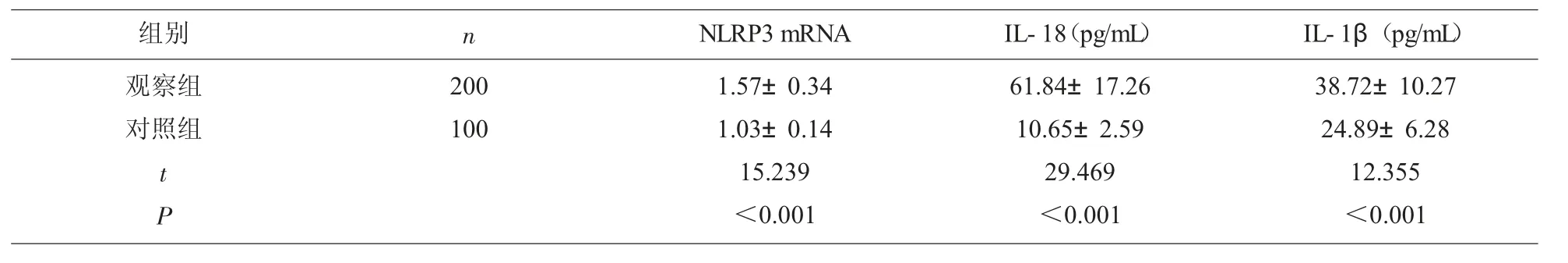
表2 两组血清炎症因子水平比较
2.2 龈沟液炎症因子水平比较 观察组龈沟液炎症因子水平均高于对照组(P<0.05),见表3。

表3 龈沟液炎症因子水平比较
2.3 两组牙周指数比较 观察组牙周指数明显高于对照组(P<0.05),见表4。
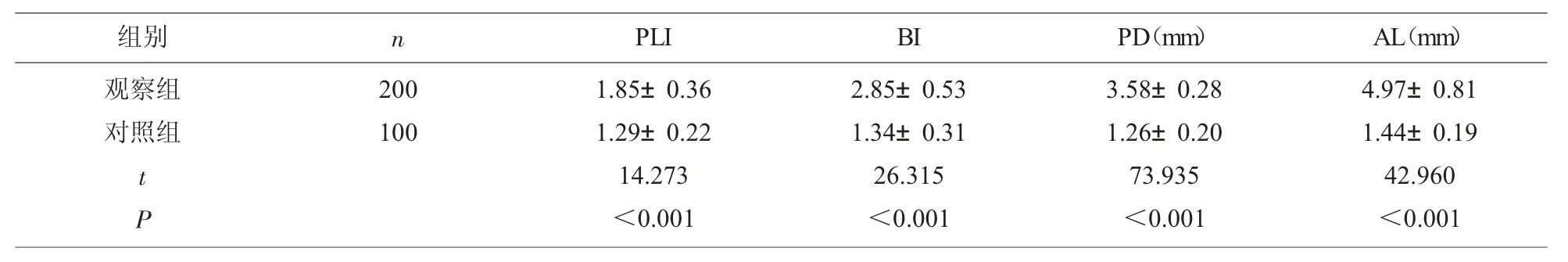
表4 两组牙周指数比较
2.4 相关分析 血清、龈沟液NLRP3 mRNA 表达量、IL-18、IL-1β 水平与牙周指数均呈正相关(P<0.05),见表5。

表5 炎症因子与牙周指数的相关分析
2.5 ROC 分析 ROC 分析显示,血清NLRP3 mRNA 表达量(AUC=0.854)、IL-18(AUC=0.745)、IL-1β(AUC=0.791)、龈沟液NLRP3 mRNA 表达量(AUC=0.878)、IL-18(AUC=0.818)、IL-1β(AUC=0.811)均是诊断牙周炎的重要因素(P<0.05),见表6、图1-2。
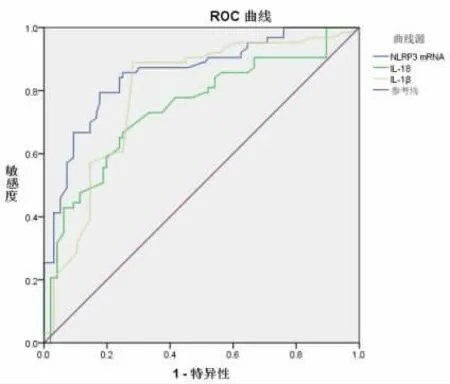
图1 血清炎症因子水平诊断牙周炎的ROC 分析
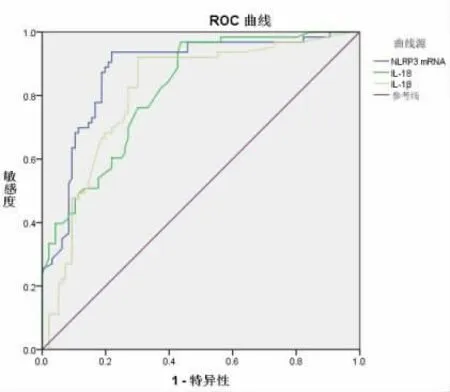
图2 龈沟液炎症因子水平诊断牙周炎的ROC 分析
3 讨论
慢性牙周炎是由细菌等致病微生物侵袭导致的一种牙周组织的炎症性病变。其发病与牙菌斑、牙结石密切相关。慢性牙周炎一旦发生,会导致牙周组织出现不可逆的损伤,随着病程延长,炎症反应长期持续存在,可进一步危及牙槽骨,导致牙槽骨结构与功能遭到破坏,不仅可导致牙体脱落,而且可能损害颌骨骨质,造成严重不良影响[5]。因此,临床中对于慢性牙周炎的干预应以预防为主,通过定期筛查发现高危患者,并及时进行早期诊治。
NLRP3 是一种糖基化细胞分裂素,其又被称为血管通透因子,参与慢性牙周炎的发病。当牙周组织出现炎症反应时,NLRP3 聚集于牙周部位,提高了牙周膜渗透性,同时,其可刺激牙周膜末端毛细血管迅速生成,诱导牙周膜细胞快速生长,阻止抑制牙周膜上皮细胞的凋亡进程[6]。已有多项研究发现,NLRP3 是慢性牙周炎发病的重要调控因子[7-8]。致病微生物存在于牙周炎患者牙周袋内,并产生多种代谢产物(包括脂多糖、内毒素等),从而加重局部炎症,导致IL-18、IL-1β 等多种炎症因子大量分泌与合成[9]。IL-18 是一种多肽调节因子,主要由活化的单核细胞合成,其生物学活性较强,能够参与机体的免疫应答过程,同时调控机体细胞生长和分化等[10]。已有研究的报道,牙周炎患者IL-18水平升高,其主要作用包括促进炎症细胞吞噬功能,加速急性期蛋白的分泌与合成,刺激细胞快速增殖、分化[11]。IL-18 水平升高与牙周炎患者各项临床症状密切有关[12]。IL-1β 是IL 家族的重要亚型,具有提高趋化性细胞因子的作用,其水平升高可导致单核细胞、T 淋巴细胞在病变部位聚集与浸润,从而导致龈沟液等局部炎症介质水平升高[13-14]。IL-1β 的血清水平升高可诱导牙周炎相关基因的表达,同时,还能够对多种效应蛋白(包括环氧化酶2、磷脂酶A2、NO 合酶、干扰素γ 等)产生强烈的刺激作用,提高其表达水平,从而在炎症反应中发挥重要作用[15]。
本研究结果显示,观察组血清、龈沟液NLRP3 mRNA、IL-18、IL-1β 水平升高,分析其原因是牙周炎患者牙周袋以及牙周出血等病理变化,导致血液及龈沟液中炎症因子浓度明显增高,刺激牙周组织诱发及加重炎症反应。相关分析显示,血清、龈沟液NLRP3 mRNA、IL-18、IL-1β 水平与牙周指数均呈正相关,这进一步证实,上述炎症指标与牙周炎的疾病进展密切相关,能够反映患者的症状严重程度。本研究中ROC 分析显示,血清、龈沟液NLRP3 mRNA 表达量、IL-18、IL-1β 水平诊断牙周炎 的AUC 值分别为0.854、0.745、0.791、0.878、0.818、0.811,均有统计学意义,表明上述细胞因子水平均是诊断牙周炎的重要因素,可作为临床诊断牙周炎病情的参考指标。
本研究的创新点在于应用血清及龈沟液炎症介质对牙周炎患者进行早期诊断,有助于改善传统的对牙周炎患者的临床检查,进而改善牙周炎的早期预防及临床应对措施,对临床有参考应用价值。
