海带岩藻聚糖对艰难梭菌肠炎预防活性作用
2023-10-16刘垚王展李鑫江刘湘铭吕和孺王寒梅赵雪
刘垚,王展,李鑫江,刘湘铭,吕和孺,王寒梅,赵雪*
(1.中国海洋大学食品科学与工程学院,山东青岛 266003;2.青岛市中心医院内镜中心,山东青岛 266042)
目前研究发现,广谱抗生素(甲硝唑、环丙沙星、青霉素、克林霉素)的滥用会导致肠道微生物群紊乱,增加炎症性肠病和致病性细菌感染的风险,尤其是艰难梭菌感染,占抗生素相关腹泻病例的10%~20%[1]。艰难梭菌毒素A(Clostridium difficiletoxin A,TcdA)和艰难梭菌毒素B(Clostridium difficiletoxin B,TcdB)是艰难梭菌产生的主要毒力因子,它可以促进肠道炎症[2],从而导致腹泻、假膜性结肠炎、毒性巨结肠和结肠穿孔。使用万古霉素和甲硝唑等抗生素进行治疗会进一步破坏肠道微生态,进而引发复发率更高和症状更严重的结肠炎[3-4],给病人造成极大痛苦和经济负担。因此预防艰难梭菌感染对抗生素治疗的病人至关重要。目前,艰难梭菌疫苗、肠道菌群移植、益生菌、噬菌体治疗法等生物治疗方法均存在着一定的不足和危险[5]。因此寻找一种安全、无副作用的抗艰难梭菌侵染的活性物质是目前研究的热点。
岩藻聚糖是一种天然的由岩藻糖和硫酸根组成的复杂硫酸多糖,具有抗凝血、免疫调节、抗肿瘤、抗炎症、抑制细胞凋亡和抑制病毒感染等生物活性[6-8]。有研究表明,来自奥氏海藻(Cladosiphon okamuranus)和墨角藻(Fucus vesiculosus)的岩藻聚糖在小鼠慢性结肠炎和葡聚糖硫酸钠(dextran sulfate sodium salt,DSS)诱导的急性结肠炎中表现出优异的抗炎活性,同时对肠上皮屏障功能和细胞旁通透性具有良好的保护作用[9-11]。Barreto 等[12]发现,在由艰难梭菌毒素A 而引发的结肠炎中,岩藻聚糖可以使结肠组织中炎症水平显著降低。相关研究表明,岩藻聚糖的活性与其肠道菌群代谢产物(尤其是短链脂肪酸)密切相关,岩藻聚糖在结肠部位被肠道微生物酵解会产生乙酸、丙酸、丁酸等短链脂肪酸,提高肠道中的乳酸杆菌、肠杆菌、异丙戊酸杆菌和反刍菌科的数量,减少机会致病菌的数量,从而调节肠道菌群[13-15]。因此,岩藻聚糖在调节肠道菌群、预防和治疗肠道炎症方面具有较好的潜质。但是抗生素会严重破坏肠道菌群,导致拟杆菌、鼠杆菌等多糖利用菌的相对丰度显著下降,进而改变岩藻聚糖在肠道中的代谢产物[16-17]。但目前没有相关研究证明,在抗生素造成的肠道菌群紊乱从而导致的艰难梭菌肠炎中,岩藻聚糖是否仍有活性作用。
本研究使用头孢哌酮诱导的肠道紊乱小鼠模型,探究岩藻聚糖对艰难梭菌感染和产毒、肠道菌群紊乱和炎症因子表达的影响,旨在揭示岩藻聚糖对抗生素相关艰难梭菌结肠炎的预防作用。
1 材料与方法
1.1 材料与试剂
海带:市售;葡聚糖标准品、单糖标准品、头孢哌酮、克林霉素:美国Sigma 公司;乙腈(色谱纯):德国Merck 公司;艰难梭菌VPI 10463(ATCC43255):美国ATCC 菌种保藏中心;万古霉素:大连美仑生物技术有限公司;磷酸盐缓冲溶液(phosphate buffer saline,PBS):武汉赛维尔生物科技有限公司;PowerFecalTMDNA 分离试剂盒:美国MoBio 公司;小鼠TcdA、TcdB 酶联免疫检测试剂盒:江苏晶美生物科技有限公司;总RNA抽提试剂盒:上海生工生物工程股份有限公司;荧光定量转录试剂盒:上海Abcam 公司;TruSeqTMDNA 样本制备试剂盒:美国Illumina 公司;醋酸、无水乙醇、硫酸钠(Na2SO4)、氢氧化钾(KOH):国药集团化学试剂有限公司。
1.2 仪器与设备
Nicolet-Nexus 470 型傅里叶红外光谱仪、Q Exactive Plus LCMS 质谱仪、Ul-tiMate 3000 型高效液相色谱仪、电喷雾LTQ-Orbitrap XL 型质谱仪、IonPac AS11-HC 分离柱(4 mm×250 mm):美国Thermo Fisher 公司;1260 型高效液相色谱仪器、ZORBAX EC-C18 分离柱(4.6 mm×150 mm,2.7 μm):美国Agilent 公司;ICS-2000 型离子色谱仪:美国Dionex 公司;TSK-gel G3000 PWx 分析柱(8.0 mm×300 mm,10 μm):日本东曹株式会社;855-AC 型厌氧操作箱:美国Plas-Labs 公司;Eclipse E10 正置光学显微镜:日本Nikon 公司;SIGMA 1-1 型高速冷冻离心机:美国Sigma 公司;FQD-96C 型荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪:杭州博日科技有限公司。
1.3 方法
1.3.1 岩藻聚糖的制备
以海带为原料,用酸浸泡、热水提取和醇沉淀,得到岩藻聚糖粗糖[18],经10 kDa 的透析袋透析,直至透析液pH 值为7 左右,收集透袋内液体,冷冻干燥,得到试验所需岩藻聚糖。
1.3.2 岩藻聚糖的化学性质检测
1.3.2.1 岩藻聚糖分子量的测定
采用高效凝胶排阻色谱法(high perfomance size exclusion chromatography,HPSEC)测定岩藻聚糖的分子量。高效液相色谱仪为Agilent 1260,分析柱为TSK-gel G3000 PWx(8.0 mm×300 mm,10 μm),流动相为0.1 mol/L Na2SO4。使用分子量为5 220、11 600、48 600、147 600、273 000 Da 的葡聚糖标准品,以葡聚糖标准品分子量的对数(lgM)和保留时间(t)作图,得到回归方程(y=-0.156 1x+7.181 6,R2=0.980 5),根据标准曲线计算样品中硫酸多糖的重均分子量(weight-average molecular weight,Mw)、数均分子量(number-average molecular weight,Mn)和分散系数[19]。分散系数的计算公式如下。
I=W/N
式中:I为分散系数;W为重均分子量,kDa;N为数均分子量,kDa。
1.3.2.2 岩藻聚糖硫酸根含量的测定
采用高效阴离子交换色谱法测定岩藻聚糖中硫酸根含量,分离柱为IonPac AS11-HC(4 mm×250 mm),淋洗液及流速为9 mmol/L KOH、1.0 mL/min。
1.3.2.3 岩藻聚糖单糖组成的测定
采用PMP 柱前衍生高效液相色谱法(high performance liquid chromatography,HPLC)法测定岩藻聚糖的单糖组成,色谱柱为分离柱ZORBAX EC-C18(4.6 mm×150 mm,2.7 μm)。流动相A 为18%乙腈(0.1 mol/L 磷酸盐缓冲液溶解),流动相B 为35%乙腈(0.1 mol/L 磷酸盐缓冲液溶解)[20]。
1.3.2.4 岩藻聚糖的红外光谱扫描
将KBr 在110 ℃烘箱内烘干5 h 彻底脱水后,与岩藻聚糖样品磨粉、压制成片,利用傅里叶红外光谱扫描仪扫描4 000~500 cm-1波数范围内的光谱吸收值[21]。
1.3.3 艰难梭菌肠炎小鼠模型的建立和给药方式
无菌操作台内,将艰难梭菌加入脑心浸液肉汤培养基(brain heart infusion ,BHI)中,于37 ℃厌氧培养24 h 后复苏。将复苏菌悬液加入BHI 中进行37 ℃厌氧培养36 h 活化。将菌液进行1 000×g离心10 min,取沉淀,加入生理盐水重悬成4×107cfu/mL 悬浊液,待用。
六周龄的SPF 级C57BL/6J 雌性小鼠标准喂食适应性喂养7 d 后开始正式实验。小鼠随机分为6 组,分别为空白组、艰难梭菌模型组(简称模型组)、万古霉素组、100、300、500 mg/kg 岩藻聚糖。每组8 只,每笼内不超过4 只,每笼的体质量为(18±2)g。本研究中所有方案和程序由中国海洋大学食品科学与工程学院实验动物护理伦理委员会的审批通过。
1~10 d,空白组、模型组和万古霉素组口服10 mL/kg纯净水,岩藻聚糖组分别口服100、300 和500 mg/kg的岩藻聚糖。11~20 d,每次给予岩藻聚糖1 h 后,模型组和万古霉素组、岩藻聚糖组分别口服280 mg/kg 头孢哌酮溶液,而空白组口服0.2 mL 超纯水。第21 天,休整1 d,空白组、模型组和万古霉素组口服0.2 mL 超纯水,而岩藻聚糖组继续口服0.2 mL 100、300、500 mg/kg 的岩藻聚糖。第22 天,模型组、万古霉素组、岩藻聚糖组注射100 mg/kg 克林霉素。注射克林霉素1 h 后,岩藻聚糖组继续口服100、300 和500 mg/kg 的岩藻聚糖。第23 天,模型组、万古霉素组、岩藻聚糖组口服0.2 mL 4×107cfu/mL艰难梭菌菌液,建立艰难梭菌肠炎模型。24~28 d,万古霉素组口服0.2 mL 50 mg/kg 的万古霉素,其余各组口服0.2 mL 超纯水。第29 天,处死各组小鼠[22]。
在艰难梭菌肠炎小鼠模型的建立期间,每日观察小鼠状态、体质量,在给予艰难梭菌后,观察小鼠症状、体质量、存活率。艰难梭菌侵染5 d 后,用乙醚安乐死小鼠。
1.3.4 结肠组织病理学观察
取小鼠结肠组织1 cm 放入4%甲醛固定24 h,石蜡切片脱蜡至水,苏木素-伊红(hematoxylin-eosin staining,H&E)染色处理,脱水封片,正置光学显微镜镜检,在成像系统(NIKON DS-U3)进行图像采集分析[17,22]。
1.3.5 盲肠内容物中艰难梭菌毒素A 和毒素B 的测定
用1×磷酸缓冲盐溶液(phosphate buffer saline,PBS)稀释收集到的小鼠50~100 mg 盲肠内容物,1 800×g离心20 min 后收集上清液。根据小鼠毒素TcdA 和TcdB 的酶联免疫吸附试剂盒说明书测定毒素TcdA 与TcdB 的水平。
1.3.6 结肠组织中F4/80 和Ly-6G 的荧光双标检测
取小鼠50~100 mg 结肠组织用4%甲醛固定24 h后,石蜡包埋切片,脱蜡至水后进行抗原修复,双氧水、血清封闭后,加入第一种一抗、对应的辣根过氧化物酶标记的二抗、Cyanine 3 Tyramide CY3-TSA,在中火8 min 停火8 min 转中低火7 min 的条件下进行微波处理。加入第二种一抗和对应的二抗。利用4’6-二脒基-2 苯基吲哚(4'6-diamidino-2-phenylindole,DAPI)复染细胞核,避光室温孵育10 min 后,加入自发荧光淬灭剂5 min,流水冲洗10 min。甩干后,用抗荧光淬灭封片剂封片,荧光显微镜下观察并采集图像。
1.3.7 结肠组织中炎症因子mRNA 表达的测定
取小鼠结肠组织50~100 mg,采用Trizol 法提取结肠组织中的总mRNA,按照逆转录试剂盒提供的标准操作说明书进行逆转录反应,获得cDNA。以逆转录后的cDNA 为模板,实时荧光定量PCR(reverse transcription-polymerase chain reaction,RT-PCR)以GAPDH基因为定量内参,使用荧光定量试剂盒分别对促炎症细胞因子肿瘤坏死因子-α(tumour necrosis factor alpha,TNF-α)、干扰素-γ(interferon gama,IFN-γ)、白介素-1β(interleukin 1 beta,IL-1β)、白介素-6(interleukin 6,IL-6)和抑炎症因子白介素-4(interleukin 4,IL-4)、白介素-10(interleukin 10,IL-10)进行相对定量并统计。RT-PCR 反应体系:cDNA 1 μg;primer 1 0.8 μL;primer 2 0.8 μL;SYBR Green I 2 μL;dd H2O 加至20 μL;40 个循环数:95 ℃15 s、60 ℃60 s。小鼠引物的序列如表1所示。炎症相关基因表达的相对定量根据2-ΔCt法[23]。
1.3.8 小鼠盲肠菌群结构的测定
参考文献[24]的方法,取小鼠盲肠内容物0.1 mg置于无菌管中,使用PowerFecalTMDNA 分离试剂盒提取结肠基因组DNA,纯化后测序。使用TruSeqTMDNA样本制备试剂盒中提供的说明生成测序文库。文库质量检测后,在Illumina MiSeqPE250 平台进行扩增测序。原始DNA 片段用FLASH(v1.2.7)进行读取、合并,QIIME2 (2019.4)软件去噪,Vsearch (v2.13.4_ linux_x86_64),cutadapt(v2.3)软件在97%相似度水平对高质量序列聚类。使用RDP 分类器(v2.2),应用70%置信阈值分析每个16S rRNA 基因序列的分类。通过对去除singleton 后的特征表进行统计,实现各样本在门、纲、目、科、属、种6 个分类水平上的组成分布可视化。利用QIIME2(2019.4)软件进行alpha 多样性分析。使用R packages 2.15 和VennDiagram_(1.6.20)生成韦恩图。
1.4 统计分析
数据结果均以平均值±标准差形式表示。利用SPASS Statistics(v22)进行单向方差分析(ANOVA)分析各组间的差异,使用Tukey 进行显著性差异检验,显著性设置为p<0.05。
2 结果与分析
2.1 岩藻聚糖化学性质检测结果
岩藻聚糖的高效凝胶排阻色谱图如图1A所示,傅里叶红外光谱官能团分析结果如图1B所示。
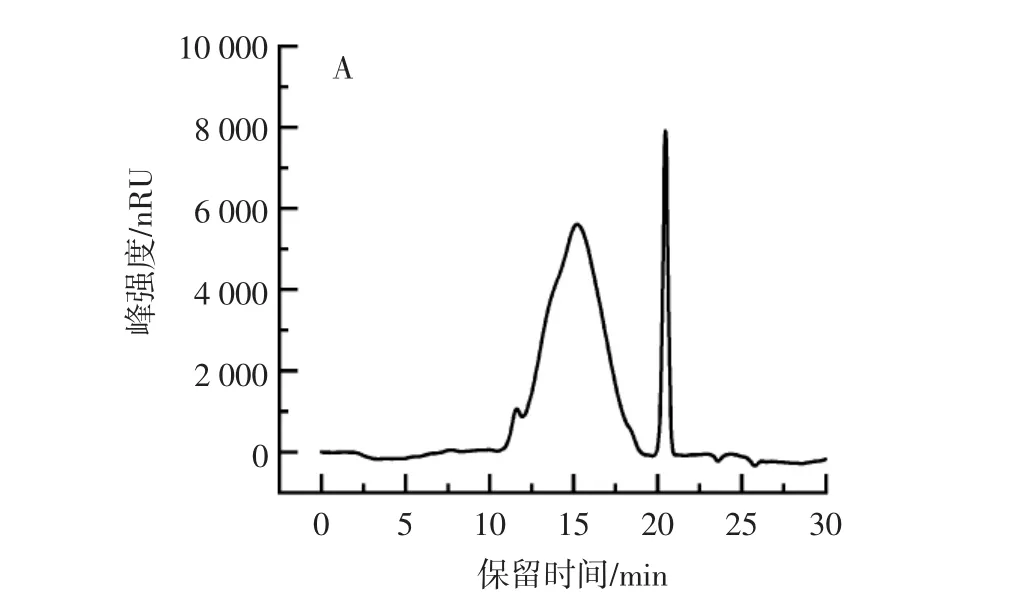

图1 岩藻聚糖化学性质检测结果Fig.1 The chemical properties results of fucoidan
由图1A 可知,岩藻聚糖的重均分子量(Mw)为126.65 kDa,数均分子量(Mn)为28.46 kDa,其分散系数为4.45。由图1B 可知,在1 250 cm-1(S=O 拉伸振动)和845 cm-1(C-O-S 拉伸振动)处有吸收峰,证实岩藻聚糖中岩藻糖残基存在大量的硫酸根。
岩藻聚糖硫酸根含量及单糖组成见表2。
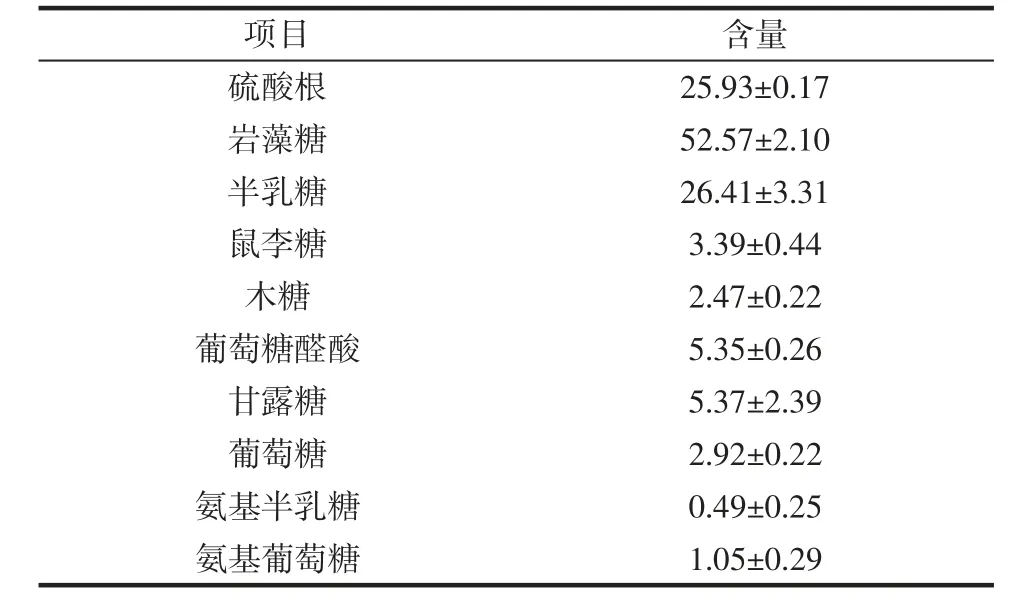
表2 岩藻聚糖硫酸根含量和单糖组成结果Table 2 The results of fucoidan sulfate content and monosaccharide composition %
由表2 可知,岩藻聚糖中含有硫酸根(25.93±0.17)%,单糖组成结果得出,岩藻聚糖中岩藻糖(52.57±2.10)%和半乳糖(26.41±3.31)%的含量较高,还含有少量的甘露糖、葡萄糖醛酸、鼠李糖、木糖、葡萄糖、氨基葡萄糖、氨基半乳糖。
2.2 岩藻聚糖对艰难梭菌肠炎小鼠腹泻程度的影响
岩藻聚糖对艰难梭菌肠炎小鼠的体质量和结肠黏膜结构的影响见图2。

图2 岩藻聚糖对艰难梭菌肠炎小鼠的体质量和结肠黏膜结构的影响Fig.2 Effects of fucoidan on the bodyweight and histopathology of C.difficile-infected mice
实验期间,正常组小鼠给予艰难梭菌后,没有出现腹泻的症状,体质量正常。说明小鼠体内正常的肠道菌群对感染艰难梭菌有很好的防御作用,不会发生艰难梭菌侵染和腹泻。模型组小鼠在服用头孢哌酮10 d 后,体质量没有明显下降,精神状态良好。但是,在艰难梭菌侵染第2 天,8 只小鼠均出现腹泻症状,并伴随体质量急剧下降,粪便呈水样,毛发竖立,精神状态不佳,然而未出现死亡。说明头孢哌酮破坏了肠道菌群,造成了艰难梭菌侵染和腹泻。在服用10 d 头孢哌酮期间,同时分别给予小鼠10 d 100、300、500 mg/kg 的岩藻聚糖,然后再进行艰难梭菌侵染。在艰难梭菌侵染后第2 天,100 mg/kg 岩藻聚糖组的8 只小鼠中,有7 只小鼠出现了腹泻。而在300、500 mg/kg 岩藻聚糖组的小鼠中,分别有3 只和1 只出现腹泻症状,其余小鼠均不腹泻,体质量保持稳定;在艰难梭菌侵染后第5天,模型组小鼠腹泻继续加重,体质量下降。而万古霉素治疗5 d 后,仅有2 只小鼠轻微腹泻,6 只小鼠由腹泻转为软便,腹泻情况得到缓解。100 mg/kg 岩藻聚糖组的小鼠中,仍有7 只小鼠严重腹泻,情况并未好转。而300、500 mg/kg 岩藻聚糖组小鼠的腹泻情况明显好转,都仅有1 只小鼠产生腹泻。说明岩藻聚糖可以很好地缓解由感染艰难梭菌引起的腹泻症状。
由图2A 可知,30 d 时,与模型组相比,万古霉素组小鼠体质量显著上升(p<0.05),但仍有2 只小鼠轻微腹泻。与模型组相比,口服300、500 mg/kg 岩藻聚糖均能够显著提高肠炎小鼠的体质量(p<0.05),而100 mg/kg岩藻聚糖对小鼠体质量没有显著影响(p>0.05)。
采用H&E 染色技术分析岩藻聚糖对结肠黏膜结构的保护作用,由图2B 可知,正常组小鼠结肠组织病理学表现为组织黏膜、隐窝和黏膜下层完整,杯状细胞排列整齐,无或稍有炎症浸润现象。而模型组小鼠结肠组织炎症细胞浸润严重,并伴随着隐窝丢失,杯状细胞明显减少,上皮层不完整。说明艰难梭菌侵染造成结肠肠黏膜严重炎症和黏膜结构损伤。与模型组相比,万古霉素组小鼠结肠组织炎症细胞浸润明显缓解,隐窝较为完整,杯状细胞数量增加并且排列整齐。300、500 mg/kg 岩藻聚糖组小鼠结肠组织中杯状细胞明显增多,且排列整齐,隐窝、上皮层和黏膜下层相对完整,炎症细胞浸润情况明显缓解。100 mg/kg 岩藻聚糖组小鼠结肠组织中杯状细胞明显增多,但是上皮层和黏膜仍然有严重损伤。结果表明,预先口服300、500 mg/kg 岩藻聚糖可以有效地减轻艰难梭菌造成的肠道黏膜损伤和炎症浸润。
2.3 岩藻聚糖对艰难肠炎小鼠肠道菌群的影响
上述结果表明,口服300 mg/kg 岩藻聚糖对艰难梭菌诱导的结肠炎具有显著的保护作用。利用16s RNA 基因检测技术,进一步分析300 mg/kg 岩藻聚糖对肠道菌群的丰度和结构的影响。实验中收集了一个由1 014 883 个序列组成的数据集,每个样品的平均读数为70 486±15 264。岩藻聚糖对艰难梭菌肠炎小鼠盲肠菌群多样性的影响见表3。

表3 岩藻聚糖对艰难梭菌肠炎小鼠盲肠菌群多样性的影响Table 3 Analysis of fucoidan on microbial diversity in cecum of C.difficile infected mice
由表3所示,Good's coverage 指数可以看出测序对群落中物种的覆盖度很高,几乎没有未检测出的物种。与正常组相比,模型组OTUs 由7570 下降至699,约为正常组的9.2%,且Chao 1 指数、Observed_species指数、Shannon 指数和Simpson 指数均显著下降(p<0.05),这说明抗生素的使用和艰难梭菌感染造成肠道菌群完全紊乱。而口服万古霉素和岩藻聚糖5 d 后,OTUs 分别上升至933(正常组的12.3%)和1 146(正常组的15.1%)。与模型组相比,万古霉素组和岩藻聚糖组Shannon 指数和Simpson 指数均显著上升(p<0.05)。但是,岩藻聚糖组小鼠的OTUs 与正常组相差较大,说明虽然岩藻聚糖对肠道菌群有一定程度的保护作用,但是不能够使肠道菌群的丰度和多样性很好的恢复。
从门水平观察岩藻聚糖岩藻聚糖对肠道菌群结构的影响,结果见图3。
由图3 可知,与正常组相比,模型组的厚壁菌门(88.28%)和变形菌门(11.28%)的相对丰度明显上升,而拟杆菌门(0.30%)明显下降,软壁菌门和埃普西隆杆菌门完全消失。与模型组相比,万古霉素治疗使厚壁菌门(13.17%)的相对丰度明显下降,变形菌门(38.56%)和拟杆菌门(12.21%)明显上升,并且出现了较高丰度的软壁菌门(14.57%)和埃普西隆杆菌门(21.19%)。与模型组相比,预先口服岩藻聚糖可以使厚壁菌门(52.85%)的相对丰度明显下降,与正常组厚壁菌门的相对丰度相似,菌群中变形菌门上升至20.1%,拟杆菌门(0.65%)也略有上升。

图3 岩藻聚糖在门水平上对艰难梭菌肠炎小鼠盲肠内菌群结构的影响(n=5)Fig.3 Effects of fucoidan on the structure of the cecal microbiota in C.difficile-infected mice at the phylum level(n=5)
进一步从属水平分析岩藻聚糖对肠道菌群结构的影响,对不同组小鼠的相对丰度最高的50 个属进行分析比较,结果见图4。

图4 岩藻聚糖在属水平上对艰难梭菌肠炎小鼠盲肠菌群结构的影响Fig.4 Effects of fucoidan on the structure of the cecal microbiota in C.difficile-infected mice at the genus level
由图4 可知,正常组盲肠中鼠李杆菌和毛螺菌NK4A136 为主要优势菌,分别占30.52%和17.38%,还含有乳酸杆菌(7.41%)、布劳特氏菌属(2.09%)、瘤胃球菌_UCG-014(1.72%)、脱硫弧菌(1.53%)、Candidatus_Saccharimonas(1.31%)、另枝菌属(1.26%)、普瑞沃特菌属(1.20%)、肠杆菌属(1.09%)等。服用头孢哌酮和艰难梭菌侵染后,小鼠盲肠中与肠炎相关的肠球菌(45.53%)、艰难梭菌(15.71%)、梭菌_vadinBB60(15.18%)、变形杆菌属(10.44%)变成了优势菌属。而有益菌鼠李杆菌(0.08%)、毛螺菌NK4A136(0.02%)、瘤胃球菌_UCG-014(0.01%)均明显下降,脱硫弧菌、普瑞沃特菌属和Candidatus_Saccharimonas完全消失。此外,艰难梭菌的相对丰度增长到15.71%,这说明艰难梭菌在盲肠中大量繁殖。
万古霉素治疗5 d 后,发现小鼠盲肠中优势菌变为幽门螺杆菌(21.19%)、Parasutterella(17.83%)、支原体(14.56%)、拟杆菌(11.99%)、乳酸杆菌(9.25%)、大肠杆菌志贺菌(7.67%)、肠杆菌(2.07%)、Erysipelatoclostridium(1.82%),而艰难梭菌未检出。以上结果表明,万古霉素虽然可以有效杀死艰难梭菌,但是会造成幽门螺旋杆菌、大肠杆菌志贺菌等有害菌的增长,小鼠菌群的单一也会造成支原体感染。
预先口服岩藻聚糖使盲肠内肠道菌群的OUTs上升至1 146,细菌结构发生明显变化。其中支原体(25.61%)、Parasutterella(18.05%)、活泼瘤胃球菌(13.46%)、乳酸杆菌(8.17%)、布劳特氏菌属(6.28%)、肠球菌(5.80%)、Erysipelatoclostridium(5.44%)成为优势菌。与模型组相比,肠炎相关致病菌肠球菌和艰难梭菌的相对丰度明显下降,而有益菌扭链瘤胃球菌(0.47%)、鼠李杆菌(0.39%)、高氏瘤胃球菌(0.29%)、罗姆布茨菌(0.18%)、不动杆菌(0.13%)、假交替单胞菌属(0.12%)的相对丰度明显上升。以上结果说明,口服岩藻聚糖可以提高有益菌的相对含量,降低肠炎和腹泻相关的有害细菌的相对含量。但是,口服岩藻聚糖无法避免头孢哌酮对肠道细菌的伤害,肠道菌群的丰度和多样性均明显低于正常组小鼠,这说明岩藻聚糖只能有限地保护肠道菌群的丰度和多样性。
2.4 岩藻聚糖对艰难梭菌肠炎小鼠盲肠内艰难梭菌毒素A 和毒素B 含量的影响
图5 显示了300 mg/kg 岩藻聚糖对艰难梭菌肠炎小鼠盲肠中毒素TcdA 和TcdB 水平的影响。

图5 岩藻聚糖对艰难梭菌肠炎小鼠盲肠中毒素Tcd A 和Tcd B含量的影响Fig.5 Effect of fucoidan on Tcd A and Tcd B toxins content in the cecum of mice with C.difficile colitis
由图5 可知,与正常组相比,小鼠艰难梭菌感染后盲肠中毒素TcdA 和TcdB 水平显著升高(p<0.05),说明模型组小鼠遭到了艰难梭菌的侵染,并且产生毒素。与模型组相比,万古霉素和岩藻聚糖岩藻聚糖均可以使毒素TcdA 和TcdB 水平显著降低(p<0.05),说明口服万古霉素和岩藻聚糖均可以抑制盲肠中艰难梭菌毒素TcdA 和TcdB 的产生。
2.5 岩藻聚糖对艰难梭菌肠炎小鼠结肠组织中巨噬细胞和中性粒细胞浸润的影响
图6 为岩藻聚糖对结肠中F4/80 和Ly-6G 水平的影响。
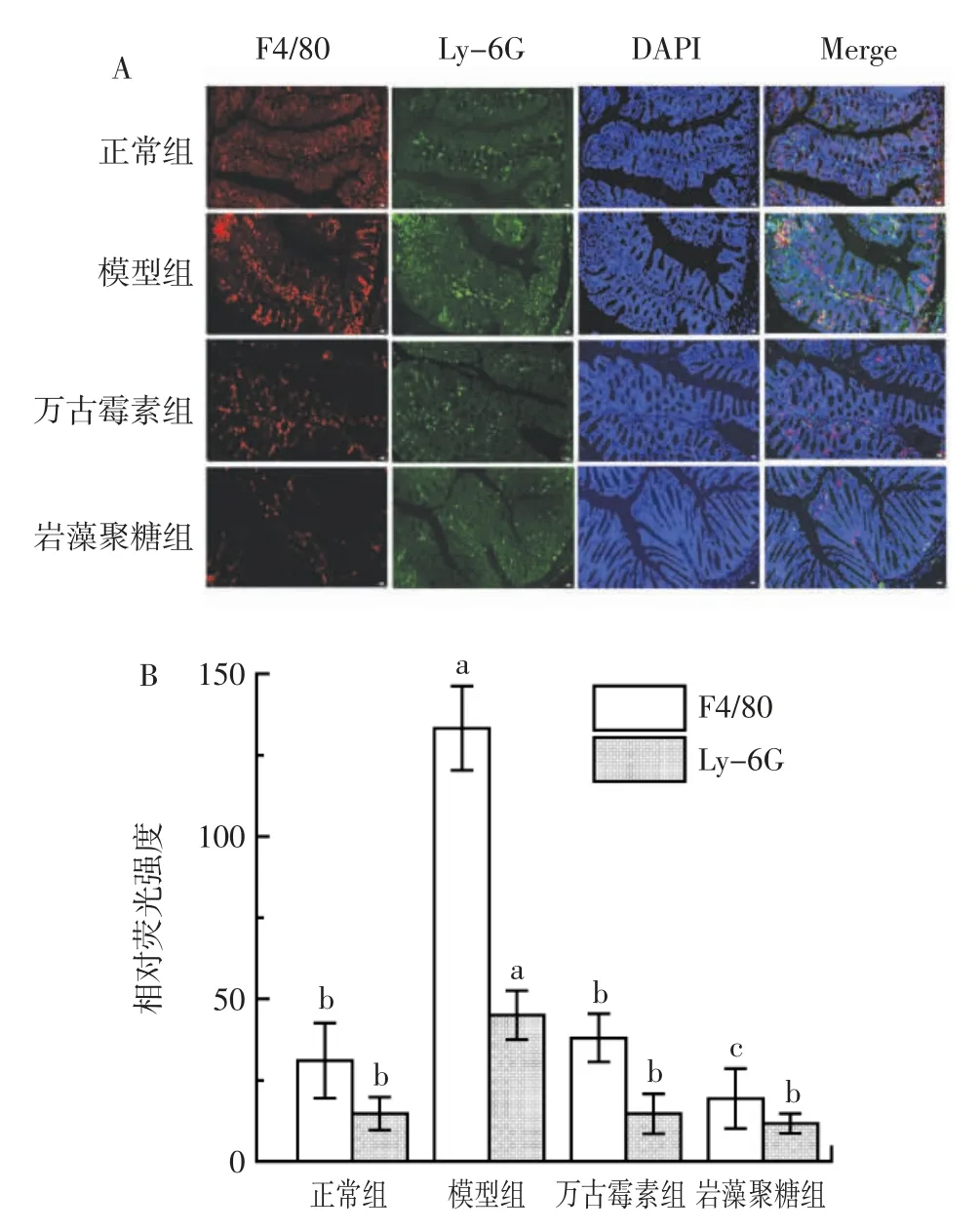
图6 岩藻聚糖对艰难梭菌肠炎小鼠结肠中F4/80 和Ly-6G 水平的影响Fig.6 Effect of fucoidan on the level of F4/80 and Ly-6G in C.difficile infected mice
通过免疫荧光双标法检测巨噬细胞标记物F4/80和中性粒细胞标记物Ly-6G 相对荧光强度,来反映巨噬细胞和中性粒细胞浸润情况。由图6 可知,与正常组相比,模型组小鼠结肠组织中F4/80 和Ly-6G 的相对荧光强度显著增加(p<0.05),说明艰难梭菌侵染导致巨噬细胞和中性粒细胞数量增加。与模型组相比,万古霉素和岩藻聚糖组小鼠结肠组织的F4/80 和Ly-6相对荧光强度均显著降低(p<0.05),其中,岩藻聚糖组F4/80 明显低于万古霉素组,说明岩藻聚糖可以显著抑制艰难梭菌侵染导致的结肠组织中巨噬细胞和中性粒细胞的浸润,尤其对巨噬细胞有很好的抑制作用。
2.6 岩藻聚糖对艰难梭菌肠炎小鼠结肠组织中炎症因子mRNA 相对表达水平的影响
图7 为q-PCR 对4 种促炎症因子TNF-α、IL-1β、IFN-γ、IL-6以及2 种抗炎因子IL-10、IL-4的mRNA表达的影响。

图7 岩藻聚糖对艰难梭菌肠炎小鼠盲肠组织中炎症因子mRNA 水平表达的影响Fig.7 Effect of fucoidan on the mRNA expression of inflammatory cytokines in the colon of C.difficile infected mice
由图7 可知,与正常组相比,模型组结肠组织中TNF-α、IL-1β、IFN-γ 3 种炎症因子mRNA 表达量均显著升高(p<0.05),但是炎症因子IL-6的mRNA 表达量没有显著变化。与模型组相比,万古霉素组TNF-α 和IL-1β 的mRNA 表达量均显著下降(p<0.05),IL-4的mRNA 表达量显著上升,而IFN-γ 和IL-6的mRNA表达量没有显著差异。这说明万古霉素有一定的抑制结肠炎症因子基因过度表达的作用。与模型组相比,岩藻聚糖组小鼠结肠组织中的TNF-α、IL-1β、IFN-γ 和IL-64 种炎症因子的mRNA 表达量均显著下降(p<0.05),这说明预先口服岩藻聚糖可以有效地抑制艰难梭菌所造成的结肠炎症因子的过度表达。与正常组相比,模型组结肠中抗炎症因子IL-10下降,IL-4无显著性变化(p>0.05)。与模型组相比,万古霉素组IL-10上升显著(p<0.05),且高于正常组,而IL-4无显著性变化(p>0.05)。与模型组相比,岩藻聚糖组IL-10和IL-4的mRNA 表达量均显著增加,尤其是IL-4的表达量显著高于正常组。这说明预先口服岩藻聚糖可以显著提高抗炎因子IL-10和IL-4的基因表达。
3 讨论
头孢哌酮是目前临床常用的抗生素,会造成的肠道微生物紊乱的时间长达4~6 个月[22]。本研究利用头孢哌酮诱导的肠道菌群紊乱小鼠模型,评价岩藻聚糖预防艰难梭菌侵染和肠炎的活性。在服用头孢哌酮期间,每日口服300 mg/kg 岩藻聚糖可以显著缓解艰难梭菌引起的腹泻,结肠黏膜损伤和炎性细胞浸润,降低艰难梭菌、肠球菌的相对丰度,增加盲肠中的有益细菌Parasutterella、活泼瘤胃球菌、乳酸杆菌和布劳特氏菌属,并使艰难梭菌毒素TcdA 和TcdB 含量下降。这说明岩藻聚糖能够抑制艰难梭菌侵染和毒素,调整肠道菌群结构。但是,岩藻聚糖组小鼠的肠道菌群的OUTs 从9.2%增加到15.1%,菌群多样性仍然很低,而且支原体和肠球菌等有害细菌的相对丰度仍然很高,说明岩藻聚糖对肠道菌群的保护有限,并不能恢复正常的肠道菌群。有研究表明,岩藻聚糖可以通过与细胞表面硫酸乙酰肝素(heparan sulfate,HS)竞争结合病毒来抑制细胞的病毒感染[8]。由此推测岩藻聚糖可以直接抑制艰难梭菌对肠上皮细胞的感染,或抑制艰难梭菌毒素的产生,从而预防艰难梭菌肠炎。
本研究发现,口服岩藻聚糖在艰难梭菌肠炎小鼠中表现出很好的抗炎症作用,显著降低结肠组织中巨噬细胞和中性粒细胞浸润,抑制TNF-α、IFN-γ 和IL-1β 基因过度表达,促进抗炎因子IL-10和IL-4的基因表达,实验结果与岩藻聚糖抑制DSS 和艰难梭菌毒素A 诱导的肠道炎症效果相似[10,12]。综合研究结果推测,岩藻聚糖预防头孢哌酮诱导的艰难梭菌感染和结肠炎的机制,与其直接抑制艰难梭菌侵染和毒素产生、抗炎活性、保护肠道黏膜结构有关。因此,岩藻多糖有潜力成为抗生素治疗患者避免艰难梭菌相关性结肠炎的功能性食品。
4 结论
在口服头孢哌酮导致的肠道菌群失调小鼠中,预先口服岩藻聚糖可以有预防艰难梭菌侵染和毒素TcdA 和TcdB 的产生,同时,岩藻聚糖可有效抑制盲肠中结肠炎相关细菌艰难梭菌和肠球菌等细菌的相对丰度,促进有益菌的生长,从而预防艰难梭菌诱导的腹泻和结肠黏膜结构损伤,但是不能够完全恢复肠道菌群的丰度和结构。岩藻聚糖具有较好的抗炎活性,能够抑制炎症细胞浸润,下调炎性因子的基因表达,上调抗炎因子的基因表达。因此,岩藻聚糖在预防抗生素相关艰难梭菌肠炎方面具有很好的潜质。
