离心法制备小麦醇溶蛋白/淀粉胶体颗粒稳定高内相Pickering乳液的性质及应用
2023-10-16于雪儿宋佳于德洋牛启鹏郑舒马晶亭马玉谭明乾王海涛
于雪儿,宋佳,于德洋,牛启鹏,郑舒,马晶亭,马玉,谭明乾,,3,王海涛,3*
(1.大连工业大学食品学院,辽宁大连 116034;2.大连工业大学食品交叉科学研究院,辽宁大连 116034;3.国家海洋食品工程技术研究中心,辽宁大连 116034)
高内相Pickering 乳液(high internal phase Pickering emulsion,HIPEs)是指内相体积分数大于74%的乳液,HIPEs 呈现半固体状,具有潜在应用价值。传统乳液通常由小分子表面活性剂来稳定,表面活性剂的潜在毒性,可能会引起健康问题[1]。Pickering 乳液是由固体颗粒而不是表面活性剂稳定的乳液[2],通过生物大分子形成的胶体颗粒制备Pickering 乳液,避免了表面活性剂潜在的健康危害,在食品工业中引起了广泛关注,是目前研究的热点[3]。通常,大多数HIPEs 都是通过一步均质法制备[4]。近年来,离心法制备HIPEs 逐渐受到人们关注。这种制备HIPEs 的方法是通过离心浓缩的方式,除去低内相乳液中的连续相,达到制备高内相乳液的目的。离心法对固体颗粒表面性质要求较低,且可以通过离心条件调节乳液的内相比例。其制备策略包括2 个步骤:一是制备具有低内相的Pickering 乳液,二是通过离心除去多余的连续相[5]。尽管离心法在HIPEs制备方面具有广阔的前景,但是目前采用该方法制备HIPEs 的研究鲜见报道。在离心作用下,可能会导致乳液的相分离或者油滴的聚集。因此,选择适当离心条件,增强预乳液的离心稳定性,是采用离心法制备HIPEs 的关键。
小麦醇溶蛋白是一类含有较多脯氨酸的醇溶性蛋白质。由溶剂极性改变而诱发的自组装,可以形成胶状微粒的小麦醇溶蛋白。而小麦醇溶蛋白可以与水溶性生物大分子在自主装的过程中发生相互作用,达到调节胶体颗粒性质的目的。由于胶体颗粒性质的可调性,小麦醇溶蛋白基胶体颗粒广泛用于制备Pickering 乳液[6]。例如,海藻酸丙二醇酯可以使其在油水界面上形成薄膜,使乳液的稳定性得到显著提高[7]。而淀粉在食品工业中同样应用广泛[8],小麦醇溶蛋白可以通过氢键和疏水键相互作用与淀粉形成二元复合物,形成具有核壳结构的小麦醇溶蛋白/糊化淀粉胶体颗粒(gliadin/gelatinized starch colloidal particles,G/SCPs),其可使Pickering 乳液稳定[9]。小麦醇溶蛋白/多糖二元复合物稳定的Pickering 乳液表现出较高的稳定性,具有通过离心法制备HIPEs 的潜力。
三维(three dimension,3D)打印是一种快速成型技术,其凭借增材制造的能力被称为“制造业的未来”[10]。具有高黏弹性的HIPEs 同样适合于3D 打印[11],其可作为3D 油墨,以较高的分辨率还原3D 打印选定的形状,印刷出可食用的产品[12],满足食品个性化定制的要求[13]。
本文利用糊化淀粉与小麦醇溶蛋白的相互作用,构建复合胶体颗粒,通过傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)、荧光光谱、粒径及电位测定等方式系统表征G/SCPs 的性质,继而对G/SCPs 稳定的预乳液进行离心,探究不同离心力下乳液的稳定性及流变特性,得到具有高黏弹性和稳定性的HIPEs,并通过对HIPEs 宏观、微观特性来探究其在不同pH 值、不同盐离子强度下的稳定性,以期为HIPEs 的综合应用提供参考价值。
1 材料与方法
1.1 材料与试剂
谷朊粉:封丘县博源制粉有限公司;玉米淀粉:荆门市京山市畅风坡食品有限公司;玉米油:山东西王食品有限公司;盐酸、氢氧化钠、氯化钠、乙醇(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
SU-8010 扫描电镜(配QUORUM PP3010T 冷冻传输系统)、F-2700 荧光分光光度计:日本日立公司;PerkinElmer 傅里叶变换红外光谱仪:美国PerkinElmer 公司;MICCRA D-4 高速数字分散机:德国MICCRA 公司;Eclipse Ti-S 倒置荧光显微镜:日本尼康公司;DHR-3 剪切流变仪:美国TA 公司;Micro17R 高速离心机:美国热电Thermo 公司;SCIENTZ-18N 冷冻干燥机:宁波新芝生物科技股份有限公司;Nano-ZS Zeta 电位及纳米粒度仪、Mastersizer300 粒度分布仪:英国Malvern公司;STL 食品3D 打印机:上海富奇凡机电科技有限公司。
1.3 方法
1.3.1 小麦醇溶蛋白的提取
根据Joye 等[14]和陈雨桐等[15]的方法提取小麦醇溶蛋白,将谷朊粉与二氯甲烷混合,在室温下搅拌3 h 后抽滤处理,收集滤渣,该操作重复3 次以除去谷朊粉中的脂质,将除去脂质的谷朊粉放置过夜,以除去其中的二氯甲烷。将除去脂质的谷朊粉按料液比1 ∶10(g/mL)溶于70%乙醇水溶液中,在室温下搅拌混合3 h,离心(9 000 r/min、4 ℃、10 min)收集上清液,将收集到的上清液真空旋转蒸发浓缩后冻干,所得粉末即为小麦醇溶蛋白。
1.3.2 G/SCPs 的制备
参考陈雨桐等[15]的方法,将淀粉浆(3%,干基)在95 ℃下糊化20 min 后,用NaOH 调节pH 值至8。小麦醇溶蛋白(1%,干基)溶于70%乙醇溶液,将小麦醇溶蛋白溶液缓慢滴入3%的糊化淀粉水溶液中,在45 ℃下真空旋转蒸发,除去多余的乙醇和部分水分,得到1%小麦醇溶蛋白/糊化淀粉胶体颗粒溶液,将其置于4 ℃冰箱冷藏备用。
1.3.3 G/SCPs 的表征
1.3.3.1 G/SCPs 粒径的测定
在室温下通过粒度分布仪对胶体颗粒的粒径进行测量,小麦醇溶蛋白浓度为0.5 mg/mL。
1.3.3.2 G/SCPs 的Zeta 电位的测定
小麦醇溶蛋白糊化淀粉复合胶体颗粒的Zeta 电位采用粒度分布仪进行测量,测量条件同1.3.3.1。
1.3.3.3 G/SCPs 的荧光光谱测定
用荧光分光光度计对G/SCPs 的荧光光谱进行测量,使小麦醇溶蛋白浓度为0.5 mg/mL。设定激发波长为280 nm、发射波长为290~500 nm。
1.3.3.4 G/SCPs 的傅里叶变换红外光谱测定
采用溴化钾压片法测定红外光谱,扫描范围为4 000~400 cm-1。利用PeakFit 4.12 软件对所得的红外光谱图进行去卷积、高斯拟合处理后,得到蛋白质二级结构分布图。
1.3.4 G/SCPs 稳定的Pickering乳液的制备
参考文献[15]中的方法,以小麦醇溶蛋白糊化淀粉复合胶体颗粒为乳化剂,油相为玉米油,油相比例为50%(体积比),用高速数字分散机在室温下分散(12 000 r/min,2 min),制备G/SCPs 稳定的Pickering乳液。
1.3.5 HIPEs 的制备
参考文献[16]中的方法,Pickering 乳液在不同离心力(0×g、1 000×g、6 000×g、12 000×g)条件下处理,测定不同离心力处理后的乳液的内相比例,内相大于74%即为HIPEs。
1.3.6 Pickering乳液的表征
1.3.6.1 Pickering乳液的流变特性测定
Pickering乳液的流变特性利用剪切流变仪和钢板(直径40 mm)进行测定。测试温度为25 ℃,测试时选择小振幅动态频率扫描模式,测量Pickering 乳液凝胶的储能模量(G')和损耗模量(G'')在0.1~100 Hz 频率范围内的固定应变(1%,线性黏弹性区域范围)。在剪切速率为0.1~100 s-1范围内测量Pickering乳液的表观剪切黏度。
1.3.6.2 Pickering乳液的微观结构测定
Pickering乳液的微观结构采用倒置荧光显微镜进行观察,将滴在载玻片上的样品用盖玻片盖上,观察乳液的微观形态,并将结果拍照记录。
1.3.6.3 Pickering 乳液粒径分布测定
使用ImageJ 软件测量记录Pickering乳液的粒度,并通过Origin 2022 软件处理数据,得出乳液的粒度分布图。
1.3.7 HIPEs 的稳定性
1.3.7.1 HIPEs 的热稳定性测定
将HIPEs 放入95 ℃水浴锅中加热30 min,观察加热前后的外观形态,分析其微观结构。测定乳液的微观结构方法同1.3.6.2,测定乳液的粒径方法同1.3.6.3。
1.3.7.2 HIPEs 的贮存稳定性测定
观察分析并拍摄记录HIPEs 在初始、7 d 后、14 d后、28 d 后的外观图、微观结构。乳液的微观结构测定方法同1.3.6.2,乳液的粒径测定方法同1.3.6.3。
1.3.7.3 HIPEs 的离子强度稳定性测定
为探究不同盐离子强度对乳液稳定性的影响,将未经离心的Pickering 乳液分为5 等份,分别加入NaCl溶液,使其终浓度分别为0、10、20、50、100 mmol/L,离心后观察其外观、微观结构并测量粒径。乳液的微观结构测定方法同1.3.6.2,乳液的粒径测定方法同1.3.6.3。
1.3.7.4 HIPEs 的pH 值稳定性测定
为探究不同pH 值对乳液稳定性的影响,将未经离心的乳液分为5 等份。用0.1 mol/L HCl 和0.1 mol/L NaOH 溶液调节pH 值,使5 等份乳液的pH 值分别为3、5、7、9、11,随后离心制得HIPEs,对其外观、微观结构和粒径进行测定。乳液的微观结构测定方法同1.3.6.2,乳液的粒径测定方法同1.3.6.3。
1.3.8 HIPEs 的3D 打印方法
打印时温度为25 ℃,喷嘴尖端的直径为0.40 mm,挤压速度为15 mm/s,打印几何图形为中国结形状。对打印出来的产品评估其可打印性并拍照记录。
1.4 数据处理
所有试验至少进行3 次,结果以平均值±标准差表示。
2 结果与分析
2.1 G/SCPs 的结构表征分析
通过反溶剂法制备小麦醇溶蛋白糊化淀粉复合胶体颗粒,并对其性质进行表征,结果如图1所示。

图1 不同质量比下G/SCPs 的粒径Fig.1 Particle sizes of G/SCPs with different mass ratios
由图1 可知,当小麦醇溶蛋白和糊化淀粉质量比为1 ∶0 时,即小麦醇溶蛋白胶体颗粒的平均粒径为400 nm,这与文献[17]中报道的相符,说明通过反溶剂法成功制备了小麦醇溶蛋白胶体颗粒;当小麦醇溶蛋白和糊化淀粉质量比为0 ∶1 时(即为糊化淀粉),获得颗粒的平均粒径为1 350 nm;当小麦醇溶蛋白和糊化淀粉质量比为1 ∶3 时,获得的颗粒平均粒径为1 100 nm,此时颗粒粒径介于小麦醇溶蛋白胶体颗粒与糊化淀粉颗粒之间,说明小麦醇溶蛋白和糊化淀粉之间发生了相互作用,形成了G/SCPs。
图2 为小麦醇溶蛋白胶体颗粒、糊化淀粉颗粒、G/SCPs 的Zeta 电位。

图2 不同质量比下G/SCPs 的Zeta 电位Fig.2 Zeta potentials of G/SCPs with different mass ratios
由图2 可知,固体颗粒的表面电位是Pickering 乳液稳定性的影响因素之一,而乳液油滴之间的静电斥力会随着固体颗粒Zeta 电位的增大而增大,油滴之间不易发生聚集现象,因而乳液的稳定性得以提高[18]。本试验中,在pH7 时测定的Zeta 电位,因为小麦醇溶蛋白的等电点为6.5,所以当pH7 时小麦醇溶蛋白会带有负电荷(-1.2 mV),与测得的Zeta 电位一致[19]。当糊化淀粉存在时,G/SCPs 的Zeta 电位减小(-5.4 mV),说明此时颗粒间的电荷排斥力增大,抑制了乳液液滴的聚集倾向,有利于获得稳定的乳液体系[20]。
为了进一步确认小麦醇溶蛋白和糊化淀粉之间的相互作用,测定了小麦醇溶蛋白的荧光光谱,结果见图3。

图3 不同质量比下G/SCPs 的荧光光谱Fig.3 Fluorescence spectra of G/SCPs with different mass ratios
由图3 可知,糊化淀粉的荧光强度很低,可以忽略;小麦醇溶蛋白颗粒的荧光光谱,在280 nm 的激发下,最大发射峰为355 nm,这与文献[21]报道的结果相符。G/SCPs 荧光强度比小麦醇溶蛋白颗粒荧光强度小,这说明在糊化淀粉存在条件下,形成了更紧密的结构,更多的氨基酸残基被包裹。
通过FTIR 表征小麦醇溶蛋白和糊化淀粉之间的相互作用,结果见图4。

图4 不同质量比下G/SCPs 的FTIR 图Fig.4 FTIR spectra of G/SCPs with different mass ratios
由图4 可知,-OH 拉伸振动的特征峰从3 389 cm-1蓝移到3 432 cm-1,这可能是由于小麦醇溶蛋白和糊化淀粉之间的氢键发生相互作用。而1 660 cm-1和1 536 cm-1处的特征峰分别对应酰胺I 带在小麦醇溶蛋白中的C=O 伸缩振动和酰胺II 带的N-H 弯曲振动。当加入糊化淀粉后,这2 个峰的强度下降,表明糊化淀粉成功地包覆了小麦醇溶蛋白,小麦醇溶蛋白和糊化淀粉的氢键和疏水键相互作用结合形成复合纳米颗粒,这与Li 等[22]的研究结论一致。另一方面,在红外光谱中没有出现新的峰,说明小麦醇溶蛋白和糊化淀粉的结合没有形成共价键。
蛋白质是由氨基酸经肽链连接而成的生物大分子,β-折叠、无规则卷曲、α-螺旋和β-转角等二级结构的相对含量可以通过红外光谱测定[23]。β-折叠结构1 610~1 640 cm-1、无规则卷曲结构1 640~1 650 cm-1、α-螺旋结构1 650~1 664 cm-1、β-转角结构1 664~1 695 cm-1[24]。图5、图6 分别为小麦醇溶蛋白、G/SCPs的二级结构分布图。

图5 小麦醇溶蛋白的二级结构分布Fig.5 Secondary structure distribution of gliadin

图6 G/SCPs 的二级结构分布Fig.6 Secondary structure distribution of G/SCPs
由图5、图6 可知,小麦醇溶蛋白中蛋白质结构主要以α-螺旋、β-转角和β-折叠为主,占比分别为40.14%、39.89%、19.96%。而G/SCPs 中无规则卷曲、α-螺旋、β-折叠和β-转角为主要二级结构,占比分别为30.62%、29.42%、20.01%、19.95%。在糊化淀粉存在下,小麦醇溶蛋白的α-螺旋含量下降,而无规则卷曲含量升高,这说明与糊化淀粉结合后,小麦醇溶蛋白的二级结构更加无序。
2.2 离心力对G/SCPs 稳定的预乳液内相比例的影响
通过对G/SCPs 稳定的预乳液进行离心除去冗余的水相,可以获得HIPEs。研究离心条件(0、1 000、6 000、12 000×g)对G/SCPs 稳定的预乳液内相比例的影响,结果如图7所示。

图7 Pickering 乳液表征Fig.7 Characterization of Pickering emulsions
由图7 可知,随着离心力的增大,乳液均未出现明显析乳和析油现象,说明本研究制得的Pickering 乳液具有较高的稳定性。随着多余的水分逐渐被分离,乳液的内相也增大,在0×g时,内相体积分数为50%,随着离心力的增加,析出水相的体积增大,内相体积分数增大。由于连续相体积的减小,油滴由较为分散状态逐渐变得紧密。在12 000×g下,得到了内相为75%的稳定的HIPEs。由图7D 可知,预乳液油滴粒径为5.47 μm,离心力的增加导致油滴粒径的增加,当离心力为12 000×g时,油滴平均粒径为5.52 μm。油滴粒径的增加说明在离心力的作用下,油滴发生了聚集融合,但油滴粒径的增加幅度较小,这也进一步说明了G/SCPs 稳定的Pickering 乳液具有较强的离心稳定性,适合使用离心法制备HIPEs。
2.3 乳液的流变性质分析
HIPEs 流变性结果见图8。

图8 Pickering乳液的流变性质Fig.8 Rheological properties of Pickering emulsions
由图8A、图8B 可知,G'和G''随着频率的增大而增大。在一定范围内,乳液的G'始终高于G'',G'值为100~1 000 Pa,G''值为5~200 Pa,表明在此频率范围内的乳液是以弹性为主的黏弹性凝胶状乳液。离心条件对Pickering乳液的G'和G''有较大影响,在同一频率下,随着离心力的增加,乳液的G'和G''呈上升趋势,表明离心力的增大有利于增加Pickering乳液的黏弹性,两者呈正相关,这可能是由于较高的内相比例促进了油滴之间的相互作用[9]。由图8C 可知,随着剪切速率的增加,Pickering乳液的黏度随之下降,呈现出剪切稀化现象。在相同剪切速率下,Pickering乳液的黏度随着离心力的增加而逐渐增加。在较高离心力条件下,连续相的比例大幅降低,导致油滴之间排列紧密,相互作用增强,具有较高的黏度,这与Zeng 等[25]的观点一致。
2.4 HIPEs 贮存稳定性分析
HIPEs 的贮存稳定性结果见图9。
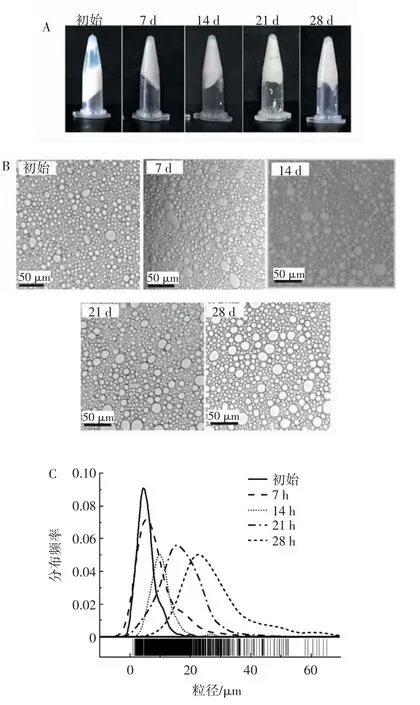
图9 HIPEs 贮存稳定性Fig.9 Storage stability of HIPEs
由图9A 可知,贮存28 d 后,HIPEs 的外观并无明显变化,未出现析乳和析油现象,说明本研究制得的HIPEs 具有较高的贮存稳定性。由图9B 可知,贮存期间HIPEs 油滴粒径有增大趋势。由图9C 可知,常温下贮存7 d 后,HIPEs 的粒径平均值由5.52 μm 增大到9.13 μm,在经历了14 d 的贮存后,油滴平均粒径增加到10.47 μm,这可能是由于液体的流动性,油滴发生聚集,导致油滴变大,形成较大的油滴。贮存21 d 后,油滴平均粒径达到17.17 μm,而经过28 d 的贮存后,油滴粒径平均值增加到28.27 μm。这些结果表明HIPEs 具有一定的抗凝聚性,贮存稳定性较高。
2.5 HIPEs 热稳定性分析
在95 ℃热处理30 min 后研究HIPEs 的热稳定性,结果见图10。

图10 HIPEs 的热稳定性Fig.10 Thermal stability of HIPEs
由图10A 可知,热处理后HIPEs 的外观没有发生明显变化,没有发生相分离现象,说明加热后油滴未发生聚集,制备的HIPEs 较为稳定[26]。由图10B、图10C可知,油滴粒径较未加热的HIPEs 粒径略微变大,平均粒径由5.52 μm 增大到8.46 μm,粒径分布曲线呈单峰分布,油滴大小均一且致密,说明乳液稳定性受温度影响变化不大,具有较高的热稳定性。
2.6 离子强度稳定性分析
乳液的稳定性与颗粒的相互作用有关,离子强度会影响颗粒之间的相互作用而对乳液的稳定性产生影响[27]。不同氯化钠浓度(10、20、50、100 mmol/L)对HIPEs稳定性的影响结果见图11。

图11 HIPEs 的离子强度稳定性Fig.11 Ionic strength stability of HIPEs
由图11A 可知,氯化钠浓度为10~100 mmol/L 时,氯化钠对HIPEs 外观影响不大。由图11B、图11C 可知,当盐离子强度从10 mmol/L 增大到50 mmol/L 时,油滴粒径随着盐离子强度增大而减小,油滴平均粒径由19.37 μm 减小为16.44 μm,在盐离子强度为10 mmol/L和20 mmol/L 时,油滴分布较不均匀,而在盐离子强度为50 mmol/L 时,油滴分布状态最佳,其平均粒径较小(10.03 μm),且油滴排列最为紧密,油滴粒径分布呈现完全的单峰分布。当盐离子强度大于50 mmol/L 时,油滴粒径随盐离子强度的增大呈增大趋势。油滴的平均粒径在盐离子强度为100 mmol/L 时增大到20.63 μm。这表明盐离子强度小于50 mmol/L 时,随着离子强度的增加,乳液稳定性增强,而当盐离子强度为50 mmol/L时,乳液油滴之间紧密堆积,乳液状态最好。离子强度大于50 mmol/L 时,随着离子强度的增大,乳液的稳定性逐渐下降。结果表明,离子强度为50 mmol/L 的乳液稳定性最好,平均粒径较小,适当提高盐离子强度可以增强乳液稳定性,过量的盐离子强度则会影响乳液的稳定性[28]。
2.7 HIPEs 的pH 值稳定性分析
图12 为不同pH 值(3、5、7、9、11)下制得HIPEs的外观图、显微镜图和粒径图。

图12 HIPEs 的pH 值稳定性Fig.12 pH stability of HIPEs
由图12A 可知,当pH 值为7 的时候,离心管中离心沉淀物最少,而其余4 种不同pH 值下的乳液离心沉淀物较多,这一结果与粒径变化结果(图12B、图12C)一致。当pH 值为7 时,油滴粒径最小,为5.52 μm,而在pH 值为3、5、9、11 时,油滴的平均粒径分别为9.18、8.97、9.42、9.41 μm,在这4 种pH 值下的油滴粒径均在9 μm 附近且变化并不明显,说明当pH 值偏离7 时,G/SCPs 在油水界面的吸附能力较弱,在12 000×g的离心力下,部分颗粒被离出,使油水界面的薄膜变薄,油滴发生轻微聚集现象。综上,虽然不同pH 值下油滴粒径不同,但是pH 值的改变并没有导致HIPEs 外观的显著变化,这说明HIPEs 在较宽pH 值范围内相对稳定[9]。
2.8 HIPEs 的3D 打印性能
将离心法制备的HIPEs 作为生物墨水进行3D 打印,打印样品如图13所示。

图13 3D 打印样品Fig.13 3D printed image
由图13 可知,打印出的产品具有高分辨率,产品形状规则,表面光滑、有清晰打印层,说明该离心法制备的HIPEs 有较强支撑力和可打印性,可用于可食用3D 打印食品[29]。
3 结论
本文通过反溶剂法制备了G/SCPs,在G/SCPs 形成过程中,糊化淀粉成功包裹住了小麦醇溶蛋白,形成的复合胶体颗粒平均粒径为1.1 μm。通过离心G/SCPs稳定的预乳液,成功获得了油相比例为75%的HIPEs。HIPEs 在高温(95 ℃)、极端pH 值和较高离子强度下具有较高的稳定性,能够稳定储存28 d 无明显变化,表现出剪切稀化的性质。本文探讨了HIPEs 在3D 打印中的应用,结果表明HIPEs 可以高分辨率还原3D打印选定的形状,表现出较好的3D 打印性能。离心法制备的G/SCPs 稳定的HIPEs 具有优良的加工性质,在食品工业中具有广阔应用前景。
