基于新孢镰刀菌的花生果腐病抗性评价方法研究
2023-10-13李步阳崔顺立孙伟明
李步阳 焦 镇 崔顺立 孙伟明
(1.河北科技师范学院农学与生物科技学院/河北省作物逆境生物学重点实验室 河北 秦皇岛 066000;2.河北农业大学 河北 保定 071001;3.河北科技师范学院海洋资源与环境学院 河北 秦皇岛 066000)
花生(Arachis hypoaea L.)是世界上广泛种植的油料作物和经济作物。 截至2021 年末,我国花生种植面积达到473 万hm2,位居世界第2 位[1],花生油产量为324.8 万t,约占世界总产量的1/2[2]。花生产业在我国国民经济和社会发展中具有重要地位[3-4]。 花生果腐病是一种世界性的严重病害[5-6],最早发现在美国,之后在各国花生种植区普遍发生,北美[7]、澳洲[8]、亚洲[9]、非洲[10]等地均有花生果腐病的发生。花生果腐病在我国山东[11]、河北[12-13]、吉林[14]、河南[15]等地发生严重,尤其是重茬地块有逐年加重的趋势[16]。
据国外研究报道,不同地域花生荚果腐烂的病原菌存在差异[17]。可引起花生荚果腐烂的病原菌主要包括腐霉菌(Pythium sp.)[18]、立枯丝核菌(Rhizoctonia sp.)[19]、花生黑腐病菌(Cylindrocladium paraasiticum)[20]、镰刀菌(Fusarium sp.)[19]、白 绢 病 菌(Sclerotium rolfsii)[22]、小菌核菌 (Sclerotium minor、Chalara elegans)[21-22]和侵脉新赤壳菌 (N.vasinfecta)(现用名F.neocosmosporiellum)[23]。 国内已报道的花生果腐病病原菌有新孢镰刀菌 (F.neocosmosporiellum)[23-29]、 尖孢镰刀菌(F.oxysporum)[30]、群结腐霉菌(P.myriotylum Drechsl)[31]和立枯丝核菌(R.solani)[32]。这些研究结果显示,花生果腐病病原菌的种类存在地域差异, 即使同一省份不同年份鉴定出的病原菌种类也不尽相同。
利用病原菌接种离体植物组织进行初步抗病性评价或鉴定是科研工作者经常采用的方法。 目前,研究人员利用群结腐霉菌、 丽赤壳菌和尖孢镰刀菌等花生果腐病病原菌进行室内离体或活体盆栽接种,从而建立了室内(盆栽)花生种质资源果腐病抗性鉴定的方法。 然而,以新孢镰刀菌为花生果腐病病原菌进行室内(盆栽)抗性评价的方法还未见报道。 本研究利用离体花生果接种新孢镰刀菌, 以果壳发病面积为分级标准获得荚果病情指数, 通过聚类分析获得了基于离体花生荚果室内接种病原菌的抗性评价方法, 为离体花生荚果接种病原菌抗性评价方法的建立奠定基础。
1 材料与方法
1.1 供试材料
花生种质资源由中国农业科学院油料作物研究所、 河北农业大学及河北省农林科学院粮油作物研究所提供。 新孢镰刀菌JNH1-2、HH-1-2 和XL-3 为本实验室保藏的花生果腐病病原菌菌株, 分别分离自邯郸市大名县、 秦皇岛市昌黎县及石家庄新乐市的花生果腐病发病荚果。
1.2 试验方法
试验于2022 年在河北科技师范学院昌黎校区微生物实验室进行。 将病原菌JNH1-2、HH-1-2 和XL-3分别接种于PDA 平板,在28℃条件下培养2 d,培养皿加入5 mL 含0.1%吐温的无菌水, 制成105个/mL分生孢子悬浮液,备用。
将新鲜健康的R5 时期离体花生荚果进行表面消毒:用自来水冲洗干净,75%乙醇消毒30 s,无菌水冲洗1 次,灭菌吸水纸吸干表面水分;5%次氯酸钠消毒3 min,无菌水冲洗4 次,吸干表面水分。 表面消毒的2 个花生品种 (高感品种PI162857 和抗病品种PI196622)[33]离体荚果分别浸沾接种病原菌JNH1-2、HH-1-2 和XL-3 分生孢子悬浮液, 每个处理30 个荚果, 以无菌水为空白对照。 接种后的荚果置于直径为180 mm 培养皿中在28℃黑暗保湿培养, 10 d后调查发病情况, 依据致病力情况确定病原菌代表性菌株。
利用筛选出来的病原菌代表性菌株按照上述方法对32 份花生种质资源进行离体花生荚果病原菌接种试验。
1.3 病害分级方法
病原菌离体接种试验采用的病害分级方法:0 级,无腐烂症状;1 级,0~10%腐烂症状;2 级,10%~20%腐烂症状;3 级,20%~30%腐烂症状;4 级,30%~40%腐烂症状;5 级,40%~50%腐烂症状;6 级,50%~100%腐烂症状。 按照荚果果皮腐烂面积占比调查荚果发病情况,计算荚果病情指数。
病情指数=∑(各级发病荚果数×各级代表值)/(总果数×最高级值)×100
发病率=发病株/总株数×100%
1.4 数据统计与分析
试验数据采用Microsoft ExceL 2017 进行数据整理, 用SPSS 21.0 统计软件进行数据的处理与分析。利用欧式距离法(euclidean distance)计算品种间距离,采用最远邻元素法进行系统聚类分析。
2 结果与分析
2.1 新孢镰刀菌的致病力测定
3 株病原菌对2 个花生品种表现出不同的致病力, 结果表明, 高感品种PI162857 发病率均大于80%, 病情指数为67.22~69.44; 抗病品种PI196622发病率为40.00%~53.33%,病情指数为30.56~36.67。其中,病原菌XL-3 接种离体花生荚果的发病率和病情指数均为最高,致病力最强,因此选择新孢镰刀菌XL-3 为病原菌代表性菌株开展基于室内离体花生荚果的抗性评价试验(表1)。

表1 不同地区接种病原菌后花生荚果发病情况
2.2 基于室内离体花生荚果的抗性评价方法建立
32 份种质资源的离体花生荚果接种新孢镰刀菌10 d 后进行病害分级,计算荚果病情指数(FDI),结果显示,供试材料的FDI 变化范围为10.56~69.44,其中湛红2 号的FDI 最低,为10.56,中花24 的FDI 最高,为69.44。 以FDI 为聚类分析的统计指标,当阈值为5.5 时,可将供试花生种质资源聚为6 类(图1)。第Ⅰ类有4 份资源, 病情指数为65.00~69.44, 属于HS 类型; 第II 类有5 份资源, 病情指数为40.67~44.44,属于MS 类型;第Ⅲ类有4 份资源,病情指数为51.33~55.56,属于S 类型,第IV 类有8 份资源,病情指数为28.00~36.67,属于MR 果腐病的资源类型;第Ⅴ类有5 份资源, 病情指数为10.56~16.67, 属于HR 类型; 第Ⅵ类有6 份资源, 病情指数为18.67~25.33,属于R 类型。 为了便于分析统计,基于室内离体花生荚果的花生果腐病抗性评价方法为:HR,0<FDI≤15;R,15<FDI≤25;MR,25<FDI≤40;MS,40<FDI≤50;S,50<FDI≤65;HS,FDI>65(表2)。
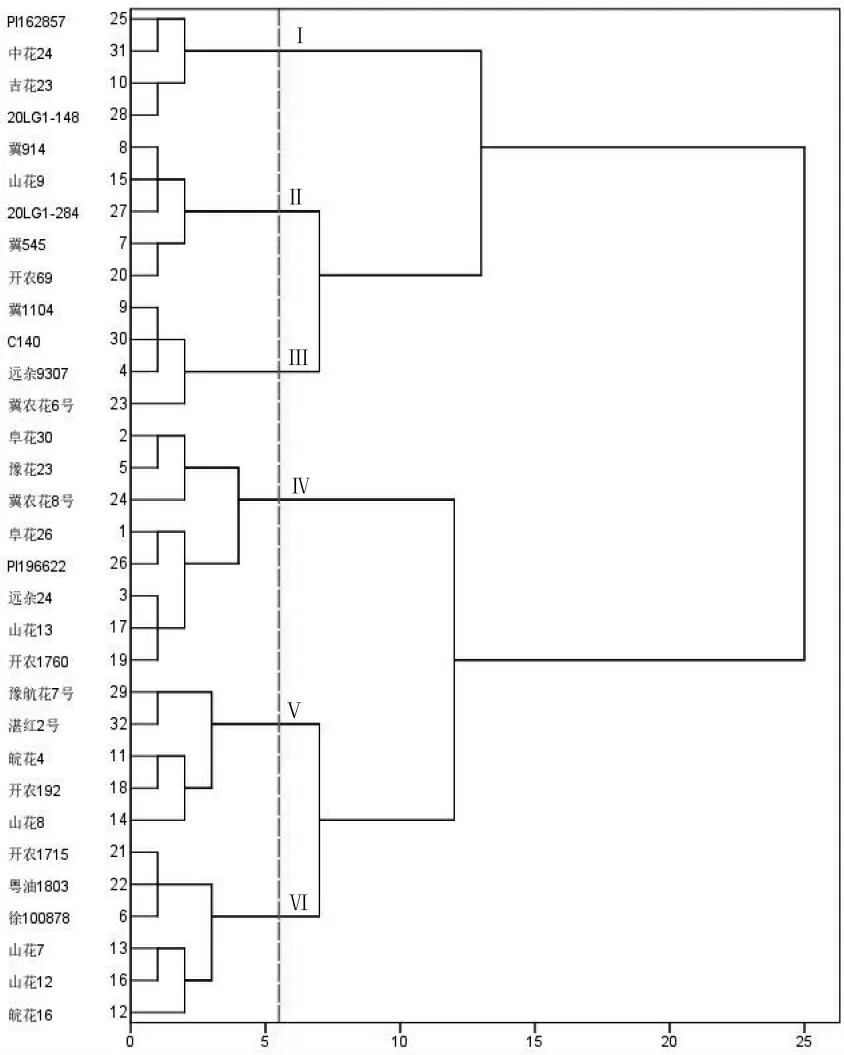
图1 基于FDI 不同花生种质资源对果腐病抗性聚类分析谱系
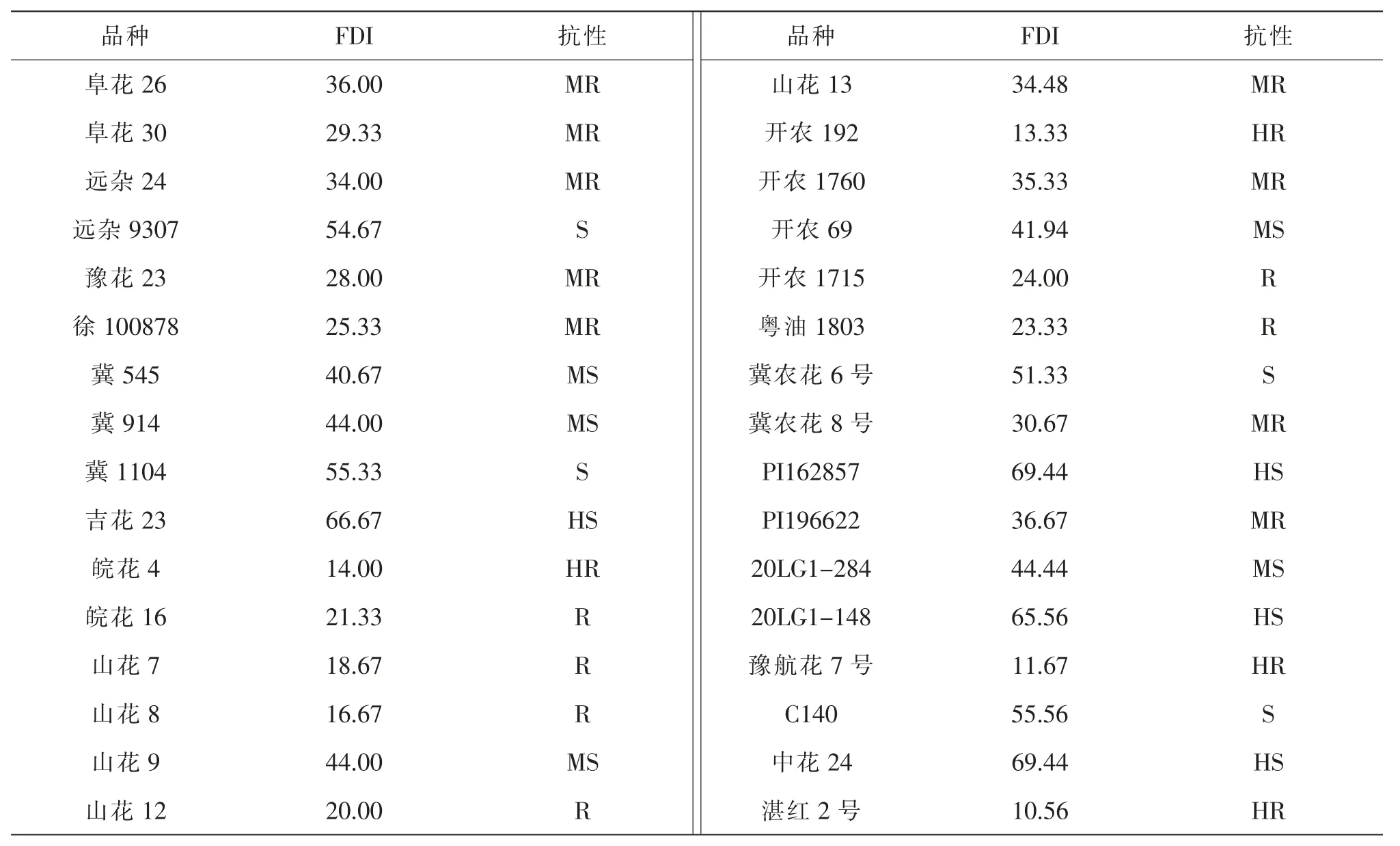
表2 室内32 份花生种质资源抗性鉴定结果
3 讨论与结论
花生果腐病是一种严重的土传病害, 并且有逐年加重趋势。 近年来引起了国内外学者的广泛关注,但目前仅主要停留在对花生果腐病病原菌及其致病性的研究上, 关于花生抗果腐病室内抗性评价方法的建立研究较少。
本研究首先对新孢镰刀菌的3 种病原菌菌株进行致病性鉴定, 以筛选出致病性最强的生理小种,并用其制备的孢子悬浮液侵染离体花生荚果, 然后进行抗性评价分析, 最终建立了基于室内离体花生荚果的抗性评价方法。于静等[34]采用盆栽花生活体接种群结腐霉菌(P.myriotylum)的试验方法,在幼苗期、 开花下针期、 结荚期和饱果成熟期进行。 此方法操作较为烦琐, 试验周期较长, 但可明显提高花生果腐病接种后的发病率。陈明娜等[35]利用丽赤壳菌(Calonectria sp.)在花生苗期、盛花期、浆果期采用掩埋喷灌的接种方法对17 个花生品种的烂果率进行统计并分析, 建立了一种花生种质资源果腐病抗性鉴定的方法。 该方法能够同时对多个花生种质资源进行果腐病抗性的鉴定,结果准确可靠,重复性好,对抗果腐病花生品种的培育及抗病机制的研究具有重要意义。 王冕等[36]利用一种尖孢镰刀菌(Fusarium oxysporum) 接种花生幼苗离体子叶, 并进行划伤处理,后期调查记录各品种的发病症状、病斑大小及发病率, 并由此建立了快速筛选花生抗果腐病种质资源的方法,筛选花生抗果腐病种质资源的方法,实验结果直观性强,易于分级鉴定,能够快速、高效率地鉴定大量种质资源, 大大缩短了种质鉴定的筛选周期,快速为花生抗病育种提供优质资源。 于静等[37]采用自然病圃鉴定法, 筛选出豫航花7 号为高抗花生果腐病的品种, 中花24 为高感花生果腐病的品种,这与本研究结果一致, 验证了本试验中基于室内离体花生荚果抗性评价方法的科学性与可行性。
本试验采用基于花生果壳腐烂面积的病害分级方法, 将供试花生种质资源的果壳腐烂面积分为0 级,无腐烂症状;1 级,0~10%腐烂症状;2 级,10%~20%腐烂症状;3 级,20%~30%腐烂症状;4 级,30%~40%腐烂症状;5 级,40%~50%腐烂症状;6 级,50%~100%腐烂症状。 因在进行室内离体侵染时极少存在烂果仁的情况,一般病害表现都出现在荚果果壳上,故将病害分级标准划分为7 个等级, 可使试验结果更为客观、准确。
