旱黄瓜茎基腐病菌鉴定及其生物学特性
2023-10-12陈怡铭张宇萍韩亚梅高玉峰贺字典
金 鸽,闵 康,陈怡铭,曹 蜢,张宇萍,韩亚梅,高玉峰,贺字典,*
(河北科技师范学院 1 农学与生物科技学院 河北省作物逆境生物学重点实验室,2 学报编辑部,河北 秦皇岛,066004)
近几年,黄瓜茎基腐病在全国各黄瓜产区危害呈现逐年递增的趋势[1],田间发病率一般为15%~20%,重者高达50%以上,甚至绝收。上海地区黄瓜茎基腐病的病原菌为胡萝卜软腐果胶杆菌巴西亚种(Pectobacteriumcarotovorumsubsp.brasiliense)[2]。山东聊城黄瓜茎基腐病病菌为瓜果腐霉(Pythiumaphanidermatum)、腐皮镰孢菌(Fusariumsolani)、立枯丝核菌(Rhizoctoniasolani)[3]。目前,旱黄瓜茎基腐病的病原菌并未见到报道。旱黄瓜俗名秋黄瓜、白黄瓜,与常见的密刺黄瓜(俗名黑黄瓜)外观上有明显区别。近年来,随着国家蔬菜产业体系和河北省蔬菜产业体系的推广,旱黄瓜种植面积逐渐扩大,已在山东、河北、东北三省等地大面积种植。但是,自2018年开始,旱黄瓜茎基部出现黄色水渍状坏死,病斑逐渐扩大绕茎一周后茎部开始纵向开裂,检查病株根系未出现腐烂,维管束也未变褐。为了明确旱黄瓜茎基腐病的病原菌种类及其生物学特性,笔者拟采用组织分离法和ITS序列对旱黄瓜茎基腐病的病原菌进行分离与鉴定,并对病原菌的生物学特性进行研究,以期为旱黄瓜茎基腐病的防治提供理论依据。
1 材料与方法
1.1 供试材料
1.1.1供试病样 2018~2022年从河北省昌黎县马坊营旱黄瓜基地发病的大棚内采集病样27份。
1.1.2供试品种 田娇8号旱黄瓜和黄籽南瓜,购自河北省昌黎县当地种子门市部。
1.1.3Richard培养基 KNO310 g,KH2PO45 g,MgSO42.5 g,FeCl30.02 g,蔗糖50 g,琼脂20 g,蒸馏水1 000 mL。
1.2 方法
1.2.1病原菌的分离 采用组织分离法对病原菌进行分离。在病健交界处切取5 mm×5mm的病组织,置于体积分数75%酒精中消毒45 s,然后于质量浓度为10 g/L的NaClO溶液中消毒1 min,用灭菌水漂洗3次后将病组织放在灭菌滤纸上,完全吸干水分后置于PDA平板上,每皿放置4块,于25 ℃黑暗恒温培养,待病组织上长出菌丝后,利用菌丝尖端纯化方法,多次纯化直至菌落形态一致。4 ℃保存备用。
1.2.2致病性测定 采用针刺法测定病原菌对黄瓜和南瓜的致病性。将直径7 mm的病原菌菌饼置于PDA平板上,待长满平板后,分次加入5 mL灭菌水,用灭菌载玻片刮取菌丝于离心管中制成孢子悬浮液。用血球计数板调整分生孢子数量达到107个·mL-1。待黄瓜与南瓜幼苗长到两叶一心时,用昆虫针在茎基部由下至上针刺5个孔,两孔间距0.5 cm。用无菌毛笔蘸取孢子悬浮液涂抹在针刺部位,黄瓜和南瓜各接种10棵。以涂抹清水的为对照。4次重复。接种后用湿脱脂棉包裹在伤口部位保湿,并用白色地膜盖住育苗盘[4]。将育苗盘置于25 ℃棚膜搭建的保湿室内培养,每天用无菌水浸湿脱脂棉。48 h后撤掉地膜,96 h后移除脱脂棉。7 d后观察幼苗发病情况,记录病变形态,并对发病部位分离,鉴定病菌形态与原病菌是否一致。
1.2.3病原菌的形态学鉴定 用直径7 mm的打孔器从病原菌菌落边缘打菌饼,接种到PDA平板上。25 ℃恒温黑暗培养4 d时测量菌落直径,7 d时观察病原菌在PDA培养基上的气生菌丝形状、色素产生情况等菌落特征,并测量大、小型分生孢子大小及厚垣孢子的形态和产生方式等特征,参照Booth的方法对病原菌的种进行初步鉴定[5,6]。
1.2.4病原菌的分子生物学鉴定 将病原菌菌株在PDA平板上活化后,每个菌株培养20皿,培养至长满培养皿,刮取菌丝冷冻保存,采用CTAB法提取基因组DNA。分别采用ITS1(5′-TCCGTAGGTG AACCTGCGG3′)/ITS4(5′-TCCTCCGCTTATTGATATGC-3′)和NL1(5′-GCATATCA ATAA GCGGAGGAAAAG-3′)/LR3(5′-GGTCCGTGTTTCAAGAC-3′)对该菌株的ITS区进行PCR扩增[7]。PCR反应程序为:94 ℃预变性2 min,94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸90 s,35个循环;72 ℃延伸7 min。PCR产物送北京生工生物工程公司测序。所得序列用NCBI中的BLAST程序搜索同源序列,下载相似性大于99%及近缘属序列,用MEGA-X软件进行多序列比对,以邻接法构建系统发育树。
1.2.5pH对病原菌生长的影响 用1 mol/L NaOH溶液和1 mol/L HCl将PDA培养基的pH调为4,5,6,7,8,9,10,11和12共9个梯度,接种菌饼后置于培养箱中25 ℃黑暗培养5 d,采用十字交叉法测量菌落直径。取培养7 d的病原菌,用打孔器在菌落边缘打取直径为7 mm的菌饼。将菌饼接种于PDA培养基上,28 ℃培养,第5天采用十字交叉法测量菌落直径,第7天用血球计数板测产孢量,3次重复。
1.2.6温度对病原菌生长的影响 取培养7 d的病原菌,用打孔器在菌落边缘打取直径为7 mm的菌饼。将菌饼接种于PDA培养基上,分别置于温度为15,20,25,30,35,40,45 ℃培养箱中培养,第5天采用十字交叉法测量菌落直径,第7天用血球计数板测产孢量,3次重复。
1.2.7碳源对病原菌生长的影响 用Richard培养基作基础培养基,分别以等量的果糖、葡萄糖、麦芽糖、木糖、淀粉代替蔗糖作为碳源。将直径为7 mm的菌饼接种到不同碳源的培养基上,25 ℃培养。第5天用十字交叉法测量菌落直径,第7天用血球计数板测产孢量,3次重复。
1.2.8氮源对病原菌生长的影响 以Richard培养基为基础,分别以NH4NO3,(NH4)2SO4,NaNO3,尿素和蛋白胨代替KNO3作为氮源。将直径7 mm的菌饼接种到含不同氮源的培养基上,25 ℃培养。第5天用十字交叉法测量菌落直径,第7天用血球计数板测产孢量,3次重复。
1.2.9菌丝致死温度测定 将直径7 mm的病原菌菌饼置于装有10 mL无菌水的试管中,将试管分别置于40,50,60,70,80 ℃的恒温水浴锅中处理10 min后迅速冷却,将菌饼取出后接种于PDA平板上,于28 ℃培养箱中进行恒温培养,3次重复,4 d后测量菌落直径,统计出致死温度范围。再次将温度设置间隔5 ℃梯度,重复上述操作,最后设置间隔1 ℃温度梯度最终确定病原菌的致死温度。
2 结果与分析
2.1 黄瓜茎腐病原菌的分离培养
采集黄瓜病株样品进行分离培养,共获得镰孢菌29株,青霉菌10株,链格孢8株。其中,菌株CL0307在PDA上25 ℃培养5 d的菌落直径为7.5~8.2 cm,菌落羊绒状,菌丝无色,产生紫红色色素。显微观察有大型分生孢子和小型分生孢子,初步确定为镰孢菌(图1)。

注:A,菌落正面特征;B,菌落背面特征 图1 菌株CL0307的菌落特征
2.2 病原菌的致病性
2.2.1田间发病症状 用南瓜嫁接的旱黄瓜田间发病后茎基部表皮变成黄色,似开水浸过,表皮逐渐变得粗糙,纵向开裂,随着裂口加大,植株失水,萎蔫死亡(图2)。

注:A,表皮呈黄色;B,表皮粗糙;C,纵向开裂图2 黄瓜茎基腐病田间发病症状
2.2.2人工接种发病症状 其他菌株接种黄瓜和南瓜后均未发病。用菌株CL0307接种黄瓜后,在茎基部出现黄色水浸状病斑,绕颈一周后,黄瓜倒伏,干枯,死亡,发病率为75%,死亡率60%(图3A)。将该菌株接种到南瓜茎基部,病情发展比黄瓜缓慢,初期南瓜叶片叶尖和叶缘呈现黄色,茎基部逐渐变色,干枯,死亡,发病率为80%,死亡率20%(图3B)。清水对照均未发病,因此确定CL0307为黄瓜茎基腐病的致病菌。

注:A,南瓜发病症状;B,黄瓜发病症状;C,黄瓜和南瓜清水对照图3 人工接种后南瓜和黄瓜的发病症状
2.3 病原菌的鉴定
在PDA培养基上25 ℃黑暗条件下培养4 d,白色菌落,菌丝层致密,菌落直径为38~45 mm,后期培养基呈淡紫色。大型分生孢子数量少,细长,镰刀型,向两端渐尖,稍弯曲,足细胞有或无,具2~5个真隔膜,多数为3个,大小为22.5~40.0 μm × 2.5~4.0 μm。PDA上产生大量的小型分生孢子,在产孢细胞顶端串生或假头生,大小为5.0~17.5 μm × 2.0~3.0 μm。未见到有厚垣孢子(图4)。ITS序列比对结果显示,菌株CL0307与Fusariumverticillioide(登录号KF031434.1和LN482457.1)序列相似性为100%(图5)。结合菌株形态及分子鉴定结果,黄瓜茎基腐病的病原菌确定为轮状镰孢菌(Fusariumverticillioide)。
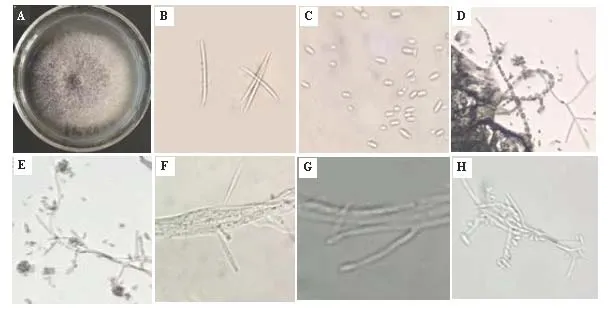
注:A,菌落形态;B,分生孢子座上大型分生孢子;C,小型分生孢子;D,链生小孢子;E,假头生小孢子;F-~H,复瓶梗图4 菌株CL0307的特征
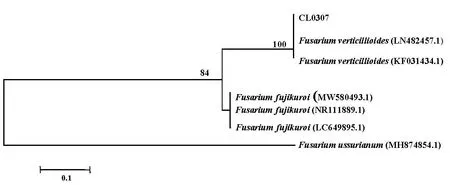
图5 拟轮枝镰孢菌(Fusarium verticillioides)的系统发育树
2.4 病原菌的生物学特性
2.4.1pH对拟轮枝镰孢菌生长的影响 拟轮枝镰孢菌菌落直径在pH为4.0和12.0时分别为4.58 cm和4.18 cm,显著低于pH为5.0和6.0时的菌落直径(表1)。拟轮枝镰孢菌只在pH为5.0和6.0时产生大型分生孢子,数量分别为0.83×107个·mL-1和0.33×107个·mL-1。小型分生孢子数量以pH为5.0时最多,显著高于其他pH的数量。
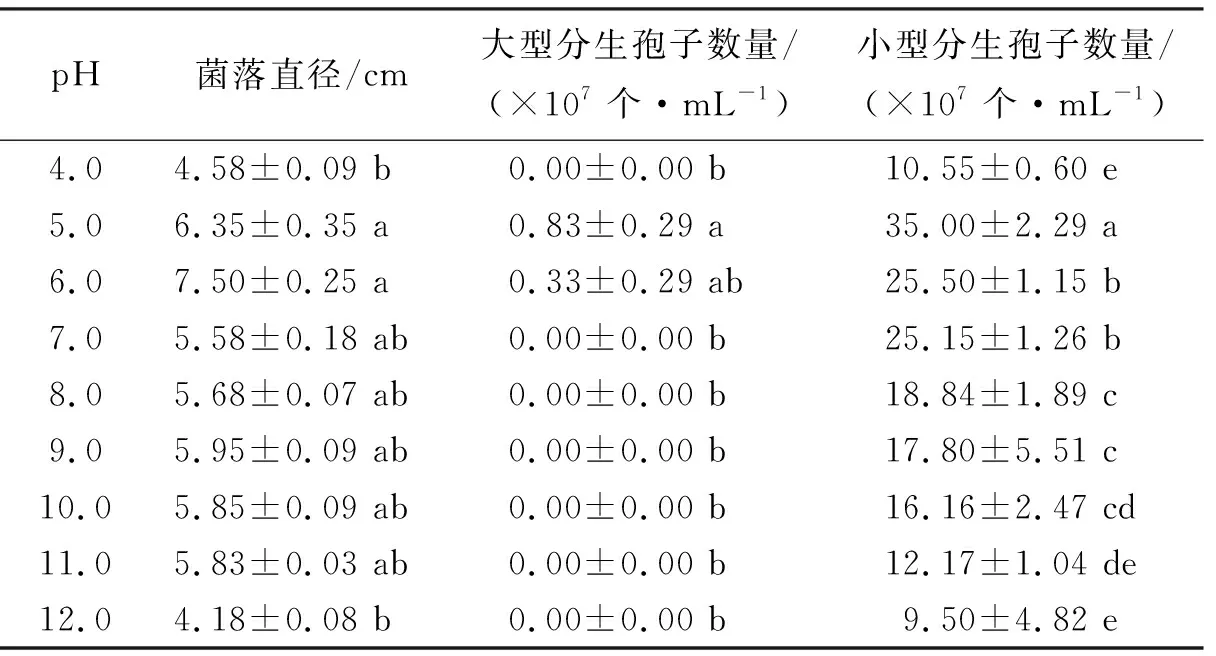
表1 pH对拟轮枝镰孢菌生长的影响
2.4.2温度对拟轮枝镰孢菌生长的影响 拟轮枝镰孢菌在15~30 ℃范围内随着温度升高,菌丝生长速度加快,菌落直径逐渐增大;30 ℃菌落直径为8.08 cm(表2);35 ℃以上菌丝生长开始受到抑制,35 ℃时菌落直径仅2.08 cm;40 ℃菌丝停止生长。拟轮枝镰孢菌的大型分生孢子生长最适温度为25 ℃,数量达到1.25×106个·mL-1,其次是30 ℃,数量为1.08×106个·mL-1,二者差异显著。小型分生孢子生长的适宜温度为30 ℃,数量达到17.33×107个·mL-1,显著高于其他温度的小型分生孢子数量。
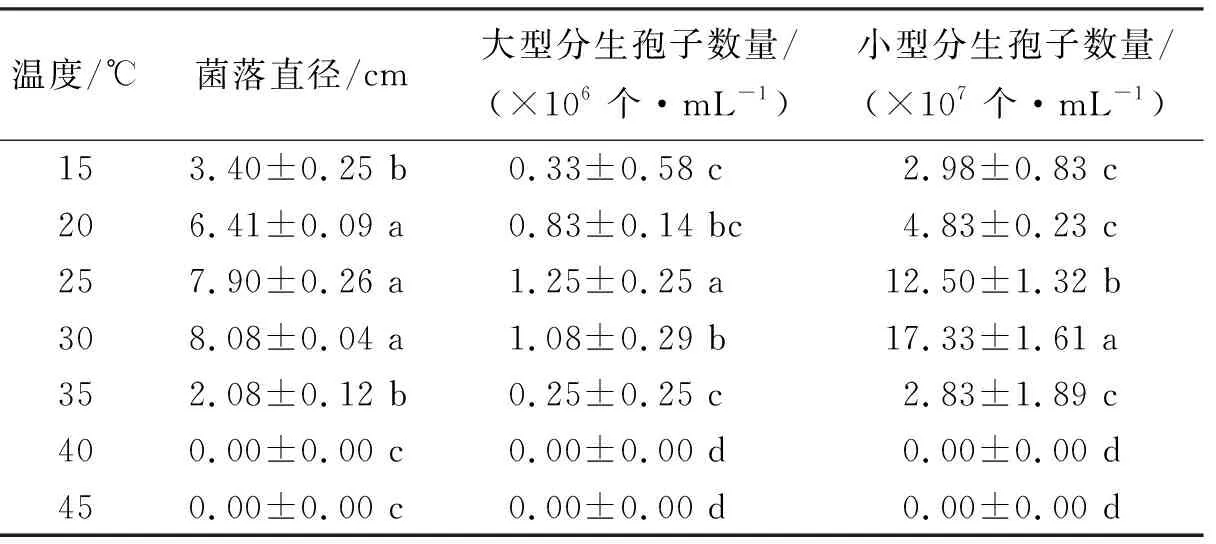
表2 温度对拟轮枝镰孢菌生长的影响
2.4.3碳源对拟轮枝镰孢菌生长的影响 碳源为淀粉时菌落直径为5.65 cm,显著低于其他碳源培养基生长速度,所有碳源上拟轮枝镰孢菌的菌落直径差异均不显著(表3)。拟轮枝镰孢菌大型分生孢子和小型分生孢子的数量均以蔗糖为碳源的培养基上最多,分别为10.00×106个·mL-1和70.83×107个·mL-1,均显著高于其他碳源的分生孢子数量。
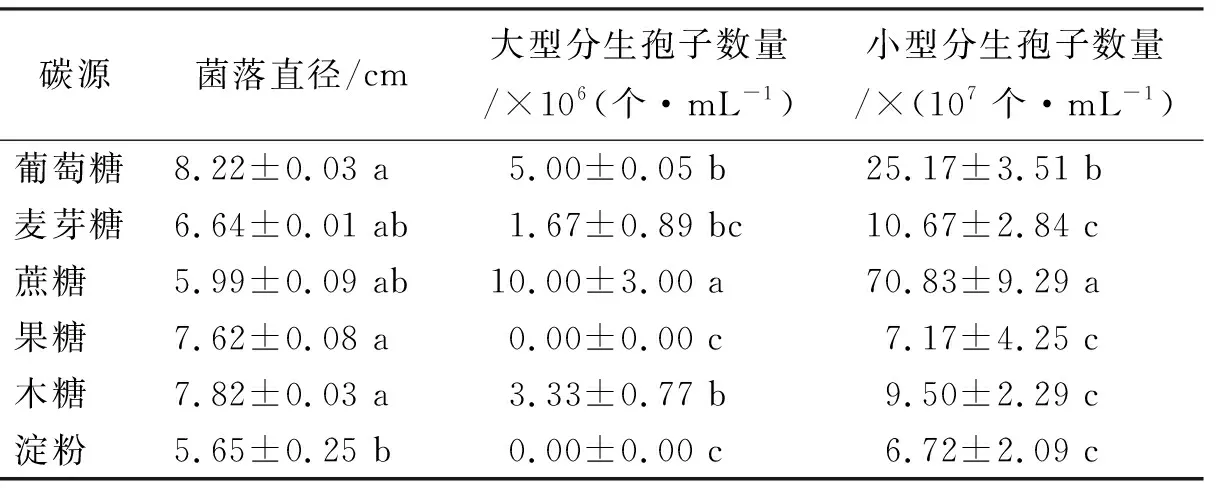
表3 碳源对拟轮枝镰孢菌生长的影响
2.4.4氮源对拟轮枝镰孢菌生长的影响 NH4NO4和(NH4)2SO4有利于拟轮枝镰孢菌菌丝生长,菌落直径分别为7.08 cm和6.62 cm,显著高于其他氮源菌丝生长速度(表4)。NH4NO4均适合于拟轮枝镰孢菌大型分生孢子和小型分生孢子生长,产孢量分别为16.67×106个·mL-1和11.67×107个·mL-1,显著高于其他氮源的分生孢子数量。
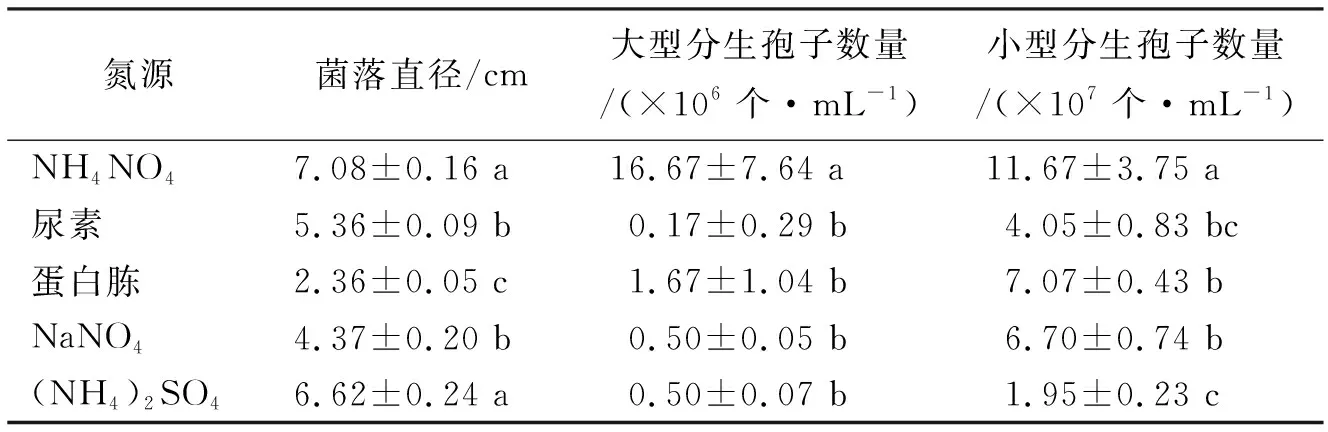
表4 氮源对拟轮枝镰孢菌生长的影响
2.4.5拟轮枝镰孢菌的致死温度 拟轮枝镰孢菌菌丝在69 ℃水浴锅中处理10 min后不再生长,因此确定拟轮枝镰孢菌的致死温度为69 ℃(表5)。
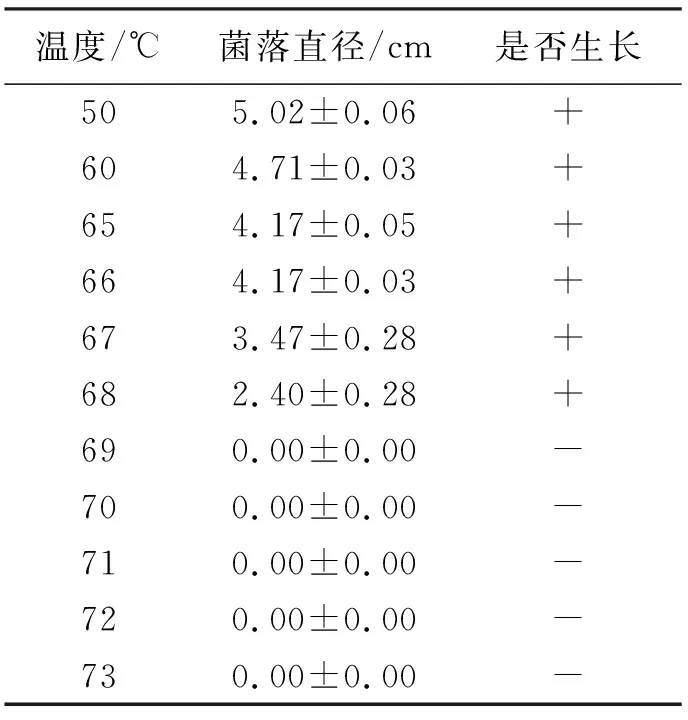
表5 拟轮枝镰孢菌菌丝致死温度
3 结论与讨论
镰孢菌是引起枯萎病、根腐病、茎腐病、顶腐病等根、茎、叶部病害的重要病原菌[8~16],造成作物、蔬菜、果树、中药材的产量下降和品质降低,其中拟轮枝镰孢菌(F.verticillioides)不仅是黄瓜茎基腐病的病原菌,也是甜瓜枯萎病[17]和番木瓜根腐茎腐病[18]的一种新的致病菌。拟轮枝镰孢菌是由串珠镰孢菌(Fusariummoniliforme)更名过来的,与藤仓镰孢菌也有密切关系[19],串珠镰孢菌侵染玉米茎秆后,随着体外气流传播到玉米穗后引起穗腐病[20]。刘树森等[21]报道,引起黄淮海夏玉米主产区玉米穗腐病的主要致病菌包括拟轮枝镰孢菌(F.verticillioides)、禾谷镰孢菌(Fusariumgraminearum)、层出镰孢菌(Fusariumproliferatum)、木贼镰孢菌(Fusariumequiseti)及藤仓镰孢菌(Fusariumfujikuroi),其中拟轮枝镰孢是主要致病菌。昌黎旱黄瓜茎腐病的病原菌与玉米茎腐病和穗腐病的病原菌相同,可能与该地区普遍采用玉米地土壤育苗有关。
生物学特性表明拟轮枝镰孢菌丝最适生长温度为30 ℃,最适pH为6.0,最适碳源为葡萄糖,最适氮源为NH4NO3,致死温度为69 ℃,这与郭成等[22]报道基本一致。因镰孢菌形态变化较大,且土壤环境因素复杂,连作也会造成病原菌菌源积累[23]。因此,关注拟轮枝镰孢与其他种类镰孢菌的种群动态变化是防治该病害的关键因素之一,还需要进一步研究。
