动态增强CT对原发性肝癌微血管侵犯的预测价值
2023-10-09张志李进涛刘朝敏
张志,李进涛,刘朝敏
1 成都医学院第一附属医院放射科,成都610500;2 中部战区总医院第四派驻门诊部;3 成都医学院第一附属医院肿瘤科
肝细胞癌(HCC)为最常见的肝脏原发性恶性肿瘤,治疗方案首选肝切除及肝移植,但术后5年复发率较高[1]。HCC术后复发与原发癌细胞肝内转移、微血管侵犯(MVI)等有关[2],但目前的研究多集中于癌细胞肝内转移,有关MVI的相关研究较少。已有研究证实,MVI是HCC术后早期复发的危险因素之一,也是影响患者术后生存的重要因素[3]。目前,临床尚无HCC术前有效评估MVI发生的手段,术后组织病理学仍是MVI诊断的金标准,因此如何通过影像学手段在术前有效预测HCC患者是否存在MVI成为当前的研究热点[4]。已有肝动脉造影CT、动态增强磁共振、超顺磁性对比剂增强磁共振等检查用于HCC术前MVI的评估,但基于动态增强CT构建模型或评分系统预测HCC患者MVI更加经济实用。为此,本文就动态增强CT对HCC患者MVI的预测价值进行了研究。
1 资料与方法
1.1 临床资料 选取成都医学院第一附属医院2019年5月—2021年5月收治的92例HCC患者,男72例,女20例,年龄33~78岁;肝功能Child-pugh分级:A级81例、B级7例、C级4例;合并疾病:糖尿病13例、乙型肝炎42例、酒精性肝炎17例、肝硬化29例。纳入标准:①行根治性手术切除,术后病理证实为HCC,且为单发肿瘤;②治疗前1个月内进行CT动态增强扫描;③CT检查前未进行射频消融等相关肿瘤治疗;④有MVI病理分级的评估资料。排除标准:①有其他系统肿瘤病史者;②出现肺、骨转移等远处转移者;③CT图像有明显伪影或增强扫描期图像不全者;④临床资料不完整者。
1.2 术前动态增强CT检查 患者常规禁食4 h后进行CT检查,检查前10 min口服清水500 mL。采用Siemens 128层螺旋CT机,扫描层厚6 mm,螺距5 mm,电压120 kV,180~240 mAs,矩阵512×512。先行全肝CT平扫,由膈顶扫描至肝下缘,确定肿瘤位置和大小。用单筒高压注射器以2.5~3.5 mL/s流率注入80 mL碘帕醇对比剂行肝脏三期扫描,可根据体形酌情调整碘帕醇剂量,但不少于1.5 mL/kg。扫描时间:肝动脉期25~30 s,门静脉期50~60 s,延迟期180~200 s,三期扫描参数相同。调整窗宽(250~300 HU)和窗位(40~80 HU),使肿瘤得到显示清晰,由2名高年资放射诊断医师对以下项目进行观察并判定。①病灶大小:病灶最大层面直径;②肿瘤边缘:门静脉期,肿瘤周围边界清楚为光滑;肿瘤周围边缘不清,呈浸润性生长或周边多发结节或毛刺,为不光滑;③包膜:延迟期肿瘤周围可见一层包裹肿瘤的较薄线性强化影,则为有包膜(包括完整与不完整),否则为无包膜;④瘤周强化:动脉期肿瘤周边出现明显强化灶,且延迟期相较于邻近肝脏实质则出现密度减低;⑤低密度晕征:门脉期肿瘤周围出现低密度环,部分或完全地包围肿瘤;⑥瘤内动脉:动脉期肿瘤内持续存在的散在动脉血管强化表现;⑦癌灶动脉期强化率:(癌灶动脉期CT值-癌灶平扫CT值)/癌灶平扫CT值×100%;⑧癌灶动脉期CT值百分比:邻近正常肝实质动脉期CT值/癌灶动脉期CT值×100%;⑨癌灶门脉期CT值百分比:邻近正常肝实质门脉期CT值/癌灶门脉期CT值×100%。癌灶感兴趣区域(ROI)选取方法:横断位上肿瘤最大层面,避开液化坏死区,ROI面积尽可能大。邻近正常肝实质ROI选取方法:避开肉眼可分辨的血管及胆管,动脉期、门脉期肝实质均匀强化,且距离癌灶至少1 cm,圆形ROI直径为1~2 cm。
1.3 MVI病理诊断及其分组 肝癌的病理诊断参考《原发性肝癌规范化病理诊断方案专家共识》[5]。手术标本在离体30 min内送达病理科,沿肿瘤最大径每隔1 cm剖面切开并置于甲醛溶液中固定。采用“7点取材法”取材,由2名高年资病理专家进行判定,重点观察包膜、MVI情况。根据Edmondson Steiner分类判定肿瘤分化程度,以显微镜下内皮细胞衬覆的血管腔内癌细胞集簇巢团且脉管腔内悬浮癌细胞数目≥50个判定为MVI。MVI病理分级:未发现MVI,为M0;MVI≤5个,且出现于近癌旁肝组织,为M1;MVI>5个或发生于远癌旁肝组织,为M2。将M0患者纳入非MVI组,将M1+M2患者纳入MVI组。
1.4 统计学方法 采用SPSS19.0软件进行统计处理。计量资料符合正态分布以表示,组间比较采取独立样本t检验;计数资料采用例(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 MVI与非MVI患者的一般临床特点 92例HCC患者,MVI病理分级为M0级36例、M1级40例、M2级16例,最终分为MVI组56例、非MVI组36例。两组年龄、性别、Child Pugh分级、糖尿病、乙型肝炎、酒精性肝炎、肝硬化情况比较,差异无统计学意义(P均>0.05)。见表1。

表1 MVI组与非MVI组一般资料比较[例(%)]
2.2 MVI组与非MVI组增强CT特征 两组瘤周强化、低密度晕征的比较差异无统计学意义(P均>0.05)。MVI组肿瘤直径>5 cm、肿瘤边缘不光滑、无包膜、存在瘤内动脉的占比以及癌灶动脉期CT值百分比、癌灶门脉期CT值百分比高于非MVI组,癌灶动脉期强化率低于非MVI组,差异均有统计学意义(P均<0.05)。见表2。
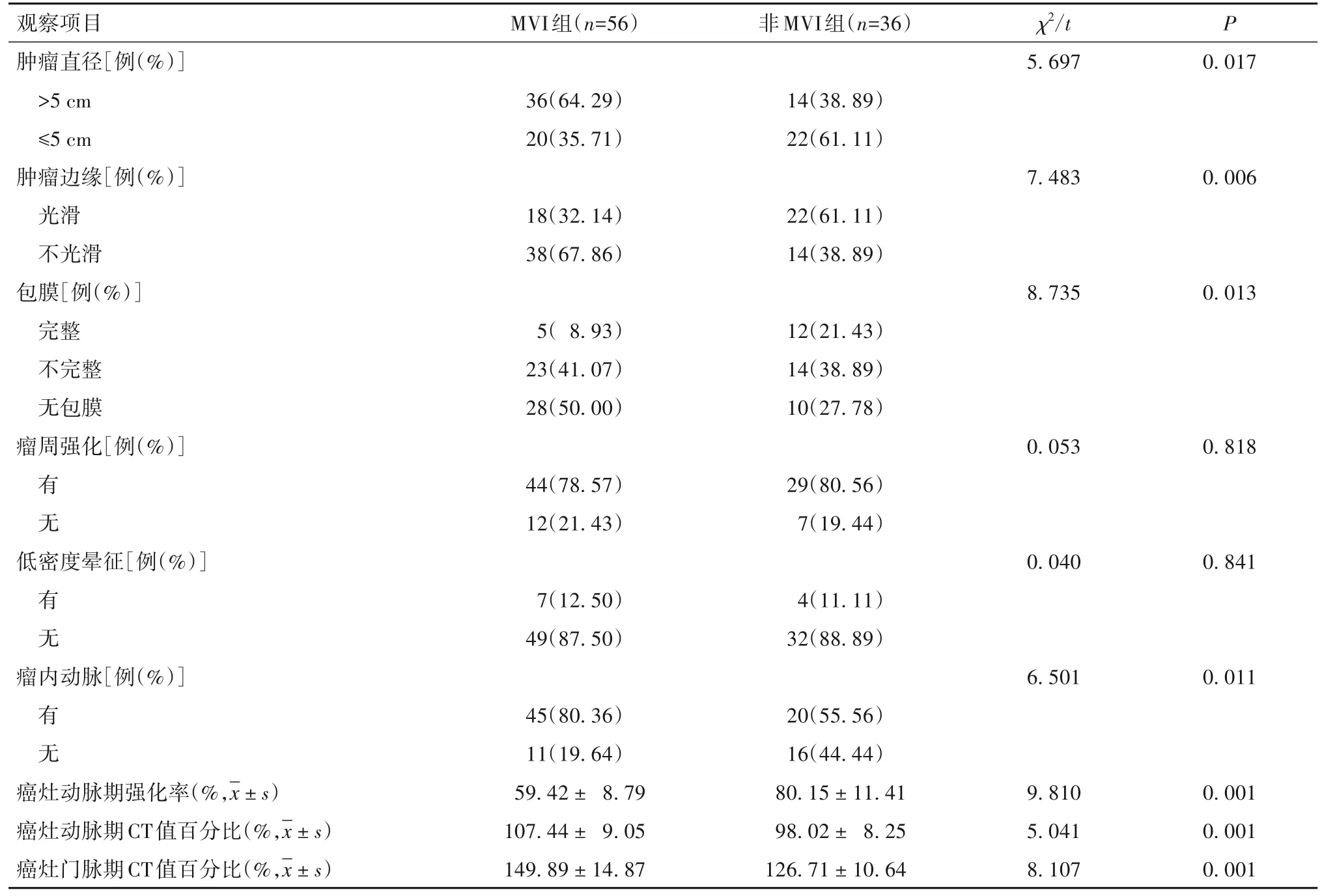
表2 MVI组与非MVI组增强CT特征比较
2.3 MVI的影响因素 以病灶是否存在MVI作为因变量(MVI=1,非MVI=0),以两组有统计学意义的变量作为自变量进行多因素Logistic回归分析,结果显示肿瘤直径、肿瘤边缘、瘤内动脉是MVI的影响因素(P均<0.05)。见表3。
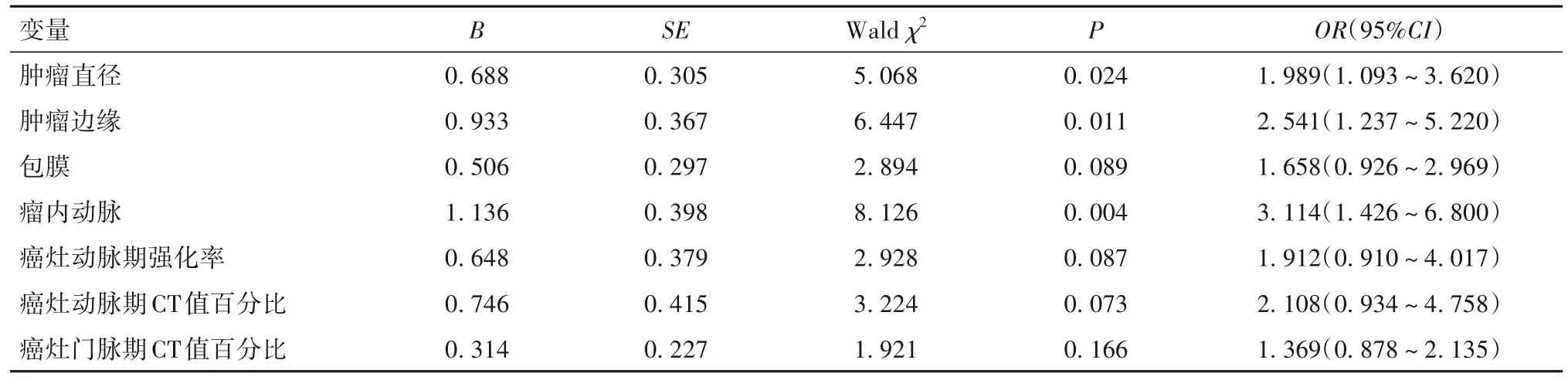
表3 HCC患者MVI影响因素的多因素Logistic回归分析
2.4 动态增强CT预测MVI评分模型 根据多因素Logistic回归分析结果构建动态增强CT预测HCC患者MVI预测方程,并由此得到MVI评分模型的评分体系,即肿瘤直径>5 cm=1分,肿瘤边缘不光滑=1分,有瘤内动脉=2分,总分0~4分。同时,建立HCC患者MVI的预测概率公式(β0:常数项,βm:回归模型中最小的回归系数)。根据公式计算出HCC患者MVI的预测概率,显示MVI的预测发生率随模型评分的升高而升高。见表4。绘制评分模型预测MVI的ROC曲线,曲线下面积为0.932(95%CI为0.814~0.985),显示评分模型对HCC患者MVI有较高的预测价值。
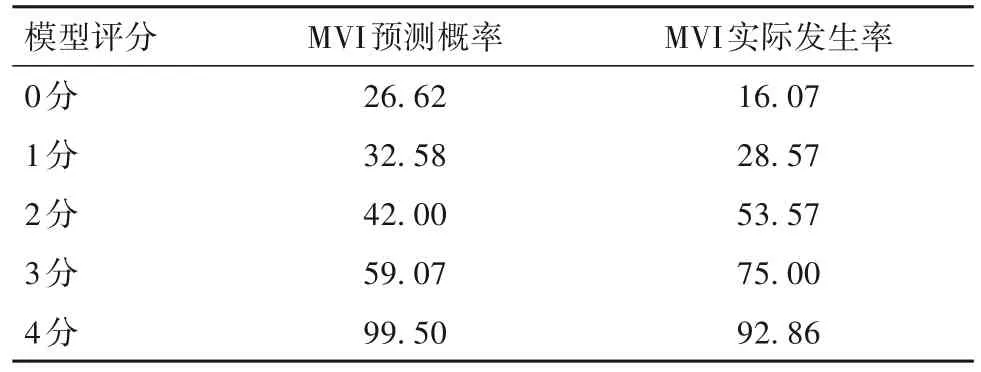
表4 模型评分预测MVI的概率及MVI实际发生率(%)
3 讨论
肝内小血管主要由内皮细胞构成,而内皮细胞被纤维连接蛋白及纤维蛋白原组成的基底膜包绕。当细胞外基质被降解时,细胞间黏附及组织完整性随之大幅降低,此为肿瘤细胞侵入微小血管创造了条件[6-7]。有研究认为,侵入血管的肿瘤细胞免疫逃逸也会明显增强,从而增加形成转移灶的风险[8-9]。因此,HCC患者发生MVI被认为与肿瘤局部侵袭、远处转移有关,可导致肿瘤早期复发,严重影响患者预后。正确评估HCC患者是否存在MVI可有效预测肿瘤术后复发风险。但是,目前MVI的诊断仅能依据术后病理检查,无法对HCC患者的术前管理提供指导[10]。
本研究依据术后病理检查将HCC患者分为MVI组与非MVI组,比较两组一般临床特点及动态增强CT特征,并进行HCC患者发生MVI的多因素Logistic回归分析。显示肿瘤直径、肿瘤边缘、瘤内动脉是MVI发生的影响因素。肿瘤大小对MVI的影响目前已得到临床认可,此与肿瘤大小可影响其侵袭行为、较大肿瘤其生物恶性程度较高有关[11]。有研究报道,肿瘤直径<3 cm、3~5 cm、>5 cm的HCC患者MVI发生率分别为25%、40%和65%,肿瘤越小,MVI发生率越低[12]。本研究结果与此报道一致。肿瘤边缘也与肿瘤的的恶性生物学行为有关,边缘不光滑(结节或毛刺)肿瘤侵袭能力更强,更易出现MVI[13]。边缘不光滑的肝细胞癌更易合并DNA多倍体,提示边缘不光滑肝细胞癌的发生和发展模式有一定特异性;尤其当多个小结节融合成一个肿瘤时,更易将诸多微小血管包裹在肿瘤内部,使MVI发生概率增大[14]。也有学者认为,边缘不光滑是肿瘤侵袭周围正常肝实质的结果,反映肿瘤生物恶性程度更高,且侵袭部位发生MVI的概率较高[15]。此外,有瘤内动脉的HCC患者更易伴发MVI,瘤内动脉密度与肿瘤病理分化程度、肿瘤细胞增殖、侵袭及血管生成等相关[16]。国外有学者从肿瘤病理及肿瘤细胞生物学行为方面研究瘤内动脉与MVI的关联性,发现存在瘤内动脉的HCC患者伴发MVI的风险是无瘤内动脉HCC患者的2.5倍[17]。本研究基于动态增强CT的多因素Logistic回归分析结果建立囊括所有影响因素的评分模型,结果显示当模型评分升高时,MVI风险也增大,采用该模型预测HCC患者发生MVI的ROC曲线下面积为0.932(95%CI为0.814~0.985)。该评分模型综合了动态增强CT的相关参数,将患者动态增强CT检查结果带入模型即可判断MVI危险人群,简便易行,可实现HCC患者MVI的术前评估,此为HCC患者MVI早期诊断、重点人群的监控以及手术方案的调整提供了重要参考。
综上所述,术前动态增强CT检查的肿瘤直径、肿瘤边缘、瘤内动脉等指标是影响HCC患者发生MVI的重要因素,基于上述因素建立的评分模型可有效预测患者MVI的发生概率。但需强调的是,该评分模型仅是基于动态增强CT影像学部分指标,指标分析不全面,预测MVI的发生有一定局限性。在具体临床工作中,还应针对不同患者的自身特点,综合考虑症状体征、血清学指标、影像学特点等各类因素,全面评估HCC患者MVI发生的可能性,然后选择最佳治疗方案。
