骨髓增生异常综合征患者血清miR-125b-5p、miR-17-5p表达变化及其与临床特征和预后的关系
2023-10-09姜铭徐娟贲海祥丁林林尹红
姜铭,徐娟,贲海祥,丁林林,尹红
1 如皋市人民医院检验科,江苏如皋226500;2 如皋市人民医院血液内科;3 南通大学附属医院血液病研究室
骨髓增生异常综合征(MDS)是起源于造血干细胞的一组异质性髓系克隆性疾病,主要表现为病态造血或无效造血、难治性血细胞减少等。约30%MDS患者会进展为急性髓系白血病[1]。近年来,尽管去甲基化、化疗、免疫抑制剂、造血干细胞移植等治疗手段不断改进,MDS的治疗效果有所提升,但其预后依然较差,5年总体生存率仍不足30%[2]。迄今为止,MDS的发病机制仍不完全清楚。微小核糖核酸(miRNA)是一类由20~24个核苷酸组成的短链非编码RNA分子,可与目标mRNA结合并调控目标基因的表达。miRNA异常表达能够参与包括MDS在内的血液系统恶性肿瘤的发生、发展[3]。miR-125b-5p属于miR-125家族,定位于人11号染色体区域,是一种抑癌基因。有研究报道,miR-125b-5p可通过靶向抑制肿瘤蛋白D52表达抑制乳腺癌细胞的增殖、侵袭和迁移[4]。miR-17-5p属于miR-17家族,定位于人染色体13q31.3,是一种促癌基因。有研究报道,miR-17-5p可通过靶向抑制热休克蛋白B2促进结直肠癌细胞的增殖、迁移和侵袭[5]。但miR-125b-5p、miR-17-5p在MDS中作用的研究报道较少。鉴于此,本研究探讨了MDS患者血清miR-125b-5p、miR-17-5p表达变化及其与临床特征和预后的关系。现报告如下。
1 资料与方法
1.1 临床资料 选择2017年1月—2020年1月如皋市人民医院收治的MDS患者76例(观察组)。MDS诊断依据《骨髓增生异常综合征诊断与治疗中国专家共识(2014年版)》[7]。纳入标准:①符合MDS诊断标准;②初诊;③入院前未接受任何抗肿瘤治疗;④年龄>18岁。排除标准:①合并急性淋巴细胞白血病、急性髓系白血病、淋巴瘤等其他血液系统恶性肿瘤者;②合并自身免疫性疾病者;③合并严重肝肾功能障碍者;④合并严重神经或精神疾病者;⑤妊娠期或哺乳期妇女。其中,男52例、女24例,年龄53~77(68.12 ± 7.65)岁;WHO分型:病态造血(SLD)13例,多系病态造血(MLD)14例,难治性贫血(RA)18例,原始细胞增多(EB)21例,不能分类(U)10例;国际预后评分系统(IPSS-R)分级[6]:低危20例,中危23例,高危17例,极高危16例。同期选择在如皋市人民医院体检健康的志愿者32例(对照组),男19例、女13例,年龄50~78(67.95 ± 7.02)岁。两组性别、年龄具有可比性。本研究经如皋市人民医院伦理委员会批准(审批编号:KY20200161),所有研究对象或其家属知情同意并签署书面知情同意书。
1.2 血清miR-125b-5p、miR-17-5p检测 观察组入组次日,对照组体检当日,采集空腹外周静脉血3 mL,注入干燥试管中,待血液凝固后,3 204 × g离心5 min,留取上层血液,-80 ℃保存待测。采用TRIzol法提取血清总RNA,Multiskan SkyHigh微孔板分光光度计鉴定,OD260/OD280为1.8~2.0。按PrimeScript RT试剂盒说明将总RNA逆转录为cDNA。逆转录条件:42 ℃ 30 min,85 ℃ 5 min。以cDNA为模板,按SYBR Premix Ex Taq试剂盒说明进行PCR扩增。所有引物序列设计由美国Thermo Fisher Scientific公司完成。引物序列:miR-125b-5p上游引物5′-TCCCTGAGACCCTAACTTGTGA-3′、下游引物5′-AGTCTCAGGGTCCGAGGTATTC-3′;miR-17-5p上游引物5′-TCTAGATCCCGAGGACTG-3′、下游引物5′-ATCGTGACCTGAACC-3′;β-actin上游引物5′-TGTCCACCTTCCAGCAGATGT-3′、下游引物5′-GCTCAGTAACAGTCCGCCTAGA-3′。PCR反应体系共50 µL:cDNA模板2 µL,上下游引物各1 µL,Premix Ex Taq DNA聚合酶25 µL,RNase-Free ddH2O 21 µL;反应条件:95 ℃ 2 min,95 ℃ 15 s、60 ℃ 30 s共40个循环。扩增反应结束,获取循环阈值(CT)。以β-actin为内参,采用2-ΔΔCT法计算目的基因相对表达量。
1.3 随访 MDS患者均接受化疗(小剂量阿糖胞苷基础上联合阿克拉霉素或高三尖杉酯碱或去甲氧柔红霉素)、支持对症治疗(输血、血小板,粒细胞集落刺激因子升白细胞治疗)等,完成足够疗程化疗且无严重并发症,病情平稳后出院。出院后通过电话和门诊复查形式定期随访3年,第1、2年每3个月随访一次,第3年每6个月随访一次。随访截至2023年1月。统计3年无进展生存率和总体生存率。无进展生存期定义为从开始治疗至观察到疾病进展或因任何原因死亡的时间,总体生存期定义为从开始治疗至因任何原因死亡的时间。
1.4 统计学方法 采用SPSS25.0统计软件。符合正态分布的计量资料以表示,结果比较采用单因素方差分析或独立样本t检验。计数资料比较采用χ2检验。生存分析采用Kaplan-Meier法,生存率比较采用Log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组血清miR-125b-5p、miR-17-5p表达比较 观察组血清miR-125b-5p、miR-17-5p相对表达量分别为1.02 ± 0.24、3.65 ± 1.24,对照组分别为2.97 ±0.75、1.52 ± 0.33。观察组血清miR-125b-5p相对表达量低于对照组,血清miR-17-5p相对表达量高于对照组(t分别为20.425、9.552,P均<0.05)。
2.2 血清miR-125b-5p、miR-17-5p表达与MDS患者临床特征的关系 见表1。
表1 血清miR-125b-5p、miR-17-5p表达与MDS患者临床特征的关系()
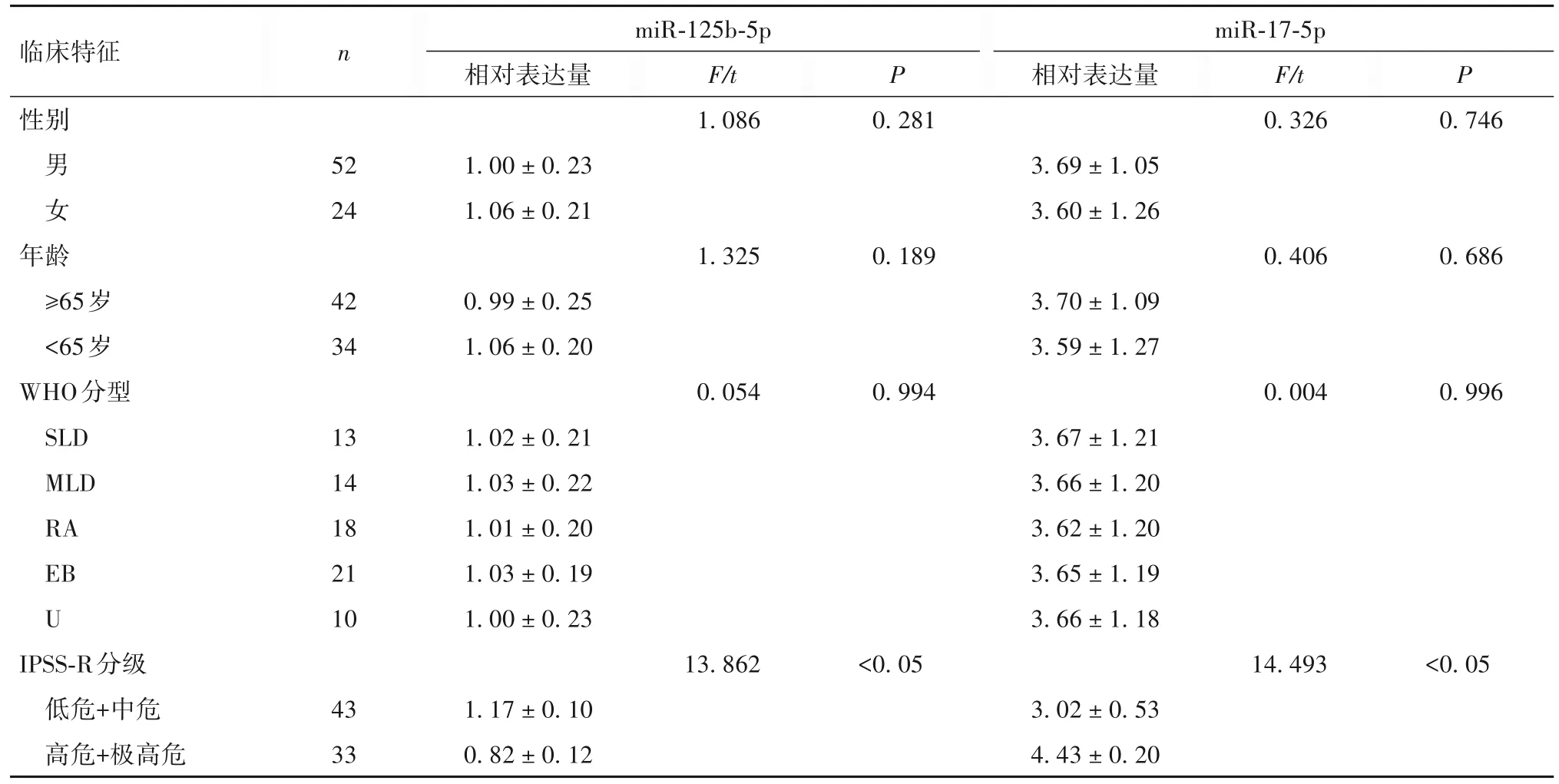
表1 血清miR-125b-5p、miR-17-5p表达与MDS患者临床特征的关系()
临床特征性别男女年龄≥65岁<65岁WHO分型SLD MLD RA EB U IPSS-R分级低危+中危高危+极高危n miR-125b-5p相对表达量P miR-17-5p相对表达量P F/t 1.0860.281 F/t 0.3260.746 52 24 1.00 ± 0.23 1.06 ± 0.21 3.69 ± 1.05 3.60 ± 1.26 1.3250.1890.4060.686 42 34 0.99 ± 0.25 1.06 ± 0.20 3.70 ± 1.09 3.59 ± 1.27 0.0540.9940.0040.996 13 14 18 21 10 1.02 ± 0.21 1.03 ± 0.22 1.01 ± 0.20 1.03 ± 0.19 1.00 ± 0.23 3.67 ± 1.21 3.66 ± 1.20 3.62 ± 1.20 3.65 ± 1.19 3.66 ± 1.18 13.862<0.0514.493<0.05 43 33 1.17 ± 0.10 0.82 ± 0.12 3.02 ± 0.53 4.43 ± 0.20
2.3 血清miR-125b-5p、miR-17-5p表达与MDS患者预后的关系 随访截至2023年1月,失访3例,死亡33例,复发16例。以血清miR-125b-5p、miR-17-5p表达的均数为临界值,将MDS患者分为血清miR-125b-5p低表达者(<1.02,39例)与血清miR-125b-5p高表达者(≥1.02,34例)、血清miR-17-5p低表达者(<3.65,35例)与血清miR-17-5p高表达者(≥3.65,38例)。血清miR-125b-5p低表达者与血清miR-125b-5p高表达者3年总体生存率分别为41.03%(16/39)、70.59%(24/34),3年无进展生存率分别为17.95%(7/39)、50.00%(17/34);血清miR-17-5p低表达者与血清miR-17-5p高表达者3年总体生存率分别为62.86%(22/35)、47.37%(18/38),3年无进展生存率分别为42.86%(15/35)、23.68%(9/38)。血清miR-125b-5p低表达者3年总体生存率和3年无进展生存率均低于血清miR-125b-5p高表达者(Log-rankχ2分别为5.815、12.030,P均<0.05),血清miR-17-5p低表达者3年总体生存率和3年无进展生存率均高于血清miR-17-5p高表达者(Log-rankχ2分别为4.557、6.237,P均<0.05)。
3 讨论
作为一种抑癌基因,miR-125b-5p在恶性肿瘤的发生、发展和治疗耐药中发挥重要作用。在胰腺癌中,miR-125b-5p可通过抑制己糖激酶2、丙酮酸激酶肌肉同工酶2表达,阻止有氧糖酵解,降低葡萄糖发酵速率,进而抑制胰腺癌细胞增殖[8]。miR-125b-5p过表达可通过靶向黏附连接蛋白KIAA1522抑制乳腺癌细胞的增殖、侵袭和迁移[9]。miR-125b-5p还可靶向己糖激酶2抑制磷脂酰肌醇3-激酶/蛋白激酶B信号通路,继而抑制膀胱癌细胞的增殖和侵袭[10]。miR-125b-5p与血液系统恶性肿瘤也存在一定关联。有研究报道,miR-125b-5p在白血病细胞中表达下调,上调miR-125b-5p表达可通过靶向抑制其下游靶标人髓细胞白血病基因1,抑制白血病细胞增殖并促进其凋亡[11]。本研究结果发现,MDS组血清miR-125b-5p相对表达量低于对照组;IPSS-R分级高危+极高危MDS患者血清miR-125b-5p表达低于IPSS-R分级低危+中危MDS患者;血清miR-125b-5p低表达者3年总体生存率和3年无进展生存率均低于血清miR-125b-5p高表达者。提示miR-125b-5p能够参与MDS的发生、发展。目前,miR-125b-5p参与MDS的分子机制尚不清楚。有研究认为,Janus激活激酶2(JAK2)和信号传导与转录激活因子3(STAT3)信号通路激活促使细胞周期G0/G1期进展,下调抗凋亡基因的表达,增强MDS细胞的增殖活性[12],而STAT3的3′-UTR区域存在miR-125b-5p的结合位点[13],miR-125b-5p可通过抑制JAK2/STAT3信号通路,从而抑制MDS的发生、发展。因此,miR-125b-5p表达缺失可能促进MDS的发生、发展并导致患者预后不良。
miR-17-5p可通过靶向抑制基质金属蛋白酶组织抑制剂2促使基质金属蛋白酶表达,进而促进胃癌细胞的增殖、侵袭和迁移[14]。miR-17-5p还可靶向抑制CADM2表达激活促肿瘤表型,从而促进结肠癌细胞的增殖、侵袭和迁移[15]。近年发现,miR-17-5p还能参与血液系统肿瘤的发生、发展。有研究报道,miR-17-5p可通过调控BCL11B过表达诱导急性淋巴细胞白血病细胞增殖并抑制其凋亡[16]。本研究结果发现,MDS组血清miR-17-5p相对表达量高于对照组;IPSS-R分级高危+极高危MDS患者血清miR-17-5p表达高于IPSS-R分级低危+中危MDS患者;血清miR-17-5p低表达者3年总体生存率和3年无进展生存率均高于血清miR-17-5p高表达者。提示miR-17-5p能够参与MDS的发生、发展。究其原因,组蛋白赖氨酸甲基转移酶SETD2表达缺失可激活丝裂原活化蛋白激酶信号通路,促使S100钙结合蛋白A9表达,诱导MDS向急性髓系白血病进展,从而导致MDS患者预后不良[17]。SETD2是miR-17-5p的靶基因,miR-17-5p可负向调控SETD2表达,促使MDS细胞增殖并抑制其凋亡[18],最终导致MDS恶性进展和预后不良。
综上所述,MDS患者血清miR-125b-5p表达下调、血清miR-17-5p表达上调,二者表达变化与IPSS-R分级高危、极高危以及预后不良有关。
