沉默CCND1对肝细胞癌细胞5-氟尿嘧啶耐药性的影响及机制
2023-10-09阮起超陈松芝丁浩孙国芳汪杨
阮起超,陈松芝,丁浩,孙国芳,汪杨
1 南昌大学第二附属医院消化内科,南昌330006;2 南昌大学第二附属医院心电诊断室
肝细胞癌(HCC)是常见的原发性肝癌[1-2],具有复发率高和对抗癌药物耐药的特点,治疗效果较差。5-氟尿嘧啶(5-Fu)是治疗HCC的药物之一,因获得性耐药限制了其临床使用。探究HCC的5-Fu耐药机制具有重要临床意义。细胞周期蛋白D1(CCND1)基因编码全酶的一个不稳定调控亚基,参与协调细胞周期的DNA合成阶段和线粒体生物合成[3]。高表达的癌基因CCND1与HCC等多种恶性肿瘤的复发和预后不良有关[4-7]。体外实验发现,沉默CCND1可抑制HCC细胞增殖,抑制HCC生长[7]。然而,关于这一癌基因与HCC化疗耐药之间的相关性尚不清楚。因此,2021年1月—2022年12月,本研究探讨沉默CCND1对HCC细胞5-Fu耐药性的影响及机制。
1 材料与方法
1.1 细胞、试剂及仪器 HCC细胞系(SMMC-7721、HepG2细胞)购自中国科学院细胞库;CCND1-siRNA和NC-siRNA购自上海吉玛制药技术有限公司;TRIzol试剂和Lipofectamine®2000购自美国Invitrogen公司;FACS Calibur™流式细胞仪购自美国BD Biosciences公司;荧光分析仪购自芬兰Thermo Fisher Scientific公司;CCK-8试剂盒购自上海碧云天生物技术有限公司;FITC/PI凋亡检测试剂盒购自美国Sigmae-Aldrich公司;I抗CCND1、磷酸化组蛋白(γ-H2AX)、同源重组修复蛋白(RAD51)和β-actin购自美国Abcam公司。
1.2 细胞培养、转染及5-Fu暴露 将HCC细胞置于杜氏改良Eagle培养基中,并加入10%胎牛血清、100 mg/mL链霉素、100 U/mL青霉素于增湿空气中培养。在细胞达90%融合率时,将细胞随机分别分为HepG2+NC-siRNA组、HepG2+CCND1-siRNA组和SMMC-7721+NC-siRNA组、SMMC-7721+CCND1-siRNA组,分别用靶向CCND1的siRNA(CCND1-siRNA)、阴性对照siRNA(NC-siRNA)转染细胞。转染48 h后取各组细胞置于含10 µg/mL 5-Fu的培养基中培养48 h。
1.3 CCND1 mRNA表达检测 收集转染后的各组细胞。TRIzol试剂提取总RNA,按照说明书,使用PrmeScript RT试剂盒将其反转录为cDNA,用荧光定量PCR预混液进行实时荧光定量PCR:95 ℃10 min,95 ℃ 15 s、60 ℃ 1 min循环40次。采用2-ΔΔCT法计算目的基因的相对表达量,以β-actin作为参照基因。CCND1上游引物序列5′-CCCTCGGTGTCCTACTTCAA-3′,下游引物序列5′-GTGTTCAATGAAATCGTGCG-3′;β-actin上游引物序列5′-CGGGAAATCGTGCGTGAC-3′,下游引物序列5′-TGGAAGGTGGACAGCGAGG-3′。
1.4 细胞活力检测 取各组细胞,使用CCK-8试剂盒进行细胞活力测定。将各组细胞接种至96孔板中,加入10 µL的CCK-8试剂孵育2 h,重复3次,最后用荧光分析仪测量波长450 nm处的光密度(OD)值,取3次平均值。以OD450代表细胞活力。
1.5 细胞凋亡率检测 取各组细胞,使用FITC/PI凋亡检测试剂盒检测细胞凋亡率。PBS洗涤,重悬,用FITC Annexin V和PI双重染色后,采用流式细胞仪分析细胞混合物。细胞凋亡率=流式细胞仪散点图右上象限百分率+右下象限百分率。
1.6 CCND1、DNA修复相关蛋白(γ-H2AX、RAD51)表达检测 采用Western blotting法。取转染后及5-Fu培养后各组细胞,RIPA法提取总蛋白,用BCA法测定,加入样品蛋白20 mg,10% SDS-PAGE凝胶电泳后转移至PVDF膜。分别加入CCND1(1∶1 000)、γ-H2AX(1∶1 000)、RAD51(1∶1 000)和β-actin(1∶5 000)一抗,4 ℃孵育过夜,加入HRP结合的二抗进行孵育。用化学发光法进行检测,Image J软件分析结果,目的蛋白灰度值与β-actin灰度值的比值为目的蛋白相对表达量。
1.7 统计学方法 采用GraphPad Prism7.0软件。符合正态分布的计量资料以表示,两组间比较采用t检验,多个时间点比较采用重复测量方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组CCND1 mRNA、蛋白表达比较 与HepG2+NC-siRNA组比较,HepG2+CCND1-siRNA组CCND1 mRNA、蛋白表达低(P均<0.05);与SMMC-7721+NC-siRNA组比较,SMMC-7721+CCND1-siRNA组CCND1 mRNA、蛋白表达低(P均<0.05)。见表1。
表1 各组CCND1 mRNA、蛋白表达比较()
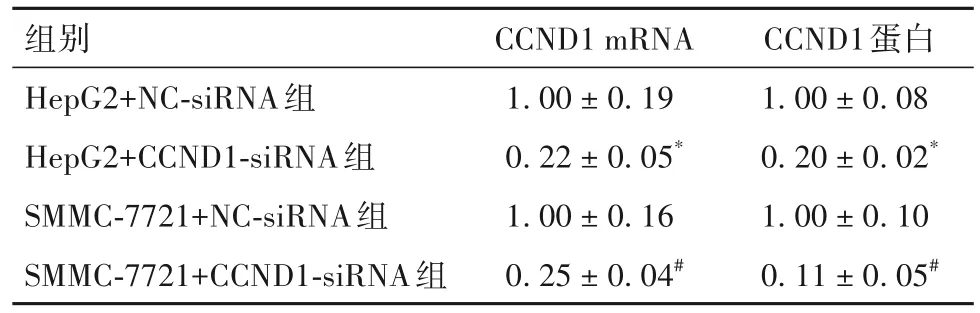
表1 各组CCND1 mRNA、蛋白表达比较()
注:与HepG2+NC-siRNA组比较,*P<0.05;与SMMC-7721+NC-siRNA组比较,#P<0.05。
CCND1蛋白1.00 ± 0.08 0.20 ± 0.02*1.00 ± 0.10 0.11 ± 0.05#组别HepG2+NC-siRNA组HepG2+CCND1-siRNA组SMMC-7721+NC-siRNA组SMMC-7721+CCND1-siRNA组CCND1 mRNA 1.00 ± 0.19 0.22 ± 0.05*1.00 ± 0.16 0.25 ± 0.04#
2.2 各组细胞活力、凋亡率比较 与HepG2+NC-siRNA组比较,HepG2+CCND1-siRNA组5-Fu暴露72 h的OD450低(P<0.05),凋亡率高(P<0.05);与SMMC-7721+NC-siRNA组比较,SMMC-7721+CCND1-siRNA组5-Fu暴露72 h的OD450低(P<0.05),凋亡率高(P<0.05)。见表2。
表2 各组5-Fu暴露下细胞活力、凋亡率比较()
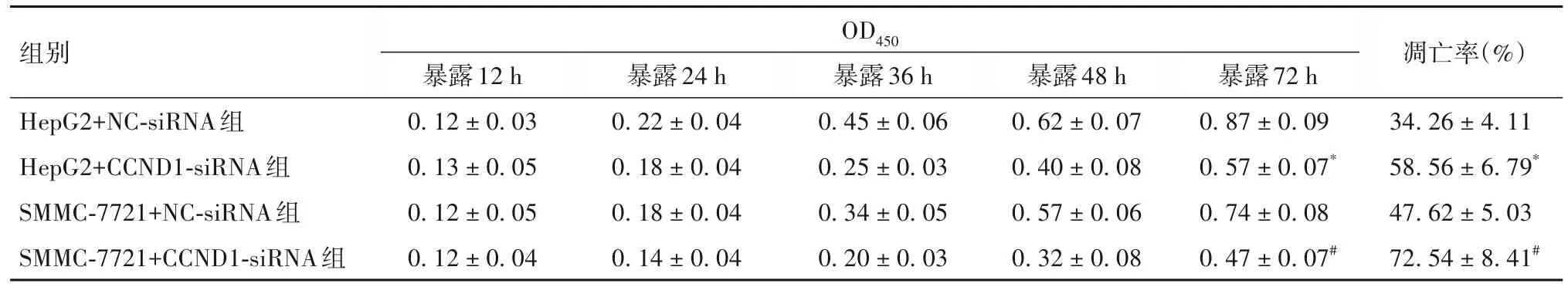
表2 各组5-Fu暴露下细胞活力、凋亡率比较()
注:与HepG2+NC-siRNA组比较,*P<0.05;与SMMC-7721+NC-siRNA组比较,#P<0.05。
组别HepG2+NC-siRNA组HepG2+CCND1-siRNA组SMMC-7721+NC-siRNA组SMMC-7721+CCND1-siRNA组凋亡率(%)34.26 ± 4.11 58.56 ± 6.79*47.62 ± 5.03 72.54 ± 8.41#OD450暴露12 h 0.12 ± 0.03 0.13 ± 0.05 0.12 ± 0.05 0.12 ± 0.04暴露24 h 0.22 ± 0.04 0.18 ± 0.04 0.18 ± 0.04 0.14 ± 0.04暴露36 h 0.45 ± 0.06 0.25 ± 0.03 0.34 ± 0.05 0.20 ± 0.03暴露48 h 0.62 ± 0.07 0.40 ± 0.08 0.57 ± 0.06 0.32 ± 0.08暴露72 h 0.87 ± 0.09 0.57 ± 0.07*0.74 ± 0.08 0.47 ± 0.07#
2.3 各组细胞DNA损伤修复相关蛋白表达比较 与HepG2+NC-siRNA组比较,HepG2+CCND1-siRNA组5-Fu暴露下γ-H2AX蛋白表达高(P<0.05),RAD51蛋白表达低(P<0.05);与SMMC-7721+NC-siRNA组比较,SMMC-7721+CCND1-siRNA组5-Fu暴露下γ-H2AX蛋白表达高(P<0.05),RAD51蛋白表达低(P<0.05)。见表3。
表3 各组5-Fu暴露下γ-H2AX、RAD51蛋白表达比较()

表3 各组5-Fu暴露下γ-H2AX、RAD51蛋白表达比较()
注:与HepG2+NC-siRNA组比较,*P<0.05;与SMMC-7721+NC-siRNA组比较,#P<0.05。
RAD51蛋白1.00 ± 0.04 0.38 ± 0.05*1.00 ± 0.08 0.23 ± 0.10#组别HepG2+NC-siRNA组HepG2+CCND1-siRNA组SMMC-7721+NC-siRNA组SMMC-7721+CCND1-siRNA组γ-H2AX蛋白1.00 ± 0.10 1.70 ± 0.19*1.00 ± 0.10 6.89 ± 0.15#
3 讨论
HCC是全球癌症死亡的第4大原因,也是肝硬化死亡的主要原因[8]。HCC的预后极差,其死亡率接近世界范围内的发病率。在我国,HCC最常见的病因是病毒性肝炎,而国外最常见的病因是酒精性肝病。目前HCC的治疗方案包括肝切除、肝移植、肝动脉化疗栓塞、化疗、免疫治疗、靶向治疗等[1,8]。化疗是HCC重要的辅助治疗方法之一,但因内在耐药或获得性耐药限制了其临床使用。HCC的耐药机制复杂,有研究表明可能与抗癌药物泵出肿瘤细胞的药物外排转运体的表达增加、DNA损伤修复能力的增强、凋亡信号通路的失活、自噬、miRNA和lncRNA失调等多种因素密切相关[9-10]。其中5-Fu是全身局部化疗过程中最常用的化疗药物,可阻断胸腺嘧啶合成,从而诱导细胞周期阻滞和细胞凋亡[11]。因此,探究HCC的5-Fu耐药机制具有重要的临床意义。
癌细胞DNA修复能力高,易放疗或化疗耐药,因此靶向DNA修复机制可能提高放疗和化疗的疗效[12-13]。作为细胞周期机制的重要组成部分,CCND1在DNA修复中起重要作用,与癌症的化疗耐药相关[14-15]。研究表明,γ-H2AX用于评估修复切口核酸酶引起的DNA链断裂,RAD51用于测量同源重组在链间修复交联的活性[16]。MARAMPON等[12]报道,沉默CCND1通过促进放疗诱导的DNA损伤而增强前列腺癌细胞的放疗敏感性。在沉默CCND1诱导的套细胞淋巴瘤细胞DNA损伤中,CCND1发挥保持基因组稳定性的重要作用[17]。ZHONG等[13]研究结果表明,沉默CCND1可以抑制RAD51并诱导细胞周期G0/G1期阻滞,从而增加BRCA1野生型卵巢癌细胞对奥拉帕利化疗的敏感性。本研究首先构建CCND1沉默模型,并通过检测CCND1 mRNA、蛋白表达验证其沉默效率。5-Fu暴露下沉默CCND1后,肝癌细胞的细胞活力下降,凋亡率上升,表明沉默CCND1增加HCC对5-Fu的敏感性。进一步研究表明,在5-Fu暴露下,沉默CCND1升高了两种肝癌细胞中γ-H2AX表达,降低了RAD51表达,这表明沉默CCND1可通过抑制癌细胞的DNA损伤修复能力参与调节癌细胞对放化疗的耐药性。
综上所述,CCND1是HCC和5-Fu抗性的关键介导因子,沉默CCND1可以通过靶向DNA损伤修复能力增强HCC细胞对5-Fu的敏感性。这一发现为5-Fu治疗难治性HCC提供了潜在治疗靶点。
