Anti-CD19Fab- (CP)3新型二聚化抗体的构建及靶向性观察
2023-10-09雷晓敏范冬梅袁向飞卢杨张砚君王建祥熊冬生
雷晓敏,范冬梅,袁向飞,卢杨,张砚君,王建祥,熊冬生
1 中国医学科学院血液病医院(中国医学科学院血液学研究所) 北京协和医学院 天津市血液病细胞治疗研究重点实验室 实验血液学国家重点实验室 国家血液系统疾病临床研究中心 细胞生态海河实验室,天津300020;2 天津医学健康研究院;3 天津市急腹症器官损伤与中西医修复重点实验室
杂交瘤技术发明前,早期抗肿瘤免疫曾多次尝试使用各种来源的免疫血清多克隆抗体,但由于抗体亲和力或者肿瘤特异性较差以及难以获得大量抗体以失败告终[1]。随着单克隆抗体技术愈发成熟,用于癌症治疗的商业单抗快速进入市场,但全长抗体分子量较大,难以穿透肿瘤组织到达肿瘤部位,且Fc段易引起非特异性结合等缺点,因此构建小分子抗体(如单价可变区片段scfv[2]、抗原结合片段Fab、单域抗体等)对于临床应用具有十分重要的意义。与单价小分子抗体相比,设计双价或多价抗体可以增强与抗原表位结合力[3-4]、减缓在体内的清除速率、延长药物代谢半衰期。目前,常见的多价抗体主要有Diabodies、Triabodies、Tetrabodies、F(ab′)2等[5-6]。近年来随着基因工程抗体技术的发展,人源化嵌合抗体可保留鼠源的抗原结合区,又可降低免疫原性,正被深入研究并广泛应用[7-8]。2021年5月—2022年6月,本课题组拟通过基因工程方式构建一种新型的二聚化比例更高的嵌合抗体,以达到增强与抗原亲和力的目的。
1 材料与方法
1.1 主要材料 PAYZ-Anti-CD19Fab载体由本室构建并保存;大肠杆菌16C9由本室保存;人B细胞淋巴瘤细胞系Raji由本室冻存,在含有10%胎牛血清及2 mmol/L的L-谷氨酰胺的RPMI1640(购于Gilbco公司)培养基中培养,培养条件为5%C02、37 ℃、饱和湿度;Protein G亲和层析柱购于GE公司;10 kD超滤浓缩管购于Merck公司;BCA定量试剂盒购于Thermo公司;PE/CY5标记的小鼠抗人IgG抗体购自abacm公司;PD-1鼠源抗体购自旷博生物;APC标记的抗鼠IgG F( ab’)2抗体购自CST公司;CD19亲本鼠源全抗购自旷博生物。
1.2 抗体的表达纯化与鉴定
1.2.1 PAYZ-Anti-CD19Fab-(CP)3、PAYZ-Anti-CD19Fab-(CPP)3的构建 PAYZ-Anti-CD19Fab载体中VL、VH分别连接在人源CL、CH1的N端,通过限制性内切酶ApaI及SphI酶切载体PAYZ-Anti-CD19Fab;利用基因克隆技术分别将合成的基因片段CH1-(CP)3、CH1-(CPP)3与载体PAYZ-Anti-CD19Fab连接,构成表达载体PAYZ-Anti-CD19Fab-(CP)3及PAYZ-Anti-CD19Fab-( CPP)3。
1.2.2 Anti-CD19Fab(-CP)3、Anti-CD19Fab(-CPP)3、Anti-CD19Fab表达 将构建好的PAYZ-Anti-CD19Fab-(CP)3、PAYZ-Anti-CD19Fab-(CPP)3、PAYZ-Anti-CD19Fab质粒各25 ng通过热激法转化至感受态大肠杆菌16C9中,随机挑取单菌落于10 mL 2-YT培养基中,37 ℃、200 r/min 振荡培养14 h。取小摇菌液2 mL接种于200 mL 2-YT培养基中,37 ℃、200 r/min振荡培养8 h;8 000 r/min,4 ℃离心30 min收集菌体弃上清,将菌体轻轻重悬于400 mL低磷AP5培养基中,37 ℃、200 r/min诱导表达24 h;8 000 r/min、4 ℃离心30 min收集菌体弃上清,将菌体在-80 ℃冰箱和室温下反复冻融3次,加入20 mL周质腔蛋白提取液重悬,冰上100 r/min,裂解1 h;8 000 r/min、4 ℃离心30 min,收集上清。
1.2.3 Anti-CD19Fab-(CP)3、Anti-CD19Fab-(CPP)3、Anti-CD19Fab的分离纯化 将所获上清于7 000 Da的透析袋中置于磷酸盐缓冲液(PBS)中4 ℃下透析24 h(每3~6 h换液1次),4 000 r/min、4 ℃离心10 min,上清经0.45 µm滤膜过滤,上样于Protein G亲和层析柱;经PB buffer平衡后用pH 2.8~3.0的甘氨酸溶液洗脱,pH 9.0的Tris-HCL缓冲液中和,于10 kDa的超滤浓缩管中浓缩并用PBS置换3次至体积为1 mL。采用PierceTMBCA蛋白分析试剂盒定量后,Anti-CD19Fab-(CP)3为3.95 mg/L, Anti-CD19Fab-(CPP)33.15 mg/L,Anti-CD19Fab为5.5 mg/L。
1.2.4 Anti-CD19Fab-(CP)3、Anti-CD19Fab-(CPP)3的二聚化鉴定 取纯化后蛋白各10 µg分别与上样缓冲液混合后于95~100 ℃金属浴中10 min,其中还原性的样品中另加入了终浓度2%的巯基乙醇,经12%SDS-PAGE、考马斯亮蓝R250染色5 min,脱色液脱色16 h以上,SDS-PAGE电泳法可显示出清晰的条带。用Image J图像分析软件对非还原电泳图进行扫描分析,可粗略得出高分子量组分在纯化后蛋白样品中所占的百分含量比。选择Anti-CD19Fab-(CP)3蛋白,采用液相色谱串联质谱法(LC-MS)进一步精确检测Anti-CD19Fab-(CP)3蛋白样品中各组分的分子量及相对含量。取Anti-CD19Fab-(CP)3纯品,于4 ℃、12 000 r/min速度下离心10 min,收集上清液至新的离心管中备用。根据设置好的液相色谱和质谱条件,完成LC-MS鉴定。
1.3 抗体对CD19高表达细胞系Raji的靶向性观察
1.3.1 Anti-CD19Fab-(CP)3、Anti-CD19Fab-(CPP)3、Anti-CD19Fab与CD19高表达细胞系Raji直接结合试验 抗体以终浓度0.135、0.675、1.35 µg/mL分别与5×105个对数生长期Raji细胞室温共孵育30 min,1 500 r/min离心8 min,弃上清,PBS洗2次;100 µL PBS重悬细胞,以PE/CY5标记的小鼠抗人IgG抗体作为二抗,每管0.8 µL,室温避光孵育30 min,1 500 r/min离心8 min,弃上清,PBS洗两次,将细胞重悬于400 µL PBS中。同时设置空白对照管及二抗对照管,FACS测定荧光强度并绘图。
1.3.2 Anti-CD19Fab-(CP)3、Anti-CD19Fab-(CPP)3、Anti-CD19Fab与CD19亲本鼠源全抗竞争结合试验 取抗体使其终浓度为9 µg/mL(低浓度)、27 µg/mL(中浓度)、81 µg/mL(高浓度),同时分别加入终浓度与抗体相同的PD-1鼠源全抗,以消除CD19亲本鼠源全抗Fc端与细胞的非特异性结合而减弱抗体竞争力的影响;再加入终浓度15 µg/mL的CD19亲本鼠源全抗,共同与5×105个对数生长期Raji细胞进行孵育。室温孵育30 min,1 500 r/min离心8 min,弃上清,PBS洗2次;200 µL PBS重悬细胞,加入APC标记的抗鼠IgG F(ab’)2抗体1 µL;室温避光孵育30 min,1 500 r/min离心8 min,弃上清,PBS洗2次,将细胞重悬于400 µL PBS中。同时设置空白对照管、阳性对照管(未竞争)、二抗对照管、非特异性同型对照管, FACS测定荧光强度。
1.4 统计学方法 采用GraphPad Prism 8.0统计软件。计量资料采用Shapiro-Wilk正态性检验呈正态分布以表示,多组间比较采用方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 Anti-CD19Fab-(CP)3、Anti-CD19Fab-(CPP)3高分子量聚体组分 SDS-PAGE电泳法显示纯化后的Anti-CD19Fab-(CP)3、Anti-CD19Fab-(CPP)3电泳条带位置均相同(见图1)。从图1a非还原条件的电泳图中可看出,与Anti-CD19Fab相比,Anti-CD19Fab-(CP)3和Anti-CD19Fab-(CPP)3均形成了高分子量的聚体(①位置对应的条带),且Anti-CD19Fab-(CP)3所形成的高分子量聚体明显高于对照蛋白Anti-CD19Fab-(CPP)3。根据Image J图像分析扫描结果,粗略得到Anti-CD19Fab-(CP)3的高分子量聚体组分在其样品中占比为(57.18± 1.17)%,而Anti-CD19Fab-(CPP)3的高分子量聚体组分在其样品中占比为(22.52± 0.96)%,二者比较差异有统计学意义(P<0.05)。此电泳结果说明引入 (CP)3结构比 (CPP)3结构更易形成高分子量聚体。

图1 三种抗体电泳图
2.2 Anti-CD19Fab-(CP)3单体、二聚体分子量 LCMS鉴定结果见图2。已知Anti-CD19Fab-(CP)3的单体氨基酸数为450,理论分子量为48 543.3 Da,与图2中②48 724.5 Da相对应,该组分为单体形式。图2中①峰分子量为97 088.4 Da,由单体理论值推测该组分为二聚体形式。另该方法鉴定结果显示:①在样品中所占比例为76.2%,②在样品中所占比例为18.4%。由于LC-MS结果可表示峰高与样品中的组分含量呈正相关,即图2标注的①、②对应图1a的①、②,聚体所占比例亦与电泳结果相符。综上结果可知,①为二聚体,②为单体。结合电泳结果可说明,相比于在CH1的C端引入的 (CPP)3结构,(CP)3结构形成的二聚体含量更高(P均<0.05)。
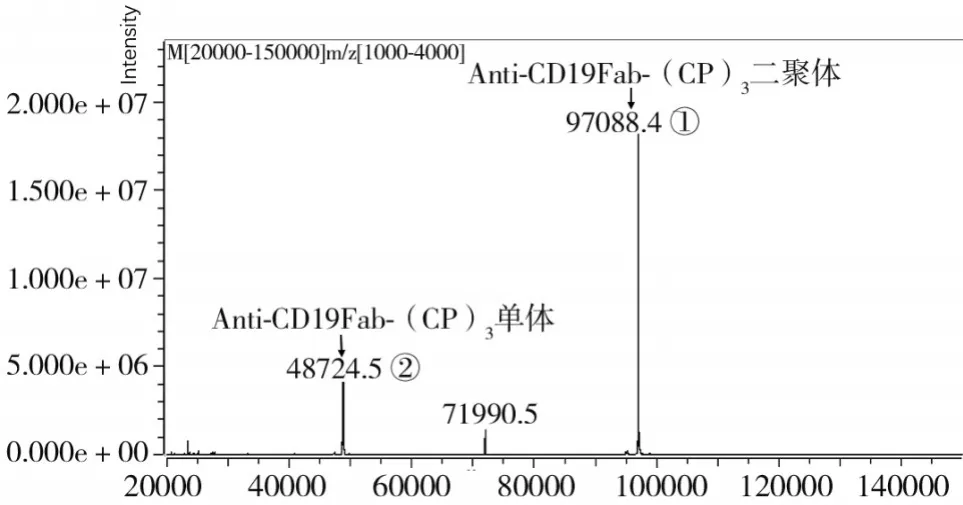
图2 Anti-CD19Fab-(CP)3单体、二聚体分子量
2.3 Anti-CD19Fab-(CP)3、Anti-CD19Fab-(CPP)3、Anti-CD19Fab与Raji细胞直接结合能力 直接结合实验表明,抗体与细胞的结合能力随抗体浓度升高呈剂量依赖性,且同浓度下Anti-CD19Fab-(CP)3亲和能力强于Anti-CD19Fab-(CPP)3及Anti-CD19Fab(P均<0.05)。见图3。
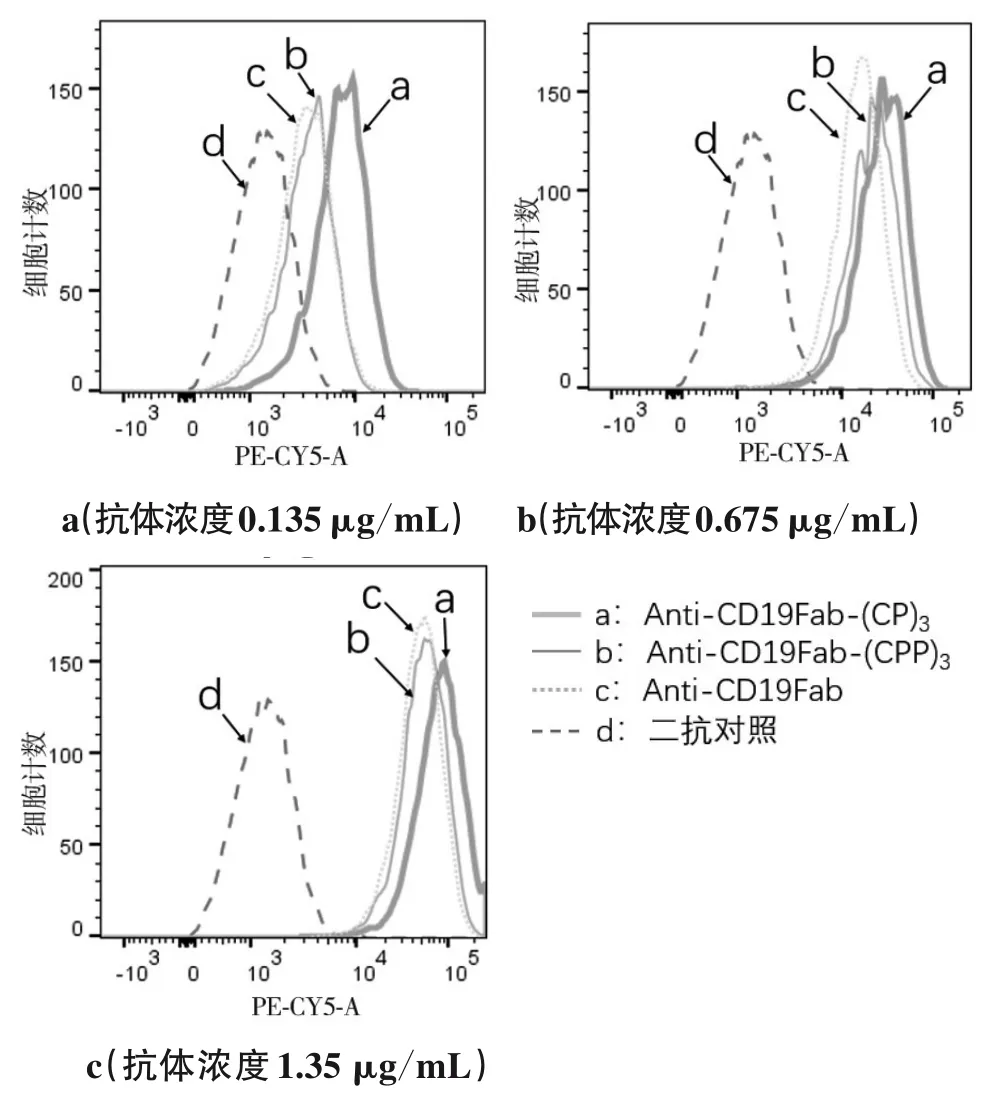
图3 不同浓度抗体与Raji细胞结合能力
2.4 Anti-CD19Fab-(CP)3、Anti-CD19Fab-(CPP)3、Anti-CD19Fab与CD19亲本鼠源全抗竞争力 竞争性免疫荧光结合实验显示,Anti-CD19Fab-(CP)3、Anti-CD19Fab-(CPP)3和Anti-CD19Fab随使用浓度增高,对亲本CD19抗体的竞争逐渐增强。中浓度(27 µg/mL)时Anti-CD19Fab-(CP)3对亲本抗体的竞争率为(57.8± 2.12)%,高浓度(81 µg/mL)时为(78.1± 1.34)%;中浓度、高浓度时,Anti-CD19Fab-(CPP)3对亲本抗体的竞争率分别为(49.6± 0.94)%、(74.3± 1.13)%,Anti-CD19Fab分别为(14.4±0.59)%、(54.2± 0.74)%。改构后的Anti-CD19Fab-(CP)3对亲本CD19的亲和力强于Anti-CD19Fab-(CPP)3及Anti-CD19Fab(P均<0.05)。
3 讨论
本研究构建的是小分子双价抗体F(ab’)2,无Fc段,可在原核表达系统大肠杆菌中表达[9];此表达系统成本低、周期短,易于操控。实验中,我们通过在Anti-CD19Fab嵌合抗体的CH1的C末端引入 (CP)3结构,其中脯氨酸提供空间位阻,以防止3个半胱氨酸相邻形成链内二硫键;1个Fab的半胱氨酸的-SH可与另1个Fab的-SH通过氧化形成二硫键,将2条重链共价连接在一起,进而形成二价同源抗体分子F (ab’)2。另外,本课题组亦构建了在CH1的C末端引入 (CPP)2、(CPP)、(CP)2、(CP)结构,形成二聚化的比例均没有引入 (CP)3结构高。
多价抗体的构建可通过亮氨酸拉链法[10]、连接肽法、蛋白酶消化IgG[11]等方式获得F(ab’)2。本实验室前期工作通过引入IgG的恒定区CH3,通过CH3与CH3之间的非共价键相互作用构建抗CD19的二聚化蛋白,成功获得了二聚化的抗体[12]。与以上不同的是,本文意在通过形成共价键的方式构成二聚化蛋白。蛋白二硫键的形成对于蛋白折叠及稳定二级结构发挥着十分重要的作用[13],且通过二硫键形成的多聚蛋白更稳定,半衰期更长[14]。此外,有研究报道二硫键的引入不仅可以保持蛋白的稳定性,也可用于修饰或改善蛋白质功能[15-16]。由此可见,基因工程引入二硫键对于蛋白结构和功能的研究意义重大。
本研究先通过SDS-PAGE法初步判断是否形成了高分子量聚体及Anti-CD19Fab-(CP)3与Anti-CD19Fab-(CPP)3各自形成聚体的比例,但由于非还原状态的电泳不能反映实际的二聚化蛋白分子量,因此我们后续又通过LC-MS方法进一步鉴定蛋白分子量,最终确定了目的蛋白确为二聚化蛋白,与预期分子量相符。接着我们通过流式细胞术检测二聚化蛋白的靶向性,发现与现有的二聚化蛋白Anti-CD19Fab-(CPP)3、单体蛋白Anti-CD19Fab相比,Anti-CD19Fab-(CP)3与抗原的结合力及亲和力均更强,此结果也符合非还原电泳图中的二聚体所占比例越高,对靶细胞的靶向性越强。为验证引入(CP)3结构是否可在不同的靶点上通用,本课题组后续进行了在Anti-CD20及Anti-BCMA靶点的工作,也得出了相同的结论,即引入 (CP)3结构的二聚化蛋白与靶细胞的亲和力明显强于引入 (CPP)3结构的二聚化蛋白。因此,我们可认为通过基因工程引入的(CP)3结构为构建双价抗体提供了更优的选择。
