直肠癌术前磁共振成像特征与微卫星不稳定状态的相关性
2023-10-09刘中元张黎李敏
刘中元,张黎,李敏
1 济宁市第一人民医院胃肠外科,山东济宁272100;2 山东第一医科大学附属省立医院胃肠外科 3 邹城市人民医院消化内科
近年来,由于多种肿瘤筛查手段的应用,早期结直肠癌的生存率明显提高,但晚期结直肠癌患者的5年生存率仍然较低[1-2]。年轻患者一般不愿意接受结直肠癌筛查,即使出现结直肠癌特征性症状如大便出血、腹痛,其罹患癌症的可能性也可能被忽视,容易导致癌肿一经发现已至晚期[3]。结直肠癌被认为起源于两种不同的分子遗传途径:染色体不稳定性和微卫星不稳定性(MSI);在MSI突变途径中,结直肠癌患者微卫星短串联重复DNA序列基因的内突变率增加。目前,评估结肠镜活检状态的MSI存在两种挑战。首先,从结肠镜活检样本中提取的DNA可能不符合测定的最低质量标准;其次,由于结直肠癌的高度异质性,无法通过病理穿刺获得准确的结直肠癌微卫星状态。因此,找到一种预测结直肠癌术前MSI状态并反映结直肠癌异质性的方法十分必要。近10年来,临床对直肠癌局部分期的研究有了较大进展,依赖直肠磁共振对肿瘤病变形态、侵袭情况和疗效评价等各种参数的研究逐渐增多[4]。通过高分辨率磁共振对直肠癌进行分期,可以帮助临床医生了解局部浸润、淋巴结转移和周围切缘状况,对治疗方案的选择及预后评估有重要作用[5]。因此,中国临床肿瘤学会直肠癌诊疗指南和美国国立综合癌症网络指南都将直肠磁共振作为直肠癌患者的必要术前检查。有研究显示,直肠癌临床病理特征与MSI状态有关,但此研究结果的客观性仍存在争议。为此,本研究观察直肠癌患者术前磁共振特征,并探讨磁共振预测患者MSI状态的可行性。
1 资料与方法
1.1 临床资料 选取2020年1月—2023年1月济宁市第一人民医院经手术和病理确诊的直肠癌患者242例,男130例,女112例,年龄28~83岁。纳入标准:①接受直肠癌根治术的患者;②术前未进行新辅助放化疗;③术后病理确诊为直肠腺癌;④无免疫性基础疾病。排除标准: ①病灶过小(直径<5 mm);②手术前曾接受新辅助放化疗;③除腺癌以外的其他病理类型直肠癌; ④临床和病理资料不全。
1.2 术前磁共振检查 磁共振检查前禁食8 h。对于可以口服泻药的患者,磁共振检查前5 h口服泻药排空肠道内容物;不能口服泻药的患者,应在磁共振检查前2 h进行肥皂水灌肠,以确保肠道清洁。使用3.0T超导磁共振扫描仪 (荷兰Philips Ingenia 3.0T)和16通道相控阵体线圈进行扫描,由两名影像学专科医师测量并记录表观扩散系数(ADC)、最大肿瘤轴向长度(ATL)、最大肿瘤纵向长度(LTL)、ATL/LTL比值,观察淋巴结转移及肿瘤环周切缘(CRM)情况,最终结果取两人测量的平均值。淋巴结短径>8 mm或<8 mm但淋巴结形态不规则、边缘毛糙、信号不均匀、DWI高信号(与肿瘤信号特点相似)定义为淋巴结转移阳性(+);否则为淋巴结转移阴性(-)。原发肿瘤及恶性结构如直肠系膜内转移性淋巴结、癌结节、直肠壁外血管侵犯与直肠系膜筋膜及相邻结构的距离小于1 mm时,即为CRM阳性(+);否则为CRM阴性(-)。
1.3 术后组织病理学及基因检测 术后将切除标本送病理科和基因检测机构分别进行常规病理及相关基因检测。由病理专家评估肿瘤大小、分化程度、浸润深度、淋巴结转移、TMN分期、血管和神经浸润情况;由基因检测公司使用第二代测序方法检测MSI基因。MSI状态共检测52个微卫星位点,设定微卫星高度不稳定(MSI-H)阳性阈值为15%,即≥8个MSI位点检出时判定为MSI-H型,<8个MSI位点检出时判定为微卫星低度不稳定(MSI-L)型,由此将患者分为MSI-L组和MSI-H组。同时检测KRAS和BRAF基因,如患者存在KRAS和BRAF基因突变则提示对表皮生长因子受体(EGFR)抑制剂不敏感。
1.4 统计学方法 采用SPSS 27.0软件包处理数据。计量资料符合正态分布采用表示,组间比较采用独立样本t检验;计数资料以例数或百分比表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 MSI-L组和MSI-H组的临床特点 根据基因检测结果,242例直肠癌患者分为MSI-L组 230例、MSI-H组12例。两组肿瘤大小、分化程度比较差异有统计学意义(P均<0.05)。两组年龄、性别、肿瘤浸润深度、淋巴结转移、TNM分期、脉管癌栓、神经侵犯、术前CEA、CA199以及术后KRAS、BRAF基因突变差异无统计学意义(P均>0.05)。见表1。
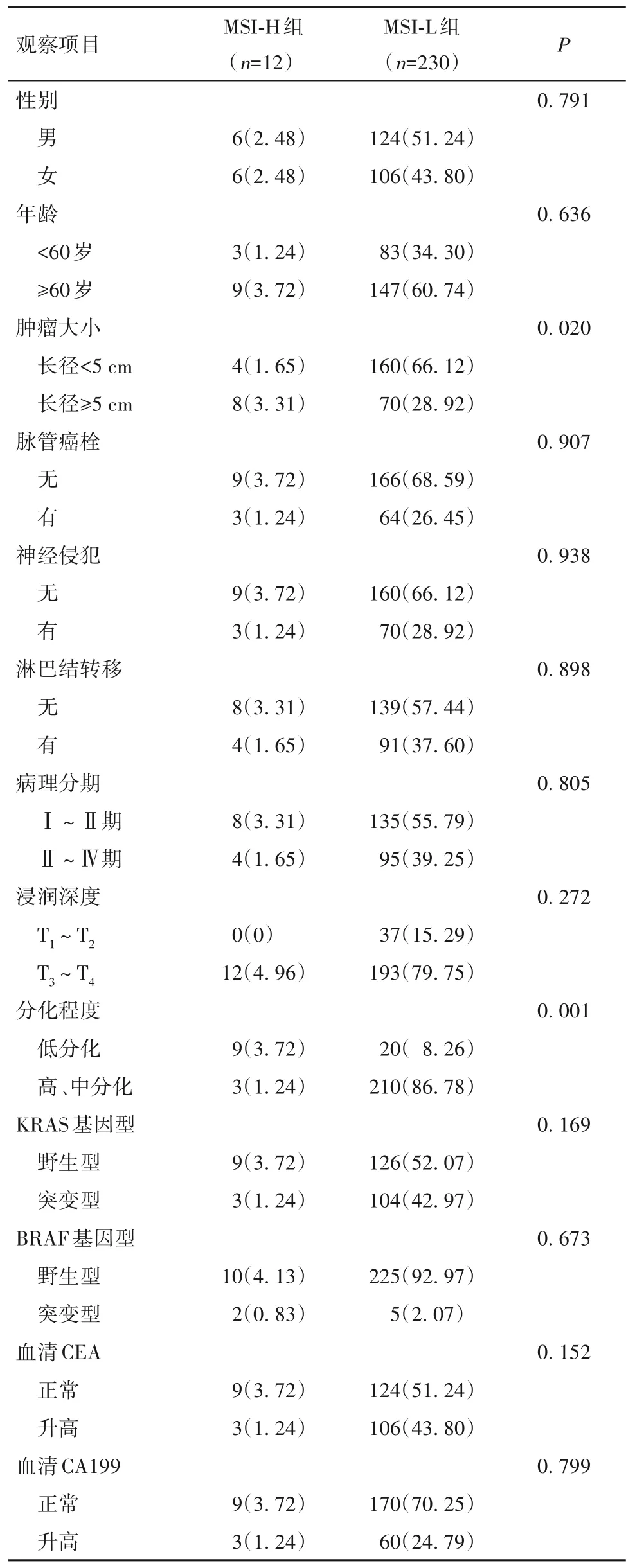
表1 MSI-L组和MSI-H组临床特点比较[例(%)]
2.2 MSI-L组和MSI-H组的磁共振影像特征 MSI-H组ATL和ATL/LTL高于MSI-L组,差异有统计学意义(P均<0.05);两组ADC、LTL、淋巴结转移和CRM情况比较差异无统计学意义(P均>0.05)。见表2。

表2 MSI-L组和MSI-H组磁共振影像特征比较
2.3 直肠癌患者MSI-H相关影响因素 设定ATL≥13.50 mm为高水平,<13.50 mm为低水平;LTL≥41.30 mm为高水平,<41.30 mm为低水平;ATL/LTL≥0.287为高水平,<0.287为低水平。以ATL(高水平=1,低水平=0)、ATL/LTL(高水平=1,低水平=0)为自变量,MSI状态(MSI-H=1,MSI-L=0)为因变量进行Logistic回归分析,结果表明ATL和ATL/LTL是直肠癌患者MSI-H的独立危险因素(P均<0.05)。见表3。

表3 直肠癌患者MSI-H影响因素的Logistic回归分析
2.4 ATL、ATL/LTL对直肠癌患者MSI-H的诊断价值 绘制ATL、ATL/LTL诊断直肠癌患者MSI-H的ROC曲线,曲线下面积分别为0.829和0.788。ATL截断值取13.50 mm,其诊断直肠癌患者MSI-H的敏感度为0.750,特异度为0.909; ATL/LTL截断值取0.287,其诊断直肠癌患者MSI-H的敏感度为0.667,特异度为0.909。
3 讨论
研究显示,20%~25%的结直肠癌患者在确定诊断时已经发生转移,处于临床晚期,5年生存率仅为5%~15%[7-8]。因此,提高结直肠癌患者早期检出率对降低病死率非常重要[6]。MSI状态与结直肠癌的5年无病生存率密切相关[9]。最近研究表明,结直肠癌MSI可以分为两种不同的肿瘤表型: MSH-H和MSI-L。与MSI-L相比,MSI-H具有独特的临床病理特点,二者预后也存在显著差别,这意味着MSI状态可用于结直肠癌患者的预后评估。国外研究表明,部分错配修复缺陷肿瘤患者对免疫检查点抑制剂治疗有反应[10]。西方人群中,MSI-H型结直肠癌占所有结直肠癌的15%~20%,并且临床Ⅱ期患者较Ⅲ期更常见[11]。国内研究表明,中国MSI-H型结直肠癌的发病率为11.9%~13%[12-13],略低于国外报道。此外,MSI-H肿瘤的致癌途径(MMR修复缺陷)被认为与非MSI-H癌症的宫颈上皮内瘤变途径不同。基于这些表型和遗传差异,MSI-H和非MSI-H肿瘤之间的区别已被普遍接受。相反,MSI-L表型与不同的临床病理特征或错配修复蛋白1或错配修复蛋白2表达的改变无关,MSI-L的生物学基础仍不确定。鉴于此,围绕MSI-L肿瘤与微卫星稳定肿瘤分离的有效性和临床效用仍存在相当大的争议。我们的结果表明,MSI-H直肠癌患者分化差且肿瘤体积大,与MSI-L组比较差异具有统计学意义;与MSI-H组比较,MSI-L组KRAS基因突变好像更易发生,但二者突变率差异无统计学意义。
近年来,癌症的磁共振成像发展迅速,已成为肿瘤基线分期和治疗计划的关键组成部分[14]。直肠磁共振除了评估原发性肿瘤和局部淋巴结外,还可以通过识别高风险特征(如壁外血管侵犯)来帮助进行风险分层,并可以评估接受新辅助化放疗患者对治疗的反应性。直肠磁共振诊断肿瘤的价值取决于获得高质量的图像,这对于表征主要直肠解剖结构及其与肿瘤的关系非常重要。直肠磁共振可以帮助放射科医生描述肿瘤位置和形态、提供肿瘤大小和淋巴结转移类别、明确壁外血管浸润的存在以及确定肿瘤与周围结构的关系,包括括约肌复合体和直肠系膜筋膜的受累情况。磁共振检查的每个特征参数都能可能与微卫星状态有一定的关系,同时磁共振也能更准确地反映肿瘤病理组织的形态特征[15]。本研究结果表明,MSI-H患者ATL、ATL/LTL高于MSI-L;这表明磁共振检查中ATL、ATL/LTL越高,直肠癌患者发生MSI-H的可能性越大。高水平的ATL、ATL/LTL在某种程度上反映了更广泛的肿瘤病变,如肿瘤进展更快、分化程度更低等等。肿瘤体积大、浸润深度深、分化程度低可影响MSI程度,ATL、ATL/LTL是直肠癌患者MSI-H发生的独立危险因素。本研究显示磁共振检测指标ATL、ATL/LTL对直肠癌患者MSI-H具有较高的诊断效率。磁共振检查为非侵入性、经济方便,且患者耐受性良好,因此,应早期应用磁共振评估直肠癌患者的MSI状态,以便制定个性化、精准化的治疗方案。
总之,直肠癌患者术前磁共振检查参数如ATL、ATL/LTL对MSI状态相关,术前进行磁共振检查评估直肠癌患者MSI程度对病情判定及其选择治疗方案均有重要价值。但需要指出的是:本研究纳入样本过小,可能导致结果出现偏差,未来增加病例进一步验证此研究结果的客观性十分必要。
