基于脑肠菌轴研究电针与穴位埋线对食源性肥胖大鼠肠道菌群及脑肠肽的影响
2023-09-27钱虹宇颉媛媛许婧
钱虹宇,颉媛媛,许婧
(成都中医药大学,四川 成都 610075)
自1975年以来,全球肥胖症发病率几乎增加了两倍,其中欧洲地区有60%的公民属于超重或肥胖,亚太地区有40.9%的成年人患有肥胖症[1-2]。《中国居民营养与慢性病状况报告(2020年)》中数据显示,17岁以下青少年儿童的肥胖率高达29.4%,成年居民肥胖率更是超过了50%[3]。《中国居民肥胖防治专家共识》指出,目前,中国是全球超重和肥胖人数最多的国家,肥胖已成为危害居民健康的严重公共卫生问题[4]。因此,使用安全有效的干预措施来治疗肥胖症已成为国内外研究热点。
近年来,脑肠菌轴(Brain-Gut-Microbiota Axis,BGMA)作为大脑和胃肠道之间双向调节的复杂神经-内分泌网络系统,与肥胖症之间的联系引起了研究者的广泛关注。研究发现,肥胖症的发生发展与肠道菌群和BGP中PYY、CCK、GLP-1和Ghrelin水平密切相关[5]。在前期的研究中,已有大量的研究证实电针与穴位埋线治疗肥胖症均有较好的临床疗效[6-8]。 《肥胖症中医诊疗方案专家共识》中电针与穴位埋线疗法均为A级推荐[9]。电针与穴位埋线治疗肥胖症均安全有效,本研究通过观察电针与穴位埋线对DIO大鼠体质量、Lee’s指数、摄食量、肠道菌群及血清中PYY、CCK、GLP-1和Ghrelin水平的影响,探讨电针与穴位埋线对肠道菌群及脑肠肽的影响,为临床治疗肥胖症提供更多的理论依据。
1 实验材料
1.1 实验动物
采用4周龄SPF级SD大鼠50只(雌雄各25只),体质量在60-80 g范围内,实验动物由成都达硕实验动物有限公司提供【SCXK(川)2015-030】。饲养于成都中医药大学SPF级实验动物中心【SYXK(川)2019-049】,喂养条件昼夜节律与湿度恒定,室温(23±3)℃。大鼠购入后适应性喂养一周,期间普通饲料喂养,摄食饮水自由。
1.2 主要试剂与仪器
试剂:磁珠法土壤和粪便基因组DNA提取试剂盒 (天根生化科技有限公司,中国,货号:DP712),Phusion High-Fidelity PCRMaster Mix with GC Buffer(New England Biolabs公司,美国,货号:M0532S),GeneJET胶回收试剂盒 (Thermo Scientific公司,美国,货号:K0692),TruSeq DNA PCR-Free Library Preparation Kit建库试剂盒(Illumina 公 司,美 国,货 号:FC-121-3001),PYY、GLP-1、GHRH ELISA试剂盒 (Elabscience公司,批号分别是XfiE2sd2HV、DMLFPD4414、TGK1867T8Q;货号分别是E-EL-R0720c、E-ELR3007、E-EL-R2856c,中国),CCK ELISA试剂盒(酶免实业有限公司,货号:MM-0034R1,中国)。
仪器:PCR仪(Bio-rad T100梯度PCR仪);华佗牌0.25 mm×25 mm的一次性无菌针灸针(苏州医疗用品厂有限公司,中国);SDZ-Ⅴ型电针仪(苏州医疗用品厂有限公司,中国);7号一次性使用埋线针(镇江高冠医疗器械有限公司,中国);材料为PDO的4-0可吸收性外科缝线(杭州爱普医疗器械股份有限公司,中国);台式高速微量离心机(赛洛捷克SCILOGEX公司,型号:D3024,美国);台式高速冷冻离心机(赛洛捷克SCILOGEX公司,型号:D3024R,美国);高速低温组织研磨仪(武汉赛维尔生物科技有限公司,型号:KZ-III-F,中国);光谱仪(伯腾BioTek公司,型号:μQuant,美国)。
2 实验方法
2.1 食源性肥胖模型建立及分组
适应性喂养结束后,将50只(雌雄各25只)SD大鼠随机分为空白组(B组)和造模组,B组8只(雌雄各4只),造模组42只 (雌雄各21只),分别给予普通饲料、高脂饲料喂养,均自由摄食饮水,建立食源性肥胖(Diet Induced Obesity,DIO)大鼠模型。造模成功标准为造模组大鼠体质量超出同期空白组大鼠平均体质量的20%。6周后,雄性大鼠造模成功12只,8周后,雌性大鼠造模成功12只。共24只大鼠造模成功,随机平均分为模型组(M组)、电针组(E组)和穴位埋线组(A组),每组8只(雌雄各4只)。
2.2 干预方法
空白组:大鼠固定30 min,使用自制大鼠束缚木架固定,1次/d,连续6 d,休息1 d,共28 d。其余不做任何其他处理,给予普通饲料喂养。模型组:与空白组操作处理方法相同,给予高脂饲料喂养。电针组:大鼠固定后,参考《实验针灸学》[10]选取“天枢”穴和“丰隆”穴。将干预穴位2 cm×2 cm面积区域的毛发剃除干净,并使用无菌棉球沾取75.0%的医用酒精对“天枢”穴和“丰隆”穴进行消毒。随后将针灸针刺入3-5 mm,先以平补平泻法行针约1 min后,连接SDZ-Ⅴ型电针治疗仪,选用频率为3-8 Hz,强度为0.5-1 mA的疏密波,观察大鼠下肢及针柄变化,以轻微节律抽搐为度,留针30 min,1 d/次,连续6 d,休息1 d,共28 d,左右两侧穴位交替使用,给予高脂饲料喂养。穴位埋线组:同样给予固定30 min,1次/d,连续6 d,休息1 d,共28 d。大鼠固定后,穴位选取与电针组相同,将治疗穴位2 cm×2 cm面积区域的毛发剃除干净,并使用无菌棉球沾取医用碘伏两侧对“天枢”穴和“丰隆”穴进行消毒,随后将7号一次性使用埋线针刺入,边退针边将4-0 PDO线推入穴位,使线体完全置于大鼠体内,针体退到皮下时快速出针并用医用棉签按压针孔,1次/14 d,共28 d,给予高脂饲料喂养。
2.3 评价指标
2.3.1 一般指标
体质量、Lee’s指数和摄食量。实验期间,在造模前、造模后和干预后,固定时间测量并记录大鼠体质量和Lee’s指数。Lee’s指数=/体长×1000,体长(cm)指从大鼠鼻尖到肛门的长度。摄食量每天进行测量,摄食量=起始量-剩余量。
2.3.2 肠道菌群
比较各组大鼠肠道菌群ASVs分类总体情况,在门、科、属3个不同水平上肠道菌群的相对丰度,对肠道菌群的Alpha多样性和Beta多样性进行比较,并分析组间群落结构差异。
2.3.3 脑肠肽
各组大鼠血清中PYY、CCK、GLP-1和Ghrelin的含量。
2.4 取材
治疗第28 d结束后,搜集所有大鼠新鲜粪便样品,置于EP管中,-80℃保存备用。所有大鼠禁食不禁水12 h,第29 d清晨测量并记录所有大鼠体质量。大鼠麻醉后,腹主动脉采血5 mL,置于一次性负压采血管内,2000 rpm,离心半径6 cm,离心10 min,取上层血清,放置于-80℃冰箱避光保存。
2.5 肠道菌群检测
大鼠粪便样本采取16S rDNA扩增子测序法对肠道菌群进行检测。
2.6 ELISA检测
将放置于-80℃保存的血清取出,严格按照ELISA说明书要求检测血清样本中PYY、CCK、GLP-1和Ghrelin含量。
2.7 数据统计分析
肠道菌群数据分析使用了诺禾云平台,组间群落结构差异显著性检验运用T-test检验。其余数据指标均为计量资料,用均平均值±标准差±s)表示,运用SPSS 27.0和Graph Pad Prism9软件进行数据处理和绘制统计图。造模前后使用独立样本t检验法,干预后多组比较使用单因素方差分析法,方差齐时,组间比较采用最小显著性差异法(LSD);方差不齐时,选择Hotelling T2检验进行组间比较。不属于正态分布的数据使用非参数检验。P<0.05表示差异具有显著性。
3 实验结果
3.1 造模期间大鼠体质量、Lee’s指数变化情况
造模前,两组大鼠之间的体质量与Lee’s指数均无差异(P>0.05),分别给予两组大鼠普通饲料或高脂饲料喂养。造模后,高脂饲料组大鼠的体质量与Lee’s指数均明显高于普通饲料组(P<0.05),表明高脂饲料诱导的DIO大鼠模型造模成功。见表1、表2。
表1 各组大鼠造模前后体质量比较±s,g

表1 各组大鼠造模前后体质量比较±s,g
注:与普通饲料组同时期相比,▲P<0.05
组别 n体质量造模前造模后雄性 雌性普通饲料组 4 68.07±2.47 70.62±6.31 235.16±8.66 224.68±雄性 雌性29.97高脂饲料组 12 75.22±6.71 72.99±3.73 324.38±26.80▲ 279.69±13.76▲
表2 表2各组大鼠造模前后Lee’s指数比较±s
注:与普通饲料组同时期相比,▲P<0.05
Lee’s组别 n 造模前造模后雄性 雌性普通饲料组 4 298.57±3.56 309.33±18.83 281.22±3.80 280.雄性 雌性78±8.78高脂饲料组 12 320.19±19.85 330.22±17.79 300.94±10.32▲ 307.04±12.99▲
3.2 电针与穴位埋线对DIO大鼠体质量、Lee’s指数的影响
通过电针与穴位埋线干预后,与模型组比较,电针组与穴位埋线组DIO大鼠的体质量均明显减少(P<0.05),Lee’s指数均显著降低 (P<0.01)。电针组与穴位埋线组进行比较,两者对DIO大鼠体质量和Lee’s指数的影响无明显差异(P>0.05)。见图1、图2。
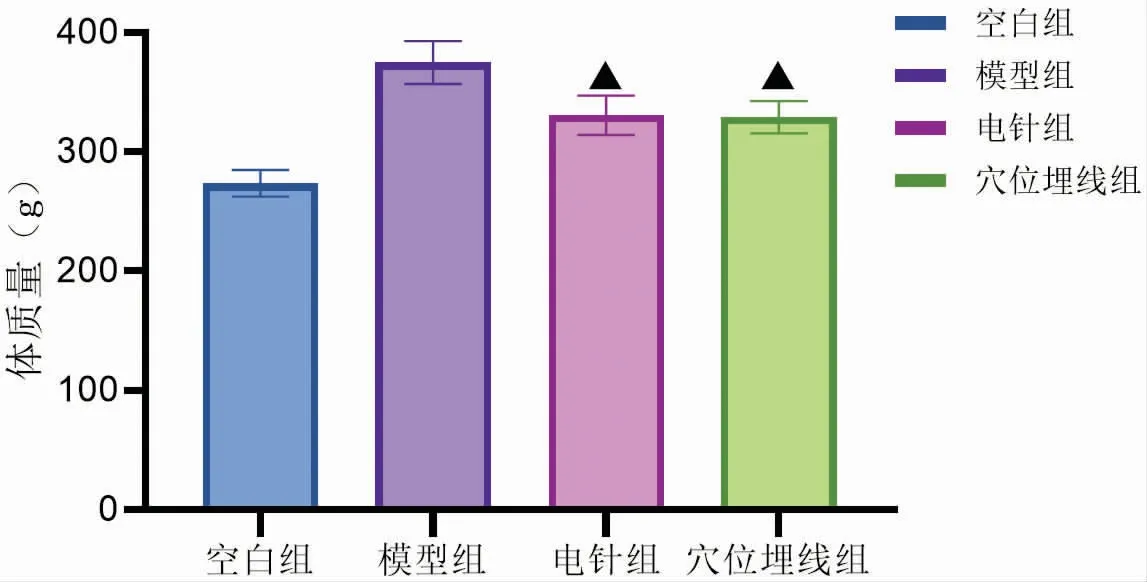
图1 干预后各组大鼠体质量比较

图2 干预后各组大鼠Lee’s指数比较
3.3 电针与穴位埋线对DIO大鼠摄食量的影响
通过电针与穴位埋线干预后,与模型组比较,电针组与穴位埋线组DIO大鼠的摄食量均显著降低(P<0.01)。电针组与穴位埋线组进行比较,两者对DIO大鼠摄食量的影响无明显差异(P>0.05)(见图3)。
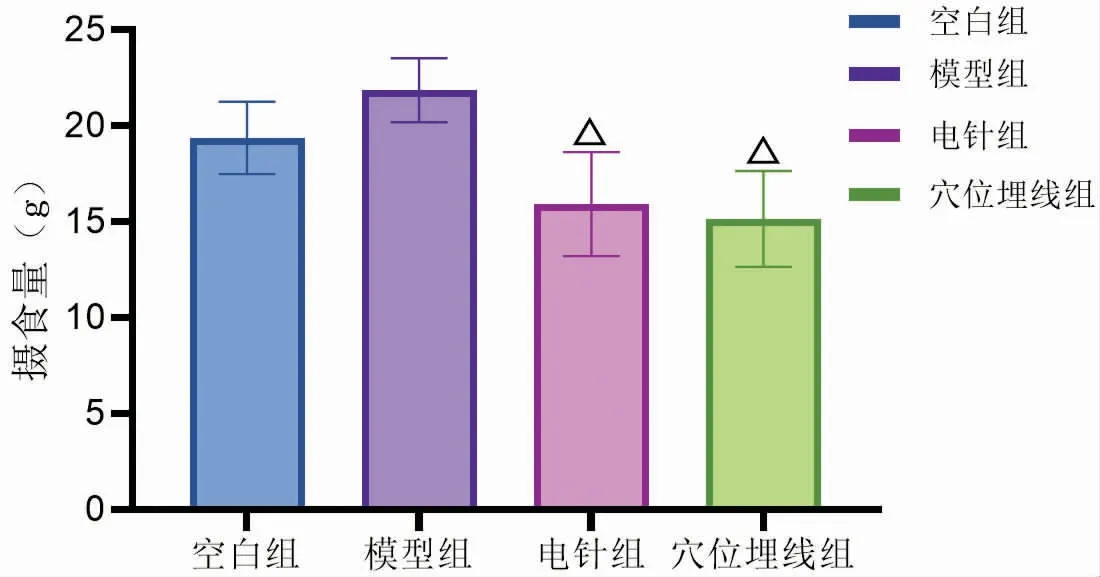
图3 干预后各组大鼠摄食量比较
3.4电针与穴位埋线对DIO大鼠肠道菌群的影响
3.4.1 扩增子序列变体(Amplicon Sequence Variants,ASVs)分析
通过韦恩图(图4)中的数据所示,可得到不同组别大鼠肠道菌群ASVs分类总体情况,空白组、模型组、电针组和穴位埋线组特有的ASVs个数分别为2553、2904、2636和1082。其中模型组特有的ASVs个数最多,穴位埋线组特有的ASVs个数最少。

图4 不同组别大鼠肠道菌群ASVs分类总体情况韦恩图
从图5和图6可以看出,在门水平上,厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)所占比例最大。其中具体数值为,空白组中厚壁菌门占29.08%,拟杆菌门占56.65%;模型组中厚壁菌门占56.57%,拟杆菌门占21.72%;电针组中厚壁菌门占35.08%,拟杆菌门占45.74%;穴位埋线组中厚壁菌门占36.65%,拟杆菌门占48.28%。与空白组比较,模型组肠道菌群中厚壁菌门、变形菌门(Proteobacteria)、广古菌门(Euryarchaeota)、Desulfobacterota、放 线 菌 门 (Actinobacteria)、Campilobacterota和酸杆菌门 (Acidobacteria)相对丰度增加,拟杆菌门 (Bacteroidetes)和Patescibacteria相对丰度减少,厚壁菌门与拟杆菌门的比值(F/B)升高。通过电针与穴位埋线干预后,与模型组比较,电针组与穴位埋线组肠道菌群中厚壁菌门、变形菌门、广古菌门、Desulfobacterota和放线菌门的相对丰度均减少,拟杆菌门、Patescibacteria和疣微菌门(Verrucomicrobiota)相对丰度均增加,F/B的比值均降低,其相对丰度逐渐趋于空白组。
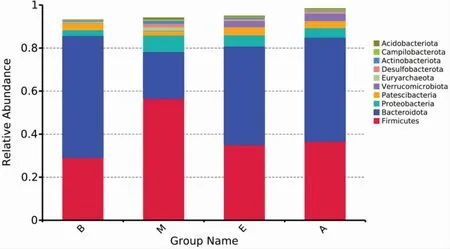
图5 门水平上物种相对丰度柱状图
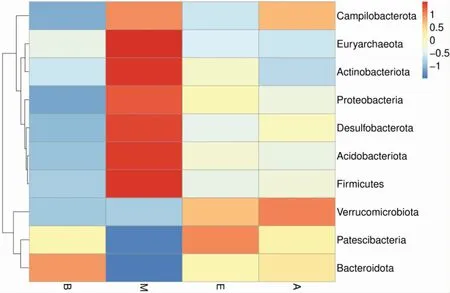
图6 门水平上物种丰度聚类图
从图7和图8可以看出,在科水平上,与空白组比较,模型组肠道菌群中普雷沃氏菌科(Prevotellaceae)、Muribaculaceae、Saccharimonadaceae和乳杆菌科(Lactobacillaceae)相对丰度减少,毛螺球菌科(Lachnospiraceae)、Oscillospiraceae和拟杆菌科(Bacteroidaceae)相对丰度增加。通过电针与穴位埋线干预后,与模型组比较,电针组与穴位埋线组肠道菌群中普雷沃氏菌科、Muribaculaceae、Saccharimonadacea、Akkermansiaceae和拟杆菌科相对丰度均增加,毛螺球菌科、Oscillospiraceae和乳杆菌科相对丰度均减少,其中乳杆菌科相对丰度在模型组的基础上进一步减少,并且电针可使琥珀菌科(Succinivibrionaceae)相对丰度增加,穴位埋线可使肠杆菌科(Enterobacteriaceae)相对丰度增加。

图7 科水平上物种相对丰度柱状图
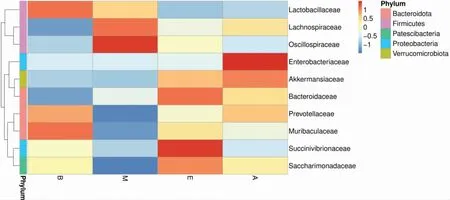
图8 科水平上物种丰度聚类图
从图9和图10可以看出,在属水平上,与空白组比较,模型组肠道菌群中普氏菌属(Prevotella)、Muribaculaceae、拟普雷沃氏菌属(Alloprevotella)、Candidatus_Saccharimonas、乳杆菌属(Lactobacillus)和Prevotellaceae_UCG-003相对丰度减少,拟 杆 菌 属 (Bacteroides) 和 假 单 胞 菌 属(Pseudomonas)相对丰度增加。通过电针与穴位埋线干预后,与模型组比较,电针组与穴位埋线组肠道菌群中普氏菌属、Muribaculaceae、Candidatus_Saccharimonas、Akkermansia、Prevotellaceae_UCG-003和拟杆菌属相对丰度均增加,假单胞菌属和乳杆菌属相对丰度均减少,其中乳杆菌属相对丰度在模型组的基础上进一步减少,并且电针可使厌氧螺菌属(Anaerobiospirillum)相对丰度增加。

图9 属水平上物种相对丰度柱状图

图10 属水平上物种丰度聚类图
3.4.2 Alpha多样性分析
通过图11-图15,可以看出Dominance、Shannon、Simpson和Goods_coverage指数走势均趋于平坦,表明各组大鼠肠道菌群物种的测序覆盖度高,数据量渐进合理,每组样本测序数据量足够。Dominance、Shannon和Simpson指数显示,模型组物种的多样性和均匀性均高于空白组,Chao1指数显示模型组中所含的物种总数最高,表明DIO大鼠肠道菌群物种的总数、多样性和均匀性均升高。通过电针与穴位埋线干预后,与模型组比较,电针组与穴位埋线组DIO大鼠肠道菌群物种的多样性和均匀性均降低,所含的物种总数也都降低,并且穴位埋线组降低得更为明显。表明电针与穴位埋线均能降低DIO大鼠肠道菌群物种的总数、多样性和均匀性,并且穴位埋线的效果优于电针。

图11 Dominance稀释曲线
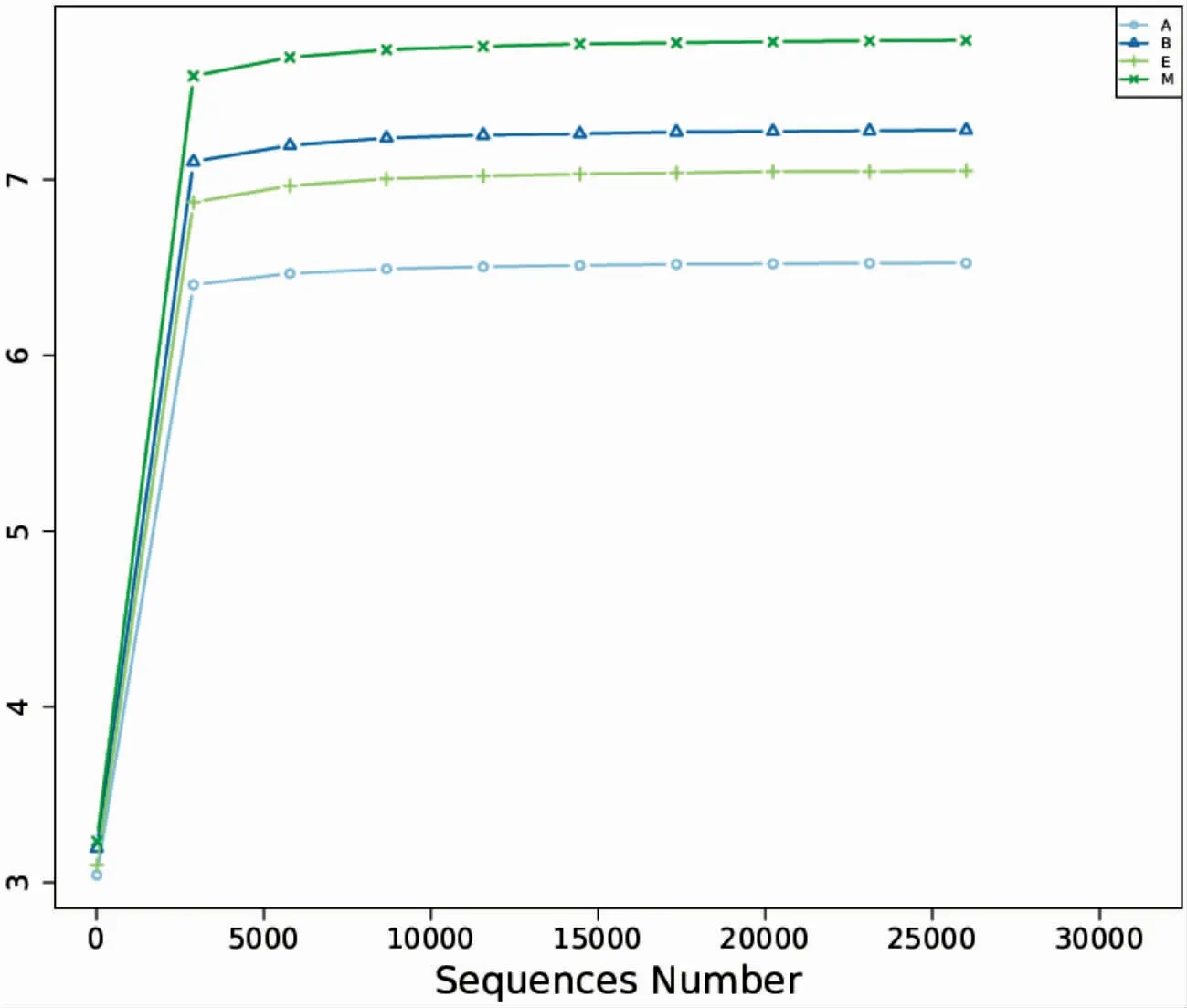
图12 Shannon稀释曲线
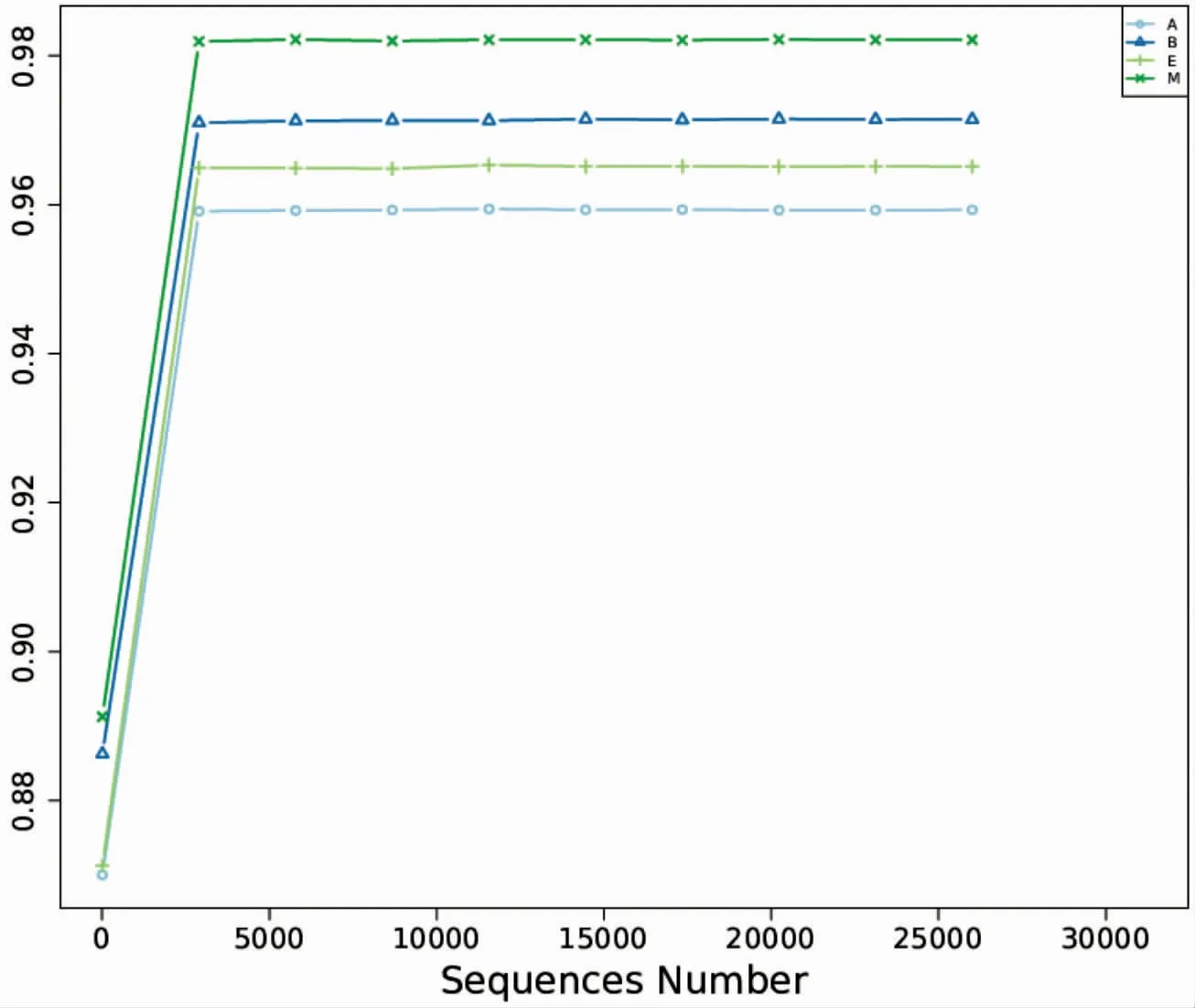
图13 Simpson稀释曲线

图14 Goods_coverage稀释曲线
3.4.3 Beta多样性分析
根据PCoA图(图16),可以看出空白组和模型组大鼠肠道菌群结构之间存在较大的差异,有明显的分离趋势,电针组和穴位埋线组大鼠的肠道菌群结构逐渐趋向于空白组。表明DIO大鼠肠道菌群的结构与正常大鼠肠道菌群结构之间存在明显的差异,通过电针与穴位埋线干预后,可使肠道菌群结构得到一定的恢复,趋于正常大鼠。

图16 不同组别大鼠肠道菌群结构PCoA图
3.4.4 组间群落结构差异分析
通过T-test分析可找出在门水平上不同组别之间具有显著差异性的物种。图17-图20显示,模型组与空白组、电针组和穴位埋线组之间肠道菌群结构最具有显著差异的是厚壁菌门和拟杆菌门(P<0.05)。模型组与空白组比较,厚壁菌门显著增加,拟杆菌门显著减少(P<0.01)。电针组和穴位埋线组与模型组比较,均表现为拟杆菌门显著增加(P<0.01),电针组厚壁菌门明显减少(P<0.05),穴位埋线组厚壁菌门显著减少(P<0.01)。与空白组比较,穴位埋线组中蓝细菌(Cyanobacteria)明显减少(P<0.05)。

图17 模型组与空白组的T-test图

图18 模型组与电针组的T-test图

图19 模型组与穴位埋线组的T-test图
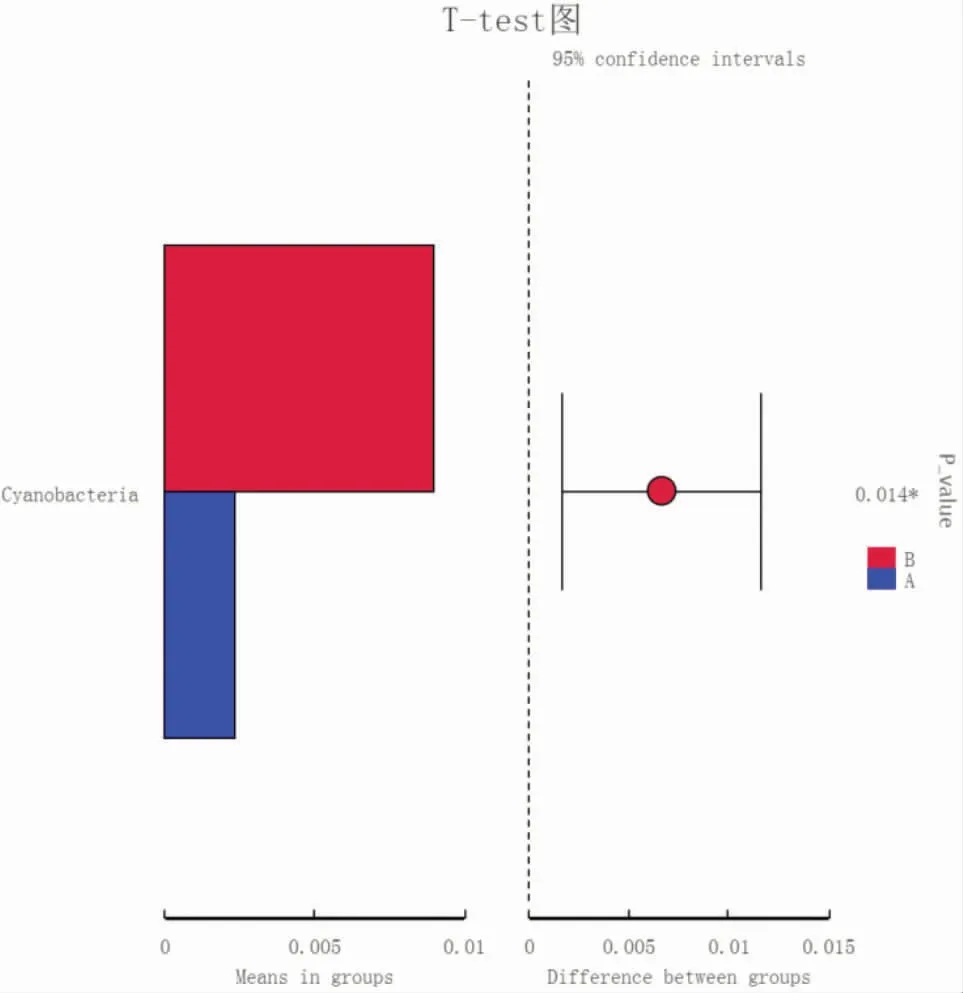
图20 空白组与穴位埋线组的T-test图
3.5 电针与穴位埋线对DIO大鼠血清中PYY、CCK、GLP-1和Ghrelin的影响
图21-图24显示,与空白组比较,模型组血清中PYY、CCK、GLP-1和Ghrelin水平均显著下降(P<0.01),表明DIO大鼠血清中PYY、CCK、GLP-1和Ghrelin水平均显著低于正常大鼠。通过电针与穴位埋线干预后,与模型组比较,电针组和穴位埋线组血清中PYY、CCK和Ghrelin水平均显著升高(P<0.01),GLP-1水平明显升高(P<0.05)。与电针组比较,穴位埋线组血清中PYY和Ghrelin水平显著升高(P<0.01),血清中CCK和GLP-1水平无明显差异(P>0.05)。由此可见,电针与穴位埋线均能使DIO大鼠血清中PYY、CCK、GLP-1和Ghrelin水平升高,电针与穴位埋线对DIO大鼠血清中CCK和GLP-1水平影响无明显差异,但在对DIO大鼠血清中PYY和Ghrelin水平影响方面,穴位埋线优于电针,其中穴位埋线对升高DIO大鼠血清中Ghrelin水平尤为显著。
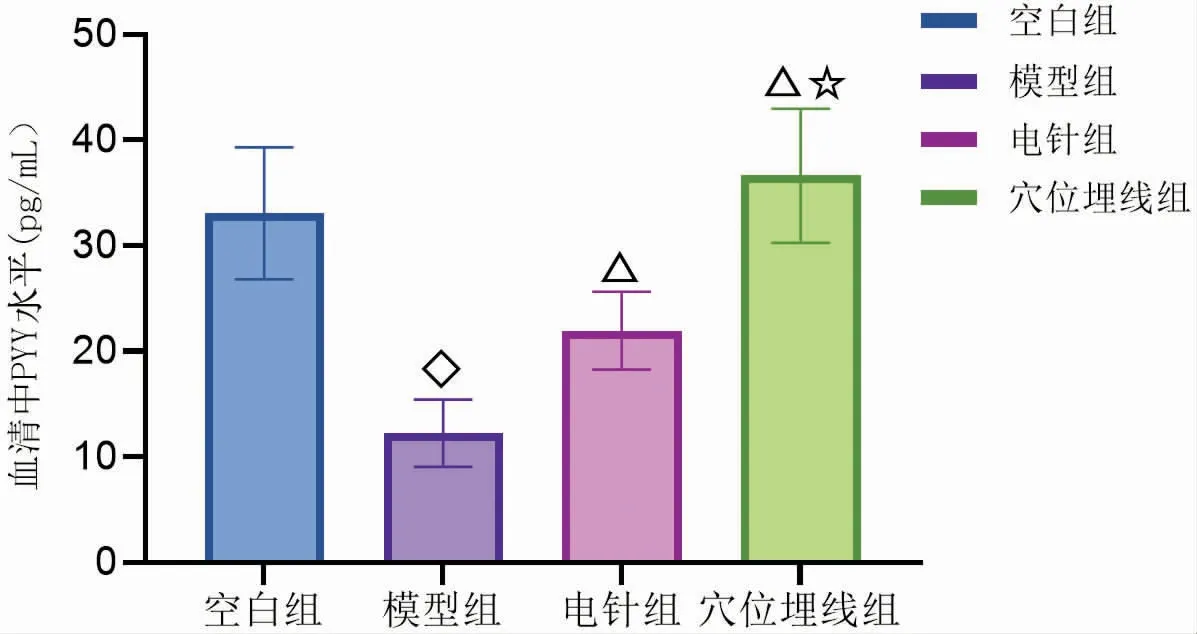
图21 干预后各组大鼠血清中PYY水平比较
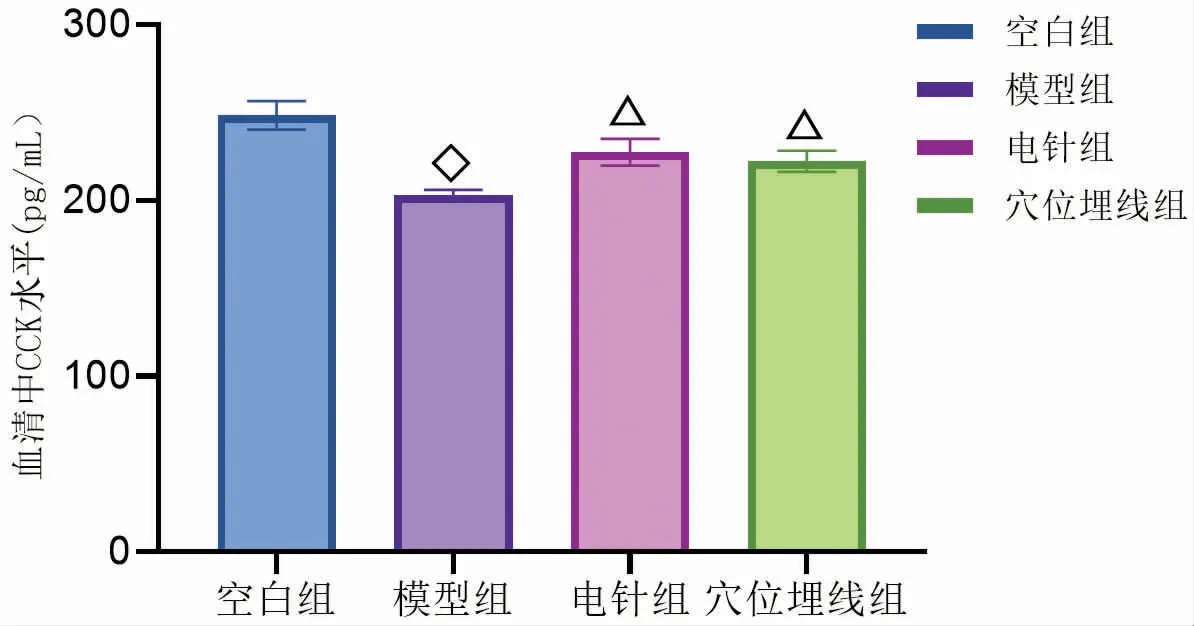
图22 干预后各组大鼠血清中CCK水平比较
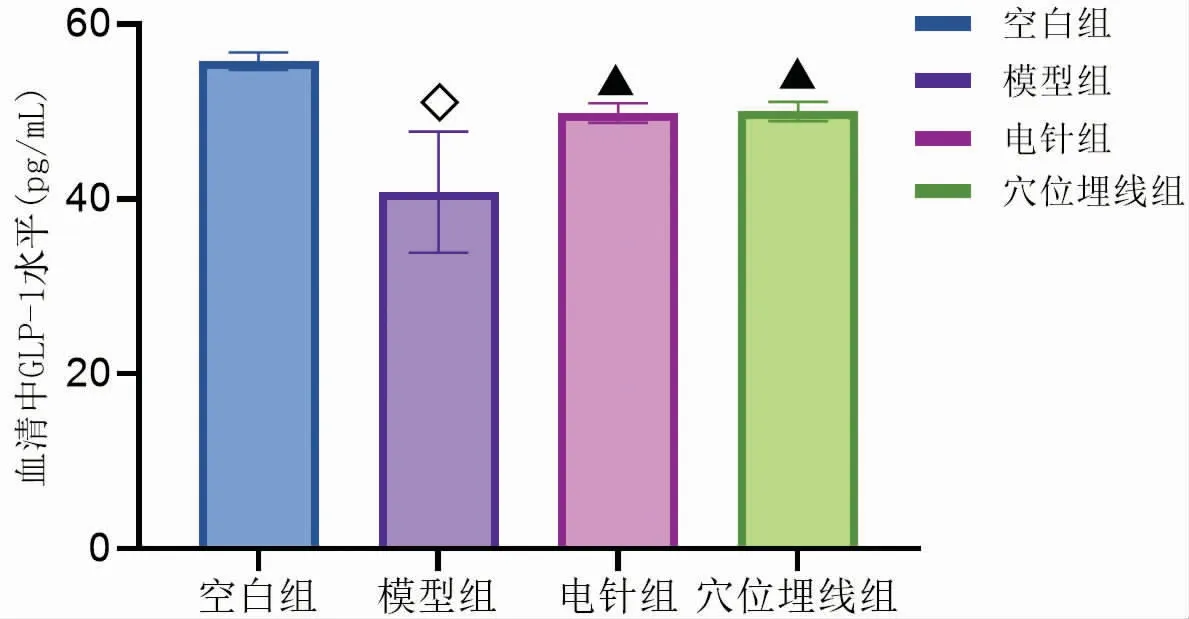
图23 干预后各组大鼠血清中GLP-1水平比较

图24 干预后各组大鼠血清中Ghrelin水平比较
4 讨论
中医认为肥胖与饮食不节、先天禀赋和劳逸失度等诸多因素相关,其主要病机为“阳气虚衰、痰湿偏盛”,病位主要在脾胃。从古至今,历代医家均认为痰饮与水湿是肥胖症发生与发展的关键,元代朱丹溪首次提出了“肥白人多痰湿”的观点,清代傅青主所著《傅青主女科》中写到“妇人体质肥盛,恣食厚昧,痰湿内生”,现代名老中医蒲辅周先生也认为“若食少而肥者,非强也,乃病痰也”。“天枢”穴和“丰隆”穴均属足阳明胃经,“天枢”穴是大肠的募穴,“丰隆”穴是胃经的络穴,属阳而络阴,“一络而通二经”可通脾胃两经之气血,并且“丰隆”穴还为化痰奇穴。通过分析电针与穴位埋线在临床上治疗肥胖症所使用的穴位, “天枢”穴和 “丰隆”穴均为常用穴位[11-12]。故本实验选用“天枢”穴和“丰隆”穴作为干预穴位。
现代医学将BGMA定义为大脑和肠道细菌群落之间双向调节的复杂神经-内分泌网络系统,并参与胃肠道生理和病理过程[13]。在神经-内分泌网络系统中,大脑与肠道菌群之间的相互作用可通过神经元、免疫系统和化学递质的间接或直接信号通路来进行[14]。BGMA在维持中枢神经系统和胃肠系统的稳态方面具有重要作用,肠道菌群及其代谢物所产生的信号经传入神经元上行传导至中枢神经系统,而中枢神经系统的信号又可以通过下行通路传递到胃肠,并对其生理功能产生了一定的影响,这种双向传导主要是通过中枢神经系统(Central Nervous System,CNS)、肠道神经系统(Enteric Nervous System,ENS)和自主神经系统(Autonomic Nervous System,ANS)[14],肠道菌群及代谢产物能使ENS直接或间接的作出反应。下丘脑被称为“饱腹感中心”或“进食中心”,主要负责调节食物摄入和能量平衡[15]。人体中最大的内分泌器官是胃肠道,它所分泌的激素能对机体的体质量产生较大的影响[16]。下丘脑与胃肠道可通过BGMA广泛而复杂的双向网络系统,对机体的体质量起到调节作用,因此,肥胖症与BGMA之间有着密切的相关性。
肠道菌群中F/B的比值升高,能让人体更充分地吸收食物中的热量,并且更容易将热量转化为脂肪存积于皮下[17]。Gordon教授及其团队第一次提出肠道菌群可对脂肪储存进行调节,并发现肥胖症患者肠道菌群F/B的比值升高[17]。Turnbaugh等[18]通过研究发现,在成年无菌小鼠肠道中定植“肥胖微生物群”比定植“瘦微生物群”的小鼠体脂百分比和F/B的比值均显著升高。当肥胖小鼠F/B的比值升高时,其肠道菌群酵解碳水化合物的能力也会增强,从食中获取更多的能量。本实验结果显示DIO大鼠F/B的比值升高,与上述研究结果一致。本实验结果还显示DIO大鼠肠道菌群所含的物种总数、多样性和均匀性均升高,与何珂[19]的研究一致,但Chatelier等[20]人的研究结果却表明肥胖症患者菌群丰度明显降低,这可能与地域、检测方法不同或样本量不足等诸多因素有关。BGP分布于下丘脑和胃肠道,具有激素和神经递质的双重性质。PYY、CCK和GLP-1属于抑食欲肽,Ghrelin属于促食欲肽。本实验结果显示DIO大鼠血清中PYY、CCK、GLP-1和Ghrelin水平均显著低于正常大鼠,这与之前的研究结果具有一致性[5,21-22]。血清中Ghrelin水平下降,可能与胰岛素抵抗所导致的肥胖症相关,由于肥胖增加了空腹胰岛素水平,胰岛素对Ghrelin分泌产生了抑制作用。有研究表明在人类血清中,Ghrelin水平与胰岛素抵抗和体质量增加成反比,肥胖症患者体内较低的Ghrelin水平可能反映了一种补偿性适应机制[23]。但也有研究显示肥胖大鼠血清中Ghrelin水平高于正常体质量大鼠[16],关于Ghrelin水平变化还需进一步深入研究。
本次实验结果显示,电针与穴位埋线干预后,DIO大鼠的体质量均明显减少(P<0.05),Lee’s指数均显著降低(P<0.01),由此可见电针与穴位埋线均对肥胖症有较好的治疗效果,两者之间无明显差异。电针与穴位埋线均对紊乱的肠道菌群有良性调节作用,使DIO大鼠厚壁菌门相对丰度均减少,拟杆菌门相对丰度均增加,F/B的比降低,与司原成[24]和宋爱群[25]的研究结果一致,并且两者之间无明显差异。与此同时,电针与穴位埋线均能使血清中PYY、CCK、GLP-1和Ghrelin水平升高,这与前期的研究结果一致[22,26-28],并且穴位埋线对DIO大鼠血清中PYY和Ghrelin水平的影响优于电针。最终体现在DIO大鼠的摄食量上,电针与穴位埋线均能使DIO大鼠的摄食量显著降低(P<0.01),这与刘凯琪[29]和彭若轩[30]研究结果一致。
综上所述,电针与穴位埋线均可有效降低DIO大鼠的体质量、Lee’s指数和摄食量,可能是通过对紊乱肠道菌群的良性调节,升高血清中PYY、CCK、GLP-1和Ghrelin水平,从而减少能量的摄入和吸收,达到治疗肥胖症的目的。
