栖冷克吕沃尔氏菌临床株对碳青霉烯类耐药的分子机制
2023-09-25马艳辉刘真真冯渐焘姜美妍朱元祺赵自云
马艳辉,刘真真,冯渐焘,姜美妍,朱元祺,赵自云*
(1.青岛大学附属青岛市中心医院,青岛市肿瘤医院,山东 青岛266042;2.青岛大学附属医院,山东 青岛266003)
克吕沃尔氏菌属现归类于肠杆菌目中的肠杆菌科,被认为是一种条件致病菌,通常存在于环境中,也存在于人的胃肠道[1-2]。该菌属可引起从轻微到致命的感染,如菌血症、胆管炎、腹泻、新生儿脑膜炎、腹膜炎和肺炎[2],但关于人体感染克吕沃尔氏菌的报道较少。到目前为止,克吕沃尔氏菌属(Kluyvera)包括抗坏血酸克吕沃尔氏菌(K.ascorbata)、栖冷克吕沃尔氏菌(K.cryocrescens)、居中克吕沃尔氏菌(K.intermedia)、佐治亚克吕沃尔氏菌(K.georgiana)和四川克吕沃尔氏菌(K.sichuanensis)五个种[2]。
位于栖冷克吕沃尔氏菌染色体上的blaKLUC-1基因于2001年由Decousser报道[3],它编码属于CTX-M型的超广谱β-内酰胺酶KLUC-1。D类碳青霉烯酶基因blaOXA-181于2007年在印度被首次报道[4]。此后,blaOXA-181基因在英国、美国、丹麦和中国等国家被发现,并在肠杆菌科中的流行率呈上升趋势[5]。另外,携带blaOXA-181基因的肠杆菌科细菌主要是肺炎克雷伯菌和大肠埃希菌[5],但目前还未在克吕沃尔氏菌属细菌中检出该基因。因此,本文对首例同时携带qnrS1、blaKLUC-1和blaOXA-181基因的栖冷克吕沃尔氏菌临床株进行报道。
1 材料和方法
1.1 实验菌株对碳青霉烯类耐药的栖冷克吕沃尔氏菌临床株PD49于2022年分离自肺部感染住院患者的痰标本。沙门菌H9812、ATCC25922和ATCC 700603以及大肠埃希菌J53AziR分别作为S1核酸脉冲场凝胶电泳(S1-PFGE)的分子量标记、仪器的质控菌株以及质粒的液相接合受体菌,且这些菌株均为本实验室保存。
1.2 仪器和试剂细菌鉴定通过基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS,布鲁克,德国)。药敏试验为VITEK 2 Compact系统,结果判定依据CLSI-M100-2021[6]标准。上海复星NG-Test CARBA 5碳青霉烯酶免疫层析卡(C,质控对照线;K,KPC;O,OXA-48;V,VIM;I,IMP和N,NDM型酶)。S1核酸酶切的脉冲场凝胶电泳(S1-PFGE)的电泳系统以及凝胶成像仪均为BIO-RAD公司。
1.3 栖冷克吕沃尔氏菌临床株PD49的测序基于Illumina MiSeq(Illumina,USA)和Oxford Nanopore MinION(ONT,UK)平台对PD49株进行测序。使用Unicycler软件(v.0.4.1)重新组装所有reads,经校正后,使用PlasmidFinder(https://cge.cbs.dtu.dk/services/PlasmidFinder/)、ResFinder(https://cge.cbs.dtu.dk/services/ResFinder/)和ISfinder(https://www-is.biotoul.fr)等在线软件分析该菌株的生物学信息。
1.4 液相接合试验和S1-PFGE栖冷克吕沃尔氏菌临床株PD49与EscherichiacoliJ53AziR的液相接合以及与接合子的S1-PFGE的试验,操作参照相关文献进行[7];接合子的酶型检测采用NG-Test CARBA 5碳青霉烯酶免疫层析检测卡,操作步骤按照试剂盒内说明书。
2 结果
2.1 栖冷克吕沃尔氏菌临床株PD49的药敏和碳青霉烯酶型筛检结果
栖冷克吕沃尔氏菌临床株PD49对氨苄西林、氨苄西林/舒巴坦、哌拉西林/他唑巴坦、头孢唑林、厄他培南、亚胺培南和美罗培南耐药,但对头孢曲松、头孢他啶、头孢吡肟、头孢替坦和氨曲南以及氨基糖苷类敏感。另外,对喹诺酮类呈现中介药敏表型。药敏结果见表1。此外,经NG-Test CARBA 5碳青霉烯酶卡检测,该菌株在OXA-48型碳青霉烯酶处呈现阳性条带,结果见图1。

图1 碳青霉烯酶卡检测结果图
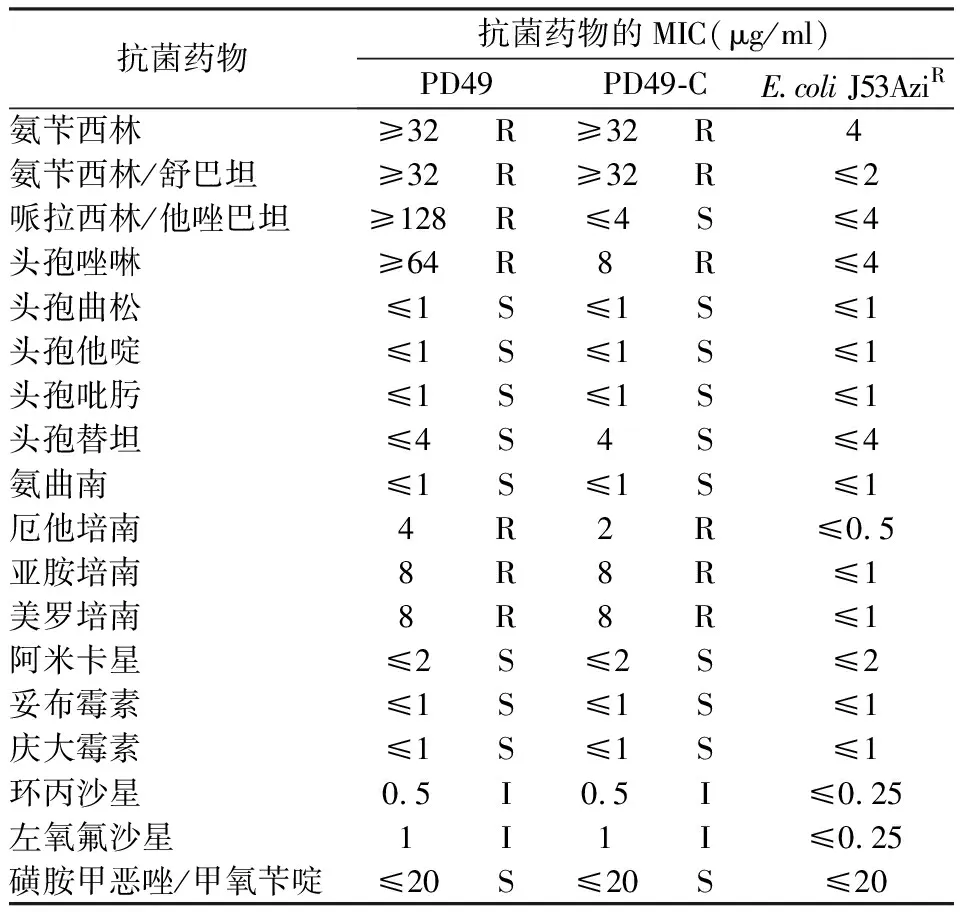
表1 PD49株、接合子和E.coli J53AziR的药敏结果
2.2 栖冷克吕沃尔氏菌临床株PD49的测序和生物信息学分析结果
基于Illumina MiSeq和Oxford Nanopore MinION测序平台技术,获得了PD49株的全基因组序列。
生物信息学分析显示:①染色体(PD49-chr)的长度为4844 054 bp,携带有超广谱β-内酰胺酶blaKLUC-1基因以及多个耐药相关的外排泵基因,如acrA、acrB、TolC、mdtB、和mdtC等。②PD49株携带1个质粒(被命名为pPD49-OXA-181),携带D类碳青霉烯类耐药基因blaOXA-181和喹诺酮类耐药基因qnrS1,大小为51 479 bp。依据复制子类型,质粒pQD49-OXA-181属于ColKP3/IncX3型杂合质粒。③与OXA-48相比(GenBank Accession Number KC354801.1),该OXA-181基因显示了45个核苷酸替代,导致4个氨基酸差异(T104A,N110D,E168Q和S171A)。测序分析的详细结果见表2。
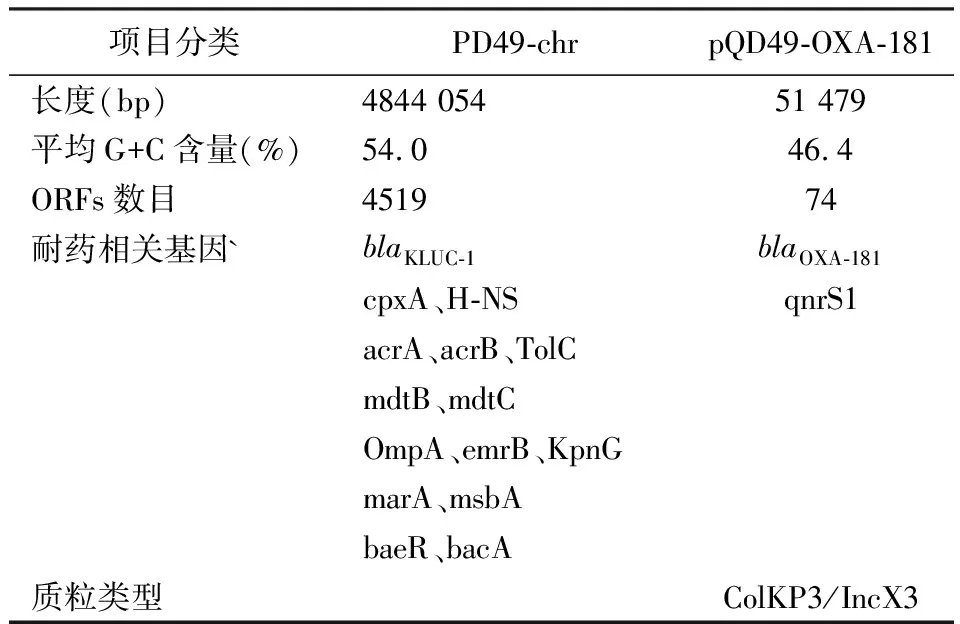
表2 克吕沃尔氏菌临床株PD49的生信分析结果
2.3 质粒的液相接合及接合子的验证结果
PD49株作为供体菌与作为受体菌的E.coliJ53AziR的液相接合,获得了接合子,命名为PD49-C株。然后,对接合子进行碳青霉烯酶检测、药敏试验和S1核酸酶切的脉冲场凝胶电泳(同时对PD49和PD49-C株),以进一步验证。结果显示:①接合子PD49-C在OXA-48型碳青霉烯酶处也呈现阳性条带。②与PD49株比较,接合子PD49-C除了对哌拉西林/他唑巴坦显示敏感外,其他药敏结果基本一致;然而,接合子PD49-C与E.coliJ53AziR比较,对厄他培南、亚胺培南和美罗培南的MIC值提高了4~8倍。PD49、接合子PD49-C和E.coliJ53AziR的药敏比较见表1。③S1-PFGE显示,PD49和接合子PD49-C都携带一个分子量大小相同的质粒,且与测序数据的质粒pPD49-OXA-181的大小相一致,结果见(S1-PFGE)图2。以上结果表明,携带blaOXA-181基因是PD49对碳青霉烯类耐药的机制。另外,携带blaOXA-181基因的pQD49-OXA-181质粒可经液相接合传递到E.coliJ53AziR,这提示该质粒具有经水平传递到其他不同种的肠杆菌科细菌的潜能,可能导致耐药基因的播散和对碳青霉烯类耐药率的上升。
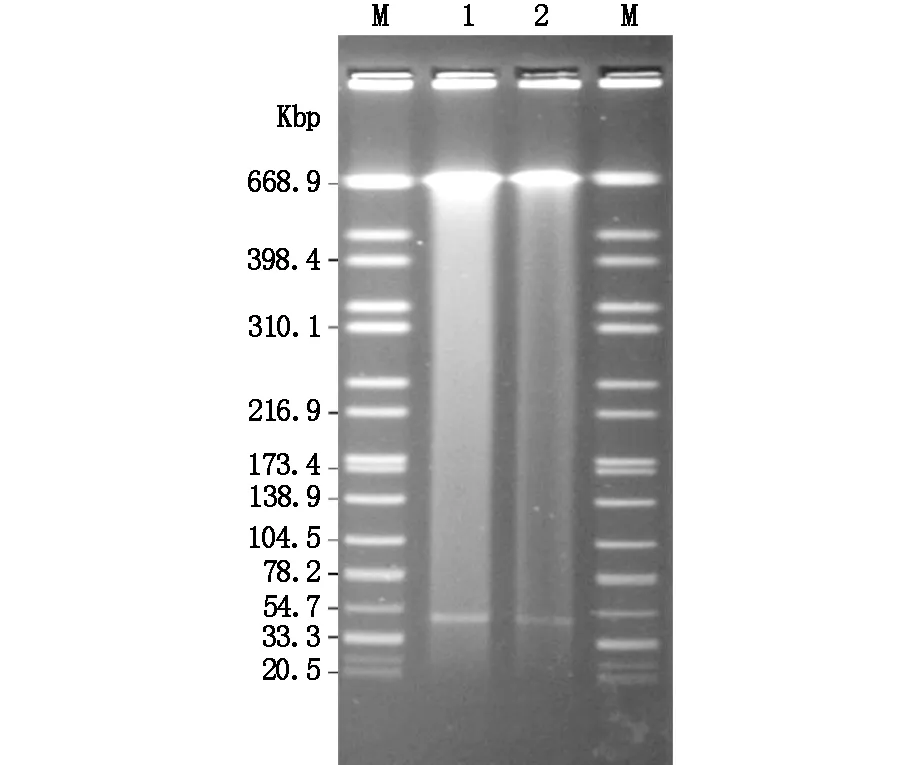
图2 S1核酸酶切的脉冲场凝胶电泳结果图
3 讨论
耐碳青霉烯类肠杆菌构成了全球紧迫的抗生素耐药性威胁,因为它既能通过克隆播散,又能通过诸如质粒等移动遗传元件介导将碳青霉烯酶基因水平转移到其他细菌。OXA-181是最常见的OXA-48-like碳青霉烯酶之一,世界上许多国家都报道了产生OXA-181酶的肠杆菌,并且携带blaOXA-181基因的细菌主要是肺炎克雷伯菌和大肠埃希菌[5],但尚未有克吕沃尔氏菌属细菌携带该基因的报道。因此,本研究的栖冷克吕沃尔氏菌临床株PD49携带blaOXA-181基因属于国内外首次报道。
厦门希瓦菌(Shewanellaxiamenensis)被认为blaOXA-181基因的祖先,其染色体遗传结构与报道的ColE型携带blaOXA-181基因的质粒相似[8]。PD49株携带1个被命名为pPD49-OXA-181的质粒,大小为51 479 bp,且碳青霉烯酶基因blaOXA-181和喹诺酮类耐药基因qnrS1都位于该质粒上,并可经液相接合试验传递到E.coliJ53AziR,这与LIU的结果[9]类似。依据复制子,该质粒属于ColKP3/IncX3杂合型。YU等[10]从NCBI RefSeq数据库下载的35150个细菌质粒中鉴定出的81个blaOXA-181阳性质粒呈现多种类型,但主要由IncX3型质粒携带。然后,YU等又系统地比较了66个blaOXA-181阳性IncX3质粒的宿主菌株、质粒类型和遗传背景,发现携带blaOXA-181的IncX3质粒大多为ColKP3/IncX3杂合质粒,每个质粒长度为51 kb,主要分布在大肠埃希菌和肺炎克雷伯菌中。另外,大多数携带blaOXA-181的IncX3质粒来自人类和大多数IncX3质粒同时含有blaOXA-181和qnrS1基因[10],这与本文研究的pPD49-OXA-181质粒相同。另外,与blaOXA-48的序列相比较(GenBank Accession Number KC354801.1),本研究的质粒pPD49-OXA-181携带的blaOXA-181基因显示了45个核苷酸替代,导致4个氨基酸差异(T104A,N110D,E168Q和S171A)。
本研究的栖冷克吕沃尔氏菌临床株PD49的染色体(PD49-chr)上携带有超广谱β-内酰胺酶blaKLUC-1基因以及多个耐药相关的外排泵基因,如acrA、acrB、TolC、mdtB、和mdtC等。
超广谱β-内酰胺酶KLUC由blaKLUC基因编码,属于CTX-M型酶。迄今为止,blaKLUC基因有6个亚型(https://www.ncbi.nlm.nih.gov/pathogens/refgene#KLUC)。2001年,从栖冷克吕沃尔氏菌中发现一个位于染色体上命名为blaKLUC-1的新基因,编码超广谱β-内酰胺酶(ESBL),它与其他CTX-M成员具有77%~86%的相同氨基酸[3]。然而,blaKLUC-2基因编码的KLUC-2是一种质粒介导的CTX-M家族ESBL,从阴沟肠杆菌中鉴定出来,与KLUC-1相比具有单一氨基酸差异(G115R)[11]。随后,blaKLUC-3和blaKLUC-4基因(编码超广谱β-内酰胺酶KLUC-3和KLUC-4)也都被证明位于大肠埃希菌和阴沟肠杆菌携带的质粒上[12]。最近,LI 等[13]报道肺炎克雷伯菌临床株携带blaKLUC-5基因,且该基因也位于质粒上。与之前发现的KLUC-1(G18S)和KLUC-3(G240D)相比,blaKLUC-5基因编码的KLUC-5酶具有氨基酸替代。blaKLUC-6基因由Tanabe在日本的城市污水中分离的栖冷克吕沃尔氏菌6BC3中发现,于2022年提交了该基因的序列(GenBank Accession Number NG_148621.1)。以上研究和报道提示,blaKLUC基因可通过移动遗传元件在菌株的染色体和质粒之间进行转移。
对于喹诺酮(fluoroquinolones,FQ)耐药的传播,质粒介导的喹诺酮类耐药(plasmid-mediated quinolone resistance,PMQR)基因起着主要作用。已知几种PMQR基因(qnr,aac(6’)-lb-cr,qepA和oqxAB)与FQ易感性降低有关。特别是qnrS1被报道为来自食品、牲畜和人源的大肠埃希菌中可传播的FQ抗性基因。另外,qnrS1基因常与广谱β-内酰胺酶或其他抗菌药物的耐药基因共存在同一个质粒上,以便通过抗微生物的共选择,使这些菌株能够长期存在,这不仅提供了选择优势,而且促进了它们的传播。此外,qnrS1基因的高度流行与携带该基因的质粒类型相关,如IncX型质粒最多见[14]。本研究的栖冷克吕沃尔氏菌临床株PD49携带的blaOXA-181和qnrS1共存于ColKP3/IncX3杂合型pPD49-OXA-181质粒上,这进一步提示了这两个基因的传播和流行都与IncX型质粒相关。
综上所述,本研究表明栖冷克吕沃尔氏菌临床株PD49对碳青霉烯类耐药的分子机制与其携带blaOXA-181基因有关。另外,同时携带blaKLUC-1、blaOXA-181和qnrS1基因的克吕沃尔氏菌为国内外首次报道。此外,本研究结果有助于增强对携带blaOXA-181和qnrS1基因的IncX3质粒的遗传多样性和特征的理解,并进一步阐明了它们在获得和传播这两个基因的肠杆菌中的作用。
