载脂蛋白C1在肾透明细胞癌中表达及意义
2023-09-25张玉玺崔万里孙熙武付永涛布占强晋学飞
张玉玺,崔万里,孙熙武,付永涛,布占强,晋学飞,3*
(1.吉林大学中日联谊医院 泌尿外科二病区,吉林 长春130033;2.吉林省泌尿系统肿瘤分子诊断重点实验室,吉林 长春130033;3.吉林省泌尿系统肿瘤重点实验室,吉林 长春130033)
肾透明细胞癌(clear cell renal cell carcinoma,CCRCC)是肾癌中常见的一种病理类型,约占所有肾细胞癌的75%~80%[1-2]。目前研究认为CCRCC具有较高的侵袭性,且对于化疗、放疗的敏感性较差,导致其病死率也较高,预后较差,晚期CCRCC患者的5年总体生存率(overall survival,OS)约为10%,且对靶向治疗不敏感[3-5]。载脂蛋白C1(apolipoprotein C1,APOC1)是载脂蛋白C家族的一员,其编码基因位于19号染色体[6]。目前研究认为APOC1可以通过调节脂蛋白代谢相关的酶的活性,影响外周血脂蛋白的代谢[7]。新近研究发现APOC1与大肠癌、胃癌、肺癌、前列腺癌等恶性肿瘤的发生及预后相关[8]。另外,KO等[9]研究发现APOC1在糖尿病肾病患者的肾小球组织中上调,并通过促进肾小球的硬化,促进糖尿病肾病的进展。本研究旨在通过生物信息学及体外实验,观察APOC1在CCRCC中的表达情况,及其与临床病理学指标和预后的关系。
1 材料与方法
1.1 数据来源
从癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库中获取CCRCC的肿瘤组织和正常组织的基因组数据和临床病理学数据,分析APOC1在两组之间的表达差异、与临床病理学参数以及预后的关系。
1.2 细胞培养与转染
786-O和UT33A细胞系均为CCRCC细胞系,HK-2细胞系为人肾皮质近曲小管上皮永生化细胞系,均购自ATCC。培养基为RPMI-1640,10%胎牛血清(FBS),100 U/ml青霉素和0.1 mg/ml链霉素。细胞培养环境条件为37℃,5%浓度CO2。应用siRNA敲降细胞系中APOC1的表达,si-APOC1-#1序列:5’-TTTGGAAACACACTGGAGGA-3’,si-APOC1-#2序列:5’-AACTCATCAGCCGCATCAAA-3’,con-APOC1序列:5’-CGAACUCACUGGUCUGACC-3’,靶向APOC1过表达载体pcDNA3.1-APOC1均由上海吉凯生物技术有限公司设计合成。转染试剂应用Lipofectamine 3000(Invitrogen,Carlsbad,CA),按照说明书进行操作。
1.3 RNA的提取及表达检测
应用TRizol试剂提取细胞中总RNA。本次研究应用RT-qPCR方法检测mRNA的表达。APOC1引物序列:正向引物5’-AGGACAAGGCTCGGGAACTCAT-3’,反向引物5’-GATGTCACCCTTCAGGTCCTCA-3’,选择β-actin作为内参,引物序列:正向引物5’-GCAGGAGTATGACGAGTCCG-3’,反向引物5’-CGGACTCGTCATACTCCTGC-3’。基因相对定量采用2-△△Ct法计算。
1.4 蛋白表达测定
应用蛋白印迹法测定细胞中蛋白表达。应用含蛋白酶抑制剂的Ripa裂解液提取细胞中总蛋白,使用BCA试剂盒定量蛋白浓度。采用常规Western blot方法,用聚丙烯酰胺凝胶电泳法进行电泳,然后转移到聚偏氟乙烯(PVDF)膜上,5%脱脂奶粉封闭15 min,4 ℃下用一抗孵育过夜。次日用TBS-T将PVDF膜清洗3次,常温下与二抗孵育1 h,再用TBS-T洗膜3次,用ECL显影液显影。相关抗体均购自Abcam公司。
1.5 细胞增殖能力测定
应用CCK-8法和集落形成法测定细胞增殖能力。CCK-8法:在96孔板中每孔铺2×103个细胞,在0、24、48和72 h时,用CCK-8试剂盒分别检测450nm激发波长的吸光光度值。集落形成法:在6孔板中每孔均匀种5×102个细胞,在培养箱中培养10 d,每3 d更换一次培养基,用4%多聚甲醛将细胞集落固定,0.1%结晶紫染料染色20 min,拍照并计集落形成数。
1.6 细胞迁移能力测定
应用Transwell法检测细胞迁移能力。在Transwell板的上室中每孔加入1×105个细胞,并加入200 μl无血清培养基,下室加入500 μl含10%FBS的培养基。在培养箱中培养24 h,取出小室,擦除上室参与细胞,将下室细胞用4%多聚甲醛固定,0.1%结晶紫染料染色20 min,显微镜下选取5个互不重叠视野,计细胞数。
1.7 统计学方法
采用SPSS 25.0统计分析软件对数据进行分析。应用t检验比较两组之间的差异,多组之间的对比通过单向ANOVA方差分析和Dunnett进行评估。χ2检验用于评估基因表达与临床特征之间的相关性。当P<0.05时,差异具有统计学意义。
2 结果
2.1 APOC1在CCRCC组织中的表达情况
在TCGA数据库中,共有532例CCRCC组织样本和72例癌旁组织样本的基因表达数据。APOC1在CCRCC组织中的表达显著高于癌旁正常组织(P<0.001),且在各个期别肿瘤组织中的表达均显著高于癌旁正常组织(P<0.001)。qRT-PCR结果提示,CCRCC细胞系(786-O和UT33A)中APOC1的表达显著高于HK-2细胞系(图1)。

图1 APOC1在CCRCC组织中的表达
2.2 APOC1的表达与临床病理资料的关系
分析CCRCC肿瘤组织中APOC1的表达与临床病理资料的关系,APOC1的表达与肿瘤分级、病理TNM分期、病理T分期、M分期相关(表1)。此外,根据APOC1表达中位数,将532例患者分为APOC1高、低表达两组。APOC1高表达的患者,OS显著低于APOC1低表达的患者,风险比(高表达组:低表达组)为1.428(图2)。
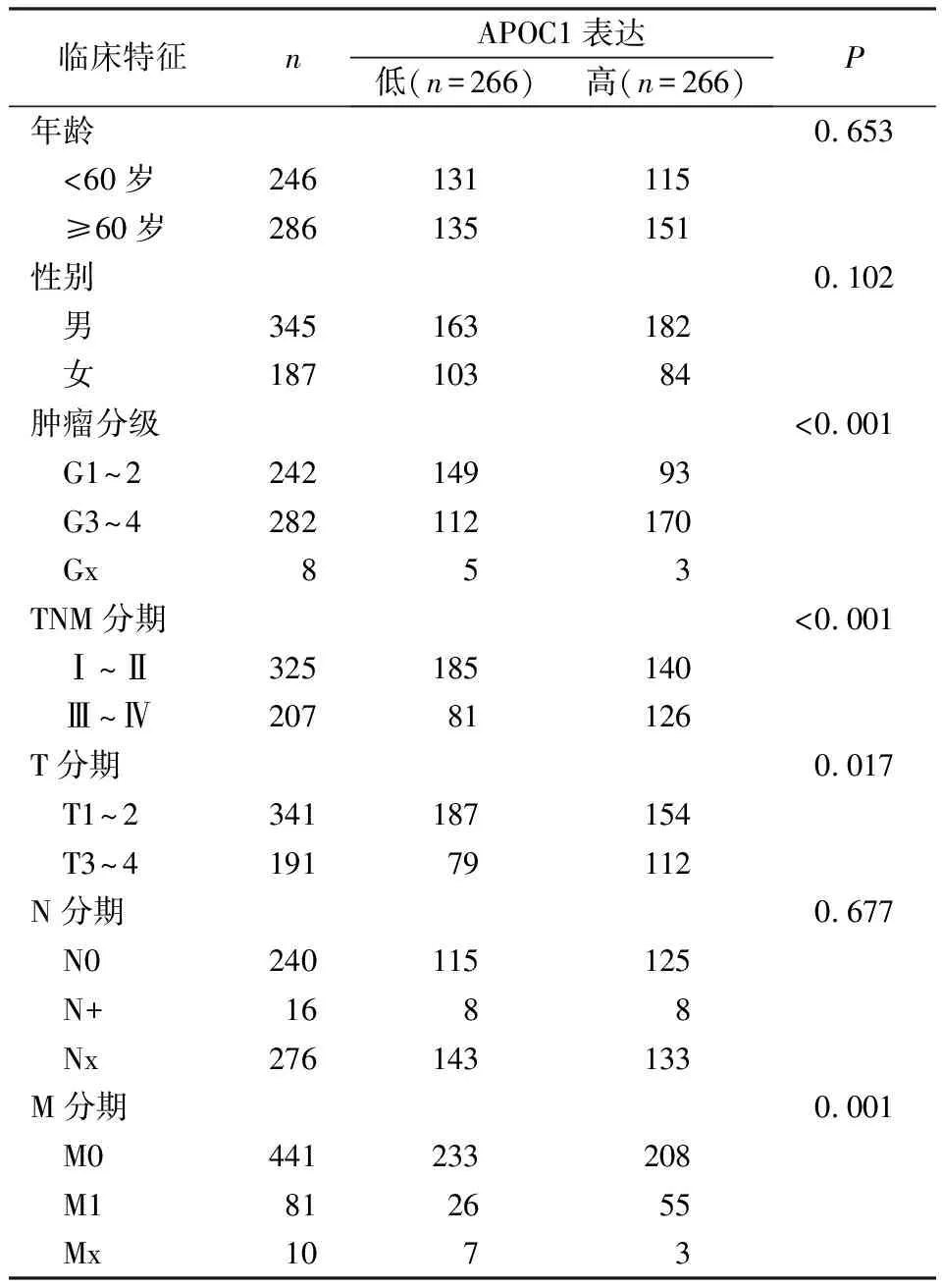
表1 APOC1的表达与临床病理资料的关系
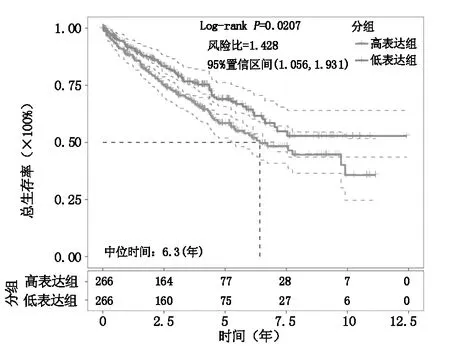
图2 APOC1的表达与OS的关系
2.3 敲降和过表达APOC1细胞株的构建
将si-APOC1#1、si-APOC1#2和con-APOC1转染至786-O细胞,构建APOC1敲降细胞株,发现si-APOC1#1敲降效率更高,故使用该细胞株作为APOC1敲降细胞株,命名为786-O-APOC1-KD,将con-APOC1转染细胞株命名为786-O-APOC1-CON。将靶向APOC1过表达的载体pcDNA3.1-APOC1转染至UT33A细胞,构建APOC1过表达细胞株,命名为UT33A-APOC1-OE,空载体pc-DNA3.1转染的UT33A细胞命名为UT33A-APOC1-vector。构建完成的细胞株用qRT-PCR和WB进行验证(图3)。
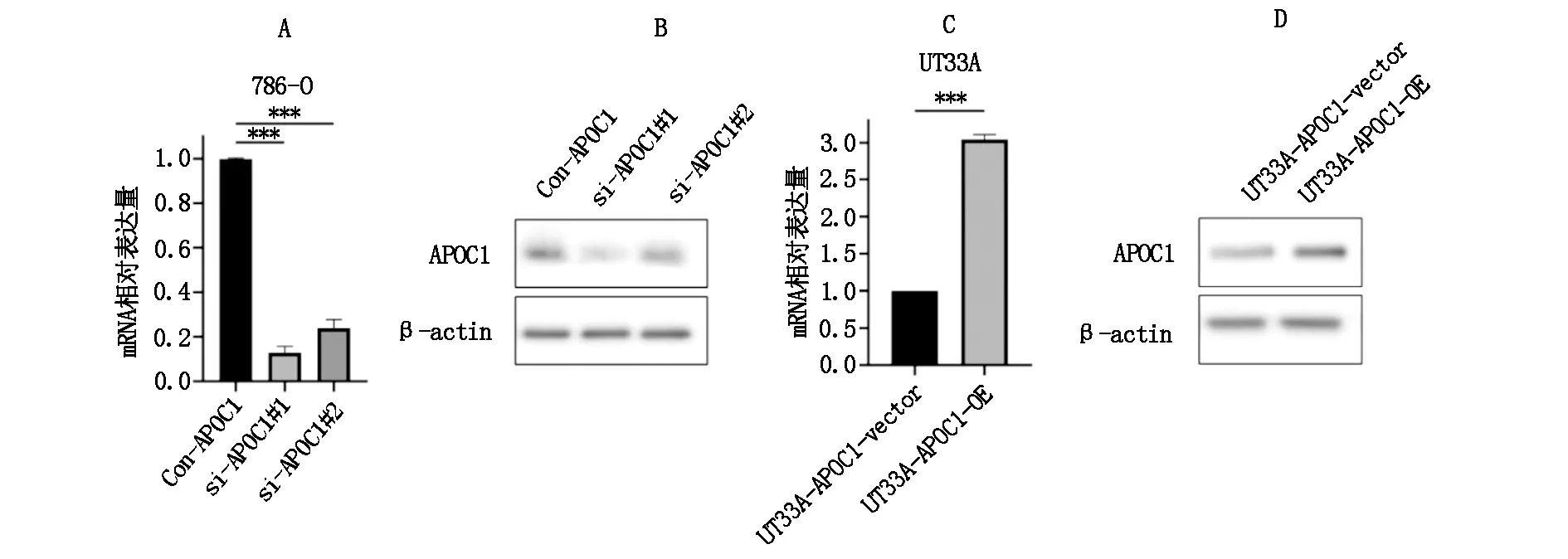
图3 敲降和过表达APOC1细胞株的构建
2.4 APOC1的表达对CCRCC细胞生物学功能的影响CCK-8结果显示,786-O-APOC1-KD细胞株增殖能力显著低于786-O-APOC1-CON细胞,而UT33A-APOC1-OE细胞株增殖能力显著高于UT33A-APOC1-vector。Transwell结果显示,786-O-APOC1-KD细胞株迁移能力显著低于786-O-APOC1-CON细胞,而UT33A-APOC1-OE细胞株迁移能力显著高于UT33A-APOC1-vector(图4)。
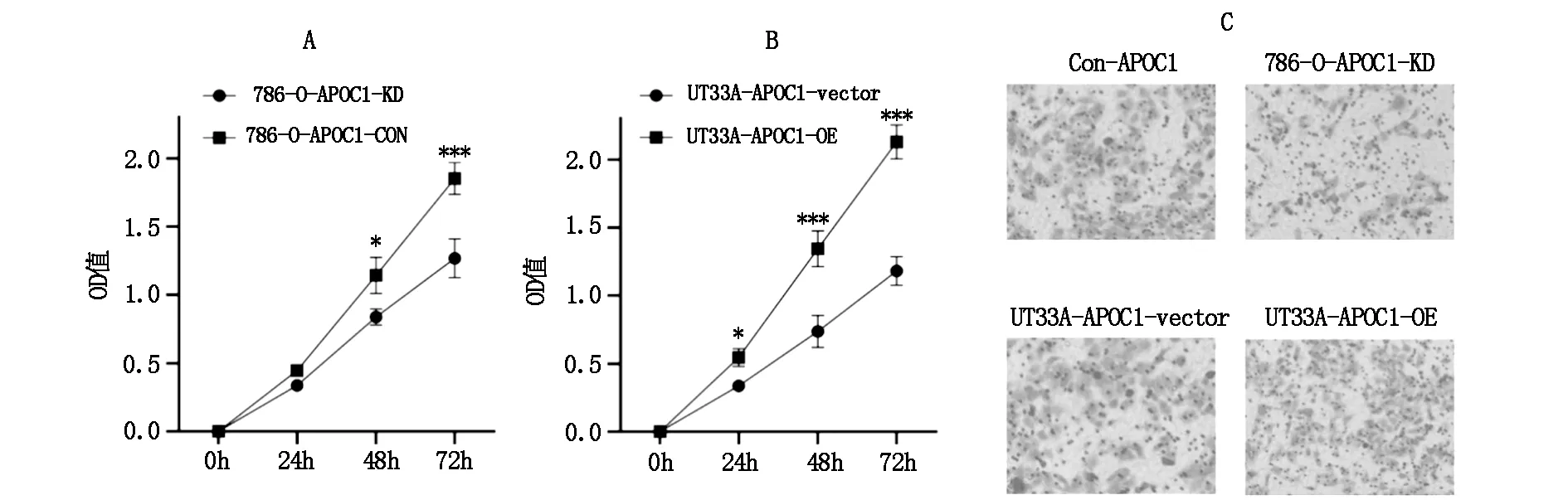
图4 APOC1的表达对CCRCC细胞生物学功能的影响
2.5 APOC1的表达对上皮间质转化的影响应用WB检测786-O-APOC1-KD、786-O-APOC1-CON、UT33A-APOC1-OE和UT33A-APOC1-vector细胞株中上皮间质转化(Epithelial-mesenchymal transition,EMT)通路相关蛋白的表达情况。发现786-O-APOC1-KD细胞株中E-cad水平显著升高,而N-cad、Vimentin和Snail表达水平低于786-O-APOC1-CON。而在UT33A-APOC1-OE和UT33A-APOC1-vector细胞株中得到了相反的结果(图5)。
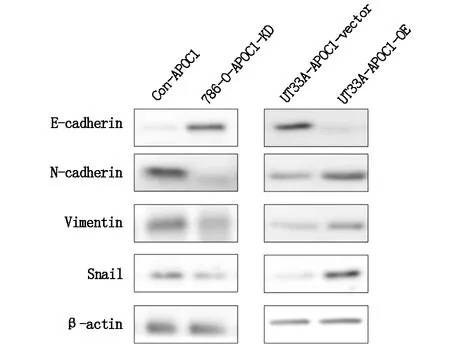
图5 APOC1的表达对上皮间质转化的影响
3 讨论
APOC1最初在脂质代谢相关疾病中被发现,随后大量研究表明,其参与了诸如糖尿病、肾小球硬化、动脉粥样硬化等多种疾病的发生和发展过程[10-11]。近年来,关于APOC1与肿瘤的关系的研究日益增多,其异常表达可能与乳腺癌、胃癌等多种恶性肿瘤预后相关[12-13],这些研究均表明APOC1高表达可能预示着较差的预后和较高的恶性程度。本研究结果显示,CCRCC患者肿瘤组织中APOC1水平显著升高,且与性别、肿瘤分级、病理TNM分期,病理T分期和M分期相关,并且APOC1高表达的患者预后更差。这提示APOC1可能是CCRCC诊断和治疗的新兴分子靶点。
一些体外研究证明APOC1可能参与了调节肿瘤细胞的生物学功能。SU等[14]研究发现降低前列腺癌细胞系中APOC1的表达,可以降低细胞的增殖速度,并在一定程度上可以促进肿瘤细胞的凋亡。TAKANO等[15]研究发现APOC1过表达,可能会使胰腺癌细胞的侵袭性增强。此外,APOC1还被证实可能作为乳腺癌的生物标志物之一,其体外研究也发现APOC1低表达的细胞,其增殖速度也较慢[16]。本研究发现APOC1在CCRCC中表达上调,通过构建APOC1敲降和过表达的CCRCC细胞株并进行体外功能实验,发现APOC1的过表达可能增强CCRCC细胞的恶性生物学行为,而降低APOC1的表达可以得到相反的结果,这提示APOC1可能加剧了CCRCC的恶性生物学行为,并可能促进了CCRCC的进展。
EMT最初认为是在人类正常发育中起着较为关键的作用,在之后的研究中发现肿瘤进展和转移过程也伴随着肿瘤细胞发生EMT。当细胞发生EMT后,肿瘤细胞极性降低,迁移能力增强,并容易发生远处转移[17-18]。所以,抑制EMT过程,可能会降低肿瘤发生转移或者复发的几率,这也为以EMT为靶点治疗肿瘤提供了理论依据。此次研究结果提示,APOC1的表达与CCRCC细胞的EMT过程呈正相关。E-钙黏蛋白的表达降低或缺失是肿瘤发展过程中,肿瘤细胞发生EMT的关键步骤,其表达水平降低提示肿瘤细胞黏附连接能力降低,不稳定性增强,故更容易发生肿瘤细胞迁移。此次研究结果提示,APOC1过表达可能会诱导CCRCC细胞发生EMT,提高了肿瘤细胞的恶性程度,从而影响了患者的预后。
综上,APOC1在CCRCC组织中表达上调,其可能通过促进CCRCC的EMT,影响肿瘤细胞表型及患者预后,APOC1可能是治疗CCRCC的新靶点。
