间充质干细胞来源的外泌体对2型糖尿病小鼠胰岛功能和炎症因子的影响
2023-09-25王振刚张闻达朱长吉李柱虎
王振刚,付 塬,张闻达,朱长吉,李柱虎
(延边大学医学院 病理学与病理生理学教研室,吉林 延吉133002)
流行病学调查显示我国糖尿病总患病人数为1.298亿,患病率高达12.8%,且呈逐年上升趋势[1]。在糖尿病患者中,2型糖尿病约占95%以上,并呈年轻化趋势,给患者及其家庭带来巨大的心理及经济负担[2]。大量研究发现,间充质干细胞(Mesenchymal stem cells,MSCs)移植能降低血糖,改善胰岛β细胞功能,降低糖尿病各种并发症发生的风险[3-7]。MSCs主要通过旁分泌的方式发挥组织损伤的修复作用,其中外泌体是MSCs旁分泌的主要成分[8-11]。本研究通过诱导2型糖尿病小鼠模型,探讨多次输注胎盘MSCs来源的外泌体对2型糖尿病小鼠的血糖水平、糖耐量水平、炎症因子水平及胰岛功能的影响,报道如下。
1 材料与方法
1.1 材料取4周龄健康的雄性C57BL/6小鼠30只,体重约20 g,购自北京维通利华公司。主要试剂:链脲佐菌素和4%的多聚甲醛组织固定液购自北京索莱宝生物有限公司。DAPI染液购于上海碧云天生物技术有限公司。α-MEM培养基、0.25%胰蛋白酶、胎牛血清(fetal bovine serum,FBS)购自HyClone公司,无外泌体血清及外泌体提取试剂盒购自SBI公司。抗胰岛素及抗胰高血糖素抗体分别购自武汉塞维尔生物科技有限公司。小鼠C-肽ELISA试剂盒和小鼠胰岛素ELISA试剂盒均购自酶联生物科技股份公司。Luminex试剂盒购自上海优宁维生物科技股份有限公司。罗氏活力血糖仪及血糖试纸均购自罗氏血糖健康医护公司。
1.2 胎盘MSCs外泌体的制备
采用含10%胎牛血清的α-MEM培养基培养MSCs,待细胞融合度达到70%左右,更换含10%无外泌体血清的α-MEM培养基继续培养48 h后,收集细胞上清,然后采用SBI外泌体提取试剂盒提取外泌体。将获得的外泌体沉淀悬浮在PBS缓冲液中,分装并放于-80℃冰箱保存,备用。
1.3 外泌体的鉴定
使用透射电子显微镜(transmission electron microscope,TEM)观察外泌体的形态。取10 μl外泌体滴加在无定形碳包覆铜网上沉淀5 min,吸去多余液体,晾干。滴加10 μl的1%磷钨酸复染2 min,吸去多余液体,晾干。通过TEM观察外泌体并照相。采用NanoSight纳米颗粒跟踪分析仪测定外泌体的粒径分布范围及浓度。取20 μl外泌体进行50倍稀释,然后进行上机检测。
1.4 模型建立及分组
从购买的30只小鼠中随机取出24只作为造模组,剩余6只作为对照组。造模组进行高脂高糖饮食喂养8周后,按40 mg/kg的剂量进行腹腔注射链脲佐菌素溶液一次,连续注射5天。正常组小鼠正常饲养8周后,腹腔注射等剂量的PBS一次,连续注射5天。一周后开始检测小鼠血糖,连续3天检测随机血糖大于等于13.9 mmol/L的小鼠被认为糖尿病造模成功。将糖尿病小鼠随机分为模型组和外泌体治疗组。模型组小鼠每隔一天尾静脉注射100 μl PBS,外泌体治疗组每隔一天尾静脉注射20 μg外泌体,治疗4周。治疗结束后,再观察2周,对小鼠行安乐死,收集胰腺组织和血清样本。
1.5 观察指标
1.5.1体重和血糖检测 第一次静脉注射外泌体后每周测定一次体重和随机血糖,随机血糖监测均于上午9:00~10:00进行。
1.5.2腹腔内葡萄糖耐量实验(intraperitoneal glucose tolerance test,IPGTT) 外泌体治疗4周后行腹腔注射葡萄糖耐量实验。小鼠禁食12 h,腹腔注射葡萄糖溶液(2.0 g/kg)。在注射后0、30、60、90和120 min分别测定血糖水平。
1.5.3酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA) 获得全血后,室温放置1 h 后,3 000 g 离心10 min,取上层血清检测。根据ELISA试剂盒说明书检测小鼠血清中C-肽和胰岛素水平。
1.5.4Luminex多因子检测 按照Luminex多因子检测说明书检测小鼠血清中的IL-1β、IL-4、IL-10、IL-12、IFN-γ和TNF-α等炎症因子水平。
1.6 胰腺组织HE染色及免疫荧光染色
4%的多聚甲醛固定组织48 h,常规石蜡包埋并制作石蜡切片,进行HE染色并用光学显微镜观察拍照。石蜡切片经脱蜡、梯度酒精脱水后,进行抗原修复,然后在1%BSA中封闭30 min。再将石蜡切片与抗小鼠胰岛素抗体和抗小鼠胰高血糖素抗体在4℃下孵育过夜。次日,PBS洗涤3次后,加入稀释好的荧光二抗避光孵育1 h。最后,使用荧光显微镜观察并拍照。
1.7 统计学处理
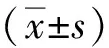
2 结果
2.1 MSCs外泌体的鉴定
采用外泌体试剂盒提取的MSCs外泌体通过透射电镜可以观察到膜结构完整,为直径小于200 nm的圆形囊泡(图1A)。对获得的MSCs外泌体进行纳米颗粒跟踪分析,显示其直径小于200 nm(图1B),符合外泌体的直径范围。
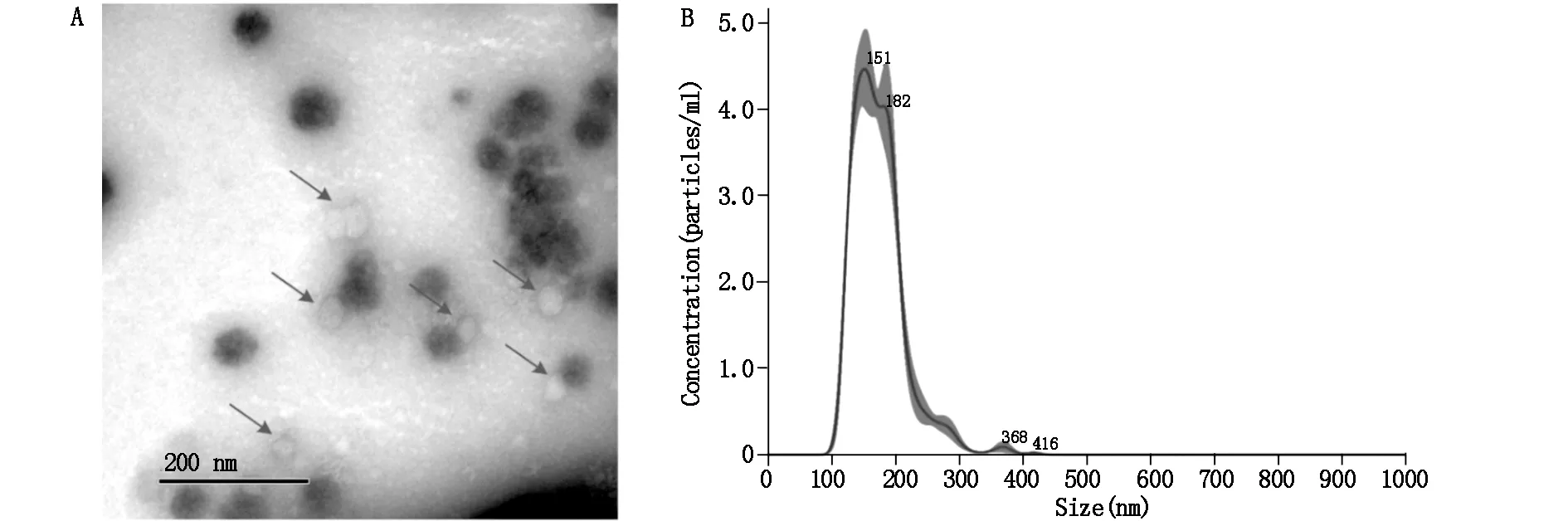
图1 MSCs外泌体的形态和鉴定
2.2 MSCs外泌体治疗后小鼠体重、血糖及糖耐量的变化
与模型组相比,MSCs外泌体治疗组的小鼠消瘦状态有所缓解(图2A),随机血糖明显降低(图2B)。IPGTT 实验结果显示任何时间点 MSCs外泌体治疗组血糖均明显低于模型组(图3)。
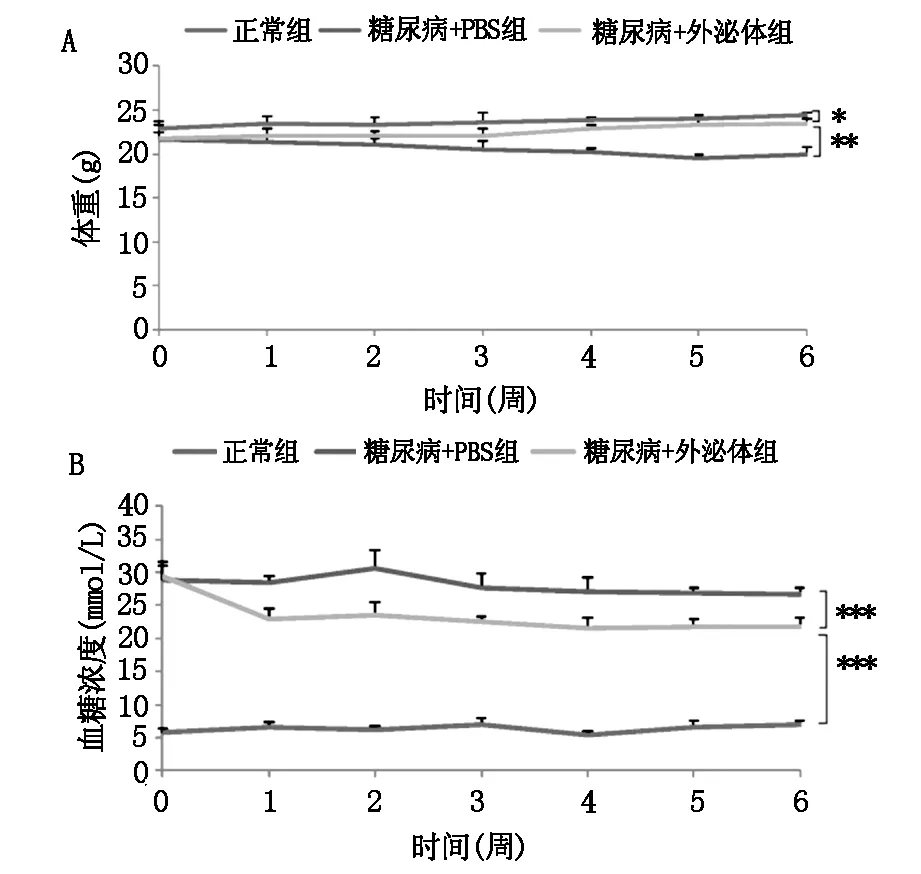
图2 多次输注MSCs外泌体对糖尿病小鼠随机血糖和体重的影响(*表示P<0.05,**表示P<0.01,***表示P<0.001)
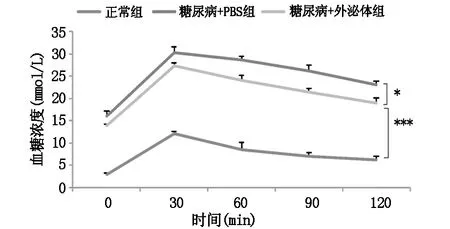
图3 多次输注MSCs外泌体对糖尿病小鼠糖耐量的影响(*表示P<0.05,***表示P<0.001)
2.3 MSCs外泌体治疗后小鼠血清中C-肽和胰岛素水平
与正常组相比,模型组的小鼠血清中C-肽水平和胰岛素水平均明显下降,与模型组相比MSCs外泌体治疗,小鼠血清中C-肽水平和胰岛素水平均明显升高(P<0.001)。见图4。
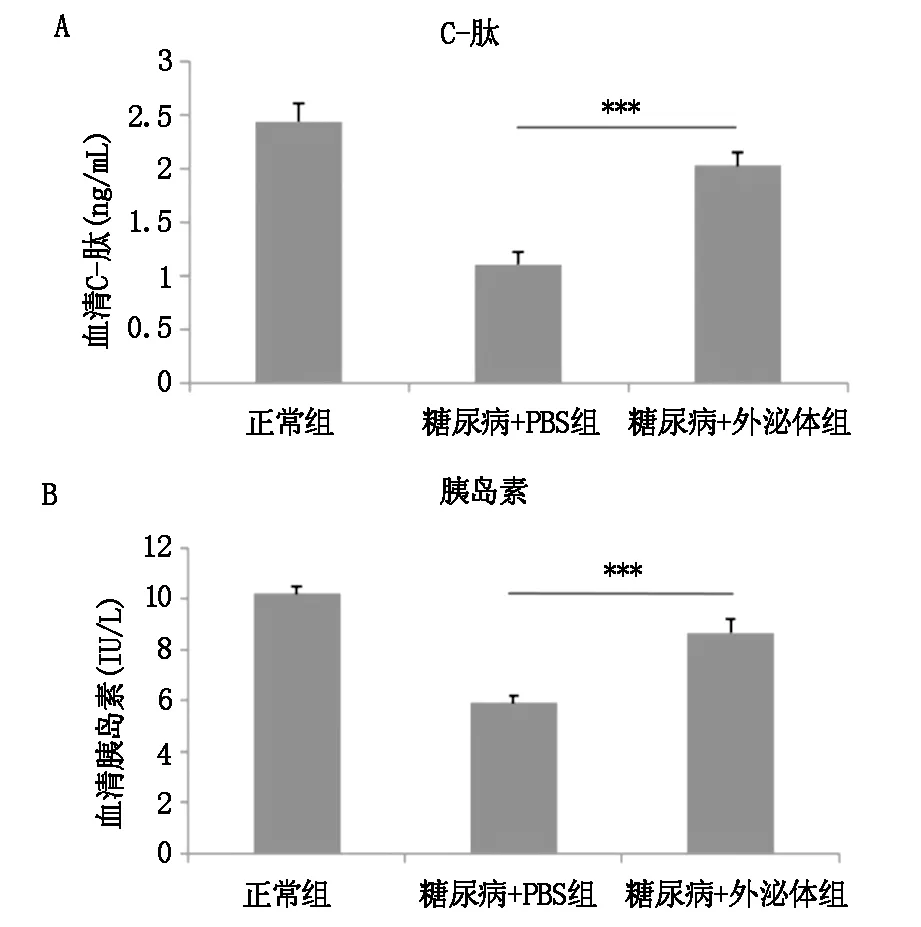
图4 小鼠血清中C-肽(A)和胰岛素水平(B)(***P<0.001)
2.4 MSCs外泌体治疗后小鼠血清中炎症因子水平
与正常组相比,模型组的小鼠血清中促炎症因子IL-1β、IL-12、IFN-γ和TNF-α水平均明显升高,抗炎因子IL-4和IL-10水平明显降低。与模型组相比经MSCs外泌体治疗小鼠血清中促炎症因子IL-1β、IL-12、IFN-γ和TNF-α水平均明显降低(P<0.001),而抗炎因子IL-4和IL-10水平明显升高(P<0.001)。见图5。
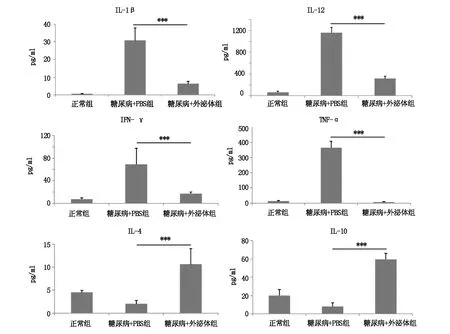
图5 小鼠血清中炎症因子水平(***P<0.001)
2.5 MSCs外泌体治疗后糖尿病小鼠胰腺组织HE染色及免疫荧光染色分析
HE染色及免疫荧光染色结果显示,正常组的小鼠胰腺组织形态完整,胰岛内细胞排列整齐;模型组小鼠胰岛明显变小,胰岛形态不规则,细胞排列紊乱,胰岛数目明显降低;与模型组相比,外泌体治疗组小鼠胰岛形态及大小得到明显改善,胰腺组织结构清晰可见,结构较完整(图6,图7),其胰岛β细胞的数量及比例与模型组比较也显著上升(图8)。
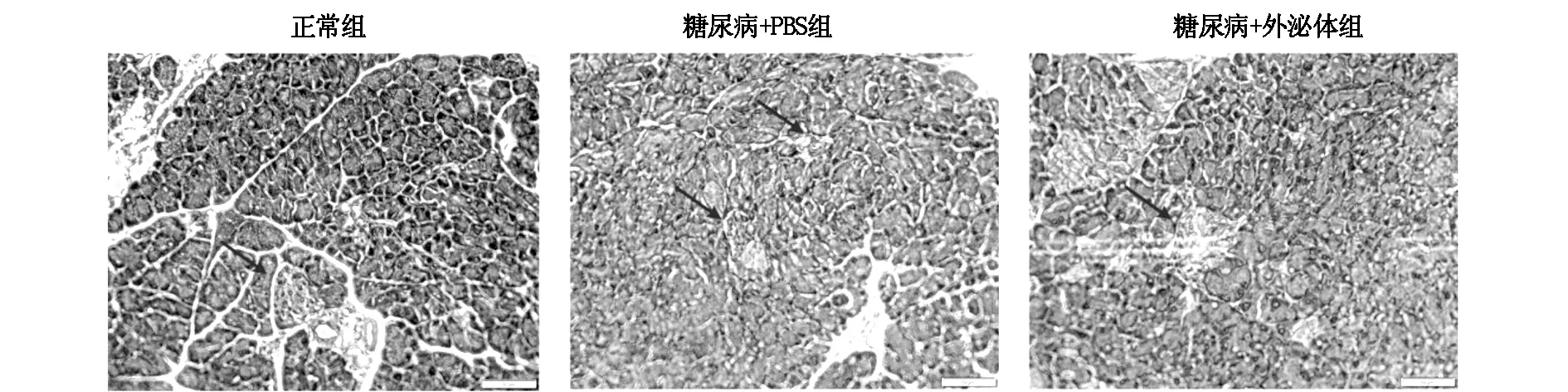
图6 各组小鼠胰腺HE染色图(×400)
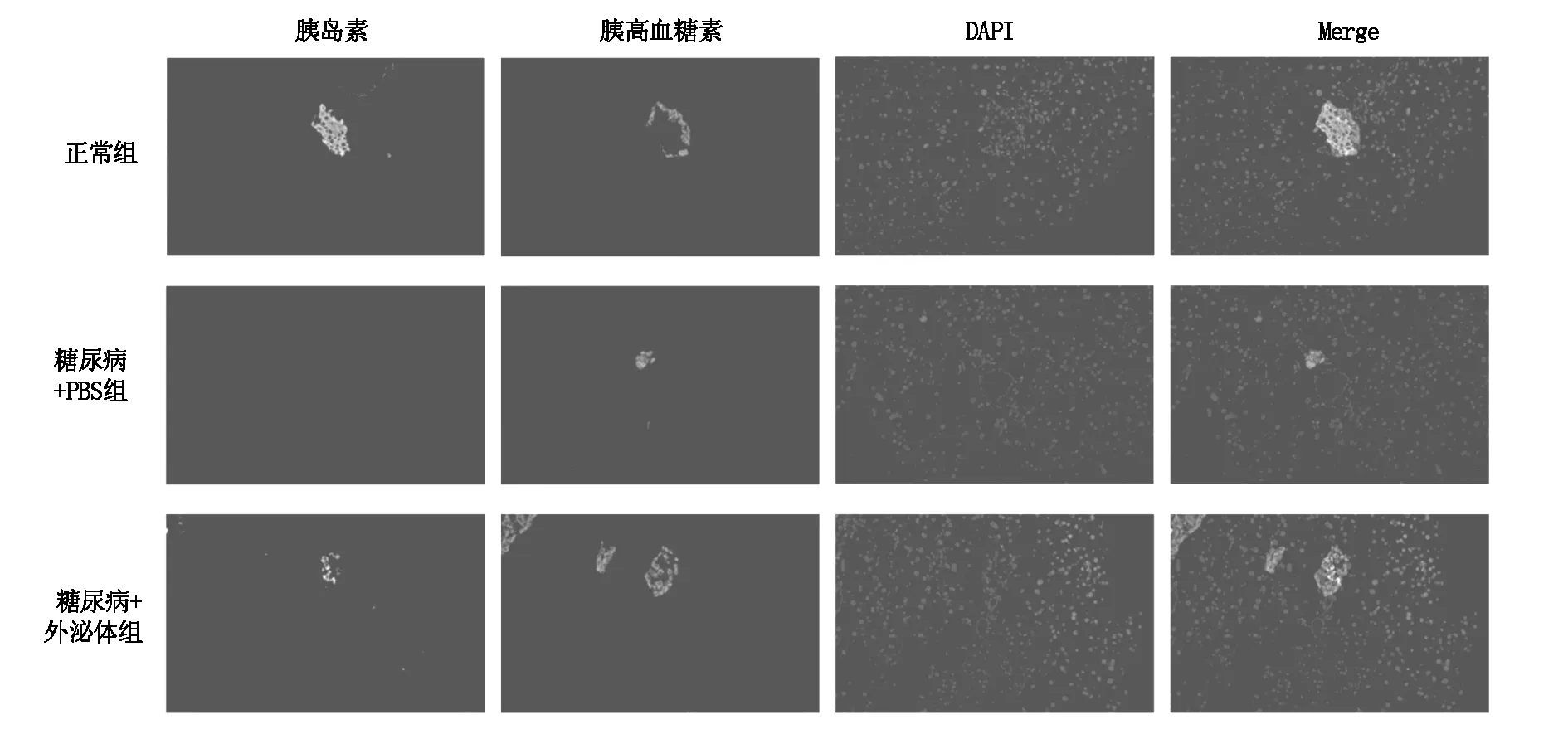
图7 各组小鼠胰腺免疫荧光染色图(× 200)
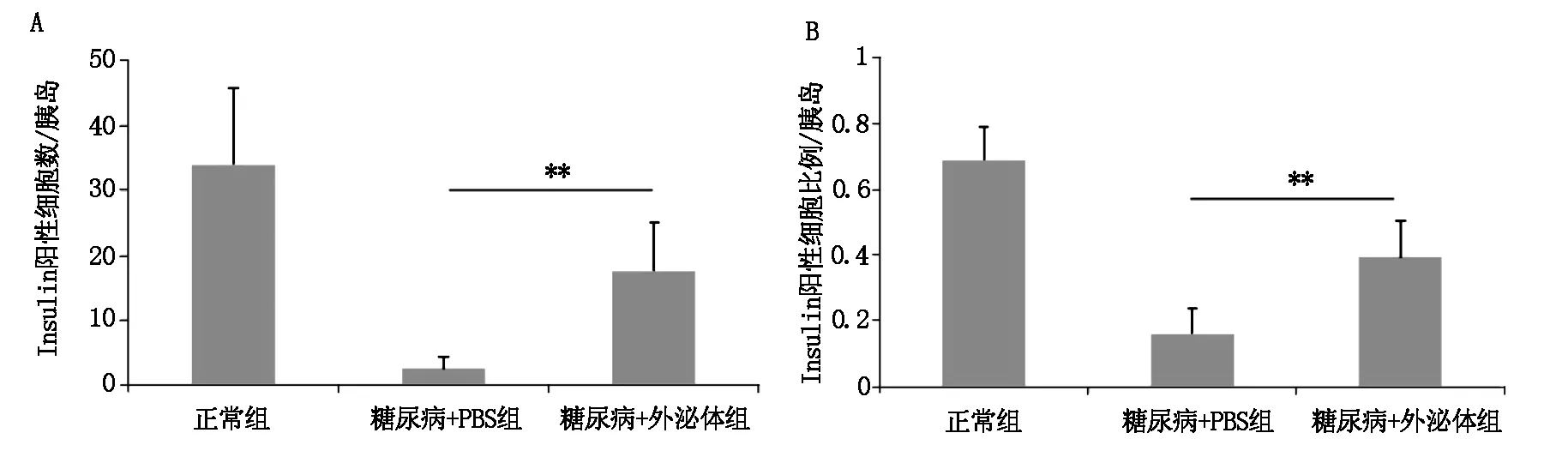
图8 各组小鼠胰岛β细胞数量及比例比较
3 讨论
研究证明,MSCs可以改善胰岛β细胞的功能,抑制胰岛β细胞凋亡,从而改善机体的高血糖状态[4,12-14]。MSCs可以在体外分化为β细胞或胰岛素产生细胞[15-17],但是HESS等[18]发现MSCs在体内仅可以刺激胰岛β细胞的增殖,却不能转分化为胰岛β细胞。MSCs也可能通过旁分泌多种细胞因子、生长因子或者外泌体进而改善胰岛功能[19-20]。
本研究采用多次输注MSCs外泌体的方式,探讨外泌体对2型糖尿病的价值。从血糖的检测数值、血清中C-肽、胰岛素及炎症因子水平以及病理分析不同实验组糖尿病小鼠胰腺组织的结果证明,经尾静脉多次输注MSCs外泌体可有效降低血糖、增加对葡萄糖的耐受能力,且抑制体内的炎症反应,促进胰岛细胞分泌胰岛素进而发挥降糖的作用。MSCs外泌体治疗组的小鼠,在输注外泌体一周后,其血糖水平下降较为明显,这可能与外泌体中含有大量的microRNA 有关。研究显示,MSCs外泌体中的miR-let-7a-5p,miR-24-3P和miR-19-b-1-5p能够提高胰岛β细胞功能进而促进胰腺修复[21]。因此,多次输注MSCs外泌体可以有效的降低血糖水平和抑制炎症反应,从而对2型糖尿病小鼠有良好的治疗作用。
