术中快速免疫组化在乳腺良恶性易混淆肿瘤诊断中的价值
2023-09-25王杨杨钗丽干苏依图
王杨杨,汪 锋,武 慧,钗丽干,苏依图
(1.内蒙古科技大学包头医学院,内蒙古 包头014010;2.内蒙古自治区人民医院 病理诊断中心,内蒙古 呼和浩特010000)
中国女性乳腺癌发病率和死亡率居世界首位,且近年来呈上升趋势[1]。术中冷冻诊断是乳腺肿物辨别良恶性的重要方法[2]。研究发现,术中冷冻延迟诊断的主要原因包括:浸润癌分化良好,难以与腺病鉴别;癌组织分化差或癌细胞胞质稀少,酷似淋巴瘤,干扰诊断;硬化性腺病造成假浸润与浸润性癌难以区别;导管不典型增生及导管原位癌与导管上皮普通型增生难以鉴别等[3]。术中快速免疫组化不需经抗原修复的过程,染色时间大大减少,且可提高术中快速病理诊断的符合率,能为冷冻诊断提供较为可靠的参考[4-9]。本研究针对乳腺良恶性易混淆病变,选用CK5/6、CK7、SMA三种抗体,应用术中快速免疫组化染色辅助诊断,分析该方法在此类疑难病例中的应用价值。
1 材料与方法
1.1 临床资料
收集2021年12月至2022年4月内蒙古自治区人民医院病理诊断中心接收乳腺术中冷冻标本78例,均为单侧乳腺。患者均为女性,中位数年龄46岁(29~73岁)。既往无乳腺恶性肿瘤手术病史。诊断标准参照第5版《WHO乳腺肿瘤分类》[10],由两名副主任医师以上人员对病理诊断及组织学分级进行再确认。本组良恶性易混淆病例包括导管原位癌29例、低级别浸润性癌11例(包括小管癌、筛状癌、微浸润性乳腺癌)、高级别浸润性癌6例、浸润性小叶癌7例、硬化性病变13例(包括硬化性腺病、放射状瘢痕/复杂硬化性病变)、普通型导管上皮增生3例、炎症性病变9例。本研究经医院伦理委员会审核批准。
1.2 方法
采用单纯术中冷冻制片、术中快速免疫组化法制片、常规石蜡及免疫组化制片。免疫组化抗体为CK7、CK5/6、SMA(抗体均购自福州迈新生物技术有限公司),操作按试剂盒说明进行。
1.3 统计学分析
使用统计学软件SPSS23.0处理所有数据,计数资料采用率或者例数表示,率的比较采用χ2检验或Fisher确切概率法,P<0.05表示差异有统计学意义。
2 结果
2.1 3种方法诊断乳腺肿瘤结果比较
本组78例乳腺病变常规冷冻诊断及结合快速免疫组化冷冻诊断与石蜡诊断的结果比较见表1、表2。本组病例中2例小叶癌常规冷冻延迟诊断,结合快速免疫组化明确诊断(图1)。2例硬化性病变常规冷冻延迟诊断,结合快速免疫组化诊断。2例常规冷冻诊断普通型导管上皮增生,结合快速免疫组化诊断为导管原位癌(图2),与常规免疫组化诊断结果一致。1例炎症性病变,组织细胞增生活跃,常规冷冻延迟诊断,结合快速免疫组化明确诊断(图3)。
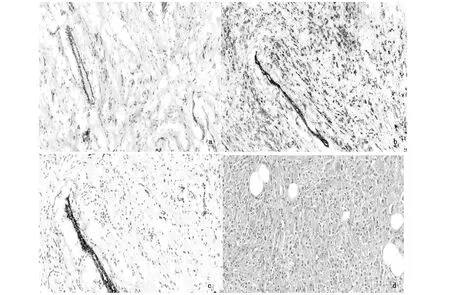
图1 浸润性小叶癌冷冻HE、快速免疫组化染色及石蜡HE病理图像[a为浸润性小叶癌冷冻HE切片,乳腺间质中散在肿瘤细胞呈组织细胞样(×200);b为术中快速免疫组化肿瘤细胞CK7阳性(×200);c为术中快速免疫组化肿瘤细胞CK5/6阴性(×200);d为石蜡HE切片肿瘤细胞呈组织细胞样散在间质中(×200)]
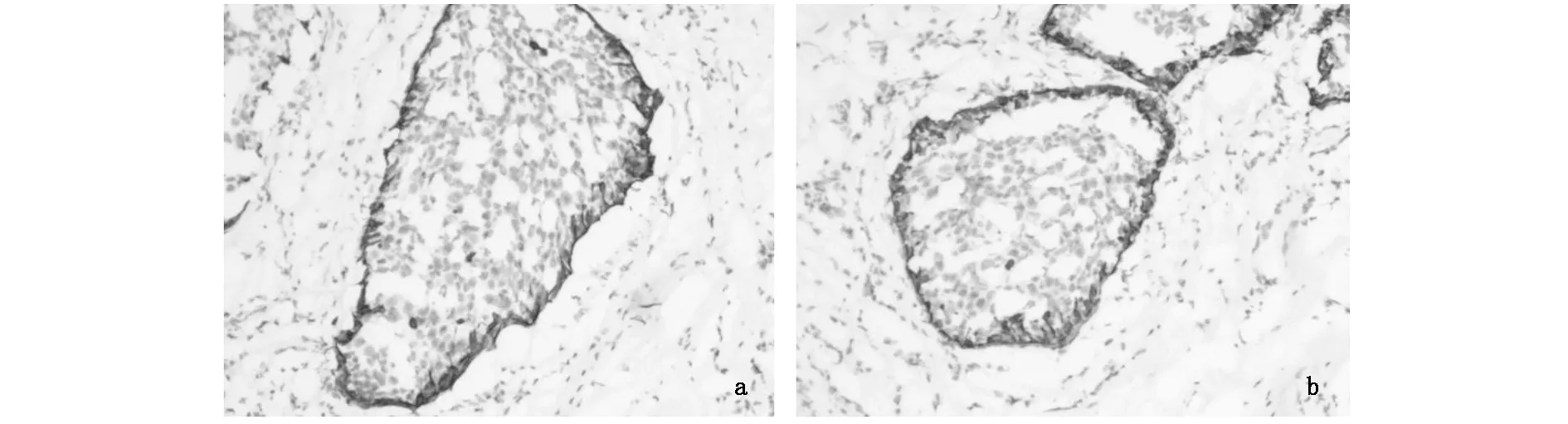
图2 导管原位癌快速免疫组化染色图像
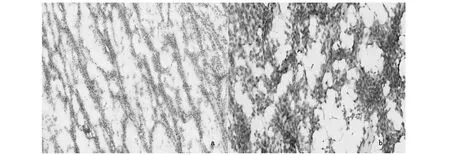
图3 乳腺炎症较重病变术中冷冻及快速免疫组化染色图像
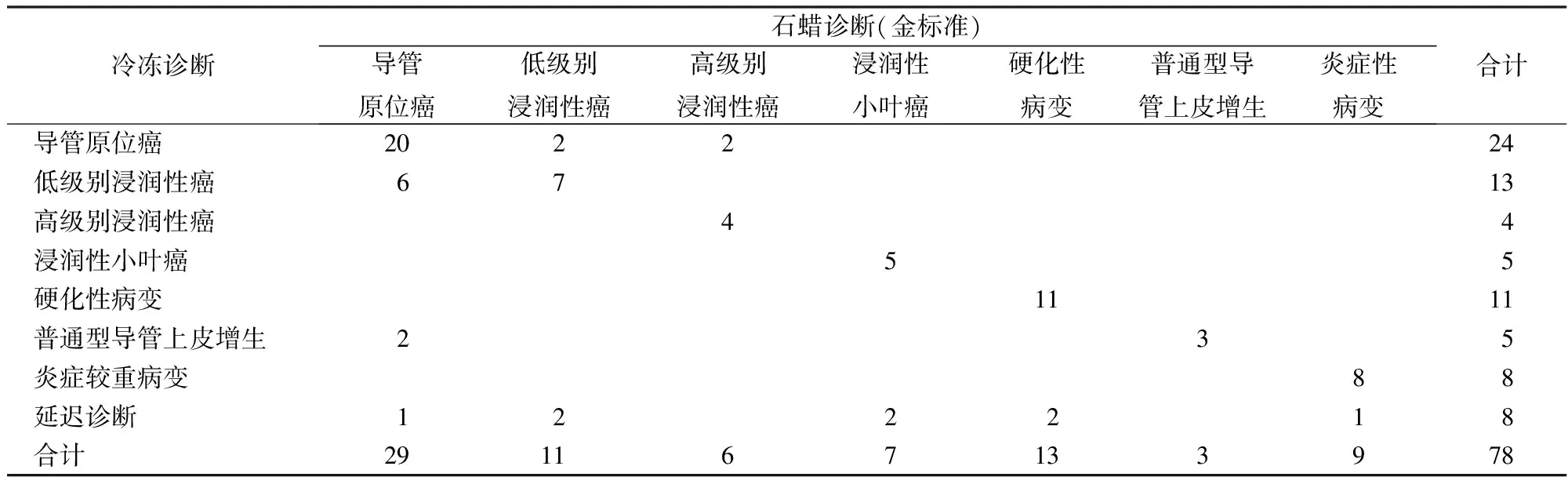
表1 78例乳腺肿瘤术中冷冻诊断与石蜡诊断比较
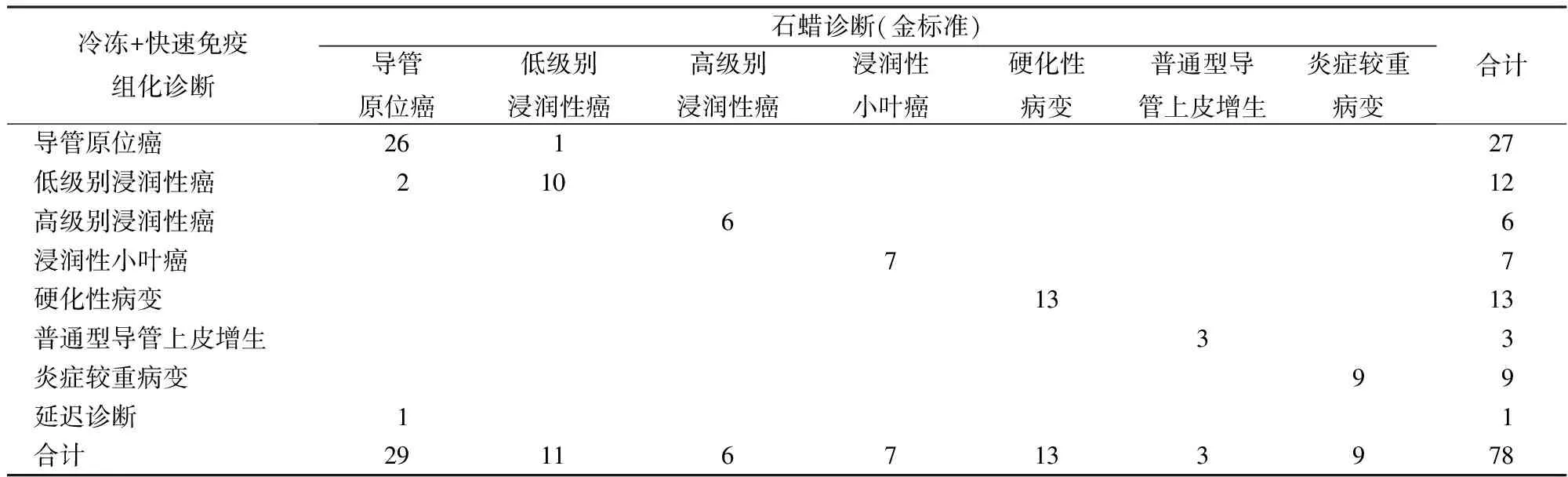
表2 78例乳腺肿瘤术中冷冻+快速免疫组化诊断与石蜡诊断比较
2.2 诊断符合性评价
与常规冷冻诊断相比较,结合快速免疫组化的冷冻诊断符合率显著提高、延迟诊断率下降,差异均具有统计学意义(P<0.05),见表3。与常规冷冻诊断相比较,结合快速免疫组化诊断的假阴性率有下降趋势,但差异无统计学意义(P>0.05)。
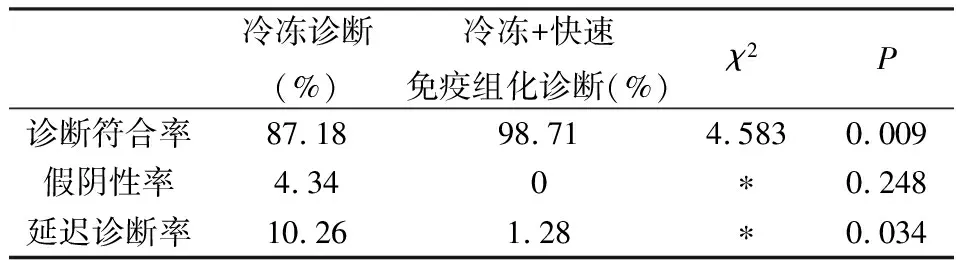
表3 78例乳腺肿瘤冷冻诊断与快速免疫组化诊断符合性比较
3 讨论
术中冷冻诊断结果是临床决定手术方案的重要方式,但有些病例会因为各种原因在冷冻诊断中只能给出倾向性诊断或延迟诊断,这就增加了患者二次手术的可能,同时病理医师及临床医师承担较高的诊断及治疗决策的压力。文献报道,乳腺乳头状病变等疑难病变利用快速免疫组化诊断符合率(98%)较术中冷冻诊断符合率(71%)显著升高,快速免疫组化假阴性率(0%)较术中冷冻诊断(65%)下降、快速免疫组化延迟诊断率(2%)较术中冷冻诊断(14%)下降,能为术中疑难病例提供较为可靠的诊断依据[11]。本研究针对良恶性易混淆疑难病变进行研究,发现本组病例快速免疫组化诊断符合率(98.71%)较单纯HE术中冷冻诊断符合率(87.18%)升高。快速免疫组化假阴性率(0%)较术中冷冻诊断(4.34%)有下降趋势。结合快速免疫组化延迟诊断率(1.28%)较术中冷冻诊断(10.26%)下降。与宋欣等[11]的文献报道较为一致。本组病例中,疑难病例原因主要在于:①低级别的恶性肿瘤的良恶性鉴别诊断;②高级别恶性肿瘤与淋巴瘤等化疗及靶向治疗为主的其他类型肿瘤的鉴别;③一些良性病变如炎症,因为术中冷冻自身特点导致组织细胞、血管内皮细胞及纤维母细胞等核增大深染,与肿瘤性病变鉴别困难;④乳腺硬化性病变结构复杂程度远远超过其他器官类似病变,易误诊为浸润性病变等。故本组选用CK5/6、CK7、SMA三种抗体。CK5/6一方面能提示低级别肿瘤的单克隆性增生,另一方面能较好标记原位癌周围的肌上皮,对比清晰,第三可以除外低级别化生性癌(如纤维瘤病样化生性癌[12-13]等)的存在,可谓一抗多用。CK7可以提示肿瘤的上皮属性,除外淋巴瘤、炎症等非上皮源性肿瘤及病变。SMA是乳腺肌上皮敏感性标记,对原位病变及浸润性病变鉴别诊断具有一定价值。且三种抗体均有容易得到的乳腺内对照,可以较好保证诊断的质量。
据报道少数分化差的乳腺癌,冷冻时很难排除淋巴瘤的可能,需与外科医生沟通,待石蜡切片及免疫组化进一步确诊,勿勉强诊断[14]。本组病例中,高级别浸润性癌中癌巢与周围组织界限不分明,周围炎细胞多时,与高级别导管原位癌及淋巴瘤不易鉴别,尤其是将淋巴瘤误诊为高级别浸润性癌,则导致乳腺切除及腋窝淋巴结的清扫。本组结合快速免疫组化指标CK7阳性明确了病变上皮来源属性,明确诊断,提高了冷冻符合率。
冷冻未明诊断的乳腺病变的病理特点,诊断最大的难点是导管上皮增生程度的把握和一定程度的导管上皮非典型增生,当病灶超过一定范围是癌非癌的问题[15]。本组病例中导管原位癌主要与普通型导管上皮旺炽性增生鉴别,有时导管原位癌也会出现部分旺炽性增生的特征,如细胞大小较不一致,不规则开窗,出现鉴别诊断困难,本组病例中2例单纯HE染色冷冻诊断不除外普通型导管增生,结合快速免疫组化CK5/6染色阴性后,诊断为导管原位癌(图2)。提高了冷冻诊断符合率。宋欣等[11]报道了8例乳头状瘤合并癌的冷冻诊断假阴性病例结合快速免疫组化的CK5染色后,均得到明确诊断。本组研究结果与此报道一致。
李巧稚等[16]的研究认为,硬化性腺病与浸润性导管癌的鉴别是冷冻切片的难点之一,延迟诊断中有4例冷冻诊断用了描述性语言,归纳为“导管上皮增生呈条索状排列并向周围组织呈浸润性生长,考虑硬化性腺病或浸润癌”,石蜡诊断均为浸润癌。本研究中2例硬化性病变术中冷冻需延迟诊断,经快速免疫组化染色CK5/6、SMA阳性排除了恶性病变,避免了过度诊断。
综上所述,术中冷冻诊断直接关系到乳腺患者手术方式的选择。而单纯HE染色冷冻切片诊断存在一定的延迟诊断率,尤其是在良恶性易混淆病例中。本研究通过三个抗体的术中冷冻组织快速免疫组化染色,大大提高此类病变诊断准确率,避免了过度治疗及治疗不足导致的二次手术。为术中快速免疫组化在良恶性易混淆病变中的临床应用,提供一定的实验参考。
