卵巢甲状腺肿伴类癌的超声及MRI 影像特点分析
2023-09-22宁绍爽王伟董莹
宁绍爽 王伟 董莹
卵巢甲状腺肿及类癌是临床罕见肿瘤的疾病, 发病年龄一般在20~78 岁[1-3], 单侧卵巢居多。卵巢甲状腺肿主要是指肿瘤的甲状腺滤泡组织成分大于瘤组织的50%, 或甲状腺滤泡组织成分<50%, 但临床症状及实验室甲状腺肿分泌相关成分及症状呈阳性, 仅少数肿瘤合并类癌[4,5], 临床早期容易漏诊[6], 因其生物学特征上早期大多呈低度恶性, 一般只需要切除患者的患侧附件,早期手术治疗病情预后良好, 可达到完全根治的目的,5 年生存率约为100%。腹部超声检查及MRI 影像表现对卵巢甲状腺肿伴类癌具有非常重要的诊断价值, 分析并探讨卵巢甲状腺肿伴类癌的超声及MRI 影像表现,可有效指导临床治疗并改善患者预后生活质量。
1 资料与方法
1.1 一般资料 收集本院2011 年6 月~2022 年10 月收治的7 例甲状腺肿伴类癌患者, 年龄最大69 岁, 最小34 岁, 中位年龄47 岁;临床症状:4 例腹痛患者,2 例无明显临床症状, 1 例患者仅表现为间断的头晕、头疼;其中3 例患者实验室检查糖类抗原125(CA125)水平升高, 其余4例患者实验室检查结果未见明显异常。
1.2 方法 所有患者均行B 超及MRI 检查。B 超检查:检查前患者需要憋尿, 使用B 型超声波设备, 检查时患者平卧于检查床上, 暴露被检部位;医师将探头频率设置为 3~5 MHz, 对患者腹壁进行扫查, 检查范围包括耻骨联合及耻骨联合上方, 取纵横切面及扇形影像, 测量卵巢及病变组织大小。MRI 检查:检查前患者需摘除金属物品、穿棉质衣物, 并排除禁忌证。使用 1.5T 超导型MRI 设备及腹部联合相控阵线圈。患者平躺于检查床上, 技师放置线圈后进行冠状位、矢状位和轴位扫描, 增强扫描时注入二乙三胺五乙酸钆(Gd-DTPA)对比剂进行增强, 行多期增强扫描。扫描矩阵 256×256, 层厚/间距 :6 mm/1 mm, 视野(FOV):32~36 cm。扫描范围为自髂前上棘水平至盆底, 检查后需饮水促进对比剂排泄, 预防肾脏损伤。
1.3 观察指标 分析卵巢甲状腺肿伴类癌患者的超声影像学征象及MRI 检查表现, 并请两位高年资医师对超声及MRI 影像征象给出一致意见, 意见不同者请第3 位上级医师共同协商一致。
2 结果
7 例卵巢甲状腺肿伴类癌患者, 超声及MRI 影像表现均为囊实性肿瘤, 肿瘤实性部分均为丰富血流(见图1), 囊性部分囊壁及囊分隔亦可见丰富血流(见图2)。超声及MRI 影像表现有明显结节灶患者5 例, 在超声声像图显示为边界清楚的偏强回声结节灶, 超声多普勒无明显血流回声;在MRI 检查中呈长T1WI 低信号、短T2WI(见图3a)低信号结节, MRI 多期增强扫描此低信号结节灶无强化征象(见图3b);此外, MRI 多期增强扫描显示肿瘤实性部分及囊壁、囊分隔有明显强化征象(见图3c), 与超声声像图所示的肿瘤实性部分及囊壁、囊分隔有丰富血流回声的结果保持一致, 并呈低阻力表现。另有2 例卵巢甲状腺肿伴类癌囊实性肿瘤超声检查显示肿瘤囊性区域可见多发斑点状强回声、部分可见声影, 囊壁稍增厚、毛糙, 考虑超声检查可以任何切面呈现肿瘤的回声特点, 因此属于超声检查所见的特殊征象;患者可见少量盆腔积液, 其病理组织学及免疫组化显示类癌区域CD56、Syn、CgA、Pan-CK、CDX2、1%~2% Ki-67 阳性, Ki-67 指数多为1%~5%(见图4)。7 例患者卵巢甲状腺肿区域病理免疫组化可见Pan-CK、TTF-1、CD56 阳性。
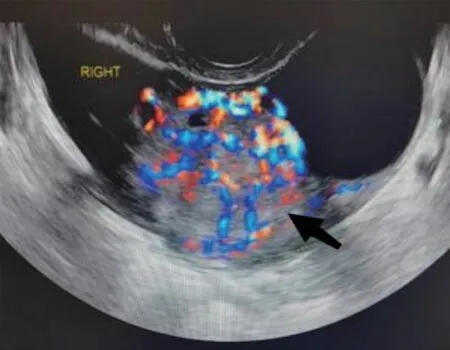
图1 B 超显示肿块血流丰富(黑箭所示患者卵巢囊实性肿块, 实性部分血流丰富)

图2 B 超显示肿块囊分隔血流丰富(黑箭所示患者卵巢肿块分隔可见较丰富血流)

图3a MRI T2WI(黑箭所示结节边界清楚, 为短T2WI 低信号)
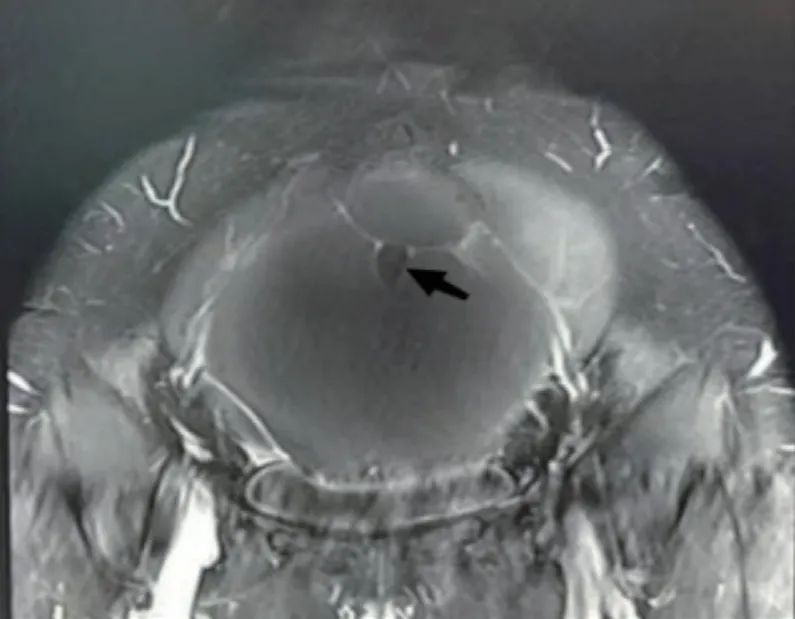
图3b MRI 多期增强扫描结节无强化(黑色箭头所示, 结节无强化征象, 提示结节没有血流)
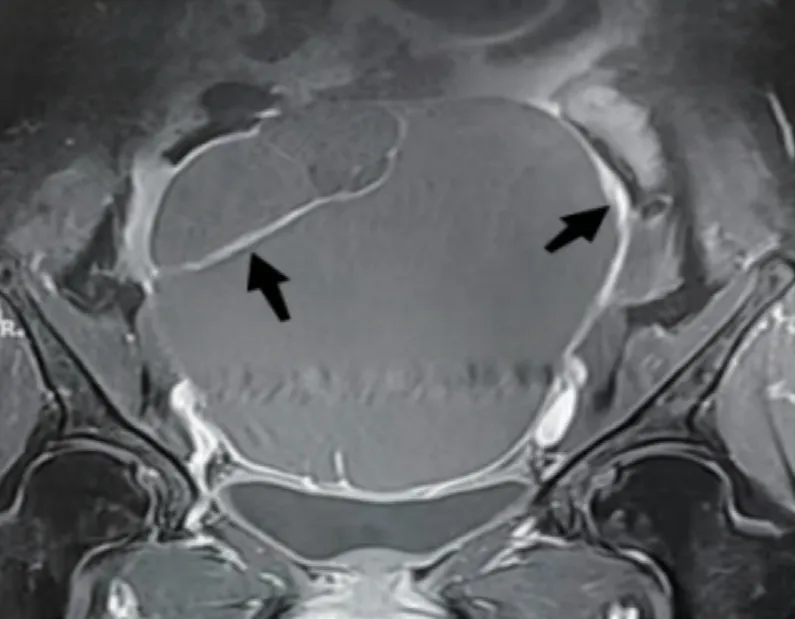
图3c MRI 多期增强扫描肿瘤囊壁及分隔可见呈明显强化

图4 卵巢甲状腺肿伴类癌病理图片(HE×100)
3 讨论
3.1 卵巢甲状腺肿伴类癌的临床及病理特征 原发性卵巢甲状腺肿伴类癌临床症状不典型[7], 多数在体检时发现, 仅少数患者因肿瘤体积较大、盆腔脏器受压或周围神经牵拉引起不适就诊, 病理组织学类型是生殖细胞肿瘤的一种特殊类型[8], 也属于低级别的神经内分泌肿瘤, 部分患者可见便秘、腹痛、腹泻或外周血管舒缩功能紊乱等类癌综合征[9,10], 其中顽固性便秘可作为比较特异的首发症状, 需要引起临床医师的重视。还有研究认为肿瘤细胞的分泌功能与肿瘤大小呈正相关, 本组4 例患者因肿瘤较大, 有腹痛、便秘等类癌综合征相关表现, 另1 例无明显临床症状, 仅体检发现, 考虑与肿瘤体积较小有关;患者顽固性便秘症状可能与肿瘤细胞分泌的肽YY(PYY)有关, 是一种由类癌摄取的色氨酸转化而来的含有36 个氨基酸的肽类激素, 可抑制正常肠道蠕动及分泌功能, 从而临床出现便秘症状, 术后便秘可消失, 如果便秘复发, 需要排除肿瘤复发的可能;卵巢甲状腺肿伴类癌以囊实性肿瘤多见, 根据肿瘤的生长方式可分为单纯型、瘤壁结节型、混合型。以本组7 例及所查文献报道总结, 卵巢甲状腺肿伴类癌以瘤壁结节型较为多见, 部分卵巢甲状腺肿伴类癌患者的血清肿瘤标记物如CA125、糖类抗原199(CA199)及癌胚抗原(CEA)值可升高, 但值得注意的是, 上述指标升高也可能是其合并成分或其他临床症状导致, 如相关报道1 例卵巢甲状腺类癌伴同侧皮样囊肿和黏液性囊腺瘤, 上述指标的升高是由黏液性囊腺瘤引起[11]。相关报道1 例血清CEA 水平升高同时伴有便秘的患者, 使用缓泻剂后便秘症状缓解、CEA 水平下降, 术后肿瘤组织中的CEA 检测呈阴性,表明该患者CEA 水平的升高可能是由于便秘所引起的肠道炎症所致[12]。
3.2 卵巢甲状腺肿伴类癌的影像特点 超声及MRI检查对提示临床肿瘤的良恶性、病变累及范围及鉴别诊断具有重要意义, 本组7 例卵巢甲状腺肿伴类癌超声表现均为囊实性, 纯实性的卵巢甲状腺肿伴类癌很少见, 其中5 例可见边界清晰的偏强回声结节灶, 占比为71%(5/7), 超声多普勒彩色血流显示此偏强回声乳突状结节无明显血流征象, 但是其他实性部分或囊壁均可见丰富血流信号影, 这种无血流结节灶病理学基础是结节灶的滤泡内含有大量的粘滞凝胶样物质;另有2 例卵巢甲状腺肿伴类癌囊实性肿瘤超声检查显示肿瘤囊性区域可见多发斑点状强回声、部分可见声影,囊壁稍增厚、毛糙, 考虑超声检查可以任何切面呈现肿瘤的回声特点, 因此属于超声检查所见的特殊征象,需要考虑卵巢甲状腺肿伴类癌的可能性;卵巢甲状腺肿伴类癌的MRI 检查可见囊实性肿瘤的囊性部分信号强度不同, 其病理学基础与囊液的成分有关;此外, 超声声像图中的边界清楚的偏强回声、无血流信号的结节灶, 在MRI 检查中多表现为瘤壁局灶结节样长T1WI短T2WI 低信号, 边界清晰, 多期增强扫描低信号壁结节未见强化, 而肿瘤囊壁及其他实性部分可见明显强化征象, 其MRI 影像特点与超声声像图检查结果本质上是一致的。超声及MRI 检查使用了两种成像技术,患者检查前准备简单, 可方便显示病变与邻近脏器的相关情况、是否合并少量腹水, 并提示有无并发小淋巴结等并发症, 对临床术后复查随访也具有重要意义。
3.3 卵巢甲状腺肿伴类癌的影像鉴别诊断 需与以下肿瘤相鉴别[13-15]:①成熟性畸胎瘤:卵巢甲状腺肿伴类癌可与成熟性畸胎瘤合并生长, 成熟性畸胎瘤常见脂肪, 而卵巢甲状腺肿伴类癌一般无成熟脂肪组织;②卵巢转移性类癌常表现为双侧卵巢受累, 如Krukenberg 瘤, 多灶性、有腹水, 有临床胃肠道肿瘤病史;③囊腺瘤与囊腺癌:囊腺瘤一般以囊性成分为主,实性部分较少, 囊壁薄且光滑, 囊壁厚度常<5 mm, 实性成分多位于分隔处。囊腺癌实性成分较囊腺瘤多,其实性部分常表现为壁结节或向囊腔内突出, 超声多普勒血流声像图可见较丰富血流, 增强扫描壁结节较明显强化, 与卵巢甲状腺肿伴类癌的无血流结节灶明显不同, 另外囊腺癌多合并腹水、有淋巴结、网膜转移, 恶性征象比卵巢甲状腺肿及类癌要相对明显, 而卵巢甲状腺肿伴类癌属于低度恶性肿瘤, 早期恶性征象不明显[16]。
3.4 卵巢甲状腺肿伴类癌的治疗及预后 卵巢甲状腺肿伴类癌属低度恶性肿瘤[17], 手术治疗后肿瘤罕见复发[18], 大多数文献认为Ⅰ期的卵巢甲状腺肿伴类癌通过外科切除可以治愈, 手术治疗应根据患者年龄及生育要求而选择不同的治疗方案。年轻有生育需求的早期肿瘤患者, 仅行单侧附件切除即可;对于年龄较大者、绝经后或围绝经期、无生育需求的卵巢甲状腺肿伴类癌患者, 根据肿瘤分期情况可行全子宫+双附件切除。但根据国内外报道, 该肿瘤术后需要长期随访[19-22], 因为少数较晚期肿瘤患者可存在转移的风险,另文献报道卵巢甲状腺肿伴类癌患者并发心脏病者尿液中的5-羟基吲哚乙酸平均浓度明显高于正常人, 且存活率明显下降。
综上所述, 卵巢甲状腺肿伴类癌临床表现不典型,但具有比较显著的超声影像及MRI 检查影像特点, 因此术前进行超声或MRI 检查对于卵巢甲状腺肿伴类癌的诊断及鉴别诊断非常重要, 熟悉其超声影像图及MRI 检查特征有利于此类疾病的诊断和进一步治疗。
