治疗药物监测下奈玛特韦片/利托那韦片组合包装与伏立康唑的联合应用Δ
2023-09-13郭冬杰李少强陈文倩王晓星孔旭东李朋梅刘丽宏中日友好医院药学部北京100029
陈 玥,郭冬杰,李少强,陈文倩,王晓星,陈 玮,孔旭东,李朋梅,刘丽宏(中日友好医院药学部,北京 100029)
奈玛特韦片/利托那韦片组合包装(以下简称“奈马特韦/利托那韦”)为治疗新型冠状病毒感染(COVID-19)的小分子口服抗病毒药,世界卫生组织、美国国立卫生研究院和我国诊疗方案均推荐该药是具有进展为重症风险的高危人群的首选药物[1-3]。该药在国内外的适用人群均为发病5 d以内的轻、中型且伴有进展为重症高风险因素的成年患者。然而,由于其他药物在我国不可获取,如推荐用于重症患者的瑞德西韦,因此,对于部分住院的重症及危重症患者、明确病毒仍在活跃复制的患者,使用奈马特韦/利托那韦仍然有可能获益[4]。但是,由于利托那韦为CYP3A的强抑制剂,还可能诱导CYP1A2、CYP2C8、CYP2C9和CYP2C19的葡糖醛酸化和氧化作用,奈马特韦/利托那韦与伏立康唑联合应用在药品说明书中被标示为禁忌,各大药物相互作用数据库中也显示不推荐联合应用[5]。但通常没有进一步分析不同剂量利托那韦的差异。由于我国可获取的经济、有效、可监测的抗曲霉菌药有限,而重症COVID-19患者合并曲霉菌感染比例极高,因此,有必要进一步研究奈马特韦/利托那韦与伏立康唑是否可以联合应用。
1 资料与方法
1.1 资料来源
针对国家呼吸医学中心2022年12月至2023年1月收治的COVID-19患者进行回顾性研究,纳入同时使用伏立康唑和奈马特韦/利托那韦且进行了伏立康唑血药浓度监测的患者。纳入标准:年龄>18岁;使用伏立康唑≥3 d(口服或静脉滴注);伏立康唑与奈马特韦/利托那韦联合应用时间≥2 d;血药浓度测定日在联合用药≥2 d至奈马特韦/利托那韦停药2 d内。排除标准:联合应用其他明显影响伏立康唑血药浓度的药物(如利福霉素类)的患者;联合用药时间<2 d者;血药浓度测定日期不在联合治疗时间窗内者。共纳入14例患者,联合治疗期间伏立康唑血药浓度监测数据17个,其中7例患者可查询到伏立康唑的基线浓度数据。本研究经我院临床研究伦理委员会批准(批准号:2022-KY-193-1)。
1.2 方法
收集患者的人口学基础数据、伏立康唑和奈马特韦/利托那韦的药物治疗信息、伏立康唑血药浓度基线数据(定义为使用奈马特韦/利托那韦前测定的伏立康唑血药浓度,或奈马特韦/利托那韦停药>3 d后的伏立康唑血药浓度)、其他可能影响伏立康唑血药浓度的医嘱信息以及病程中记录的与药物使用相关的不良反应等,进行分析。
2 结果
所有患者初始均采用标准伏立康唑给药方案,由于纳入患者中无明显异常体重或重度肝功能损伤的患者,故均采用了首次400 mg、每12 h给药1次,之后1次200 mg、每12 h给药1次的给药方案。患者基本情况和治疗药物使用情况见表1。所有患者使用奈马特韦/利托那韦时,奈马特韦根据肾功能调整剂量,利托那韦均为1次100 mg、每12 h给药1次。测定伏立康唑血药浓度时,两药联合应用时间均≥3 d。在具有伏立康唑基线浓度数据的7例患者中,3例患者联合治疗时谷浓度超过正常范围(1~5.5 mg/L),但仅有1例患者(No.5)超过正常上限幅度>50%,随后降低给药剂量至300 mg/d。其余所有患者的伏立康唑血药浓度均在治疗范围内,且联合治疗时的浓度均与基线浓度类似或略高,见表2、图1。没有基线浓度数据的患者中,仅有1例患者出现了伏立康唑谷浓度过低(No.20);另有3例患者谷浓度超过正常值上限,但其中仅1例患者谷浓度>10 mg/L(No.14)。回顾性分析未发现可归因于伏立康唑或奈马特韦/利托那韦的不良反应。
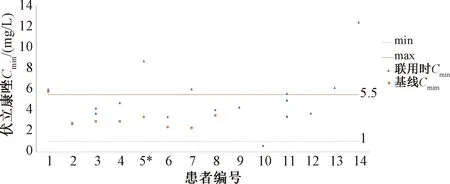
“*” 表示该患者基线伏立康唑浓度为进行剂量调整后测定。“*” indicates that the baseline concentration of voriconazole in the patient was determined after dose adjustment.图1 患者伏立康唑血药浓度分布Fig 1 Distribution of voriconazole concentration in patients
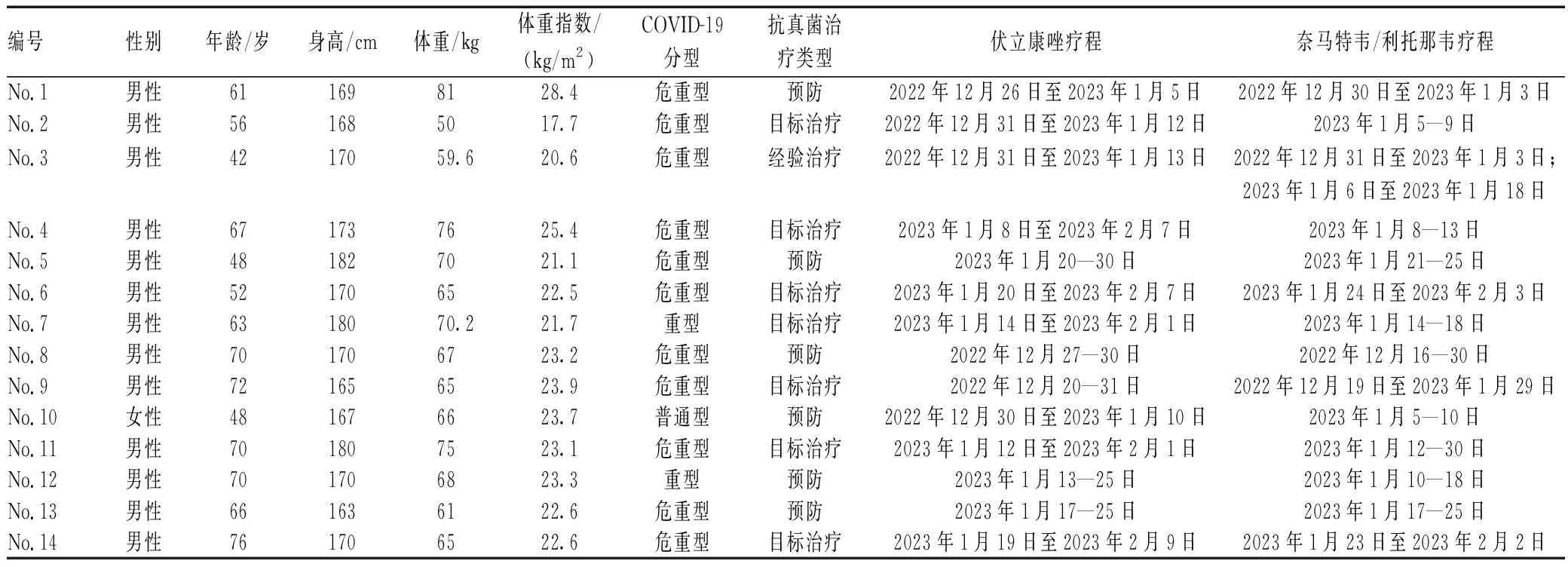
表1 患者基本情况和治疗药物使用情况Tab 1 Basic information of patients and use of therapeutic drugs
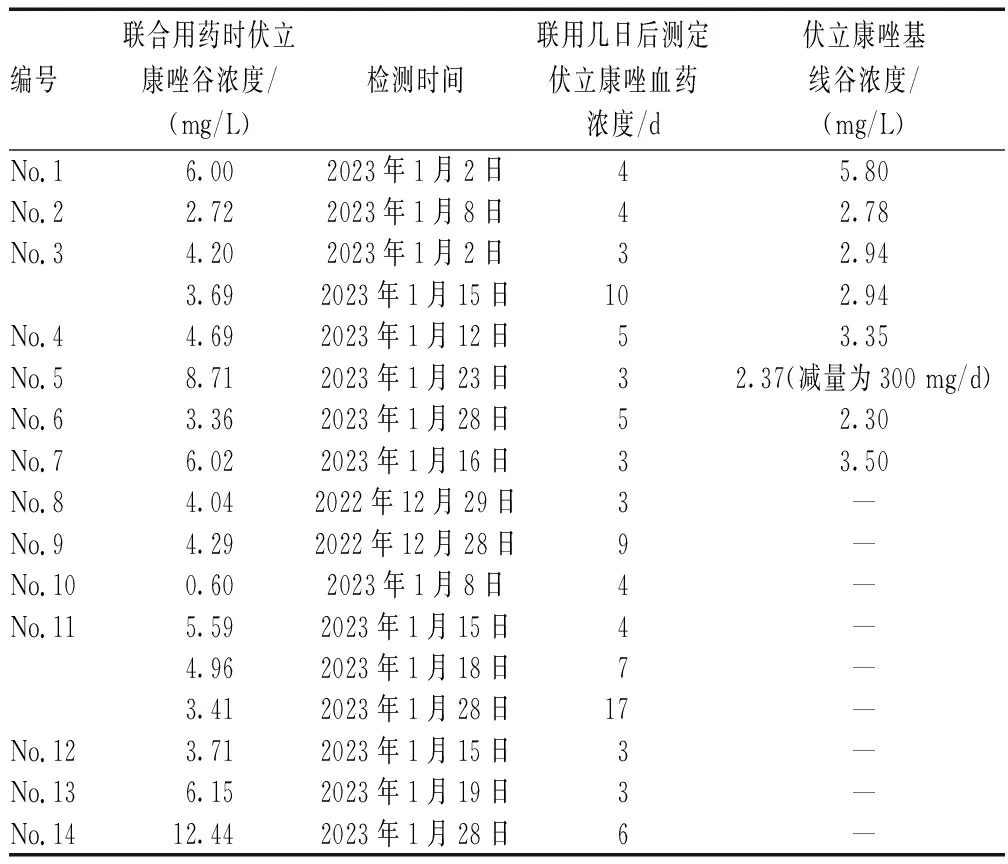
表2 患者伏立康唑血药浓度监测情况Tab 2 Voriconazole concentration monitoring in patients
系统统计同期我院其他所有测定伏立康唑血药浓度的患者数据,共439个样本,伏立康唑谷浓度为(3.47±2.53) mg/L,9.97%(43/439)低于正常值下限,14.58%(64/439)高于正常值上限,其中4.1%(18/439)高于正常值上限的50%。
3 讨论
本研究回顾性分析了重症、危重症COVID-19患者联合应用伏立康唑与奈马特韦/利托那韦时的伏立康唑血药浓度情况,通过14例患者的案例研究发现仅1例患者的伏立康唑谷浓度偏低,2例患者的伏立康唑谷浓度超过治疗上限的50%,而多数患者均可达标,甚至部分浓度偏高;具有基线伏立康唑浓度数据的7例患者中,除1例患者因浓度过高减量外,其余患者联合用药时浓度均与基线浓度类似或略高。与同期其他未联合治疗的患者数据比较,联合用药中伏立康唑血药浓度偏高的比例略有增加,但低浓度患者的比例较少。同时,回顾性研究未发现可归因于两药的不良反应。因此,笔者认为,对于有治疗需求的患者,伏立康唑可与奈马特韦/利托那韦联合应用,并建议结合血药浓度监测,以保证安全性和有效性。
奈马特韦/利托那韦用于重症、危重症COVID-19患者并无充足的循证医学证据,也未被指南推荐,但考虑我国可获取的抗病毒药有限,且部分重症、危重症患者仍然有活跃的病毒复制,《新型冠状病毒感染重症病例诊疗方案(试行第四版)》指出,对于这部分患者(病程较短、核酸载量较高),仍可以考虑使用奈马特韦/利托那韦[4]。COVID-19相关肺曲霉菌病(CAPA)常见于急性呼吸道衰竭的COVID-19患者,特别是使用糖皮质激素或托珠单抗治疗之后[6]。CAPA与50%的COVID-19患者死亡率有关[6]。在多中心大型研究中,CAPA是COVID-19死亡率的独立预警因素(1.45~1.97)[6]。因此,有专家推荐对COVID-19患者进行常规抗真菌预防;对已确诊和疑似CAPA的患者,应立即进行抗真菌治疗,推荐应用伏立康唑、艾沙康唑、泊沙康唑和两性霉素B脂质体进行单药或单药序贯治疗;两性霉素B脱氧胆酸盐和棘白菌素类药物可考虑为替代治疗[7]。在我国可获取的药物中,伏立康唑为指南一线推荐药物,且治疗药物监测开展得较为成熟,价格相对低廉;其他药物均因价格、可获取性或无法监测,临床应用可能面临一定的问题。由于奈马特韦/利托那韦与伏立康唑存在药物相互作用,在药品说明书和部分数据库中直接标示为禁忌使用,但并未针对不同剂量的利托那韦进行分层分析。此外,我国人群和西方人群存在基因型差异,导致伏立康唑血药浓度可能会受到不同的影响,也未在数据库中体现[8]。因此,临床医师不敢同时使用上述2种药物,导致患者转为使用更昂贵(如艾莎康唑),或不良反应更大(如两性霉素B脱氧胆酸盐),或疗效可能不确切(如棘白菌素类)的药物。
奈马特韦/利托那韦与伏立康唑禁止联合应用的机制源自利托那韦对肝药酶的影响[9]。利托那韦对肝药酶的影响较为复杂,尽管利托那韦对CYP3A的效应是抑制的,但使用伏立康唑时,利托那韦对CYP2C19和CYP2C9的诱导似乎抵消了对CYP3A的抑制作用,因为CYP3A不是伏立康唑代谢的主要途径[10]。在接受伏立康唑(1次200 mg,1日2次)和低剂量或高剂量利托那韦(1次100或400 mg,1日2次)的两组艾滋病受试者(每组17例)中测定伏立康唑和利托那韦的药动学,高剂量利托那韦可显著降低伏立康唑的曲线下面积(AUC,降低82%)和峰浓度(Cmax,降低66%);而低剂量利托那韦的作用不太明显,AUC降低39%、Cmax降低24%;2例受试者(每组1例)的伏立康唑暴露量增加(2.5~3.0倍)[10]。也有研究结果指出,不同CYP2C19基因型患者,利托那韦对伏立康唑药动学数据的影响不同[11]。我国人群CYP2C19基因型分布频率与西方人群显著不同,我国CYP2C19弱代谢型的比例为14.7%[12]。有研究结果指出,使用利托那韦(1次300 mg、每12 h给药1次)时,因为清除率降低66%±14%而导致更高的伏立康唑暴露,可能会增加不良反应发生风险[13]。这与本研究发现的少部分患者血药浓度偏高(>50%治疗上限,2例/14例)的情况相符。而与药品说明书中表述的“奈马特韦/利托那韦导致伏立康唑血药浓度降低而失效”情况不同。另有研究结果指出,伏立康唑和利托那韦表现出时间和剂量依赖性相互作用。利托那韦最初抑制伏立康唑的代谢,但长期服用后会诱导伏立康唑的代谢。这种相互作用在利托那韦高剂量时更为明显,在利托那韦低剂量时不显著[14]。由于奈马特韦/利托那韦的使用中,利托那韦的剂量为1次100 mg、每12 h给药1次,疗程一般为5 d,根据本研究和既往文献报道的结论,可评估该药导致我国人群伏立康唑暴露量降低的情况不显著,甚至部分患者可能会略有升高。当然,由于伏立康唑为非线性药动学药物,同时具有较多的药物相互作用,也可能存在特殊基因型导致血药浓度异常的情况,仍建议在治疗药物监测下使用,以保证安全性和有效性。
本研究的缺陷在于未能对奈马特韦/利托那韦进行治疗药物监测,由于截至撰文时,该药在我国大规模使用时间仍不足2个月,未能及时建立方法学并应用于临床。如前所述,伏立康唑可能降低低剂量利托那韦的AUC和Cmax[10]。利托那韦为奈马特韦的增强剂,因此可能导致奈马特韦浓度降低。但同时,伏立康唑也是CYP3A4的抑制剂[15],也有可能抑制奈马特韦的代谢而导致奈马特韦浓度升高。预估伏立康唑可能对奈马特韦/利托那韦的影响不显著。此外,由于临床并不常规监测CPY2C19基因型,因此这部分数据缺失,目前我院已建立联合用药临床路径,建议对使用该联合治疗方案的患者常规进行CPY2C19基因型检测。此外,使用单一基因型往往无法解释非线性药动学药物的暴露量情况[16]。尽管本研究的案例数相对较少,但通过与我院同期测定的使用伏立康唑进行曲霉菌病治疗或预防肺曲霉菌病全院各类人群的血药浓度情况进行比较,可初步得到奈马特韦/利托那韦不是影响伏立康唑暴露量的关键因素,而伏立康唑本身的非线性药动学及复杂的其他影响因素,可能导致伏立康唑血药浓度变化,因此推荐常规进行治疗药物监测[12]。
综上所述,在我国COVID-19患者中,伏立康唑与奈马特韦/利托那韦可以联合应用。药品说明书中描述的奈马特韦/利托那韦导致伏立康唑暴露量降低的患者比例并不高,对多数患者伏立康唑暴露量的影响不显著,部分患者可能出现伏立康唑血药浓度略有升高的情况,建议进行血药浓度监测,以保证用药安全性和有效性。
