2型糖尿病与非2型糖尿病患者发生细菌性肝脓肿临床特征分析*
2023-09-12宁月季成家飞朱瑞农
宁月季,成家飞,钱 佶,朱瑞农
细菌性肝脓肿(pyogenic liver abscess,PLA)是细菌侵入肝脏引起的肝内局灶性、化脓性病变。起病隐匿,病情发展迅速。若未及时进行有效的治疗,可导致病情恶化,甚至患者死亡[1,2]。目前,2型糖尿病(type 2 diabetes,T2DM)与PLA发生的关系已得到认可。T2DM患者发生PLA的风险较非T2DM患者高约3.6倍[3]。因此,随着T2DM发病率的逐渐上升,PLA的发病率也不断升高,受到临床关注。T2DM合并PLA患者主要表现为寒战、高热、肝区疼痛、肝肿大等,以上临床表现可能不典型,使早期诊断PLA的难度加大,易被漏诊、误诊,延误最佳治疗时机,影响临床转归[4,5]。研究报道,因地区、民族、病原学差异等原因,T2DM合并PLA的结局存在差异,了解T2DM合并PLA的临床特征和转归将有助于积极防治PLA,改善患者预后[6]。本研究回顾性分析了T2DM患者发生PLA的临床特征,为优化诊治方案提供参考,现报道如下。
1 资料与方法
1.1 病例来源 2016年1月~2021年12月我院收治的T2DM合并PLA患者54例和无T2DM的PLA患者72例,经临床症状、实验室和影像学检查诊断为肝脓肿,经穿刺脓液细菌培养后诊断为PLA。T2DM诊断符合中华医学会糖尿病学分会发布的《中国2型糖尿病防治指南(2013年版)》[7]的标准。排除标准:结核性肝脓肿、真菌性肝脓肿、阿米巴性肝脓肿和肝包虫病;合并恶性肿瘤。本研究经我院医学伦理委员会审核通过,患者及其家属签署知情同意书。
1.2 治疗方法 根据《中国2型糖尿病防治指南(2013年版)》[7]治疗方案积极控制血糖。针对细菌性肝脓肿,治疗方案包括以下三个方面:①单用抗生素治疗;②脓肿穿刺抽脓联合抗生素治疗;③经皮肝脓肿穿刺置管引流联合抗生素治疗。在获得病原学结果前,在考虑原发病因的基础上给予经验性应用广谱抗生素,在获得病原学结果后再根据药敏结果调整抗生素。
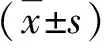
2 结果
2.1 两组一般资料比较 T2DM组年龄显著大于,PLA病程显著长于和合并心血管疾病比率显著高于非T2DM组(P<0.05,表1)。

表1 两组一般资料比较
2.2 两组症状和体征比较 T2DM组临床症状显著重于非T2DM组(P<0.05,表2)。
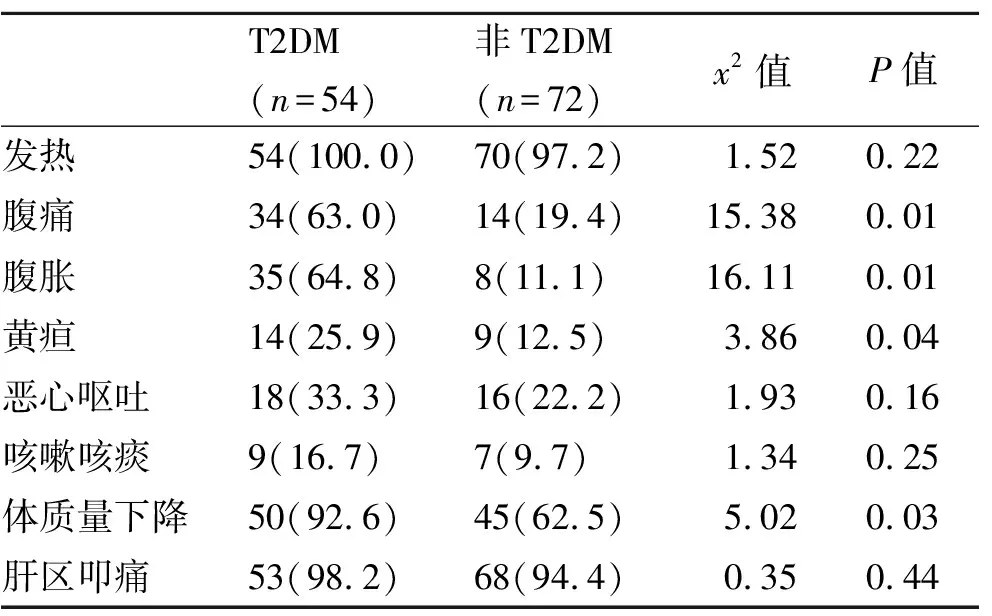
表2 两组症状和体征[n(%)]比较
2.3 两组实验室指标水平比较 在入院时,T2DM组外周血WBC、NEUT和血清白蛋白水平显著低于非T2DM组,而血清TBIL水平显著大于非T2DM组(P<0.05,表3)。
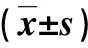
表3 两组实验室指标水平比较
2.4 两组治疗方案及临床转归 两组治疗方案及临床转归情况比较差异无统计学意义(P>0.05,表4)。

表4 两组治疗方法和临床转归[n(%)]比较
3 讨论
T2DM为慢性内分泌代谢性疾病。在疾病进程中,患者因机体长期处于高血糖状态会抑制白细胞趋化、黏附、吞噬、杀菌能力,使机体免疫功能降低,进而增加了感染风险,且高血糖环境也为病菌提供了良好的生存环境,增加了对感染性疾病的易感性,故T2DM是PLA的易患人群[8,9]。T2DM与PLA合并存在后,PLA会导致应激性高血糖,使患者血糖水平进一步升高,而高血糖又会加重PLA患者的病情,形成恶性循环[10,11]。虽然两种疾病的合并存在也会造成临床症状的加重,但仍缺乏特异性的临床表现,早期诊疗需要一定的警惕性。若未能及时进行有效的治疗,PLA患者感染灶可发生脓肿转移,造成脑脓肿、肺脓肿,甚至发生败血症,威胁患者生命安全[12]。本研究分析了T2DM与非T2DM患者发生PLA的临床特征,为临床诊疗提供了参考。
本研究显示,相较于非T2DM组,T2DM组患者年龄更大、合并心血管疾病比例更高,提示随着年龄增大,机体免疫力降低,T2DM患者更易发生PLA,且T2DM为慢性代谢性疾病,患者更易发生多种疾病。在临床症状和体征方面,T2DM组腹痛、肝区叩痛比例更高,提示T2DM合并PLA患者临床症状更重。体质量下降可能与合并T2DM时机体对葡萄糖的利用、脂肪的分解增加,在感染应急状态下机体代谢增加更明显有关[13]。腹痛、腹胀、肝区叩痛等症状和体征表现更明显。有人认为,在T2DM病程中机体长期处于高血糖状态,可并发自主神经和微循环损伤,神经营养供应不足,导致患者痛阈提高,对疼痛等刺激的敏感性降低[14]。T2DM组外周血WBC计数、NEUT比率和血清ALB水平显著低于非T2DM组,说明合并T2DM的PLA患者存在更为明显的蛋白消耗和炎症反应稍低。在实验室指标中,外周血WBC计数和NEUT百分比能反映患者感染状态和炎症反应能力。PLA患者感染的病原体为细菌。在细菌感染后在肝脏内形成炎症性和化脓性病灶,还会引起应激性高血糖,使合并T2DM的PLA患者血糖进一步提高。高血糖水平可加重患者PLA病情,加重感染和炎症,故上述指标水平升高。必要时需要对患者进行抗感染治疗[15]。ALB则反映机体营养状态。T2DM作为一种慢性病,在长期病程中蛋白消耗增加,肝功能合成能力下降,可能出现蛋白质代谢负平衡,而在感染的应急状态下机体代谢随之增加,可进一步增加蛋白消耗。T2DM合并PLA患者血清ALB水平降低的原因可能是多方面的[16]。总而言之,T2DM合并PLA患者部分常规实验室指标存在明显变化,临床上可通过检测这些指标为诊疗提供一定的参考信息。
目前,临床针对T2DM合并PLA患者的治疗方案是在合理控制血糖水平的基础上,合理安排患者膳食,通过应用抗生素、穿刺抽脓和经皮肝脓肿置管引流等治疗PLA[17]。在临床实际工作中,通常治疗以应用抗生素为基础,联合穿刺抽脓或经皮肝脓肿置管引流。这些微创方法的应用比较多见[18]。本研究T2DM组的治疗以抗生素联合经皮肝脓肿置管引流为主,而有一部分非T2DM组患者的治疗仅仅单用抗生素即可获得疗效,尤其是在早期应用。对于早期脓肿尚未液化或脓肿较小的患者,可考虑仅进行单纯的内科抗感染治疗,而脓肿较大或靠近体表已有液化坏死的患者,需考虑进行介入治疗。T2DM组与非T2DM组的治疗方案的不同也在一定程度上表明,合并T2DM的PLA患者病情相较于单纯PLA患者更重,需要及时采取介入治疗。此外,值得注意的是T2DM组患者死亡1例,考虑死亡原因与该例患者年龄为64岁男性,糖尿病病程长达18年,血糖控制不佳,感染扩散有关。T2DM和PLA是相互影响的两种疾病,相对于血糖控制较好的患者,血糖控制不佳的患者机体长期处于明显的高血浆渗透压和高血糖状态,一方面会导致单核吞噬细胞和中性粒细胞变形,影响吞噬功能、黏附、趋化功能,抑制机体白细胞趋化活性,使抗体生成减少,易受病原菌侵袭而发生感染;另一方面,机体的高血糖状态则为病原菌生成提供了良好的营养环境。在细菌生长过程中会使病灶附近温度升高,又为细菌生长提供了良好的环境[19,20]。因此,对于合并T2DM的PLA患者,控制血糖不仅是T2DM的治疗目标,也是治疗PLA过程中应注意的重要内容。
综上所述, T2DM合并PLA患者实验室指标存在明显的异常变化,血糖控制水平不佳,临床转归变差。合并的基础疾病和低血清ALB水平,都可能影响了治疗结果。临床上,针对这类患者,需采取积极的防治措施,在脓肿液化前,尽量给予经验性抗生素治疗,进行超声监测,一旦脓肿液化,应及时给予穿刺抽脓或置管引流治疗,以促进脓肿愈合。
