Clavien-Dindo分级系统分析不同供肝类型肝移植患者术后早期并发症发生率比较研究*
2023-09-12张树庚张少博朱泽斌栗雪峰郭亚飞刘连新
张树庚,张少博,朱泽斌,栗雪峰,蔡 伟,郭亚飞,刘连新
肝移植仍然是治疗终末期良性肝病的最好方法[1]。随着肝脏外科手术技术的发展、新型免疫抑制剂的应用和术后对受者管理的进步,肝移植患者预后得到了极大的改善[2]。根据报道,目前我国肝移植术后1 a生存率可达90%以上,5 a生存率达70%~80%[3]。但随着肝移植的需求越来越多,肝源短缺现象越来越明显[4]。肝移植术后胆道并发症发生率为19%(5%~35%),出血发生率为14%(4%~17%),血管并发症发生率为6%(3%~8%)[5,6]。目前,公民逝世后器官捐献仍然是供肝来源的主要途径。我国现阶段公民逝世后器官捐献分为三大类:国标标准化脑死亡器官捐献(donation after brain death,DBD);国际标准化心脏死亡器官捐献(donation after cardiac death,DCD);中国过渡时期脑-心双死亡标准器官捐献(donation after brain death awaiting cardiac death,DBCD)[7]。目前,我中心常规开展此三种捐献类型的肝移植术。本研究应用Clavien-Dindo分级系统回顾性分析了肝移植术后早期并发症,比较不同捐献类型供肝对肝移植术后并发症发生率的影响。
1 资料与方法
1.1 一般资料 2017年4月~2020年12月我中心诊治的终末期肝病患者60例,男45例,女15例;年龄为18~65岁,平均年龄为(45.9±9.7)岁。其中失代偿期乙型肝炎肝硬化20例,肝细胞癌(hepatocellular carcinoma,HCC)16例,慢加急性肝衰竭9例,酒精性肝硬化5例,肝门部胆管癌1例,布加综合征1例,Caroli病1例,原发性硬化性胆管炎(primary sclerosing cholangitis,PSC)1例,原发性胆汁性肝硬化3例,多囊肝1例,不明原因性肝硬化2例。纳入标准:受体年龄≥18岁;供肝均为公民逝世后器官捐献。排除标准:二次肝移植;合并其他器官移植;活体肝移植;背驮式、劈离式肝移植。根据供体死亡类型,分为三组,即DBD组、DCD组和DBCD组,三组受者一般资料比较差异无统计学意义(P>0.05)。本研究方案经我院医学伦理学委员会审核通过(伦理批号:2023-RE-184)。患者及其家属签署由医院医学伦理委员会批准的知情同意书,并符合医学伦理学规定。
1.2 供肝获取 采用4℃ University of Wisconsin (UW)液,通过腹主动脉和门静脉双重灌注法快速切取肝脏,置于4℃ UW液中保存、转运和修整。常规行快速冰冻病理学检查供肝脂肪变程度,修整完成后称质量并记录。
1.3 肝移植术 切除病肝后植入新肝,选用3-0或4-0 Prolene线连续缝合肝上、肝下下腔静脉,用5-0 Prolene线完成门静脉吻合,依次开放肝上、肝下下腔静脉和门静脉,灌注新肝,结束无肝期(<60 min)。肝动脉重建:常规采用供体的腹腔干动脉或其他动脉(主要为肝总动脉、肝固有动脉与胃十二指肠动脉开口分叉处)的Carrel 瓣与受体的肝总动脉、肝固有动脉与胃十二指肠动脉开口分叉处Carrel 瓣行端端吻合。胆道吻合:本组行胆管端端吻合59例,胆管空肠Roux-en-Y吻合1例,选择5-0、6-0或7-0的PDS可吸收线行前、后壁连续缝合,其中仅1例胆管端端吻合后放置T型管。术后处理:手术后转入ICU监护治疗,尽早脱离呼吸机、拔除气管插管。常规选择头孢哌酮钠/舒巴坦钠抗感染,不常规抗凝治疗。对于HBV感染的受者,给予乙型肝炎免疫球蛋白2000 IU/d,连续7 d。监测腹腔放置的右侧膈下、右侧第一肝门和左侧肝下引流管的引流情况。术后第1周,常规检测血常规、血生化和凝血功能指标。移植肝超声检查:术后第1周,2次/d;第2周,1次/2 d;第3周,1次/3 d。监测各血管血流情况。
1.4 免疫抑制方案 给予巴利昔单克隆抗体(舒莱,瑞士诺华)20 mg静脉滴注,行免疫诱导,术中和术后第4天,联合他克莫司、吗替麦考酚酯和糖皮质激素,激素用量递减。术后第2天开始监测他克莫司血药浓度,第1周内,1次/d。在药物浓度稳定后,按三联方案维持治疗。在原发性肝癌和胆管癌患者,尽早撤除激素。在手术切口愈合后,加用西罗莫司,剂量为1~3 mg.d-1,同时对他克莫司和吗替麦考酚酯减量。
1.5 并发症分级 依据2004年版Clavien-Dindo手术并发症分级标准进行分类(表 1)[8]。术后,早期并发症定义为术后30天内或术后住院期间发生的并发症。肝移植手术复杂、时间长、创伤大,按照Clavien-Dindo分级标准,术后均会出现Ⅱ级并发症。因此,本研究主要统计术后早期Ⅲ级及以上并发症的发生情况。

表1 Clavien-Dindo手术并发症分级标准
2 结果
2.1 一般资料 三组受者一般资料比较,差异无统计学意义(P>0.05,表2)。DCD组供肝WIT显著长于DBD组或DBCD(P<0.05,表3),但符合心脏死亡后器官捐献的特点。

表2 三组受体一般资料比较

表2 三组供体一般资料比较
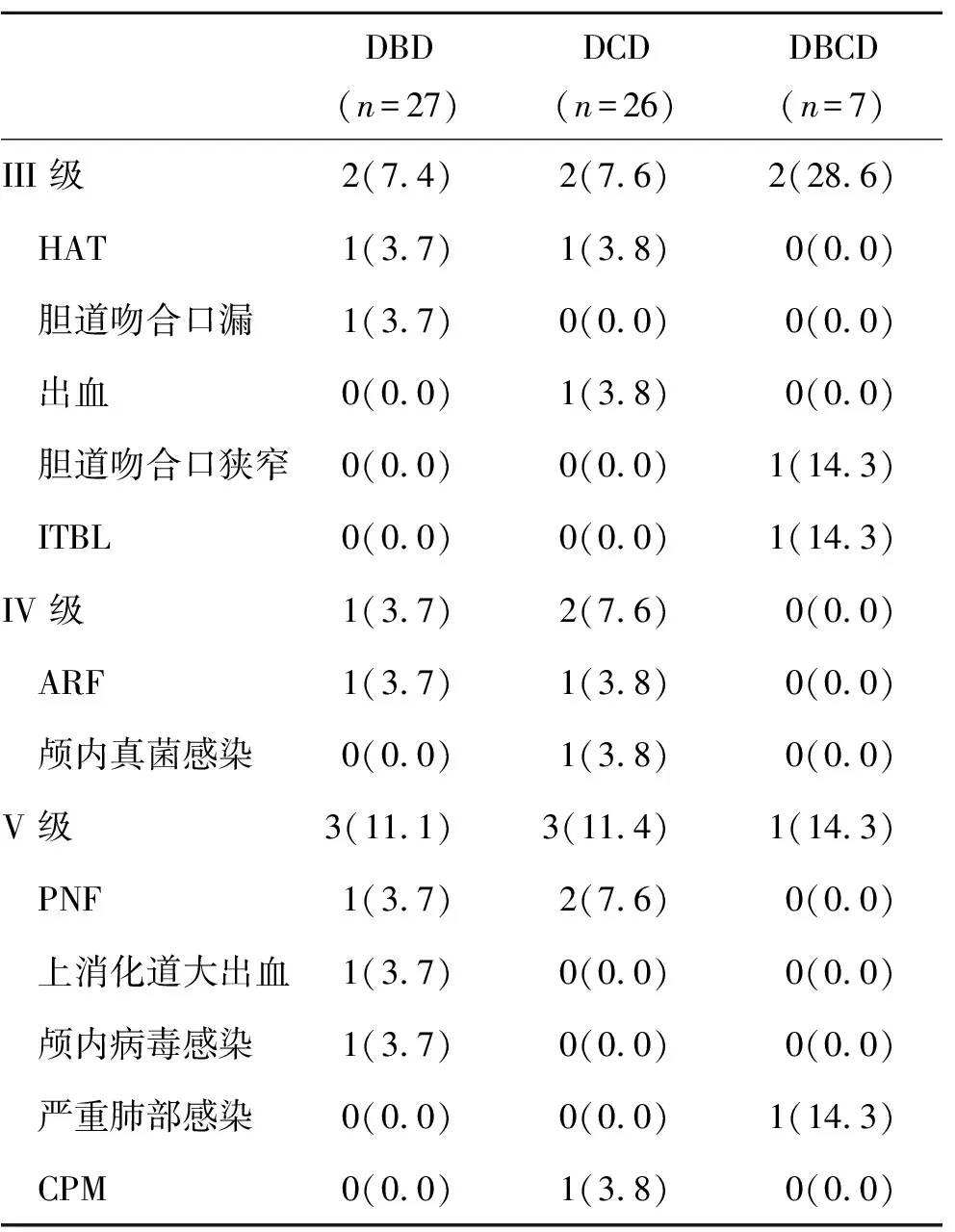
表3 三组术后并发症发生率(%)比较
2.2 手术情况 三组移植手术均获成功,术中开放血流后未发生严重的再灌注综合征(post-re-perfusion syndrome,PRS)。超声检查提示各血管通畅、血流良好。胆道可见胆汁流出。
2.3 三组并发症发生情况 术后,发生早期并发症16例(26.6%,表3)。
3 讨论
与DBD相比,DCD供肝移植后具有较高的早期移植物功能障碍(early allograft dysfunction,EAD)和PNF发生率[9-14]。由于DCD等“边缘性供肝”移植更严重的缺血再灌注损伤( ischemia reperfusion injury,IRI),导致胆道血管微灌注减少,可增加胆道吻合口漏、狭窄和ITBL等胆道并发症发生风险[15,16]。我国目前95%肝移植供肝来自于公民逝世后器官捐献[11]。
Clavien-Dindo并发症分级系统是以治疗术后并发症所需的临床干预措施为分级标准,被广泛用于评价腹部手术等术后并发症的严重程度[17,18]。依据Clavien-Dindo分级,肝移植术后基本上会出现Ⅰ级和Ⅱ级并发症。本研究根据Clavien-Dindo分级系统,Ⅲ级以上并发症发生率为26.6%。在Ⅲ级并发症中,术后腹腔内出血1例,供肝来自DCD,给予急诊手术治疗,恢复良好;2例发生术后HAT,1例供肝类型为DBD,1例为DCD,2例患者均接受了急诊手术取栓、溶栓和肝动脉重建,恢复良好;发生胆道并发症3例,1例DBD供肝移植术后出现胆道吻合口漏,2例DBCD供肝患者发生胆道吻合口狭窄和ITBL各1例,3例患者均接受ERCP治疗,恢复良好。2例发生HAT的肝癌患者,移植前均接受过外科消融和TACE治疗。研究显示,TACE治疗后患者肝移植易发生肝动脉并发症[19]。1例发生ITBL患者的原发病是PSC。PSC患者肝移植术后易发生ITBL[20]。在Ⅳ级并发症中,1例DCD供肝术后发生颅内侵袭性真菌感染,经过抗真菌、调节免疫抑制方案治疗,恢复良好;2例发生急性肾功能衰竭,其中DBD供肝1例和DCD供肝1例,经过透析治疗后恢复良好。颅内侵袭性真菌感染患者移植前因慢加急性肝衰竭行多次人工肝治疗,移植前终末期肝病模型评分(model for end-stage liver disease score,MELD)为29分。MELD评分>25分患者肝移植后侵袭性真菌感染的风险增高[21]。发生Ⅴ级并发症(死亡)者7例,其中DBCD供肝1例,死于严重的肺部感染,DBD供肝3例,1例术后发生PNF再移植后死亡,1例死于颅内病毒感染,1例死于上消化道大出血;DCD供肝3例,2例死于PNF,1例死于CPM。2例患者供肝为DCD后捐献,其中1例移植前MELD评分为45分。肝移植术后发生CPM多与低血钠快速纠正有关。