甜菜碱浸种对苏打盐碱胁迫下水稻种子萌发和生理特性的影响
2023-09-11韩爱平张佰毅李博文钟行杰罗钰颖张明聪
韩爱平 张佰毅 李博文 钟行杰 罗钰颖 张明聪
摘要:以水稻品种垦稻10为试验材料,采用室内培养法,研究10 mmol/L甜菜碱浸种对不同浓度(0、20、40、60、80 mmol/L)苏打盐碱(Na2CO3、NaHCO3)胁迫下水稻种子萌发和生理特性的影响。结果表明,苏打盐碱胁迫处理抑制了水稻种子萌发,与蒸馏水浸种处理(CK)相比,蒸馏水浸种+40、60、80 mmol/L苏打盐碱胁迫处理(S40、S60、S80)降低了水稻种子发芽率、发芽势和根/芽长,提高了根系相对电导率;而甜菜碱浸种+40、60、80 mmol/L苏打盐碱胁迫处理(SBT40、SBT60、SBT80)显著缓解了苏打盐碱胁迫对水稻种子萌发的抑制作用,与相同苏打盐碱胁迫条件下蒸馏水浸种处理相比,SBT40、SBT60、SBT80处理的发芽率分别增加了1.40%、1.15%、4.65%(P<0.05),侧根数分别增加了13.04%、15.24%、16.67%,SBT20、SBT40、SBT60、SBT80处理的根系过氧化物酶(POD)活性分别提高了50.88%、41.25%、25.68%、8.57%,GSH含量分别增加了8.33%、4.73%、6.09%、4.95%,根系MDA含量分别下降了52.91%、24.83%、29.24%、1.44%,根系相对电导率分别下降了19.88%、11.90%、12.82%、3.47%,根系可溶性糖含量分别增加了30.19%、10.57%、3.47%、6.01%,根系脯氨酸含量分别增加了19.10%、7.92%、4.28%、1.21%。综上所述,在苏打盐碱胁迫下,10 mmol/L甜菜碱浸种处理通过促进水稻根系生长、提高植物抗氧化酶和抗氧化剂活性、增加有机渗透调节物质含量、降低MDA含量来保护细胞结构的完整,从而增强水稻耐盐碱胁迫的能力,其中10 mmol/L甜菜碱浸种处理对40 mmol/L盐碱胁迫的缓解效果最佳。
关键词:水稻;甜菜碱;浸种;苏打盐碱胁迫;生长发育
中图分类号:S511.01 文献标志码:A
文章编号:1002-1302(2023)15-0079-07
基金项目:黑龙江省自然科学基金联合引导项目(编号:LH2022D019);黑龙江省博士后科研启动金(编号:LBH-Q21162);黑龙江省大学生创新创业训练项目(编号:201910223003);大庆市指导性科技计划(编号:zd-2019-78);黑龙江八一农垦大学博士科研启动基金(编号:XYB2014-04)。
作者简介:韩爱平(1996—),女,甘肃定西人,硕士研究生,现主要从事苏打盐渍土改良相关研究。E-mail:hapmx0106@126.com。
通信作者:张明聪,博士,副教授,现主要从事盐碱地改良相关研究工作。E-mail:zhangmingcong@163.com。
水稻是我国主要的粮食作物之一,然而稻田不合理的开发利用,导致土壤次生鹽碱化程度加剧,制约了水稻产量持续增长[1]。在盐碱胁迫下,水稻幼苗存活率低,根系生长、根系活力下降,导致植物体细胞内大量活性氧自由基累积,造成根细胞壁破损、胞内电位平衡紊乱、细胞质膜的氧化应激严重[2-3],同时高pH值会导致营养元素转变为无效态,严重制约了水稻种子萌发进程[4]。因此,提高水稻种子在苏打盐碱胁迫下的适应能力,对于保障我国粮食安全具有重要意义。
甜菜碱(betaine,BT)是一种动植物体内的次生代谢产物,具有无毒、高水溶性、易吸收等优点[5]。当植物受到逆境胁迫时,外源喷施甜菜碱能够维持生理生化进程中主要酶类、末端氧化酶活性及复合蛋白四元结构和功能的稳定,维持光合作用各器官完整性,调节作物体内渗透平衡,保证逆境胁迫下细胞生理生化过程的正常运转[6]。有研究发现,外源添加甜菜碱可通过维持光系统Ⅰ的高循环电子流速率、光系统Ⅱ的稳定性和叶片的相对水含量,维持作物幼苗光合作用的稳定性,提高净光合效率,促进干物质积累,调节渗透平衡,减弱细胞膜的通透性[7],并通过影响上调基因的表达来增强保护酶活性[8],有效缓解逆境胁迫对棉花[9]、大豆[10]、小麦[11]、水稻[12]等作物带来的损伤。Yang等研究发现,在高温胁迫下,甜菜碱通过阻止Rubisco激活酶的分离来维持Rubisco的活化,从可溶性基质组分中分离出类囊体膜,从而提高了对CO2同化的耐受性,通过转化BADH基因可能是增强植物耐高温能力的有效途径[13]。钱婧雅通过外源甜菜碱对高温胁迫下水稻种子萌发研究发现,甜菜碱处理可以增强种子在吸胀、萌发及幼苗生长过程中对高温的耐受性[14]。还有研究结果表明,甜菜碱浸种能够提高作物抗盐性,对改善渗透调节物质、细胞质膜透性、调节细胞内的Na+/K+平衡,维持细胞膜和光合器官的结构和功能等方面具有重要调控作用[15]。
目前,关于甜菜碱对水稻幼苗生长影响的研究主要集中在干旱、高温胁迫等方面,而在用苏打盐碱胁迫下甜菜碱浸种能否通过影响叶片抗氧化系统和渗透调节物质缓解水稻种子萌发和促进根系形态的建成尚不明确。因此,本试验采用室内培养试验,通过明确甜菜碱浸种对不同浓度苏打盐碱胁迫下水稻种子萌发的调控效应,以期为甜菜碱在苏打盐碱地水稻种植中的应用提供理论依据。
1 材料与方法
1.1 试验设计
试验于2022年3月开始,供试水稻品种为垦稻10;甜菜碱购买于国药集团化学试剂有限公司。
选取均匀饱满水稻种子,经70%乙醇消毒 5 min、10% NaClO浸泡20 min、蒸馏水反复冲洗5次后恢复至种子初始含水量。配制甜菜碱溶液(10 mmol/L),浸种24 h后,将种子阴干(前期预试验确定10 mmol/L甜菜碱溶液对水稻萌发有较好的促进作用),以蒸馏水浸种24 h作对照。共设置9个处理,分别为蒸馏水浸种处理(CK),蒸馏水浸种+20、40、60、80 mmol/L苏打盐碱胁迫处理(分别记作S20、S40、S60、S80),甜菜碱浸种+20、40、60、80 mmol/L 苏打盐碱胁迫处理(分别记作SBT20、SBT40、SBT60、SBT80)。在苏打盐碱胁迫处理中,配制Na2CO3-NaHCO3体积比为9 ∶1、pH值为9.2的溶液。9个处理各选取10粒饱满、均匀的水稻种子,每个处理设置5次重复,将其放在直径为9 cm且垫有3层滤纸的培养皿中(定期更换滤纸),于 32 ℃ 的恒温培养箱中培养,每天定时称质量,加各处理液到初始质量,
1.2 测定项目与方法
1.2.1 种子萌发相关指标 参照吴旺嫔等的测定方法[16],在处理后3 d开始测定,发芽标志为胚轴伸出2 mm,统计发芽势(GP,处理3 d时发芽的种子数占种子总数的比例)、发芽率(GR,处理7 d时发芽的种子数占种子总数的比例);处理9 d测量幼苗主根长(根基部到根尖的长度)、芽长(根基部到芽尖的高度),侧根数(主根上露出表皮的可见侧根数量)、鲜质量(用蒸馏水将根系冲洗干净,将水稻幼苗根部吸干表面水分后称得鲜质量)和干质量(放入烘箱中,于105 ℃杀青30 min,再于80 ℃烘干至恒质量,用1/10 000天平称得干质量)。
1.2.2 抗氧化酶活性的测定 用氮蓝四唑法测定超氧化物歧化酶(SOD)活性;用愈创木酚法测定过氧化物酶(POD)活性;抗坏血酸(AsA)和谷胱甘肽(GSH)活性的测定参照邹琦的方法[17]。
1.2.3 丙二醛、相对电导率的测定 丙二醛(MDA)含量采用硫代巴比妥酸显色法[17]测定。叶片电导率测定:首先用滤纸吸干植株根系表面水分,剪成均匀小块,称取0.3 g放入烧杯中,加入 50 mL 蒸馏水,室温静置24 h,其间定时搅拌,用电导仪(DDS-20)测其电导率(C1),沸水浴45 min后测电导率(C2),叶片相对电导率(REC)=C1/C2×100%,每个处理设3次重复。
1.2.4 可溶性糖及游离脯氨酸含量的测定 采用蒽酮法[17]测定可溶性糖含量,采用磺基水杨酸法[17]测定游离脯氨酸含量。
1.3 统计分析
用Excel 2021对数据进行处理和计算,用 SPSS 18.0软件进行单因素方差分析,所有数值均为3 次重复的平均值,具体表示为“平均值±标准偏差”,用Origin 2021进行绘图。
2 结果与分析
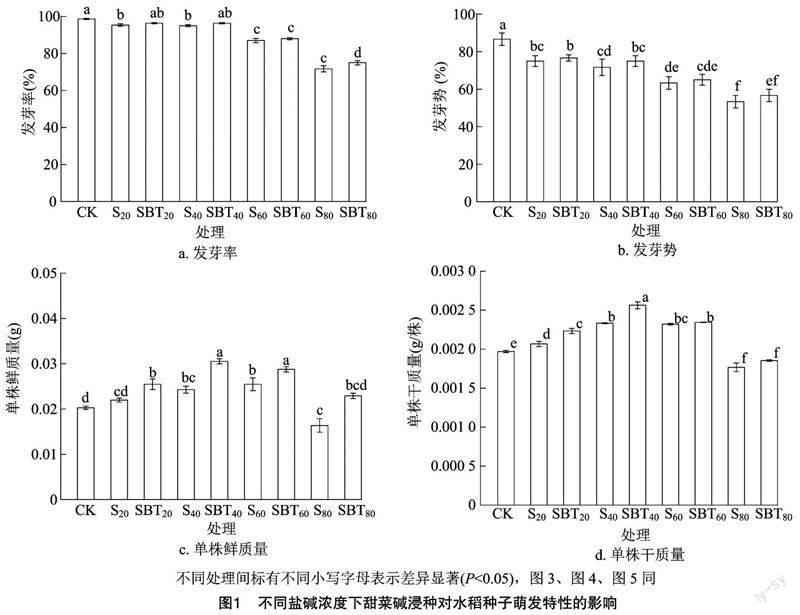
2.1 对种子萌发特性的影响
由图1可见,与CK处理相比,S20、S40、S60、S80处理的发芽率分别下降了3.38%、3.72%、11.82%、27.36%,发芽势分别下降了13.46%、17.31%、26.92%、44.44%,S20、S40、S60处理水稻单株鲜质量分别增加了8.33%、19.68%、25.60%。而甜菜碱浸种处理能够显著改善水稻种子的萌发特性,与蒸馏水浸种+20、40、60、80 mmol/L苏打盐碱胁迫处理(S20、S40、S60、S80)相比,甜菜碱浸种提高了盐碱胁迫下种子的发芽率和发芽势,SBT20、SBT40、SBT60、SBT80处理的水稻种子发芽率分别增加了1.05%、1.40%、1.15%、4.65%(P<0.05),发芽势分别增加了2.0%、5.0%、3.0%、6.0%,鲜质量、干质量也显著增加,其中SBT40处理的鲜质量、干质量增加得最显著,分别增加了25.82%、9.86%。
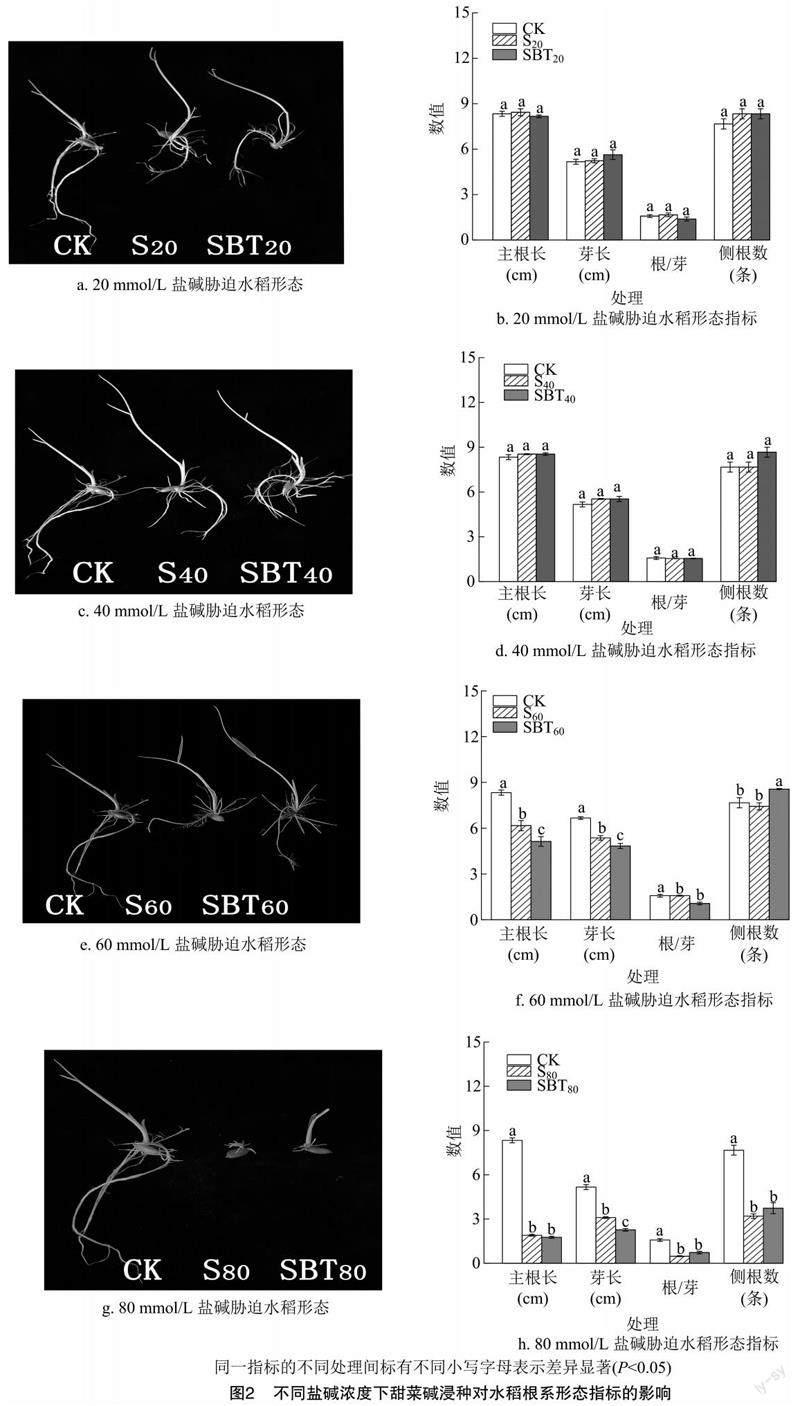
2.2 對根系形态指标的影响
由图2可见,与CK处理相比,S20处理水稻幼苗的主根长增加了1.20%,芽长增加了1.29%,侧根数增加了8.69%,根/芽提高了5.29%;S60、S80处理稻幼苗的主根长分别降低了26.0%、77.20%,芽长分别降低了19.50%、40.00%,侧根数分别减少了3.04%、58.26%,根/芽分别降低了36.70%、69.53%。与蒸馏水浸种+20、40、60、80 mmol/L苏打盐碱胁迫处理(S20、S40、S60、S80)相比,甜菜碱浸种水稻幼苗的根系形态指标均有所下降,但侧根数增加,其中SBT40、SBT60、SBT80处理的侧根数分别增加了13.04%、15.24%、16.67%。
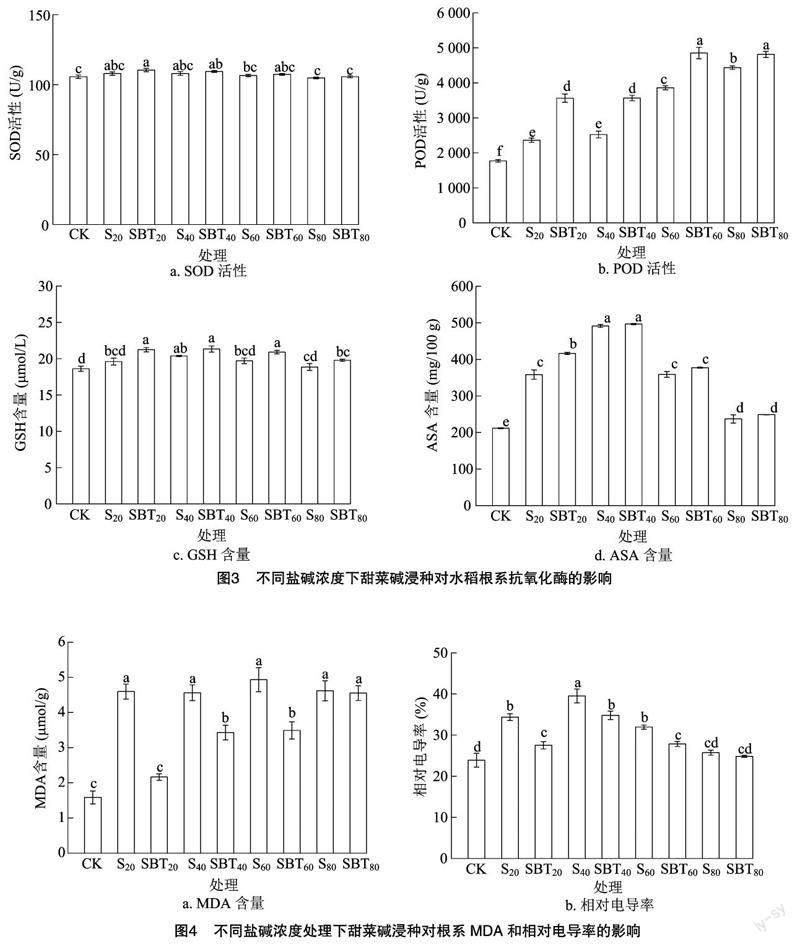
2.3 对根系抗氧化酶活性的影响
由图3可见,与CK处理相比,S20、S40、S60、S80处理水稻幼苗根系的SOD活性分别增加了2.15%、2.21%、0.82%、0.82%,POD活性分别增加了33.30%、42.52%、117.96%、150.33%,GSH含量分别增加了5.28%、9.40%、5.82%、1.25%,AsA含量分别增加了69.36%、132.22%、69.53%、12.05%;与蒸馏水浸种+20、40、60、80 mmol/L苏打盐碱胁迫处理(S20、S40、S60、S80)相比,SBT20、SBT40、SBT60、SBT80处理水稻幼苗根系的SOD活性分别增加了2.28%、1.29%、0.81%、0.81%,POD 含量分别增加了50.88%、41.25%、25.68%、8.57%;GSH含量分别增加了8.33%、4.73%、6.09%、4.95%;AsA含量分别增加了16.12%、1.09%、5.14%、4.92%。
2.4 对根系MDA及相对电导率的影响
由图4可见,与CK处理相比,S20、S40、S60、S80处理水稻幼苗根系MDA含量分别增加了190.49%、188.19%、211.72%、191.74%,相对电导率分别提高了43.78%、65.33%、33.67%、7.67%;与蒸馏水浸种+20、40、60、80 mmol/L苏打盐碱胁迫处理(S20、S40、S60、S80)相比,甜菜碱浸种+20、40、60、80 mmol/L 苏打盐碱胁迫处理(SBT20、SBT40、SBT60、SBT80)的MDA含量分别下降了52.91%、24.83%、29.24%、1.44%,相对电导率分别下降了19.89%、11.91%、12.82%、3.47%。
2.5 对根系可溶性糖及游离脯氨酸含量的影响
由图5可见,与CK处理相比,S20、S40、S60、S80处理水稻根系的可溶性糖含量分别增加了22.92%、57.55%、60.03%、34.38%,脯氨酸含量分别增加了21.97%、56.57%、55.20%、39.55%;与蒸馏水浸种+20、40、60、80 mmol/L苏打盐碱胁迫处理(S20、S40、S60、S80)相比,甜菜碱浸种+20、40、60、80 mmol/L苏打盐碱胁迫处理(SBT20、SBT40、SBT60、SBT80)水稻的可溶性糖含量分别增加了30.19%、10.57%、3.47%、6.01%,脯氨酸含量分别增加了19.10%、7.91%、4.27%、1.21%。
3 讨论
苏打盐碱胁迫显著降低了植物幼苗存活率、芽长、根长和根系活力,使植物根细胞严重损伤,膜质损伤增加。同时,高pH值胁迫会减少根细胞对离子的吸收,使植物体内K+、Na+代谢稳态失衡,细胞分裂受阻,从而抑制水稻种子萌发[18]。徐芬芬等的研究结果表明,NaCl、Na2CO3胁迫会抑制水稻种子根系生长,主要表现降低水稻种子发芽势、发芽率,并影响种子芽长、根长等指标[19]。本研究发现,在苏打盐碱胁迫下,水稻种子发芽率和发芽势显著降低,主根长、芽长、根/芽和侧根数等根际特征指标下降,并且随苏打盐碱浓度增加,抑制效果更加明显。而甜菜碱浸种+20、40、60、80 mmol/L苏打盐碱胁迫处理(SBT20、SBT40、SBT60、SBT80)可提高苏打盐碱胁迫对水稻种子的发芽率、发芽势、侧根数和干鲜质量,这与刘文露等在高温胁迫下甜菜碱浸种对水稻萌发研究的结果[20]一致,可能与甜菜碱浸种处理通过促进原生木质部中柱鞘细胞启动,加速侧根原基分化和侧根建成有关。
苏打盐碱胁迫引起叶绿体光能复合体电子传递能力下降,光量子与氧分子大量结合,导致积累过量的活性氧自由基,膜脂过氧化产物增加,引起细胞膜中酶蛋白交联、变性,膜流动性增大,从而抑制作物生长发育,甚至引起植物死亡[21-22]。有研究表明,甜菜碱可直接清除 H2O2或其激活清除 H2O2所必需的酶活性,降低体内过量的MDA、Na+含量,提高作物对逆境胁迫的耐受性[23]。本研究发现,在蒸馏水浸种+20、40、60、80 mmol/L苏打盐碱胁迫处理(S20、S40、S60、S80)下,水稻种子根系内MDA和相对电导率含量显著上升,表明苏打盐碱胁迫下水稻根系细胞膜遭到严重破坏,大量电解质外渗,而甜菜碱浸种+20、40、60、80 mmol/L苏打盐碱胁迫处理(SBT20、SBT40、SBT60、SBT80)在一定程度上增强了根系中SOD、POD活性和GSH、ASA含量,减少了苏打盐碱胁迫下 MDA含量、相对电导率,其中对于缓解40 mmol/L盐碱胁迫下水稻种子萌发的效果最显著。推测外源甜菜碱可能与酶蛋白结合,使酶蛋白处于激活状态,维护呼吸酶及能量的代谢稳态,维持酶蛋白结构的完整和功能的稳定,增加保护酶活性以清除体内过量的活性氧自由基,缓解植物细胞、蛋白质和酶不受外界因素的影响,提高水稻种子抵御苏打盐碱胁迫的能力[24]。
渗透调节能力和维持水分吸收是衡量植物耐盐碱能力的重要指标,植物细胞中脯氨酸含量的积累在植物水分损失下维持细胞正常代谢和生命活动中起着关键的作用[25-26]。甜菜碱减轻NaCl诱导的叶绿体和线粒体超微结构损伤,水稻根细胞中产生储存Na+的液泡,并在细胞中合成有机渗透调节物质,以缓解苏打盐碱胁迫引起的水分损失[27]。前人研究表明甜菜碱是季铵盐化合物中的一种,具有促进作物生长发育的渗透保护剂作用[28]。有研究表明外源甜菜碱促进水稻植株过表达甜菜碱合成基因,可增强对干旱胁迫耐受性[29]。本研究表明,与CK处理相比,蒸馏水浸种+20、40、60、80 mmol/L苏打盐碱胁迫处理(S20、S40、S60、S80)下水稻根系中可溶性糖和游离脯氨含量均有所增加,而甜菜碱浸种+20、40、60、80 mmol/L苏打盐碱胁迫处理(SBT20、SBT40、SBT60、SBT80)下根系中可溶性糖和游离脯氨酸含量显著提升,表明甜菜碱浸种可以促进水稻根细胞中大量有机溶质积累,不仅维持细胞膨压稳定,还能提高细胞渗透调节平衡,为细胞正常代谢提供能量,从而保证了细胞膜结构的完整,提高水稻对苏打盐碱胁迫的适应能力,这与前人研究结果[30-32]一致。
4 结论
綜上所述,甜菜碱浸种提高了苏打盐碱胁迫下水稻种子根系中抗氧化酶、抗氧化剂活性和有机溶剂含量,清除根系中过量活性氧自由基含量,维持结构蛋白稳态和水分吸收能力,降低MDA含量和相对电导率,保持生物膜结构完整,缓解了苏打盐碱胁迫导致的细胞氧化损伤,提高水稻种子的发芽能力,促进根系生长发育。本试验结果表明 10 mmol/L 甜菜碱浸种对于缓解40 mmol/L盐碱胁迫下水稻种子萌发效果最显著。
参考文献:
[1]杨玉坤,耿计彪,于起庆,等. 盐碱地土壤利用与改良研究进展[J]. 农业与技术,2019,39(24):108-111.
[2]谢国生,朱伯华,彭旭辉,等. 水稻苗期对不同pH值下NaCl和NaHCO3胁迫响应的比较[J]. 华中农业大学学报,2005,24(2):121-124.
[3]路旭平,李芳兰,马晓娟,等. 不同碱敏感水稻品种根系对碱胁迫的生理响应策略[J]. 中国生态农业学报,2021,29(7):1171-1184.
[4]冷春旭,郑福余,赵北平,等. 水稻耐碱性研究进展[J]. 生物技术通报,2020,36(11):103-111.
[5]Demiral T. Türkan I. Does exogenous glycine betaine affect antioxidative system of rice seedlings under NaCl treatment[J]. Journal of Plant Physiology,2004,161(10):1089-1100.
[6]Park E J,JeknicZ,Pino M T,et al. Glycinebetaine accumulation is more effective in chloroplasts than in the cytosol for protecting transgenic tomato plants against abiotic stress[J]. Plant Cell & Environment,2010,30(8):994-1005.
[7]Giri J. Glycinebetaine and abiotic stress tolerance in plants[J]. Plant Signaling & Behavior,2014,6(11):1746-1751.
[8]Alia,Hayashi H,Sakamoto A,et al. Enhancement of the tolerance of Archbishops to high temperatures by genetic engineering of the synthesis of nitroglycerine[J]. Plant Journal,2010,16(2):155-161.
[9]高 雁,娄 恺,李 春. 盐分胁迫下棉花幼苗对外源甜菜碱的生理响应[J]. 农业工程学报,2011,27(增刊1):244-248.
[10]黄英运,朱丹华,李虹章,等. 外源甜菜碱对NaCl胁迫下大豆苗期生理指标的影响[J]. 浙江农业学报,2012,24(1): 12-16
[11]赵新西,马千全,梁 超,等. 甜菜碱预处理对盐胁迫下小麦幼苗类囊体膜脂脂肪酸组分和功能的影响[J]. 作物学报,2006,32(5):703-708.
[12]刘陈晨,李 旭,任士伟,等. 低温胁迫下外源甜菜碱对水稻秧苗期生长的影响[J]. 江苏农业科学,2019,47(11):100-102.
[13]Yang X H,Liang Z,Lu C M. Genetic engineering of the biosynthesis of glycinebetaine enhances photosynthesis against high temperature stress in transgenic tobacco plants[J]. Plant Physiology,2005,138(4):2299-2309.
[14]钱婧雅. 外源甜菜碱对高温胁迫下水稻种子萌发及生长特性的生理調控机制[D]. 长沙:湖南农业大学,2020.
[15]严青青,张巨松,代健敏,等. 甜菜碱对盐碱胁迫下海岛棉幼苗光合作用及生物量积累的影响[J]. 作物学报,2019,45(7):1128-1135.
[16]吴旺嫔,周伟江,唐才宝,等. 2,4-表油菜素内酯对低温胁迫下水稻种子萌发及生理特性的影响[J]. 分子植物育种,2020,18(13):4427-4434.
[17]邹 琦. 植物生理学实验指导[M]. 北京:中国农业出版社,2000:171-172.
[18]魏 嘉,蔡勤安,李 源,等. 植物对盐碱胁迫响应机制的研究进展[J]. 山东农业科学,2022,54(4):156-164.
[19]徐芬芬,彦有娟,韦蓉香. NaCl和Na2CO3胁迫对水稻根系生长的影响[J]. 杂交水稻,2020,35(3):76-78.
[20]刘文露,钱婧雅,徐志明,等. 温度和甜菜碱对水稻种子萌发的影响[J/OL]. 分子植物育种,2022:1-8.[2023-03-12]. http://kns.cnki.net/kcms/detail/46.1068.s.20220328.1016.003.html.
[21]马红媛,梁正伟,吕丙盛,等. 松嫩碱化草甸土壤种子库格局、动态研究进展[J]. 生态学报,2012,32(13): 4261-4269.
[22]Zhang H,Liu X L,Zhang R X,et al. Root damage under alkaline stress is associated with reactive oxygen species accumulation in rice (Oryza sativa L.)[J]. Frontiers in Plant Science,2017,8:1580.
[23]Cha-Um S. Samphumphuang T. Kirdmanee C. Glycinebetaine alleviates water deficit stress in indica rice using proline accumulation,photosynthetic efficiencies,growth performances and yield attributes[J]. Australian Journal of Crop Science,2013,7(2):213-218.
[24]马婷燕,李彦忠. 外源甜菜碱对NaCl胁迫下紫花苜蓿种子萌发及幼苗抗性的影响[J]. 草业科学,2019,36(12):3100-3110.
[25]Rahman M S,Miyake H,Takeoka Y. Effects of exogenous glycinebetaine on growth and ultrastructure of salt-stressed rice seedlings (Oryza sativa L.)[J]. Plant Production Science,2008,5(1):33-44.
[26]林 兵,赵步洪. 水稻耐盐碱生理机制与遗传改良的研究进展[J]. 江苏农业科学,2022,50(16):37-43.
[27]张立新,李生秀. 甜菜碱与植物抗旱/盐性研究进展[J]. 西北植物学报,2004(9):1765-1771.
[28]Demiral T,Türkan I. Exogenous glycinebetaine affects growth and proline accumulation and retards senescence in two rice cultivars under NaCl stress[J]. Environmental and Experimental Botany,2006,56(1):72-79.
[29]Chen T H H,Murata N. Glycinebetaine protects plants against abiotic stress:mechanisms and biotechnological applications[J]. Plant Cell & Environment,2015,34(1):1-20.
[30]Park E J,Jeknic Z,Chen T H H. Exogenous application of glycinebetaine increases chilling tolerance in tomato plants[J]. Plant Cell Physiol,2006,47(6):706-714.
[31]Shemi R,Wang R,Gheith E S M S,et al. Role of exogenous-applied salicylic acid,zinc and glycine betaine to improve drought tolerance in wheat during reproductive growth stages[J]. BMC Plant Biol,2021,21(1):574.
[32]Qi Z,Rue K,Mueller J. The Effect of glycinebetaine priming on seed germination of six turfgrass species under drought,salinity,or temperature stress[J]. Hortscience a publication of the American society for Horticultural Science,2014,49(11):1454-1460.
