辽宁某规模化猪场猪源多杀性巴氏杆菌的分离鉴定及耐药性分析
2023-09-07王洪奎
王洪奎
(阜新蒙古族自治县现代农业发展服务中心,辽宁 阜新 123125)
猪巴氏杆菌病是由多杀性巴氏杆菌引起的急性流行性或散发性和继发性传染病,又叫猪肺疫。猪巴氏杆菌病根据临床症状可分为急性型和慢性型2 类。急性型多以出血性败血性病变、咽喉肿胀发炎和肺部充血、水肿、炎症等为主要临床表现,慢性病例多发病缓慢,主要表现为呼吸苦难,慢性肺炎,个别可见关节炎症状,且其常与猪瘟等混合感染,严重的可引起猪只死亡,对养猪业危害巨大[1,2]。
近日,辽宁某规模化猪场部分猪发病,病猪体温升高,可达40 ~41 ℃,精神沉郁,食欲减少或不食,干咳,部分猪鼻孔流出浆性或脓性分泌物,呼吸困难,张口呼吸,结膜发绀,皮肤表面有大小不一致且形状不规则的红色斑块,少数猪轻微腹泻,部分猪于发病7 日内死亡。剖检死亡病猪后,可见咽喉部红肿发炎,黏膜充血、水肿,胸腔与肺脏黏连,胸腔积液,肺充血、水肿,部分坏死,脾脏表面有散在出血点,轻微肿大。综合临床症状、剖检变化及流行病学情况,疑似为巴氏杆菌引起。为进一步确诊,现场采集病猪肺脏、淋巴结等组织样品,对致病菌进行分离鉴定,同时进行药物敏感性试验,以期对临床上该类疾病的防治提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 主要试剂 普通营养肉汤琼脂培养基,LB 培养基,革兰氏染色试剂盒购于北京索莱宝科技有限公司。DNA marker DL2000,TaKa-Ra Ex Taq DNA Polymerase (含dNTP Mixture)购于南京诺唯赞生物科技股份有限公司。细菌基因组DNA 提取试剂盒购于生工生物工程(上海) 股份有限公司。甲醇、无水乙醇、三氯甲烷等试剂为国产分析纯。
1.1.2 主要仪器 电热恒温培养箱,购自于北京六一仪器有限公司; c300 凝胶成像系统,购自于江苏捷达科技有限公司; 电泳仪Power-Pac HC、电泳槽 GT1704482、T100 Thermal Cycler PCR 仪,购自于美国伯乐有限公司; 无菌工作台,购自于青岛海尔公司。
1.1.3 病料及实验动物 猪场发病死亡猪2头,剖检后无菌采集肺脏组织样品,-20 ℃保存待检。SPF 级昆明小鼠20 只,雌雄各半,购自于沈阳长生实验动物有限公司。
1.2 实验方法
1.2.1 细菌分离培养 将病料组织样品涂布于营养琼脂培养基和血平板培养基上,放入培养箱培养观察。用接种环取单菌落,进一步划线培养纯化。同时挑取单个菌落在LB 培养基中进行振荡培养,纯化培养后菌株进行革兰染色镜检,观察菌体染色特性及形态。
1.2.2 生化鉴定 参考生化试验试剂说明书,将分离菌培养物接种于各生化反应管中,37 ℃培养24 h,观察并记录结果。
1.2.3 细菌16S rRNA 基因序列分析 使用16 sRNA 通用引物进行普通PCR 扩增,上下游引物分别为5′AGAGTTTGATCATGGCTCAG 3′和5′ GGCTACCTTGTTACGACTT 3′,引物由生工生物公司进行引物合成。扩增条件: 95 ℃预变性5 min,94 ℃变性45 s,退火温度52 ℃,退火时间30 s,72 ℃延伸1.5 min,共34 个循环。最后72 ℃延伸10 min,4 ℃保存。然后取5 μL PCR 产物进行琼脂糖凝胶电泳,凝胶成像仪观察结果,同时将PCR 产物送往上海生工生物公司进行测序。测序结果与NCBI 中已发表的基因序列进行同源性比对。
1.2.4 致病性试验 无菌条件下挑取普通琼脂培养基上培养的单个菌落接种于LB 液体培养基中,37 ℃、200 r/min 培养12 h。取20 只健康的SPF 级小鼠,随机分为试验组和对照组,每组10 只。对试验组小鼠腹腔注射0.2 mL 含有1 × 108个细菌的菌液,对照组小鼠注射等体积的LB 液体培养基,逐日观察小鼠发病死亡情况。并对死亡小鼠及未死亡小鼠分别进行剖检,观察记录小鼠各个组织病变情况,同时取病变脏器进一步分离病原菌。
1.2.5 药敏试验 采用纸片扩散法进行药敏试验。挑取琼脂平板培养基上的单菌落接种于LB 液体培养基,37 ℃、200 r/min 培养12 h,取100 μL 菌液分点滴加在琼脂平板上,应用玻璃棒均匀涂布于培养基上,将常用抗菌药物药敏纸片贴在平板培养基上,37 ℃培养24 h,观察抑菌圈是否出现并测定其直径。
2 结果
2.1 细菌分离培养
分离菌在普通琼脂平板上生长出灰白色菌落,表面光滑且较为湿润、边缘整齐。血平皿上生长出灰白色菌落,表面光滑且较为湿润、边缘整齐且没有溶血现象(图1)。挑取单菌落至于载玻片上,进行革兰氏染色。染色后将载玻片置于油镜下观察,镜下可见本次分离菌株呈淡红色、两端钝圆的短杆状,为革兰阴性菌(图2)。

图1 分离菌平板培养基菌落形态

图2 分离菌革兰氏染色结果(1 000 ×)
2.2 生化鉴定
生化试验结果表明,本次分离菌株可分解葡萄糖、果糖、蔗糖、甘露糖和半乳糖,产酸不产气。对乳糖、鼠李糖、肌醇不发酵。可生成靛基质,甲基红和VP 试验阴性,不液化明胶(表1)。
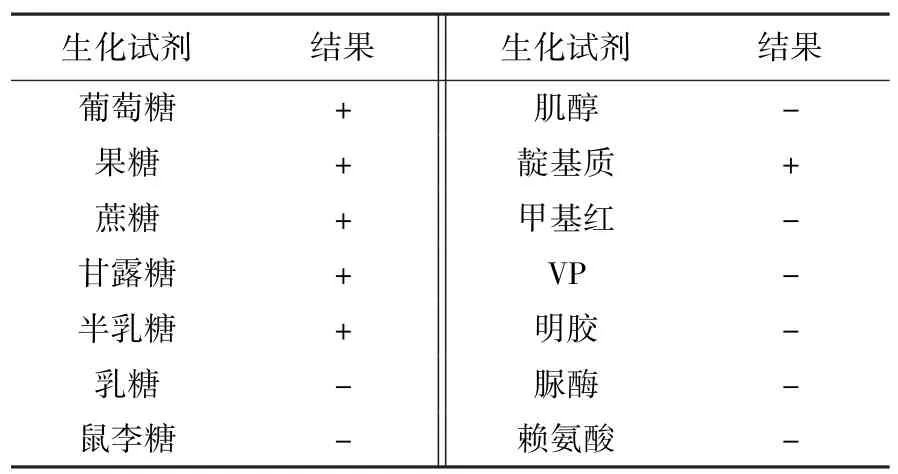
表1 分离菌的生化鉴定结果
2.3 细菌16S rRNA 基因序列分析
菌液PCR 产物琼脂糖电泳结果显示,扩增出预期1 420 bp 的单一条带(图3)。将目标片段测序后,通过BLAST 工具将其结果进行在线比对,结果显示该序列与GenBank 中多杀性巴氏杆菌的核苷酸序列相似程度最高,同源性大于99.9%。

图3 分离菌16S rRNA PCR 结果
2.4 动物试验
分离菌菌液接种小鼠8 h 后,试验组小鼠开始出现不同程度的临床表现。主要表现为运动迟缓、食欲不振、呼吸急促、体温升高等症状,36 h 后全部死亡,对照组小鼠全部正常。无菌采集小鼠肺脏,均匀涂布于普通琼脂培养基,37 ℃培养24 h,镜检及菌液16S rRNA PCR 鉴定表明,试验组小鼠肺脏中分离出的菌株为多杀性巴氏杆菌。
2.5 药敏试验
由表2 可知,本次分离的菌株对氟苯尼考、卡那霉素、氧氟沙星、庆大霉素、诺氟沙星、多西环素敏感,对环丙沙星中介,对头孢氨苄、克拉霉素、丁胺卡那、红霉素、头孢唑林耐药。可推荐养殖场选择使用氟苯尼考等药物进行临床治疗。
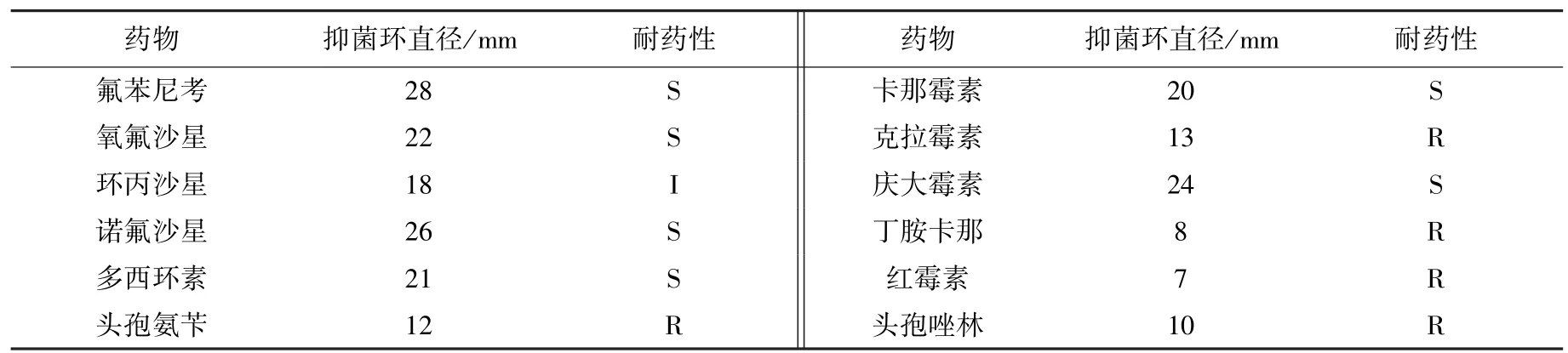
表2 分离菌药敏试验结果
3 讨论
多杀性巴氏杆菌是一种可引起多种畜禽疾病的革兰氏阴性致病菌,可导致牛出血性败血症、禽霍乱等,在猪可引起猪肺疫和猪萎缩性鼻炎等。结合本次细菌分离培养、生化实验和PCR 鉴定结果,初步确诊该猪场发病为猪巴氏杆菌病,通过对临床分离菌进行药敏试验,表明氟苯尼考、氧氟沙星等药物对临床分离菌株敏感,推荐养殖场采用上述药物进行防治,3 ~5 d后猪群整体发病率得到了控制,发病猪只临床症状也得到了控制,15 d 后猪场疾病得到了控制,取得了不错的效果。
巴氏杆菌拥有荚膜、脂多糖、菌毛和黏附素等多种毒力因子,根据荚膜类型可将其分为荚膜A 型、荚膜B 型、荚膜D 型、荚膜E 型和荚膜F 型等5 种血清型。猪巴氏杆菌肺炎(猪肺疫) 主要由荚膜A 型引起,临床症状根据病程的不同可分为多种病型,主要表现为呼吸困难、气喘等,病情重时剖检可见胸膜与病肺黏连,胸腔及心包积液。我国是畜牧业大国,生猪存栏量居世界前列,猪巴氏杆菌病在猪群中常年存在,对养猪业危害巨大。李敏研究表明,猪巴氏杆菌病在成都市发病率约为8.97%,而李永刚的研究证实猪巴氏杆菌病发病率为3.27%,病死率高达54.72%[3,4]。临床上针对该病的防控重点是疫苗免疫,国内部分规模化猪场采用猪肺疫弱毒苗进行免疫,收到了不错的预防效果。近期韦存莉尝试推广应用猪瘟、猪丹毒、猪巴氏杆菌病三联疫苗对猪只进行免疫,起到了很好地预防效果。三联苗不仅有效地降低猪巴氏杆菌病的发病率,同时也对猪瘟、猪丹毒起到了很好地预防作用。同时在猪场实行自繁自养、坚持标准化生产流程,采用免疫为主、综合防控为辅的原则,对上述疾病防控取得了显著效果[5]。2022 年6月,农业农村部第573 号公告对原«一、二、三类动物疫病病种名录» 进行修订,将巴氏杆菌病由之前的二类疫病修改为三类疫病,但这并不代表巴氏杆菌病对畜禽养殖业的危害在逐年减小,反而应该更加引起畜牧兽医工作者对该类疾病防控的重视。近年来随着分子生物学、细胞生物学技术的不断发展,巴氏杆菌病的临床诊断技术也在不断发展,多种敏感性高、特异性强的诊断技术不断涌现,可以实现快速、精准的诊断,从而提升了对该类疾病的防控水平。李伟杰等[6]也在2018 年修订了«猪巴氏杆菌病诊断技术» 行业标准,该标准的修订也将为猪巴氏杆菌病诊断技术的提升起到积极的促进作用。
