HOXD3 在宫颈癌组织中的表达及其临床意义*
2023-09-02陈小友李隆玉江维
陈小友 李隆玉 江维#
(1 南昌大学2016 级研究生 江西南昌 330006;2 江西省南昌市经开区乐化中心卫生院 南昌 330114;3 江西省妇幼保健院 南昌 330006)
宫颈癌(Cervical Cancer, CC)是世界范围内严重威胁妇女健康的恶性肿瘤之一,是唯一可以通过三级预防措施消除的恶性肿瘤[1]。2018 年全球范围有569 847 新发病例,311 365 死亡病例,全球宫颈癌的发病率和病死率均居第四位[2]。我国每年有超过13 万新发病例,约6 万人死于宫颈癌。国际妇产科联盟(FIGO)分期为ⅠA~ⅡA 期的早期宫颈癌五年生存率(OS)可以达到80%~90%,ⅡB 期60%~70%,Ⅲ期约40%,ⅣA 期只有20%。宫颈癌以直接蔓延、淋巴转移及血行转移为主,淋巴结转移是宫颈癌最为常见的转移途径之一,也是决定宫颈癌预后的一个独立危险因素。有资料显示,未发生淋巴结转移者术后五年生存率为80%~100%,有淋巴结转移者五年生存率降至约47%[3]。InoueInoue 和Morita的研究也发现转移淋巴结的多少与ⅢC1 期患者预后有密切关系,转移淋巴结1 个、转移淋巴结2~3个、转移淋巴结≥4 个的ⅢC1 期患者5 年OS 分别是81%、41%和23%[4]。手术和靶向治疗CC 有一定的发展,但是晚期CC 患者生存率不高,因此如何寻找治疗宫颈癌的新靶点,减少治疗后的复发和转移,改善存活率,具有重要意义。
近年来,研究者开始着重关注宫颈癌发生发展中的基因突变和蛋白表达,同源盒(Homebox,HOX)基因从胚胎发育到癌变的全过程中发挥着多类作用。HOX 基因最早于1915 年由卡耳文·布里吉斯(Calvin Bridges)在果蝇中发现[5],HOX 基因能使果蝇按照正常的空间顺序进行肢体发育,同时调控其形态的改变,避免畸变的发生[6]。HOX 基因编码转录因子家族是一种在进化上高度保守的基因家族,它广泛存在于真核细胞中,并主要参与动物肢体和形态发育等方面的调控[7]。此外,HOX 基因作为细胞增殖及分化的主控基因,其表达异常被证明与多种肿瘤(如白血病、前列腺癌、肾癌、胶质细胞瘤等)的发生、发展密切相关[8~9]。
HOXD3 属于HOX 基因家族的一员,其表达产物为重要的转录因子,在调控细胞增殖、凋亡、分化及肿瘤细胞侵袭转移等方面发挥重要作用,现已知其调控的基因包括黏附分子、生长因子和胞外蛋白等。目前研究表明HOXD3 具有多种生物学功能,并与多种肿瘤的进展有关,如在肺癌、乳腺癌、肝癌、胃癌、结直肠癌等多种肿瘤中异常表达[10],且与肿瘤的预后及分期密切相关。HOXD3 基因可以通过调节不同的靶点,发挥对肿瘤发生发展的作用。本研究探讨HOXD3 在宫颈癌组织中的表达水平及临床意义,提供实验依据,采取针对性的干预措施,提高生存率至关重要。现报道如下:
1 资料与方法
1.1 一般资料 回顾性收集并筛选77 例宫颈组织石蜡标本,于2020 年10 月至2022 年10 月病理确诊的33 例宫颈癌早期(ⅠB1~ⅠB2 期)、10 例局部晚期癌(ⅠB3 期)、20 例中晚期癌(Ⅱ~Ⅲ期)及5 例正常宫颈患者、9 例宫颈上皮内瘤变(CIN)为研究对象。本研究采用的宫颈癌组织、癌旁组织(与病灶之间的距离大于3 cm)标本由江西省妇幼保健院肿瘤科及病理科提供。研究中所需要的组织标本和临床病理资料,都是经本院伦理委员会索取,并征得患者知情同意。按FIGO 2018 标准进行分期。选择的癌组织及癌旁组织均经过有一定资质的病理科主任医师确定。在本研究中使用的患者病例资料均真实、完整。记录患者的一般临床病理资料:年龄、病理类型。
1.2 纳入标准 (1)除手术外,患者未经历免疫治疗、化学治疗或放射性治疗;(2)根据病理结果进行补充放化疗;(3)纳入患者仅包括病理结果显示为宫颈鳞状细胞癌的患者;(4)其他部位没有原发的第二肿瘤;(5)患者没有严重糖尿病、高血压或严重心脏病史。
1.3 主要试剂 HOXD3 兔多克隆抗体购自美国赛默飞公司;于北京中杉金桥生物技术公司购买兔二步法检测试剂盒、DAB 显色试剂盒、辣根过氧化物酶标记山羊抗兔一抗、辣根过氧化物酶标记山羊抗鼠二抗、免疫组化技术(IHC)抗体稀释液。武汉博士德生物公司购买即用型正常山羊血清。
1.4 免疫组化步骤及结果判定方法 IHC 又名免疫细胞化学,其原理是用带显色剂标志的特异性抗体与组织细胞原位发生抗原抗体反应及组织化学呈色反应来达到定性,定位目的、对相应的抗原物质进行了定量测定。该技术将免疫反应特异性与组织化学可见性巧妙融合,并且借助于显微镜可对多种抗原物质进行细胞及亚细胞层面的检测。
1.4.1 免疫组织化学方法 检测宫颈鳞状细胞癌患者石蜡标本中HOXD3 蛋白的表达情况。(1)将载玻片进行预处理:先把玻片事先放入浓酸溶液中、酒精中,再充分洗涤,干燥。其次把玻片泡在稀释多聚-L- 赖氨酸溶液10 s 左右,再拿出来,放入烤箱(45℃)晾干,避免组织切片脱落。(2)组织切片:在切片机上取石蜡包埋标本,切取厚度为4~5 μm 的组织,与玻片密贴。(3)捞取切片:待切组织样本匀速摊开,捞取摊开的切片,铺上载玻片,再把架子放在温箱内干燥,设定温度30℃。(4)脱蜡:干燥切片按顺序置于乙醇、二甲苯液浓度不等,实施梯度脱水脱蜡,每试剂脱蜡10 min,再经过双蒸水处理及磷酸缓冲盐溶液(PBS)处理。(5)修复抗原:于柠檬酸中高温高压修复。(6)增加一抗,二抗:把HOXD3 抗体按1:100 的比例稀释,慢慢地将50 μl 一抗工作液滴到玻片上,保证充分浸润组织。把载玻片放在4℃的湿盒内孵化一晚,并设阴性对照,以血清替代一抗。注意不要在湿盒中加水。次日用PBS 液清洗载玻片3次,每次5 min。利用滤纸将组织周围的液体吸出,滴100 μl 反应增强液于标本玻片上用37℃湿盒孵化20 min。然后滴100 μl 增强酶山羊/ 小鼠/ 兔IgG 聚合物37℃湿盒内孵化20 min。(7)DAB 显色;37℃室温滴加显色剂,计时4~5 min,呈现棕黄色沉淀物,说明有显色反应。随即以蒸馏水清洗玻片,结束显色反应,最后置于氨水中,组织返蓝,然后用自来水清洗2 min。(8)苏木素伊红染色封片:二甲苯中透明。透明化处理完成之后,将切片烘干,再用中性树胶进行封片,将其置于显微镜下进行观察。
1.4.2 显微镜图像采集及结果判定 HOXD3 主要在胞浆着色,随着临床病理分级不同,细胞的染色强度也不同,阳性染色呈棕褐色、棕黄色、淡棕黄色;采用半定量方法,由2 位经验丰富的病理科医师进行双盲阅片,根据细胞的染色强度及阳性染色面积进行判定。染色强度分数标准:无色为0 分,淡棕黄色为1 分,棕黄色为2 分,棕褐色为3 分。阳性胞浆面积:随机选取5 个高倍视野(×400)对阳性肿瘤胞浆面积进行统计,计算阳性细胞染色所占百分比:阳性面积≤10%,为1 分,10%~50%为2 分,50%~75%为3 分,>75%为4 分。将上述两分相加,<2 分为(-),2~3 分为(1+),4~5 分为(2+),>6 分为(3+)。依据HOXD3 免疫组化结果:0~1+ 为不表达(阴性),2+~3+为表达(阳性)。
1.5 统计学方法 采用SPSS21.0 统计软件进行数据分析,计数资料采用χ2检验,相关性采用Spearman 相关分析,P<0.05 表示差异有统计学意义,最后使用Canvas 12 和Adobe Photoshop 2022 进行照片排版处理。
2 结果
2.1 免疫组化检测HOXD3 在宫颈癌组织和正常宫颈组织中的表达情况 HOXD3 在宫颈癌组织中的阳性表达率明显高于正常宫颈组织,在高-中-低分化宫颈癌组织中阳性率显著高于宫颈正常组织,随着CIN 病情进展,HOXD3 的表达率逐渐升高,颜色逐渐加深,呈明显的递增趋势(P=0.001),在中晚期(Ⅱ~Ⅲ期)表达显著增强(P<0.05),阳性染色趋势主要呈淡棕黄色、棕黄色、棕褐色,差异有统计学意义(χ2=24.595,P=0.001)。见图1、图2、表1。

表1 HOXD3 与FIGO2018 CC 临床病理分期之间的关系[例(%)]

图1 HOXD3 蛋白在各级组织中的表达情况(×400)

图2 HOXD3 在临床病理分期与各组之间的关系
2.2 HOXD3 基因表达与患者各年龄段的相关性不同临床分析与正常组织的HOXD3 基因表达与患者各年龄段无显著相关性(χ2=18.838,P>0.05)。见图3、表2。

表2 HOXD3 与各年龄段之间的关系[例(%)]
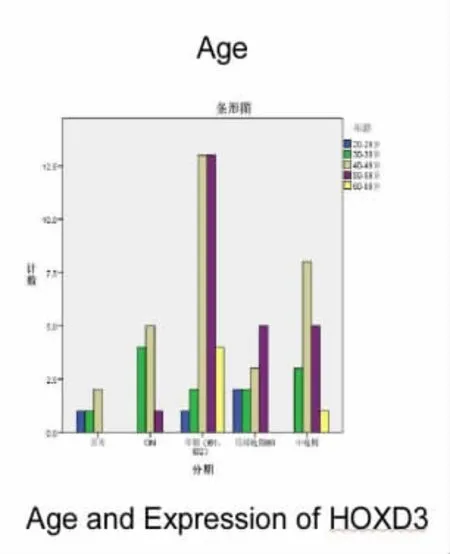
图3 HOXD3 在各年龄段之间的关系
3 讨论
宫颈癌是一种常见的恶性肿瘤,导致患者病死率增加。全球宫颈癌的发病率和病死率均居第四,我国每年有超过13 万新发病例,6 万人死于宫颈癌。进展期宫颈癌患者的生存率并不高,转移和复发是其主要死因。因此,积极探索宫颈癌细胞增殖侵袭迁移的研究,对宫颈癌的治疗有重大意义。早期宫颈癌患者可行手术治疗,治愈率较高;而化疗、放疗、手术和靶向治疗CC 取得了进展,但晚期CC 患者生存率并不高。
近年来的研究表明,多种HOX 基因与实体肿瘤的发生发展密切相关,其中人类HOX 基因有39个基因成员组成,分布在4 个保守基因簇中,HOXD包含9 个成员,分别为HOXD1、HOXD3、HOXD4、HOXD8、HOXD9、HOXD10、HOXD11、HOXD12 和HOXD13[11]。HOXD3 基因属于HOX 基因家族的第三旁系成员,是一种转录因子和信号传导蛋白。该蛋白质参与生物化学反应或细胞信号传递中,调控基因表达、细胞增殖、分化等生理过程。
在本部分研究中,通过免疫组化检测对77 例宫颈石蜡标本中宫颈癌组织和正常宫颈组织中HOXD3 的表达水平进行研究,发现HOXD3 在各组中的表达水平存在显著差异。随着CIN 病情的恶化,HOXD3 的高表达率逐渐升高,呈现递增趋势,特别是在中晚期(Ⅱ~Ⅲ期)表达显著增强。此外,随着临床病理分级的提高,HOXD3 的表达水平也相应增加,颜色更深,阳性染色呈淡棕黄色、棕黄色、棕褐色。然而,HOXD3 的表达与患者各年龄段之间并无显著相关性。研究表明,HOXD3 在促癌基因中发挥作用。在结肠癌癌旁组织中,HOXD3 基因表达水平较低,而在癌组织中表达水平较高。此外,HOXD3基因表达水平与肿瘤TNM 临床分期、肿瘤浸润深度呈正相关关系[12]。研究表明,HOXD3 mRNA 在胃癌组织中表达水平显著高于癌旁组织(t=10.48,P<0.01)[13],与正常乳腺组织相比,HOXD3 在乳腺癌组织中过表达[14]。CHEN 等[15]的研究发现,结直肠癌组织中HOXD3 的高表达能够在体外上调结直肠癌细胞中的HOXD3 表达,明显促进细胞周期进程和增殖,并且降低细胞凋亡水平,这表明HOXD3 具有促进结直肠癌细胞增殖的作用,Litovkin 等[16]发现前列腺癌组织内HOXD3 高度甲基化,并与前列腺癌的高危风险明显相关。Miyazaki 等[17]的研究表明,HOXD3 可以促进肺癌细胞A549 中转化生长因子-β(TGF-β) 的表达,从而上调基质金属蛋白酶-2(MMP-2)的表达,这表明HOXD3 可能具有促进肺癌转移的作用。此外,研究人员还分析了HOX 基因在人类肺小细胞癌移植小鼠中的表达,并指出HOXD3 在一些原发性和转移性肿瘤中表达,而在正常组织中不表达或表达水平较低[18]。
综上所述,本研究中HOXD3 在CC 中表达水平的改变与HOXD3 在乳腺癌、胃癌、结直肠癌、前列腺癌、肺癌等研究结果相一致。提示HOXD3 在CC 中表达可能是一种促癌基因。综合实验结果,可以得出结论:HOXD3 在宫颈癌组织中的表达显著增加,并与宫颈癌的FIGO 分期相关,推测HOXD3基因与宫颈癌的发生和发展密切相关,可能在促进宫颈癌的发生和发展中发挥一定作用,因此可以作为评估宫颈癌恶性程度的重要参考指标。但是HOXD3 在宫颈癌组织中异常表达的具体机制以及其对宫颈癌发生发展过程的具体影响和作用机制等问题还需要进一步深入研究。未来,HOXD3 有望作为一种监测宫颈癌进展和新治疗方法敏感性的生物标记物。
本研究存在一定的局限性,因此需要对结果进行谨慎解释。为了更好地服务于病患,未来的研究应该努力扩大研究样本的规模并改进研究方法,以提高结果的准确性和可靠性,为疾病治疗提供依据。
