小麦CBL基因家族鉴定及表达模式分析
2023-08-31陈慧婵娄贵成姜云爽王政委徐庆华
李 畅,陈慧婵,娄贵成,姜云爽,王政委,徐庆华,苍 晶
(东北农业大学生命科学学院,黑龙江哈尔滨 150030)
在植物体内,钙离子(Ca2+)作为一种普遍存在的第二信使,响应很多逆境和发育过程。植物中有大量的钙离子传感-响应器组件负责钙离子的信号转导[1]。钙调神经磷酸酶B亚蛋白(CBL)和与其相互作用的蛋白激酶(CIPKs)是钙离子介导的信号转导通路中的关键分子,参与响应不同的外界应激信号[2-3]。不同的CBL蛋白具有不同的EF-hand结构域,CBL家族不同蛋白之间结构域的差异可能与它们对钙离子的不同结合能力有关,这为CBL响应不同的刺激信号引起的Ca2+浓度变化提供了基础[4]。CBL基因在拟南芥中首次被发现,目前在水稻[5]、番茄[6]、藜麦[7]、葡萄[8]等不同植物中也检测出了多个CBL基因家族;部分CBL转基因植株在不同非生物胁迫下的表达模式会发生不同的变化,从而调节植物的抗逆性[9]。CBL家族在植物生长发育过程中发挥着关键作用,不仅能够保持植物体内离子浓度平衡与稳定,在植物对环境适应过程中也有着不可或缺的作用。拟南芥中,CBL家族基因AtCBL1、AtCBL2、AtCBL5、AtCBL9、AtCBL10均响应非生物胁迫[10-14],其中,AtCBL1响应低温胁迫[15]。玉米中,ZmCBL3、ZmCBL4、ZmCBL5和ZmCBL8与ZmCIPK16互作响应干旱、盐等逆境胁迫[16]。在水稻中,过表达OsCBL8赋予了水稻对高温和病原体的抵抗力[17],但OsCBL5对植物盐胁迫负调控[18];低温处理可提高豌豆的PsCBL转录水平,但干旱处理后,PsCBL的表达无显著差异[19];在杨树中,PeCBL1、PeCBL2、PeCBL4、PeCBL5和PeCBL9在盐胁迫下表达量均上调[20]。但目前关于小麦CBLs的基因组学和参与非生物胁迫的研究尚未见报道。
为了探讨小麦CBL的功能,本研究对小麦的CBL基因进行了全基因组分析,探究小麦CBL基因特征,并对本课题组前期在转录组数据库中筛选获得的8个差异表达的小麦CBL基因(未发表)进行表达模式分析,以期为深入研究小麦CBL基因的功能奠定基础。
1 材料与方法
1.1 小麦CBL基因家族成员的鉴定
参考齐 越等[21]对小麦DEAD-box基因家族成员鉴定的方法。首先,从Ensembl Plants 数据库(http://plants. ensembl.org/index.html)中下载小麦(中国春)全基因组数据,包括全基因组序列及注释文件,并且从水稻基因组数据库(http://rice.plant biology.msu.edu/)下载水稻的CBL蛋白。利用水稻CBL家族蛋白质序列作为query序列,以1∶5比例提取基因,并除去重复基因,检索小麦CBL家族基因。利用Pfam(http://pfam.xfam.org/)及NCBI(http://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)验证候选蛋白的结构域,手动逐一筛选错误序列,排除冗余序列,以获得目标小麦CBL家族基因成员。使用在线软件ExPASy(http://expasy.org/)预测小麦CBL蛋白氨基酸长度、分子量、等电点和脂肪指数等理化性质。在亚细胞定位预测网站(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)对CBL进行亚细胞定位预测。
1.2 小麦CBL结构域蛋白系统发育树的构建
使用ClusterX V2.0(http://www.clustal.org/clustal2/)对小麦、水稻、拟南芥的CBL基因家族所编码的蛋白质进行氨基酸序列对比分析。使用MEGA(https: //www.megasoftware.net/)软件的最大似然法(ML)构建系统发育树,设置bootstrap值为1 000。下载的序列已知染色体位置。
1.3 小麦CBL蛋白保守结构域和基因结构分析
对小麦CBL家族蛋白保守基序的检索分析采用MEME软件(http://meme-suit.org/),检索参数使用Zero or one occurrence per sequence(zoops),基序数值设为9。参考Pfam数据库,对小麦CBL基因家族进行蛋白保守结构域比对分析(E-value≤1.0)。使用在线软件GSD2.0(http://gsds.gaolab.org/)分析基因结构,TaCBL基因组和CDS序列在EnSembl Plants数据库中获得,将序列导入到在线软件GSD2.0中,对小麦CBL内含子和外显子结构进行分析。
1.4 CBL基因家族的共线性分析
应用Phytozome数据库(https://data.jgi.doe.gov/)获得水稻和拟南芥的全基因组序列及其基因注释文件。小麦基因组数据库中,使用Circos软件获得位置信息,将所有小麦CBL基因定位到染色体上。使用小麦全基因组数据与水稻及拟南芥全基因组对照提取(每个基因提取数≤30)。使用MCScanX对小麦进行共线性分析,参数设置取默认值。基因之间的进化关系由同义替代率(Ks)和非同义替代率(Ka)表现,使用KaKs_Calculator 2.0计算小麦的Ka/Ks比值,除了三对TaCBL基因的Ka/Ks比值大于1,其他TaCBL小麦基因的Ka/Ks比值均小于1,由此分别构建出小麦种内共线性图谱及小麦与水稻、拟南芥种间共线性图谱。所有TaCBL基因的位置和染色体长度从EnSembl Plants数据库注释信息中获得,并且用TB Tools进行绘制。
1.5 小麦CBL基因在低温下的表达模式分析
对课题组先前建立的转录组数据库进行分析发现,Dn1的分蘖节和叶片含有大量与低温胁迫有关的CBL,筛选到8个低温胁迫下表达量变化显著的CBL,本研究对这8个CBL在低温下的表达模式进行分析。供试材料选用强抗寒性冬小麦品种东农冬麦1号(Dn1)和东农冬麦2号(Dn2),于2020年9月12日播种于东北农业大学试验田,种植区行长2 m,种植间距0.2 m,播种深度为5 cm,每行播种约200粒。覆土进行自然萌发。大田自然降温连续10 d平均的最低温度分别达到5 ℃、0 ℃、-10 ℃和-25 ℃时,取其叶片和分蘖节用于8个基因表达量测定。
使用康为世纪的Ultrapure RNA Kit试剂盒提取样品的总RNA,使用诺唯赞HiScript III 1st Strand cDNA Synthesis Kit (+gDNA wiper)试剂盒对提取的总RNA合成cDNA。使用小麦多组学数据库(http://202.194.139.32/)设计8个CBL基因的qRT-PCR 特异性引物(表1),并且利用2-△△CT方法计算其相对表达量。

表1 qRT-PCR 特异性引物Table1 qRT-PCR specific primers
2 结果与分析
2.1 小麦CBL基因家族鉴定结果、蛋白质特征及亚细胞定位
参照水稻基因组数据库中CBL蛋白序列,在EnsemblPlants小麦全基因组数据库中共鉴定出68个CBL基因,并分别命名为TaCBL1~TaCBL68,基因长度为444~4 679 bp,编码的氨基酸在147~627 aa之间;对应的蛋白相对分子质量在16.42~68.9 kDa之间,理论等电点(pI)4.1~6.6,脂肪系数70.07~94.84;亲水性指数-0.031~-0.602,亲水性较好的。亚细胞定位分析显示,34个CBL蛋白定位于细胞核,25个定位于细胞膜,9个定位于细胞质及细胞膜(表2)。

表2 小麦TaCBL基因家族理化性质Table 2 Physical and chemical properties of wheat TaCBL gene family
2.2 小麦、水稻和拟南芥CBL家族系统发育树分析
利用ML对小麦、水稻和拟南芥CBL基因进行系统进化分析。通过拓扑结构域分析,可将CBL基因分成8类(图1),其中G类的CBL基因最多,共31个,E类中的CBL基因最少,仅有2个,且均为小麦CBL基因。A、B、C、D四类在所选三个物种间均存在;相比于拟南芥,小麦与水稻的CBL家族成员关系更近,推测二者中CBL基因的功能类似,这可能与水稻和小麦都属于禾本科单子叶农作物有关。
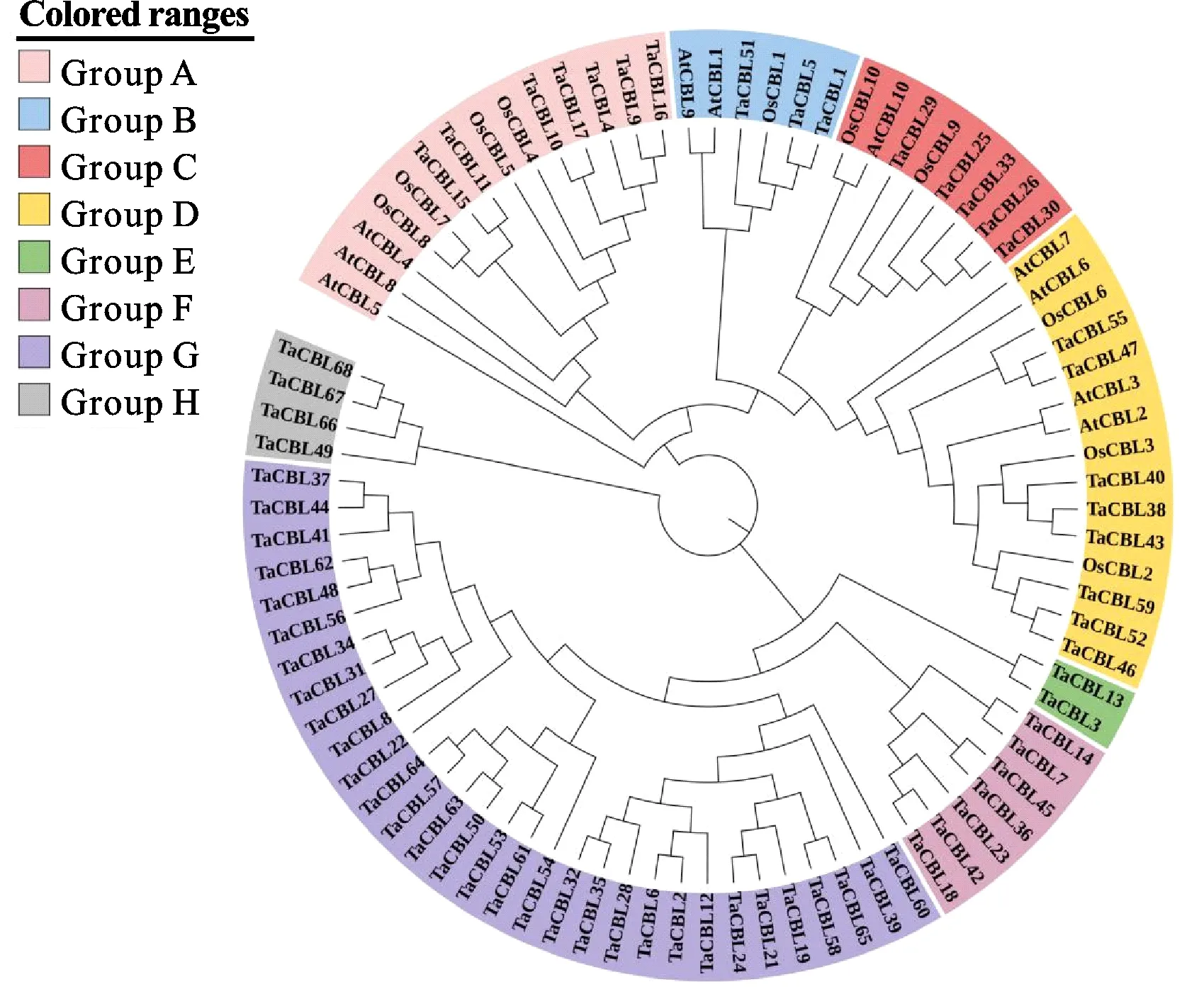
图1 小麦、水稻和拟南芥CBL家族蛋白系统进化树Fig.1 Phylogenetic tree of the CBL family proteins in wheat, rice and Arabidopsis
2.3 小麦TaCBL蛋白结构分析
基因的功能由其结构决定,MEME建树显示,68个小麦TaCBL可归为8大类,与系统进化树分类一致(图2)。同类分支中各基因核心基序排列顺序较统一,具体表现为:所有TaCBL基因均含有Motif4,绝大部分基因都含有Motif4和Motif5,推测其可能是CBL基因特有的保守序列;基序分析发现,同一类群中的大多数成员具有相似的motif,推测其功能相似;个别核心基序与其他基序排列不同,如TaCBL9基因仅包含Motif5。通过结构域分析发现,所有的CBL蛋白均含EF-hand结构域,其中F类中含有EF-hand结构域最多,D类中最少。
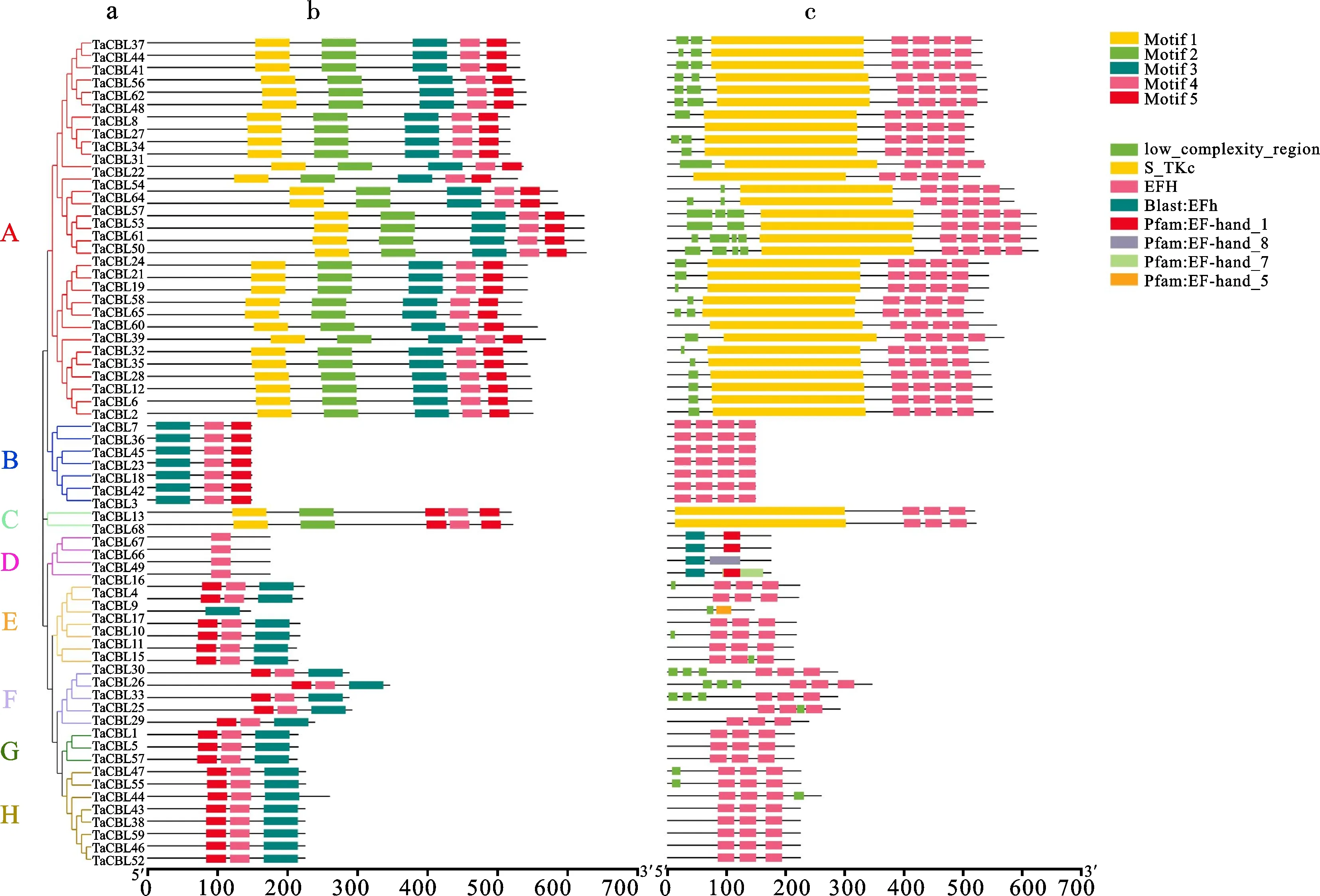
图2 小麦CBL蛋白的进化树(a)、核心基序(b)及蛋白结构域(c)Fig.2 Phylogenetic tree(a),core motif(b) and protein domain(c) of wheat CBL proteins
通过在线软件GSD2.0对小麦CBL蛋白结构分析发现,CBL基因家族成员的内含子分布并不均匀,数量为 1~8个不等,但同类中大部分CBL基因内含子与外显子数量相近,如B类中的内含子均为1个,H类中的内含子为7~8个,而结构域也均被内含子分隔。同类中大部分小麦CBL基因具有相似结构,表明基因结构可能与它们的遗传进化关系密切。
2.4 小麦TaCBL基因染色体分布与共线性分析
小麦68个TaCBL共分布在18条染色体上,每条染色体携带的基因数各不相同(图3),其中第五同源群染色体携带的TaCBL数最多,5A染色体共有6个TaCBL,5B和5D染色体均有7个TaCBL;第六同源群染色体所携带的TaCBL数最少,6A、6B、6D三条染色体均只包含一个TaCBL。
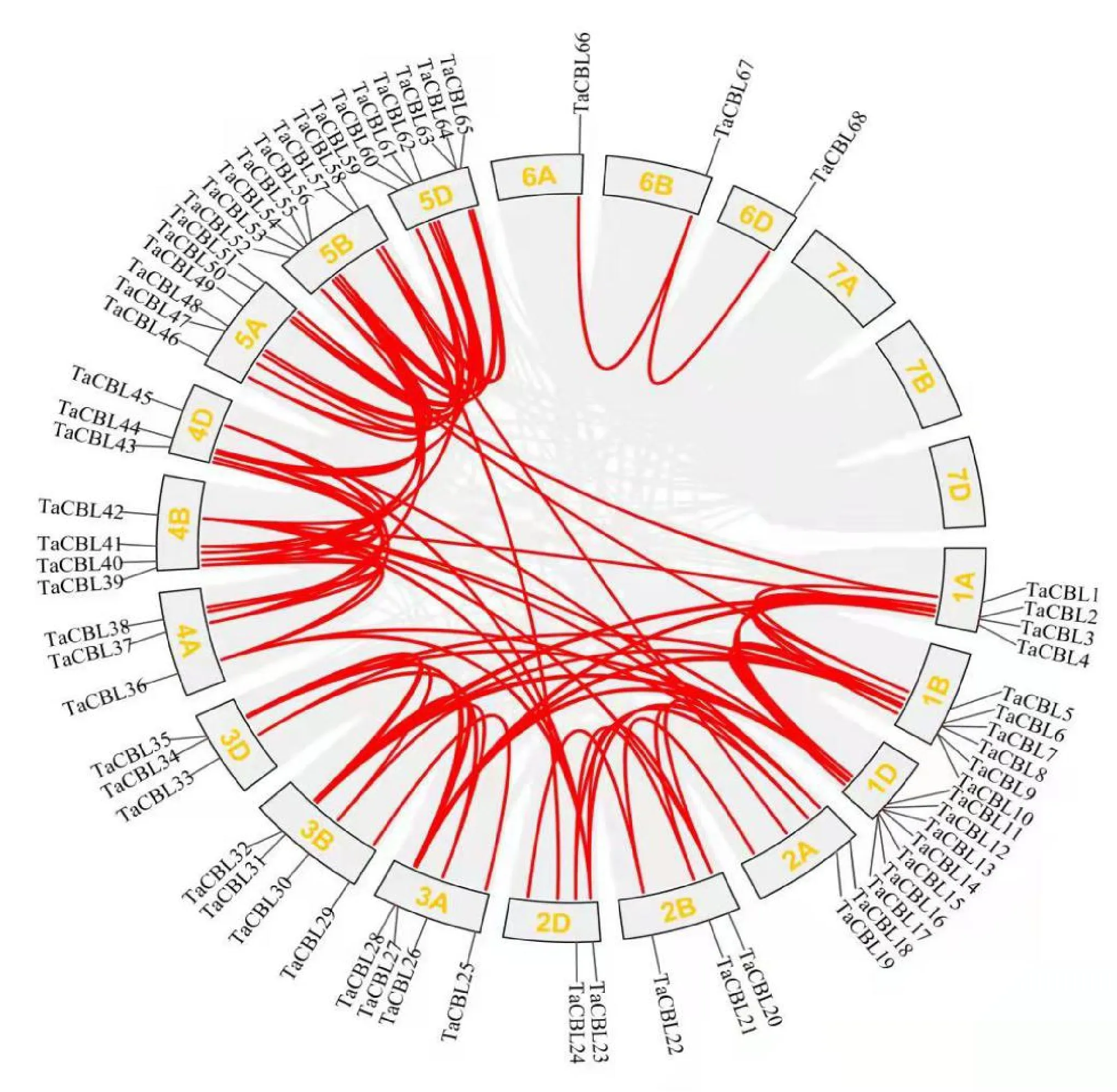
图3 小麦TaCBL基因在染色体上的分布Fig.3 Distribution of TaCBL genes on chromosomes in wheat
共线性分析表明,本研究所检测基因组共含100个共线性基因对,而分布在同基因组不同染色体的Ta-CBL也普遍表现出共线性,这表明小麦TaCBL多为同源染色体上的等位基因或旁系同源基因,映射了其在进化上存在基因扩张。例如,位于1A染色体上的TaCBL2与位于3B染色体上的TaCBL32具有共线性关系;1B染色体上的TaCBL5与5A染色体上的TaCBL51有共线性关系,位于1B上的TaCBL8分别与3A、3B和3D染色体上的TaCBL27、TaCBL31以及TaCBL34基因间存在共线性关系;位于2D染色体的TaCBL23分别与位于4A、4B和4D染色体上的TaCBL36、TaCBL42以及TaCBL45基因之间存在共线性关系(图4)。综合结果得出,小麦TaCBL可能由基因复制形成,其所编码的蛋白在进化过程中一定程度上受截断复制影响。
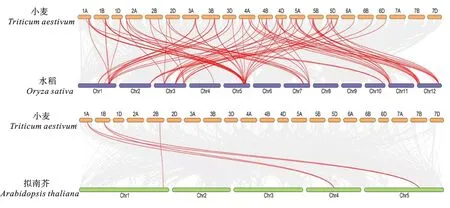
图4 小麦、水稻和拟南芥CBL基因的共线性关系Fig.4 Collinearity of CBL genes among wheat,rice and Arabidopsis
由图4可见,拟南芥与小麦基因的种间共线性关系相对较少,只有5种,分布在小麦1A、1B和2B染色体上;而小麦与水稻种间共有87组共线性关系,各个染色体上关联的共线性基因对均不相同,其中4B和5D两条染色体上的共线性基因对数量最多,各有8对,6A、6B、6D存在的共线性最少,分别只有1对;水稻1号染色体上的3个OsCBL同小麦6A、6B和6D染色体上的3个TaCBL间发生有序配对,这表示水稻1号染色体和小麦6号染色体在CBL进化的线性关系上存在高度的一致性。
2.5 低温胁迫下差异表达的小麦CBL的表达模式
Dn1的qRT-PCR分析结果(图5A和图5B)表明,在分蘖节中,随温度降低,TaCBL1的表达量呈“升-降-升”的趋势,在-25 ℃时表达量最高;TaCBL46和TaCBL59的表达量呈先升后降的趋势,均在-10 ℃时表达量最高;TaCBL17、TaCBL30、TaCBL38、TaCBL47和TaCBL55的表达量逐渐升高,-25 ℃时的表达量最高,达到了0 ℃的二倍。在叶片中,随温度降低,这8个TaCBL的表达量均呈先升高后降低的趋势,除了TaCBL47在0 ℃时的表达量最高,其他7个TaCBL均在-10 ℃时表达量最高,且均达到0 ℃时表达量的二倍以上。基因间比较,在Dn1分蘖节中,TaCBL30、TaCBL47和TaCBL55对低温胁迫的响应最为明显,且均在-25 ℃时表达量显著高于其他基因;在Dn1叶片中,TaCBL30和TaCBL55对低温胁迫的响应最为明显,在-10 ℃时表达量显著高于其他基因。
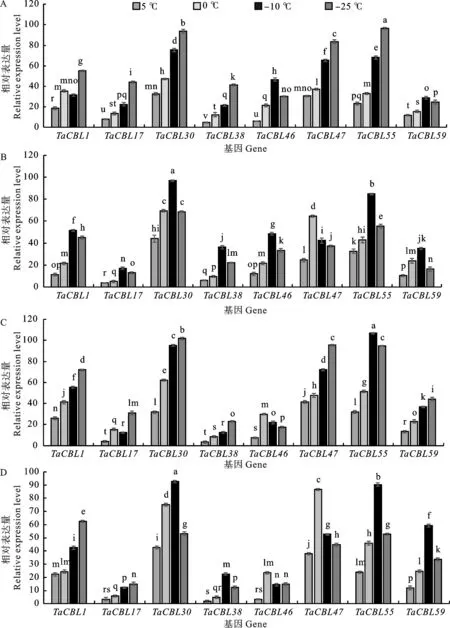
A:Dn1分蘖节; B:Dn1叶片; C:Dn2分蘖节; D:Dn2叶片; 图柱上不同小写字母表示不同处理间差异显著(P<0.05)。A:Dn1 tillering nodes; B:Dn1 leaves; C:Dn2 tillering nodes; D:Dn2 leaves; Different lowercase letters above columns indicate significant differences between different temperatures (P< 0.05).图5 低温胁迫下Dn1和Dn2叶片和分蘖节中8个TaCBL的表达Fig.5 Expression of 8 TaCBL genes in leaves and tillers of Dn1 and Dn2 under low temperature stress
Dn2的qRT-PCR分析结果(图5C和图5D)表明,在分蘖节中,随温度降低,TaCBL17的表达量呈“升-降-升”的趋势,在-25 ℃时表达量最高,达到了-10 ℃表达量的2倍;TaCBL46和TaCBL55的表达量呈现先升高后降低的趋势,其中TaCBL46在0 ℃时表达量最高,TaCBL55在-10 ℃时表达量最高;TaCBL1、TaCBL30、TaCBL38、TaCBL47和TaCBL59的表达量逐步升高,-25 ℃时的表达量达到5 ℃时表达量的二倍以上。在叶片中,TaCBL1和TaCBL17的表达量随着温度的降低而逐步升高;TaCBL30、TaCBL38、TaCBL46、TaCBL47、TaCBL55和TaCBL59的表达量呈先升高后降低的趋势,其中TaCBL46和TaCBL47在0 ℃时表达量最高,TaCBL30、TaCBL38、TaCBL55和TaCBL59在-10 ℃时表达量最高。基因间比较,在Dn2分蘖节中,TaCBL30、TaCBL47和TaCBL55对低温胁迫的响应最为明显,最高表达量均达到了0 ℃时表达量的二倍以上;在Dn2叶片中,TaCBL30、TaCBL47和TaCBL55对低温胁迫的响应最为明显,最高表达量均达到5 ℃时表达量的二倍以上。
3 讨论
目前,在多种单子叶和双子叶植物中均发现了CBL家族成员,例如,在水稻中鉴定出了10个CBL家族成员[22],玉米中鉴定出了12个CBL家族成员[23],烟草和亚洲棉中各鉴定出了20个CBL家族成员[24- 25]。本研究基于生物信息学分析,共从小麦中鉴定出68个CBL,通过对TaCBL蛋白的理化性质进行分析,基因片段、编码蛋白的氨基酸数及其分子质量和等电点(pI)及亚细胞定位均有一定的差异,预示着该基因功能具有多样性;该家族成员在染色体上呈不规则分布,但在在第一和第五同源群染色体上分布较多,推测小麦A、B、D不同基因组中的TaCBL之间可能存在功能冗余或多数TaCBL基因不具有功能。
植物中的Ca2+传感蛋白的功能主要表现在参与特定的信号转导、感受并响应Ca2+浓度变化、参与植物对多种环境刺激(包括生物和非生物胁迫)的应答等方面,在植物的多种生命活动中发挥重要作用[26]。CBL蛋白作为小麦的Ca2+传感蛋白,通过结合Ca2+并与特异的蛋白激酶互作后传递钙信号[27]。结构分析显示,小麦全部TaCBL都含有内含子和外显子,根据其结构特点可分为8类;同类中的核心基序间的排布表现出高度相似性,且所编码的蛋白质均携带数量不等,变异程度不均的EF-hand结构域。EF-hand结构域是植物中Ca2+传感器活性调节的重要影响因素[28],其数量和位点差异可能导致其Ca2+结合能力不同,从而导致基因具有不同生物学功能[29-30]。8类小麦TaCBL蛋白中,A和B类所含EF-hand结构域数量最多,推测这两类蛋白与Ca2+的结合能力更强,可能在响应Ca2+介导的抗寒调控过程中起重要作用。CIPK作为一种丝氨酸-苏氨酸蛋白激酶,通过激活磷酸化酰化级联反应对胁迫或抗应激功能相关基因的表达加以调控;CBL家族成员在各类非生物胁迫中起着重要作用,调控方式包括CBL和CIPK之间的互作及靶蛋白磷酸化等[31-32]。植物中的CIPK和CBL家族都属于多基因家族蛋白,二者在Ca2+信号传递过程中协同发挥作用,对于CBL-CIPK网络,其中的传感器蛋白和效应激酶会以复杂的排列方式相互作用,而对上述Ca2+调控过程的详细分子机制仍没有完善的解释。
CBL在植物逆境应激信号中发挥关键作用,我们根据转录组学分析选用了8个在低温条件下差异表达最显著的基因,分析其在强抗寒冬小麦的分蘖节和叶片中的表达,结果显示,这8个TaCBL在不同品种中的表达不尽相同,TaCBL在Dn2的分蘖节和叶片的表达量总体比Dn1中相应部位高;而在不同组织之间TaCBL表达模式随温度变化也表现出显著差异,例如,Dn1分蘖节中TaCBL30在-10 ℃时的相对表达量比5 ℃时提高了43%,而在叶片中TaCBL30在-10 ℃时较5 ℃时提高了60%,表明TaCBL在不同品系与组织间表达有差异。在Dn1和Dn2中,TaCBL在分蘖节中的表达量均高于叶片;分蘖节中TaCBL的表达量普遍在-25 ℃时最高,而在叶片中CBL的表达量普遍在-10 ℃时最高,说明TaCBL对寒冷胁迫响应速度不同,这可能会影响不同品系冬小麦抗寒能力,而出现这种现象的原因可能是由于叶片组织处于地上,分蘖节处于地下受到土壤保护,导致二者对环境胁迫的响应不同。
综上,本研究对小麦CBL蛋白基因家族进行了全基因组鉴定、生物信息学分析和表达模式分析,为深入解析小麦CBL基因家族的功能及其作用机制奠定了基础,对于进一步挖掘小麦抗寒基因资源,培育抗寒作物新品种,具有重要的理论和实践意义。
