小麦转录因子TaMYB5-like转录自激活能力及其参与生理型花粉败育过程表达模式研究
2023-08-31单思聪闵东红马守才王军卫孙联合张改生宋瑜龙
王 芮,唐 鹏,单思聪,牛 娜,闵东红,马守才,王军卫,孙联合,张改生,宋瑜龙
(1.西北农林科技大学农学院/国家杨凌农业生物技术育种中心/国家小麦改良中心杨凌分中心/小麦育种教育部工程研究中心/陕西省作物杂种优势研究与利用重点实验室,陕西杨凌 712100; 2.驻马店市农业科学院,河南驻马店 463000)
小麦在世界各地广泛种植,是人类不可或缺的食物来源。研究发现,杂交小麦在苗期就表现出了显著的杂种优势,如较高的净光合速率、气孔导度和蒸腾速率;净光合速率与单株产量、单株生物量呈显著正相关;穗粒重、穗粒数、穗长、总小穗数、有效小穗数均呈现不同程度的超亲优势[1-4]。然而,优异小麦雄性不育系的创制一直是限制小麦杂种优势利用的瓶颈。目前,小麦雄性不育系主要有基因型控制的遗传型雄性不育系、光温敏雄性不育系以及化学杂交剂诱导的生理型雄性不育系。研究发现,化学杂交剂SQ-1诱导花粉败育率高于95%, 饱和授粉结实率在85%以上[5],杀雄效果优良,但生产成本较高,难以在杂交小麦大面积应用。本课题组通过转录组测序在SQ-1诱导的小麦生理型雄性不育系PHYMS-1376和等量清水处理的对照可育系CK-1376五个时期花药中筛到一个共同表达差异基因,命名为TaRVE6,并通过酵母双杂交技术获得其互作蛋白,经与NCBI数据库比对将其命名为TaMYB5-like,其编码基因为TaMYB5-like(ID:Traes CS31302G2P0600),属于MYB家族。
MYB家族是真核生物中最常见一类基因家族,其参与植物生长发育的各个阶段,涉及内源激素、环境响应及其他生物或非生物胁迫通路[6-7]。MYB类家族成员还参与调节植物花粉发育过程,如MYB80基因可以调控花药绒毡层细胞提前降解,导致小孢子发育受阻,花粉粒败育[8-9];MYB24与茉莉酸途径的抑制因子JAZ(jasmonate ZIM-domain)蛋白(JAZs)互作可以调控茉莉酸(JA)的含量,MYB24表达量升高则会诱导植物花粉败育[10-11];MYB5可能对脂代谢、糖代谢等过程产生影响,造成水稻花药发育异常并导致花粉败育[12];GbMYB5可能参与花的生长分化过程[13]。上述研究表明,MYB家族成员对花粉发育有重要作用。
基于此,本研究拟以PHYMS-1376和CK-1376小麦四分体、单核早期、单核晚期、二核期和三核期花药为试材,克隆TaMYB5-like基因,并对其进行序列结构、生物信息、表达模式、亚细胞定位及转录自激活效应研究,以了解TaMYB5-like的互作蛋白及其调控关系,为明确SQ-1诱导小麦花粉败育分子机制奠定理论基础。
1 材料与方法
1.1 供试材料与处理
试验材料为西农1376和本氏烟草(Nicotianabenthamiana),均由西北农林科技大学作物杂种优势研究与利用重点实验室提供。2020年10月,小麦西农1376种植于西北农林科技大学北校区农作一站,待翌年3月植株发育至旗叶伸长到倒二叶的1/2(Feeks=8.5)时期,将其分为两组,一组用浓度为5 kg·hm-2的化学杂交剂SQ-1均匀喷施,记为PHYMS-1376;另一组用等量清水喷施作为对照,记为CK-1376。待对照植株花粉粒发育至四分体、单核早期、单核晚期、二核期和三核期时,分别取PHYMS-1376和CK-1376麦穗置于冰上带回实验室镜检,确认花药发育时期无误后,收集花药,置入EP管,液氮速冻后于-80 ℃保存备用。
1.2 试验方法
1.2.1 总RNA提取
分别取保存在-80 ℃冰箱的PHYMS-1376和CK-1376小麦四分体、单核早期、单核晚期、二核期和三核期花药0.1 g转移至液氮预冷的研钵中研磨,期间不断加入液氮,直至成粉末状;将其分别转移至2.0 mL EP管中,用RNA isolater Total RNA Extraction Reagent(R401-01,诺唯赞生物科技股份有限公司,中国南京)参照使用说明提取PHYMS-1376和CK-1376各发育时期花药总RNA,并进行纯化。
1.2.2 cDNA的获取及TaMYB5-like基因克隆
分别以上述纯化后的RNA为底物,用HiScript®IIReverse Transcriptase逆转录试剂盒(R201-01,诺唯赞生物科技股份有限公司,中国南京)参照说明书合成PHYMS-1376和CK-1376不同发育时期花药cDNA。
在NCBI数据库下载TaMYB5-like完整的CDS序列,使用Oligo 7软件设计特异性引物(表1)。PCR反应体系50 μL:2×Phanta Max Master Mix 25 μL,TaMYB5-like-F/R引物(10 μM)各2.5 μL,CK-1376小麦三核期花药cDNA(100 ng·μL-1)5 μL,ddH2O 15 μL。扩增程序:95 ℃ 3 min;95 ℃ 15 s,60 ℃ 15 s,72 ℃ 45 s,40个循环;72 ℃延伸5 min。用1%琼脂糖凝胶电泳检测PCR产物,用San Prep 柱式DNA胶回收试剂盒(B518131,上海生工)参照说明书回收目的片段,将其连接至pEASY-Blunt Cloning Vector(NO:101,北京全式金生物),转入DH5α感受态细胞;将菌液均匀涂布在含有50 μg·mL-1Amp抗生素的固体培养基上,挑阳性单克隆转至含有Amp抗生素的菌液中扩大培养,送至上海生工测序,获得TaMYB5-like基因的编码序列。

表1 本研究所用引物Table 1 Primers used in this study
1.2.3TaMYB5-like基因生物信息学分析
基于TaMYB5-like基因序列信息,参照李鲁华[14]的方法,用SMART(https://smart.embl.de/)在线软件分析TaMYB5-like蛋白结构域;用在线软件Psort1(https://www.genscript.com/wolf-psort.html)预测TaMYB5-like基因亚细胞定位;分别用PSIPRED(http://bioinf.cs.ucl.ac.uk/psipred/)和SWISS-MOLD(https://swissmodel.expasy.org/interactive)在线软件预测TaMYB5-like蛋白质的二级和三级结构。用Expasy(https://web.expasy.org/protparam/)在线分析软件对TaMYB5-like蛋白的理化性质进行分析,并分别使用TMHMM-2.0(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)和SignalP-5.0(https://services.healthtech.dtu.dk/service.php?SignalP-5.0)预测TaMYB5-like蛋白的跨膜结构和信号肽;利用PLANTCAER(https://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线软件预测TaMYB5-like基因启动子区顺式作用元件。利用MEGA软件分析不同物种TaMYB5-like基因进化关系;利用Jalveiw软件对TaMYB5-like基因进行多序列比对,明确其保守结构。
1.2.4TaMYB5-like基因亚细胞定位
以含有TaMYB5-like-pEASY-Blunt Cloning Vector菌液为模板,利用含有pCAMBIA 1302-2×Myc-EGFP同源臂的扩增引物TaMYB5-like-F1/R1(表1),扩增TaMYB5-like基因编码序列。扩增体系为50 μL,其中2×Phanta Max Master Mix 25 μL,TaMYB5-like-F1/R1(10 μmol-1)各2.5 μL,含有TaMYB5-like-pEASY-Blunt Cloning Vector的大肠杆菌菌液3 μL,ddH2O 17 μL;扩增程序为:95 ℃ 1 min; 95 ℃ 20 s,55 ℃ 20 s,72 ℃ 1 min,40个循环; 72 ℃延伸5 min。回收扩增片段,并将其与BstbⅠ线性化的pCAMBIA 1302-2×Myc-EGFP载体连接,随后转入大肠杆菌DH5α感受态细胞,涂布在含有Kan的固体培养基上,挑单克隆、摇菌、送样、测序同1.2.2。提取TaMYB5-like-pCAMBIA 1302-2×Myc-EGFP重组载体,并利用冻融法将其转至农杆菌 GV3101感受态细胞,涂至含有100 mg·mL-1Kan和100 mg·mL-1Rif两种抗生素的固体培养基上,28℃倒置培养36 h,挑阳性克隆进行菌液PCR检测,将目标菌扩大培养至OD600=0.6,5 000 r·min-1离心后弃上清;用转化液重悬菌体,之后采用注射法将菌液注入4~6叶期健壮的本氏烟草叶片中,暗处理12 h后置于光照培养箱中,正常培养48 h;取注射孔附近的叶片表皮置于载玻片上,在激光共聚焦荧光显微镜(TCS SP8 SR,德国莱卡)下观察,并拍照。阴性对照为pCAMBIA 1302-2×Myc-EGFP空载转化农杆菌侵染烟草。
1.2.5TaMYB5-like基因酵母双杂交自激活性研究
设计带有pGBKT7载体同源臂,且含有EcoRⅠ和BamHⅠ酶切位点的特异性扩增引物TaMYB5-like-F3/R3(表1),扩增TaMYB5-like基因编码框,随后将其与EcoRⅠ和BamHⅠ双酶切线性化pGBKT7(BD)载体连接。提取BD-TaMYB5-like重组质粒利用乙酸锂方法将其转入Y2HGold酵母感受态细胞,随后将其涂布在SD/-Trp固体培养基上,30 ℃恒温培养72 h。挑取SD/-Trp固体培养基上阳性菌株转接至SD/-Trp液体培养基,并分别用ddH2O稀释菌液至100、10-1和10-2倍;分别取不同浓度的稀释菌液2 μL接种至SD/-Trp和SD/-Trp/-Ade/-His固体培养基上,30 ℃恒温倒置培养3 d,观察酵母生长状况,并以转pGBKT7(BD)空载转化农杆菌为阴性对照,如果在SD/-Trp和SD/-Trp/-Ade/-His培养基中均能生长,说明TaMYB5-like蛋白具有自激活效应,如果在SD/-Trp上可以生长,而不能在SD/-Trp/-Ade/-His培养基上生长,则表明TaMYB5-like蛋白没有自激活能力。
将TaMYB5-like蛋白质序列输入Smart在线数据库,预测其结构域。将TaMYB5-like截断成N端+SNAT结构域和C端以及N端和SNAT结构域+C端,分别将其与pGBKT7连接,构建相应的重组载体BD-TaMYB5-like-SANT-C和BD-TaMYB5-like-N-SANT;参照上述乙酸锂方法将上述重组质粒分别转入Y2HGold酵母感受态细胞,接种至SD/-Trp和SD/-Trp/-Ade/-His培养基上观察生长状况,明确两个截断蛋白质结构的自激活特征,为下一步筛选TaMYB5-like互作蛋白提供一定的理论和技术支撑。
1.2.6 TaMYB5-like蛋白及TaMYB5-like-N-SANT结构蛋白自激活能力研究
为了进一步研究TaMYB5-like蛋白及TaMYB5-like-N-SANT结构蛋白自激活能力,分别向不同SD/-Trp/-Ade/-His培养基中加入5个不同浓度梯度的金担子素A (AbA)和3-氨基-1,2,4-三唑(3-AT)(AbA 10 mmol·mL-1+3-AT 200 mg·mL-1;AbA 20 mmol·mL-1+3-AT 400 mg·mL-1;AbA 30 mmol·mL-1+3-AT 600 mg·mL-1;AbA 40 mmol·mL-1+3-AT 800 mg·mL-1;AbA 50 mmol·mL-1+3-AT 1 000 mg·mL-1),同时将转化有BD-TaMYB5-like和BD-TaMYB5-like-N-SANT重组载体的Y2HGold酵母感受态细胞分别接入上述固体培养基进行培养,并观察其生长状态,直至菌斑长势与转有pGBKT7空载的Y2HGold酵母菌相同。根据AbA和3-AT浓度判断转化有BD-TaMYB5-like和BD-TaMYB5-like-N-SANT重组载体的酵母Y2HGold感受态细胞的自激活能力。
1.2.7TaMYB5-like基因表达模式分析
设计特异性引物TaMYB5-like-F6/TaMYB5-like-R6(表1),以PHYMS-1376和CK-1376小麦四分体时期、单核早期、单核晚期、二核期和三核期花药cDNA为模板,参照StarLighter SYBR Green qPCR Mix(FS-Q1002,北京启衡星)试剂盒配置PCR反应体系,置于Quant Studio 3实时荧光定量PCR仪(ABI,美国)上进行反应。程序为:95 ℃ 30 s,95 ℃ 10 s,60 ℃ 30 s,40个循环,溶解曲线分析采用系统默认值。运用2-△△CT法计算TaMYB5-like相对表达量。
1.3 数据分析
数据用SPSS 12.0 分析,采用LSD法进行差异显著性分析。
2 结果与分析
2.1 小麦TaMYB5-like序列分析
以小麦CK-1376三核期花药cDNA为模板,扩增到800 bp左右的条带(图1a),测序结果显示,该产物为819 bp,与TraesCS3B02G290600.1编码区序列一致,即为TaMYB5-like基因。对TaMYB5-like序列进行分析发现,TaMYB5-like基因含有2个外显子和1个内含子,编码272个氨基酸,5′-UTR区长度为108 bp,3′-UTR区长度为206 bp(图1b)。
2.2 小麦TaMYB5-like的结构分析
TaMYB5-like蛋白分子量为29.36 KDa,PI=6.18,在28~129 bp内含有一个由3个串联重复(螺旋-旋转-螺旋方式排列)序列构成的SANT结构域。亚细胞定位预测发现,TaMYB5-like被定位在细胞核。TaMYB5-like蛋白二级结构分析,发现有56.22%α螺旋(alpha helix),11.30%的延伸链(extended strand),5.72%的β转角(beta turn),26.75%的无规卷曲(random coil);脂肪族氨基酸指数为68.27,其中α螺旋含有大量芳香残基。TaMYB5-like蛋白的三级结构与R2R3-MYB 家族转录因子的三维结构模型高度相似,生物单位寡核苷酸状态以单体形式存在(图2a和图2b)。TaMYB5-like蛋白平均亲水性(GRAVY)值为 -0.603,氨基酸折叠弹性较大,不稳定指数(II)为55.28,负电荷残基数(Asp+Glu)为36,正电荷残基数(Arg+Lys)为33(图2c)。TaMYB5-like蛋白既没有跨膜结构,也没有信号肽。对TaMYB5-like启动子区进行预测,发现该启动子区顺式作用元件大都与光响应和赤霉素、脱落酸响应有关(表2)。利用MEGA对TaMYB5-like基因作进化树分析,发现TaMYB5-like基因与二粒小麦(Triticumdicccoides)和硬粒小麦(Triticumturgidum)亲缘关系最近(图3)。TaMYB5-like基因的同源序列较多,在A、B、D同源染色体上相对保守,其中在拟南芥、水稻等模式植物中也均能扩增出SANT结构域,且高度保守(图4),表明不同物种TaMYB5-like进化较为保守。

a:TaMYB5-like蛋白的二级结构,蓝色代表α-螺旋,绿色代表β-转角,红色代表延伸链,紫色代表无规则卷曲;b:TaMYB5-like蛋白的三维结构;c:TaMYB5-like蛋白的亲/疏水性分析。a:Secondary structure of TaMYB5-like protein; blue, green, red, and purple lines representα-helix, β-turn, extended chain, and randomcoil, respectively; b:Tertiary structure of TaMYB5-like protein; c:Hydrophilic and hydrophobic of TaMYB5-like protein.图2 TaMYB5-like的蛋白的二级结构、三维结构及亲/疏水性分析Fig.2 Analysis of secondary, tertiary structures and hydrophobicity of TaMYB5-like protein

图3 TaMYB5-like蛋白的进化树分析Fig.3 Phylogeny analysis of TaMYB5-like protein

图4 TaMYB5-like蛋白的同源序列比对Fig.4 Homologous sequence alignment of TaMYB5-like protein
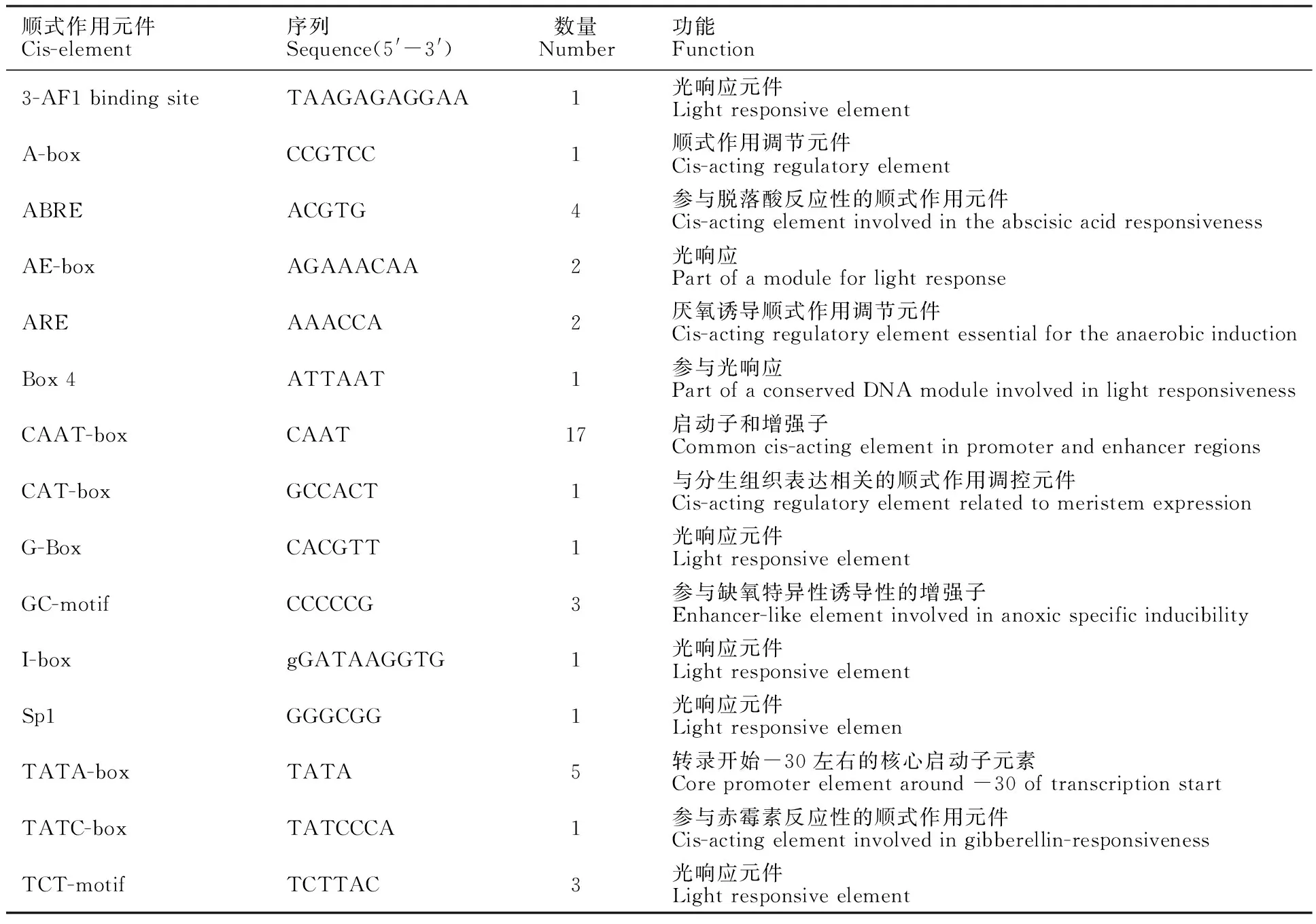
表2 TaMYB5-like基因上游启动子区顺式作用元件Table 2 Cis-element in the upstream regulation region ofTaMYB5-like

表3 PHYMS-1376和CK-1376花药中TaMYB5-like的相对表达量Table 3 Relative expression ofTaMYB5-like in anther from CK-1376 and PHYMS-1376
2.3 小麦TaMYB5-like亚细胞定位分析
转化有TaMYB5-like-pCAMBIA 1302-2×Myc-EGFP重组载体的烟草叶片细胞中绿色荧光信号主要集中在细胞核内,转化有空载pCAMBIA 1302-2×Myc-EGFP的阴性对照烟草叶片细胞核和细胞膜中绿色荧光信号都较强(图5),表明TaMYB5-like属于核表达基因,其编码蛋白定位于细胞核内。这与Plant-mPLoc在线软件预测结果一致。
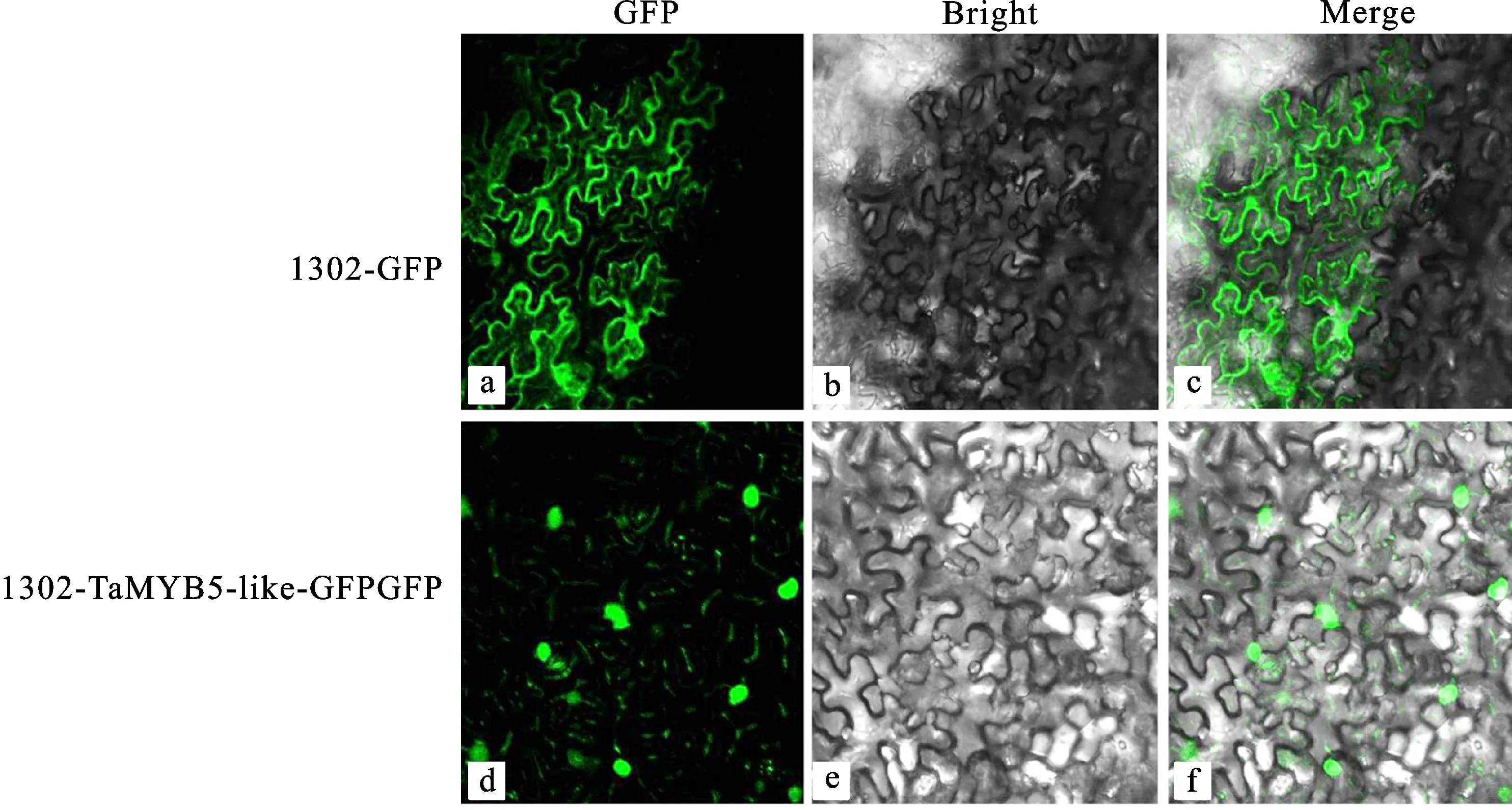
图5 TaMYB5-like的蛋白的亚细胞定位Fig.5 Subcellular localization of TaMYB5-like protein.
2.4 TaMYB5-like自激活性分析
将pGBKT7(BD)空载和BD-TaMYB5-like分别转入至酵母感受态细胞,并将其分别接种至SD/-Trp和SD/-Trp/-Ade/-His培养基上,结果发现,转有阴性对照BD空载的酵母菌株只能在SD/-Trp培养基上生长,不能在SD/-Trp/-Ade/-His培养基上生长(图6);而转有BD-TaMYB5-like重组载体的酵母菌株既能在SD/-Trp培养基上生长,同时也能在SD/-Trp/-Ade/-His培养基上生长,表明TaMYB5-like蛋白有一定的自激活效应。为了进一步了解TaMYB5-like自激活结构区,将TaMYB5-like蛋白的氨基酸序列按照功能域位置进行截断,其中N端+SANT结构域长度为393 bp,SANT结构域+C端序列长度为747 bp(图7a),分别将N端+SANT结构域和SANT结构域+C端连接到pGBKT7载体,并分别转入酵母感受态细胞后,观察BD-TaMYB5-like-N-SANT重组质粒的酵母菌株和 BD-TaMYB5-like-SANT-C重组质粒的酵母菌株在SD/-Trp和SD/-Trp/-Ade/-His酵母培养基上的生长情况,结果显示,在SD/-Trp培养基上分别转有阴性对照BD、BD-TaMYB5-like-N-SANT以及 BD-TaMYB5-like-SANT-C质粒的酵母菌株均能生长,且长势相类似,而在SD/-Trp/-Ade/-His培养基上,仅转有BD-TaMYB5-like-N-SANT重组载体的酵母菌株能生长,而转有阴性对照BD和BD-TaMYB5-like-SANT-C重组载体的酵母菌株不能正常生长,表明TaMYB5-like蛋白的自激活区段位于N端,且后续互作蛋白筛选工作可以使用SANT+C端结构域区段(图7b)。

图6 TaMYB5-like蛋白的自激活验证Fig.6 Self-activation validation of TaMYB5-like protein

图7 TaMYB5-like蛋白的截断处理Fig.7 Truncation the amino acid sequence of TaMYB5-like protein
2.5 TaMYB5-like蛋白及TaMYB5-like-N-SANT结构蛋白自激活能力分析
使用3-AT和AbA分别对TaMYB5-like蛋白全长及BD-TaMYB5-like-N-SANT的自激活活性进行抑制,结果显示,转有空载BD的酵母菌株在SD/-Trp/-Ade/-His固体培养基上不能生长;而转有BD-TaMYB5-like重组载体的酵母菌株分别在含有AbA 10 mmol·mL-1+3-AT 200 mg·mL-1、AbA 20 mmol·mL-1+3-AT 400 mg·mL-1、AbA 30 mmol·mL-1+3-AT 600 mg·mL-1、AbA 40 mmol·mL-1+3-AT 800 mg·mL-1抑制剂的SD/-Trp/-Ade/-His固体培养基上均能生长,但随二者浓度增加长势逐渐减弱;AbA 50 mmol·mL-1,3-AT 1 000 mg·mL-1时,含BD-TaMYB5-like重组载体和空载BD的酵母菌株均不能生长。转有BD-TaMYB5-like-N-SANT重组载体的酵母菌株在AbA 30 mmol·mL-1,+3-AT 600 mg·mL-1的SD/-Trp/-Ade/-His固体培养基上生长暗淡,与转有BD空载的酵母菌株生长势一致。随着抑制剂浓度的增加,转有BD-TaMYB5-like-N-SANT重组载体的酵母菌株不能在SD/-Trp/-Ade/-His固体培养基上生长。综上所述,AbA 50 mmol·mL-1+3-AT 1 000 mg·mL-1条件下,转有BD-TaMYB5-like重组载体的酵母菌株在SD/-Trp/-Ade/-His固体培养基上无自激活性;AbA 30 mmol·mL-1+3-AT 600 mg·mL-1条件下,转有BD-TaMYB5-like-N-SANT重组载体的酵母菌株在SD/-Trp/-Ade/-His固体培养基上无自激活性,表明适合浓度的AbA和3-AT可以抑制不同类型融合蛋白的自激活性,且随着蛋白质氨基酸序列的截断,自激活活性呈降低趋势(图8a和图8b)。
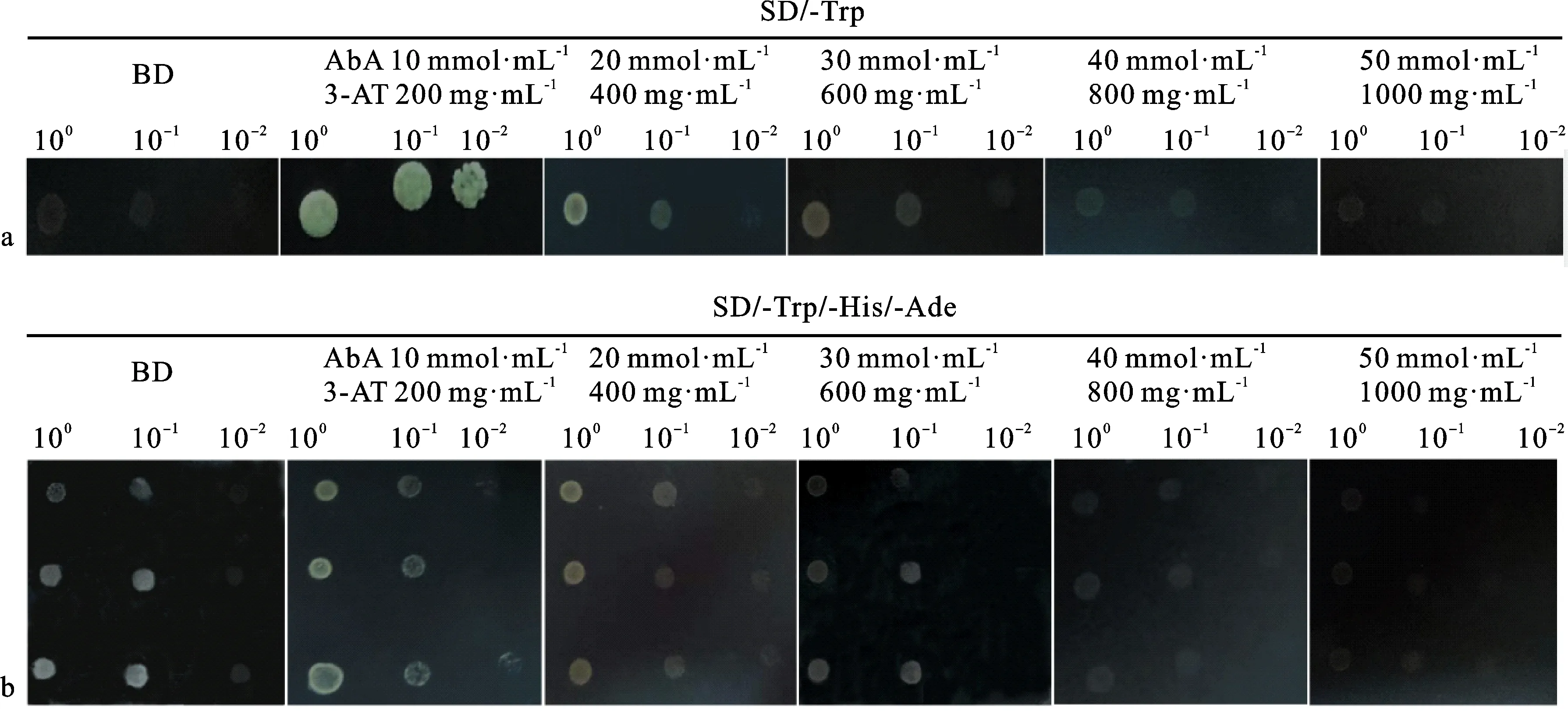
a:不同浓度AbA和3-AT抑制携带BD-TaMYB5-like重组载体的酵母菌株生长状况;b:不同浓度ABA和3-AT抑制携带BD-TaMYB5-like-N-SANT重组载体的酵母菌株生长状况。a:Growth of yeast strains with the BD-TaMYB5-like recombinant vector were inhibited by AbA和3-AT of different concentrations; b:Growth of yeast strains with the BD-TaMYB5-like-N-SANT recombinant vector were inhibited by AbA and 3-AT of different concentrations.图8 TaMYB-like蛋白的全长与N+SANT结构域抑制Fig.8 Full length of TaMYB-like protein and the N+SANT domain inhibited by AbA and 3-AT with different concentrations
2.6 小麦TaMYB5-like表达模式分析
以小麦PHYMS-1376和CK-1376四分体、单核早期、单核晚期、二核期和三核期花药cDNA为模板,利用qRT-PCR技术对TaMYB5-like基因表达模式进行分析,结果发现,TaMYB5-like基因在PHYMS-1376和CK-1376五个发育时期花药中表达趋势一致;与CK-1376相比,PHYMS-1376在四分体和单核早期的TaMYB5-like基因表达差异不显著,在单核晚期、二核期和三核期的TaMYB5-like表达量显著增加;CK-1376和PHYMS-1376在三核期的TaMYB5-like表达量均最高。
3 讨论
优良的小麦雄性不育系是推动杂交小麦产业化应用的重要基础,因此小麦雄性不育机理研究备受业界关注。本课题组具有自主知识产权的小麦化学杂交剂SQ-1目前已在进行杂交小麦的产业化应用,但因其生产成本较高,难以大面积推广。因此,需系统解析小麦化学杂交剂SQ-1诱导小麦花粉败育机理,并据此创制安全廉价高效的新型小麦化学杂交剂。基于此,对课题组前期筛选获得的TaMYB5-like进一步研究发现,TaMYB5-like基因DNA片段全长为5 207 bp,cDNA长1 133 bp,其中CDS序列长为819 bp,编码蛋白具有SANT保守结构域,发挥着DNA结合和催化作用,并参与基因的表达。将TaMYB5-like蛋白序列在模式植物拟南芥数据库和水稻数据库中进行Blastp比对,发现其与模式植物拟南芥和水稻中的MYB5基因同源性最高,推测TaMYB5-like与MYB5基因在某些过程中有相似的生物学功能,如聂 珂[15]在莲雾果实木质素合成相关的MYB转录因子中发现,SsMYB5作为转录抑制子,可延缓木质素的合成。本研究通过并比对发现,TaMYB5-like属于转录抑制因子,可能在植物发育过程中对育性的正常调节具有阻碍作用。
酵母双杂交是研究活细胞内蛋白与蛋白互作的一项技术,该技术在生物学相关领域被广泛应用[16]。为降低假阳性,通常在酵母双杂交试验开展之前对所研究蛋白质需进行自激活性研究。本研究发现,转有BD-TaMYB5-like重组载体的酵母菌株和转有BD-TaMYB5-like-N-SANT重组载体的酵母菌株均具有自激活效应,而转有BD-TaMYB5-like-SANT-C重组载体的酵母菌株不具有自激活效应,说明TaMYB5-like转录激活域在N端,这与王怀琴[17]对丹参转录因子SmMYC2的研究结果一致。而李立群[18]和吴国丽[19]发现,激活域在蛋白的C端这差异可能由于所研究蛋白和功能不同。常见的自激活抑制剂是3-AT和AbA,不同基因所需浓度不同,如谢瑞莹[20]研究中,仅用10 mmol·L-13-AT就能够抑制HIS3报告基因表达,并且成功筛选到6个与NtMYB4a具有互作关系的蛋白;武 媛[21]使用20 mmol·L-1的3-AT抑制SlMPK1自激活活性,并且成功筛选到155种候选蛋白与SlMPK1相互作用;在刘 静[22]的研究中,需要45 mmol·L-1的 3-AT才可以抑制蛋白BsMYB62的自激活张竹君[23]发现200 ng·L-1的AbA浓度对RhRD22无自激活效应,丁爱琴[24]使用400 ng·mL-1的AbA成功从cDNA文库中筛选到16个与RhNAC31相互作用的候选蛋白。本研究对BD-TaMYB5-like和BD-TaMYB5-like-N-SANT重组载体自激活效应分析发现,AbA 50 mmol·mL-1+3-AT 1 000 mg·mL-1条件下,转有BD-TaMYB5-like重组载体的酵母菌株在SD/-Trp/-Ade/-His固体培养基上无自激活性;AbA 30 mmol·mL-1+3-AT 600 mg·mL-1条件下,转有BD-TaMYB5-like-N-SANT重组载体的酵母菌株在SD/-Trp/-Ade/-His固体培养基上无自激活性。上述结果表明,适合浓度的AbA和3-AT可以抑制不同类型融合蛋白的自激活性,说明截断处理与抑制剂处理对互作蛋白的筛选并无太大影响,这为继续进行互作蛋白的筛选提供依据。本研究发现,截断之后的蛋白比全长的自激活活性低,这一结果目前还未见报道。
迄今已有多个MYB类家族成员基因在参与雄性不育的调节过程中被证实,比如R2R3类MYB转录因子TDF1-1是调控大豆花药发育的核心转录因子[25];甘蓝OguCMS雄性不育相关的MYB转录因子BoMYB1是花药发育的关键基因之一,并且在花药中高度表达。MYB转录因子CSA是水稻雄性生殖发育过程中糖分配的关键转录因子,其表达受抑制会导致水稻的雄性不育;MYB5与CSA有相似功能,对脂代谢、糖代谢等过程产生影响,造成水稻花药发育异常并导致花粉最终的败育[12,27]。小麦与水稻都是单倍体,且遗传距离相近,推测TaMYB5与OsMYB5的生物学功能相似,可能参与生理型雄性不育花粉败育过程。对TaMYB5-like进行表达模式分析,发现与CK-1376相比,PHYMS-1376四分体和单核早期花药中TaMYB5-like基因表达差异不显著,单核晚期、二核期和三核期时TaMYB5-like表达量显著增加;二者在三核期花药内TaMYB5-like表达量均最高,推测TaMYB-like基因可能在单核晚期异常高表达导致了雄花败育现象。这与党一敏[28]和刁艳茹[29]对巴西橡胶树的不育相关基因HbGEX1和HbACO1研究结果相似。推测TaMYB-like可能参与了SQ-1诱导小麦花粉败育过程。
综上所述,TaMYB5-like具有 MYB基因家族特征,属于R2R3型MYB家族,定位于细胞核内,TaMYB5-like蛋白具有转录自激活活性,自激活区域定位在N端;用600 mg·mL-1的3-AT+30 mmol·mL-1的AbA可将其自激活性抑制。上述结果的获得,为后续筛选TaMYB5-like蛋白互作蛋白,解析TaMYB5-like功能,阐释SQ-1诱导小麦花粉败育分子机制奠定了一定基础。
