滴灌春小麦根系形态特征及内源激素含量对花期干旱及复水的响应
2023-08-31王荣荣谢冰莹王海琪蒋桂英尹豪杰
王荣荣, 谢冰莹,王海琪, 蒋桂英, 尹豪杰,张 婷
(石河子大学农学院,新疆石河子 832000)
小麦是新疆最重要的粮食作物之一,2020年全疆种植面积达到1.07×106hm2,占粮食作物总播种面积的47.93%[1]。干旱是制约新疆小麦生产的主要因素之一。在6-7月份的小麦开花灌浆期,新疆常年温度在30 ℃左右,小麦生长处在高温环境下,极易受到干旱胁迫[2],而此时是小麦生长发育和需水关键时期,缺水造成的产量损失一般在20%左右[3]。前人研究表明,小麦开花期适度干旱后复水有利于同化物的积累与产量的形成[4-5],说明受旱小麦可高产稳产。因此,研究滴灌小麦开花期抗旱机理及干旱后复水的补偿效应,挖掘其生物节水潜力,对新疆小麦高效生产具有指导意义。
根系是作物吸收土壤水分的主要器官。水分亏缺条件下,根系通过生长及代谢的补偿效应,可维持必要的生长发育[6]。补偿效应是小麦根系对水分亏缺的适应策略,也是在其生育期间进行水分调控、充分挖掘根系高效利用水分潜力、实现生物节水的重要生理依据[7]。小麦根系的形成、分化主要受内源激素的调控,干旱时根系通过内源激素调节根系生育过程以适应干旱[8-9]。研究表明,适度干旱后复水根系形态特征、渗透调节物质等迅速恢复是作物产生补偿效应的主要原因,水分调控对作物根系生长发育有显著的调控作用,适度干旱可促进根系向下生长,有利于干物质积累[10-11]。干旱胁迫下生长素(IAA)、赤霉素(GA3)、玉米素(ZT)浓度的下降以及脱落酸(ABA)浓度的升高抑制了根系的生长[12-13],同时导致渗透调节物质在根系中失去平衡,使根长密度(RLD)、根体积密度(RVD)和根表面积密度(RSAD)出现下降趋势[14],干物质向生殖器官运输受阻,造成减产[15]。干旱胁迫下小麦喷施外源ABA在渗透调节物质方面产生拮抗ZT的作用[16]。在干旱区滴灌条件下,当小麦根系从干旱逆境转入正常水分条件时,内源激素的变化对根系形态及渗透调节物质有何影响?复水后内源激素是否有相同的作用及其调节机制尚不清楚。基于上述原因,本研究在新疆生态条件下,分析了开花期不同程度干旱后复水条件下滴灌春小麦根系形态、内源激素含量及干物质积累的变化特征,了解干旱胁迫后复水条件下内源激素对滴灌春小麦根系形态及渗透调节物质的调控作用,以期为干旱区滴灌春小麦高效用水技术体系的完善提供理论依据。
1 材料与方法
1.1 试验地概况
试验于2021年4-7月在石河子大学农学试验站(44°18′ N,85°59′ E)进行。供试土壤为灌溉灰漠土,试验地0~60 cm土壤中有机质、全氮、碱解氮、速效磷和速效钾含量分别为17.84 g·kg-1、1.37 g·kg-1、 58.71 mg·kg-1、16.96 mg·kg-1和139.02 mg·kg-1,土壤电导率为0.15 dS·m-1,pH值为7.80,容重为1.38 g·cm-3,田间持水量为19.8%。生育期内最高气温出现在5月下旬至7月,开花期最高温度可达39.0 ℃。年均降水量208 mm,年蒸发量1 660 mm。小麦生育期间4-7月份的降水量和温度见图1。

图1 2021年春小麦生育期最高温 (Tmax)、最低温 (Tmin)和降水量(Pr)Fig.1 Maximum temperature (Tmax), minimum temperature (Tmin), and precipitation (Pr) during the growth period of spring wheat in 2021
1.2 试验设计
试验采用裂区设计,品种为主区,水分条件为副区。供试春小麦品种为经抗旱性鉴定的新春22号(耐旱性弱)和新春6号(耐旱性强)。设置3个水分条件:(1)全生育期正常供应水分(75%~80%田间持水量),全生育期内灌水量为540 mm(CK);(2)开花期轻度干旱(60%~65%田间持水量)后复水,全生育期内灌水量为480 mm(T1);(3)开花期中度干旱(45%~50%田间持水量)后复水,全生育期内灌水量为440 mm(T2)。T1和T2处理除开花期外其余时期土壤水分保持75%~80%的田间持水量。于2021年5月27日开始控水,2021年6月8日进入开花期,为保证轻度干旱和中度干旱复水时间一致,中度干旱较轻度干旱提前5 d进行控水,在达到相应的土壤含水量后,干旱处理10 d,当干旱结束后,加大滴水量使土壤水分恢复至75%~80%的田间持水量(称为复水),复水日期为2021年6月13日(花后5 d)。
于各小区埋设厚1 cm、直径10 cm的硬质PE管进行土柱栽培试验,每3个PE管纵向连接成一个整体管,管与管之间用铁环固定,每根管总长为60 cm。灌溉采用滴灌,滴灌带(管径16 mm,滴头间距30 cm,流量2.6 L·h-1)放置在PE管中央。在土柱中装土的过程中,通过向土柱中浇水的方式模拟大田水分分布情况,先将过筛后的干土装入PE管口下40~60 cm,然后反复向PE管中灌水达到田间持水量后,再将PE管口下0~40 cm装入风干土。在装土的同时,将测定管埋入土柱中,采用电阻式水分张力感应器(Watermark,model 200SS; Irrometer Co., River-side, USA)实时监测0~60 cm土层土壤水分的变化。
播种前将PE管排放于事先按尺寸挖好的高60 cm的方形土坑中,排列方式模拟大田常规种植模式(12.5+20+12.5+15 cm),每个处理种植15管,重复3次(图2)。PE管下先平铺一层直径0.3~0.8 mm的小石子,并在其上铺100目尼龙网。试验中所用氮肥为尿素(含N 46%),磷肥为过磷酸钙(含P2O512%),氮肥基追比为3∶7,每管施纯氮 3.4 g和P2O51.6 g,将全部磷肥和基施氮肥混入0~40 cm土壤中,追肥分别于分蘖期、拔节期、孕穗-扬花期、灌浆期随水滴施20%、40%、35%、5%。每根管中留苗5株,2021年4月3日播种,2021年7月7日收获,滴水量用水表和球阀控制,其他田间管理措施同大田生产。

图2 田间种植示意图Fig.2 Schematic diagram of field planting
1.3 测定项目与方法
1.3.1 根系形态指标测定
分别于开花期干旱处理结束后及花后7、14、21和28 d取田间土柱中0~60 cm土层,20 cm为一层。取回的根样清洗后,将其置入根盒,用扫描仪(Epson V500,USA)扫描,扫描后的根系图片用Win-RHIZO(CAN)进行分析,得到小麦根长、根体积、根表面积,并计算根长密度(RLD)、根体积密度(RVD)和根表面积密度(RSAD)[17]。RLD=各土层根长/ 相应PE管体积; RVD=各土层根体积/ 相应PE管体积; RSAD=各土层根表面积/ 相应PE管体积。
1.3.2 根系渗透调节物质含量测定
分别于开花期干旱处理结束后及花后7、14、21和28 d取田间土柱中0~60 cm土层,每间隔20 cm为一层,捡取各层根系洗净后,用冰袋保存迅速带回实验室,立即置于液氮中速冻,-80 ℃冰箱中保存。参照李合生[18]的方法测定各土层根系可溶性糖(SS)、脯氨酸(Pro)含量。
1.3.3 根系内源激素含量测定
取样及储存方法同1.3.2。用酶联免疫吸附检测法[19](ELISA)测定各土层根系中生长素(IAA)、赤霉素(GA3)、玉米素(ZT)及脱落酸(ABA)含量,试剂盒由南京建成生物工程研究所提供。
1.3.4 干物质积累量和产量测定
于开花期干旱处理结束后及花后7、14、21和28 d,每处理取3根PE管,从分蘖节处剪下小麦地上部,区分茎、叶、穗,再将PE管挖出,捡取0~60 cm土层根系,各器官均放入纸袋中,立刻置于105 ℃烘箱内杀青30 min,并于75 ℃下烘干至恒重后称重。成熟期每处理取3根PE管测定其籽粒产量。
1.4 数据处理
用Excel 2019 进行数据整理和作图,用SPSS 26.0进行单因素(one-way ANOVA)方差分析,用Duncan法进行多重比较(α=0.05)。
2 结果与分析
2.1 开花期干旱对春小麦根系形态指标的影响
干旱胁迫对春小麦根系形态影响显著(图3)。在0~20 cm土层,T1处理(轻度干旱)的RLD、RVD、RSAD较CK分别平均降低2.69%、0.62%和0.19%,T2处理(中度干旱)分别平均降低4.16%、1.37%和1.61%,且T2处理与CK间差异较大。干旱胁迫促进了小麦根系向深层延伸,20~40 cm土层RLD、RVD、RSAD均表现为T1>T2>CK,T1处理较CK分别平均高4.88%、3.63%和7.99%,较T2处理分别平均高1.76%、1.85%和1.89%。40~60 cm土层各形态参数与20~60 cm土层变化趋势相似,其中T1处理较CK分别平均高7.39%、8.84%和11.55%,较T2处理分别平均高2.77%、2.86%和4.99%。两个品种相比,新春6号的根系形态指标较高,如花后7 d,T1处理下RLD、RVD、RSAD比新春22号分别高3.38%、4.30%和4.29%。水分与品种互作对RLD、RVD和RSAD影响均不显著。

CK:常规灌溉(75%~80%田间持水量); T1: 开花期轻度干旱(60%~65%田间持水量); T2: 开花期中度干旱(45%~50%田间持水量); 图柱上不同小写字母表示处理间差异显著(P<0.05)。下图同。CK: conventional irrigation (75%-80% field capacity); T1: mild drought at anthesis (60%-65% field capacity); T2: moderate drought at anthesis (45%-50% field capacity). Different normal letters above the columns indicate significant differences between treatments (P<0.05). The same in figures 5-10.图3 开花期干旱对小麦RLD、RVD和RSAD的影响Fig.3 Effect of drought at anthesis stage on RLD, RVD, and RSAD of wheat
2.2 开花期干旱对春小麦根系渗透调节物质的影响
随生育进程的推进,春小麦根系可溶性糖(SS)含量呈先升后降的趋势,花后7 d最大(图4)。开花期干旱对复水后各时期小麦根系SS含量的影响均显著。随干旱程度的增加,两品种根系SS含量变化趋势一致,不同土层均以T1处理最高,不同水分处理间均差异显著。在花后7 d,T1处理根系SS含量较CK、T2处理在0~20 cm土层平均分别提高181.39%和67.19%,在20~40 cm土层平均分别提高147.15%和52.51%,在40~60 cm土层平均分别提高136.65%和45.01%。两品种根系SS含量在花后21~28 d的平均降幅(19.13%~48.60%)大于花后7~14 d的平均降幅(8.91%~17.23%)。T1处理下,新春6号各土层根系SS含量在花后7 d较新春22号平均高21.84%。水分处理和品种对根系SS含量的互作效应达到显著水平。

图4 开花期干旱对小麦根系SS含量的影响Fig.5 Effect of drought at anthesis stage on root SS content of wheat
春小麦根系Pro含量对花期干旱的响应同SS含量的变化,也随生育进程推进表现为先增后减的趋势,花后7 d最高(图5)。水分对春小麦根系Pro含量影响显著,两个干旱处理的根系Pro含量在不同土层均高于CK,其中T1处理各时期均最高,与CK差异均显著。花后7 d,在T1处理下0~20、20~40和40~60 cm土层根系Pro含量较CK和T2处理分别高81.34%和10.64%、76.61%和11.61%、69.25%和13.59%。两个品种的根系Pro含量均以T1处理最高,其中新春6号各土层根系Pro含量在花后7 d比新春22号平均高10.81%。品种与水分处理互作对根系Pro含量影响显著。
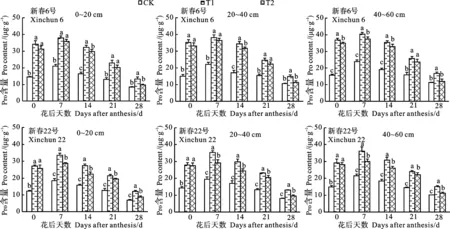
图5 开花期干旱对小麦根系Pro含量的影响Fig.5 Effect of drought at anthesis stage on root Pro content of wheat
2.3 开花期干旱后复水对小麦根系内源激素的影响
从开花期至花后28 d,各处理春小麦根系IAA含量均呈先升后降的变化,峰值出现在花后7 d(图6)。干旱胁迫后,两品种各土层根系IAA含量较CK均显著下降,T1和T2处理平均降幅分别为8.09%和17.54%。复水后,不同品种根系IAA含量变化存在差异。新春6号在复水后表现为T1>T2>CK,其中花后28 d不同处理间根系IAA含量差异显著;花后7 d,T1处理在0~20、20~40和40~60 cm土层较CK和T2处理分别增加0.81%和0.35%、0.52%和0.49%、0.62%和0.57%。新春22号在复水后表现为T1>CK>T2,花后14~28 d不同处理间差异显著;花后7 d,T1处理在0~20、20~40和40~60 cm土层较CK和T2处理分别增加2.38%和13.19%、0.23%和9.01%、0.11%和9.32%。这说明轻度干旱会增加复水后两品种的根系IAA含量,其中在花后7 d,新春6号在T1处理下的根系IAA含量较新春22号平均增加5.99%。水分处理和品种互作对根系IAA含量的影响达显著水平。

图6 开花期干旱对小麦根系IAA含量的影响Fig.6 Effect of drought at anthesis stage on root IAA content of wheat
干旱胁迫会显著降低春小麦根系GA3含量(图7)。随田间持水量的减少,T1和T2处理降幅分别为2.04%和5.45%。复水对新春6号的T1和T2处理均产生补偿效应,各土层均以T1处理最优;在花后7 d,T1处理在0~20、20~40和40~60 cm土层较CK和T2处理分别高2.98%和0.73%、1.74%和0.31%、1.64%和0.59%。新春22仅T1处理在复水后可恢复至CK水平;在花后7 d,在0~20、20~40和40~60 cm土层T1处理较CK分别增加0.70%、0.25%、0.73%,而T2处理在复水后始终低于CK。T1处理GA3含量在花后7~28 d相邻时期间的平均降幅小于CK、T2处理,表现出缓慢下降趋势,且T1处理下,新春6号在花后7 d比新春22号高出10.02%。品种与水分处理对根系GA3互作效应达显著水平。

图7 开花期干旱对小麦根系GA3含量的影响Fig.7 Effect of drought at anthesis stage on root GA3 content of wheat
春小麦根系ZT含量对干旱胁迫的响应与IAA、GA3基本一致。开花期干旱胁迫均导致根系ZT含量下降,其中T2处理的降幅在各土层均最大(9.82%),且与CK间差异均显著(图8)。复水对新春6号的T1和T2处理均能产生补偿或超补偿效应,其中在花后7 d,0~20、20~40、40~60 cm土层两个处理的根系ZT含量分别较CK高出2.63%和1.50%、2.04%和0.64%、4.01%和2.21%。新春22号的根系ZT含量在复水后表现为T1>CK>T2,其中在花后7 d,0~20、20~40、40~60 cm土层下T1处理分别比CK和T2处理高1.51%和4.62%、0.58%和3.74%、1.90%和4.41%。两品种的根系ZT含量均在花后7~28 d呈降低趋势,其中T1处理的平均降幅(64.59%)小于CK(72.90%)和T2(72.16%)处理,且在T1处理下,新春6号的根系ZT含量在花后7 d比新春22号平均高出16.05%。品种与水分互作对各时期ZT含量影响显著。
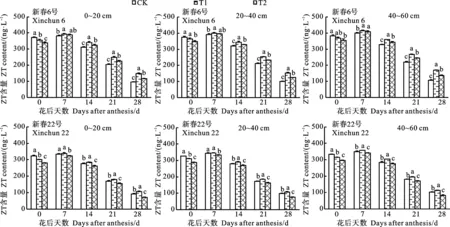
图8 开花期干旱对小麦根系ZT含量的影响Fig.8 Effect of drought at anthesis stage on root zeatin content of wheat
从开花至花后28 d,春小麦根系ABA含量不断上升(图9)。开花期干旱胁迫提高了根系ABA含量,其中T2处理的根系ABA含量在0~20、20~40、40~60 cm土层分别比CK和T1处理平均增加13.72%和4.91%、14.96%和3.68%、11.86%和1.41%。复水后,两品种的根系ABA含量均表现为T2>T1>CK。在花后28 d,0~20、20~40、40~60 cm土层下T2处理较CK和T1处理分别增加2.41%和1.97%、2.19%和1.42%、2.23%和1.33%。T1处理下,新春6号在花后21~28 d的平均增幅(29.20%)小于新春22号(30.17%),且新春6号的根系ABA含量在花后28 d比新春22号平均高3.13%。水分和品种对春小麦根系ABA含量的互作效应未达到显著水平。

图9 开花期干旱对小麦根系ABA含量的影响Fig.9 Effect of drought at anthesis stage on root ABA content of wheat
2.4 开花期干旱胁迫对春小麦干物质积累与产量
与CK相比,开花期干旱胁迫降低了春小麦地上部分干物质积累量(SDM),T1、T2处理的平均降幅分别为9.13%和23.28%(表1)。复水后,两品种干旱处理的SDM均不同程度增加。其中,新春6号的T1、T2处理的SDM复水后均高于CK,其中在花后7 d较CK分别增加27.37%和10.38%;而新春 22号在花后7~28 d均表现为T1>CK>T2,T1和T2处理在花后7 d较CK分别增加10.49%和降低22.56%。
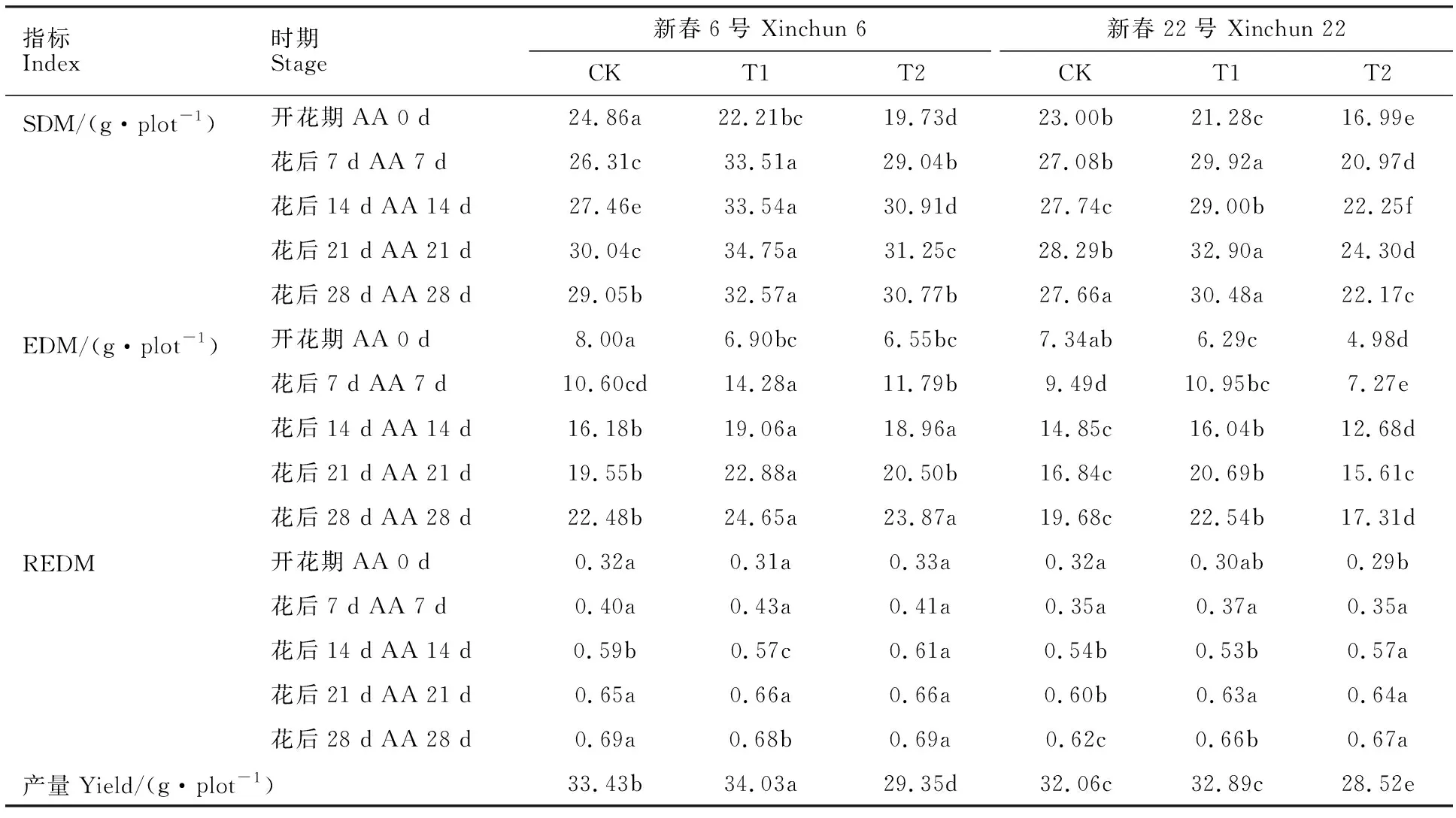
表1 开花期干旱胁迫对春小麦地上部和穗干物质积累量及产量的影响及复水后的变化Table 1 Effects of drought at anthesis stage on dry matter accumulation of shoot and ear, and yield of drip irrigated wheat, and their changes after rewatering
开花期干旱胁迫也导致春小麦穗干物质积累量(EDM)显著下降,T1、T2处理较CK分别平均降低14.02%和24.84%,其中新春 6号的T1与T2处理间差异不显著。复水后,新春6号各时期的EDM均表现为T1>T2>CK,其中在花后28 d,T1和T2处理较CK分别高9.65%和6.18%。新春22号的T1处理在花后28 d较CK平均高14.53%,而T2处理则无法恢复至CK水平,始终低于CK。在同一处理下,新春6号各时期的EDM均高于新春22号。
干旱胁迫对春小麦产量影响显著(表1)。两个品种的产量均表现为T1>CK>T2,其中新春6号的不同处理间差异均显著,而新春22号的T1处理与CK差异不显著,但二者与T2处理差异均显著,说明轻度干旱后复水能使春小麦产量恢复甚至增加。
从干物质在穗部的比例(REDM)看,干旱胁迫对新春6号影响较小,仅在花后14和28 d达到显著水平,而干旱胁迫对新春22号影响较大,除花后7 d外其余时期均显著。两品种REDM从开花期到花后28 d均呈上升趋势,其中新春6号的CK和T2处理最大,而新春22号则表现为T2>T1>CK,说明干旱胁迫会促进干物质向穗部转移分配。
2.5 花期干旱后根系指标与干物质的相关性
由表2可知,两个品种在不同干旱处理下根系形态指标(RLD、RVD、RSAD)、渗透调节物质(SS、Pro)与内源激素IAA、GA3、ZT呈极显著正相关,而与ABA呈极显著负相关;但不同干旱处理间SDM与根系形态特征和渗透调节物质的相关性存在差异,正常灌溉(CK)下,新春6号的SDM与RLD、RVD、RSAD、SS呈极显著负相关,但与Pro的相关性不显著,而新春22号的SDM与渗透调节物质间的相关性不显著;T1水平下,SDM与根系形态特征以及渗透调节物质的相关性均不显著,而新春22号的SDM与根系形态间呈显著正相关;T2水平下,两品种SDM与SS、Pro相关性均不显著。

表2 不同干旱处理后根系形态指标、渗透调节物质与内源激素、地上部分干物质的相关性Table 2 Correlation of root morphological indices, osmoregulation substances, endogenous hormones, and shoot dry matter accumulation after different drought treatments
3 讨论
3.1 开花期干旱对小麦根系形态特征及分布的影响
在干旱胁迫条件下,小麦根系最易受到影响,RLD、RVD、RSAD均明显降低。White等[20]发现,小麦开花期前后保持较高的RLD和RVD有利于生育中后期捕捉更多的水分以满足自身需求,并促进后期灌浆并提高产量。本研究中,开花期轻度干旱后复水(T1,60%~65%田间持水量)条件下,小麦根形态指标均表现出明显的生长补偿,从而提高根系吸水能力。有研究表明,重度干旱后复水产生的补偿效应低于轻度干旱,甚至无法恢复到正常水平[21]。本研究也证明了这一点,新春22号在T1处理复水后各形态指标均恢复甚至超出正常水平,而T2处理后即使复水也无法恢复。适当控水可促进根系向较深土层发育,可吸收较多水分,以满足根系本身和地上部分的需求,这是作物对干旱环境的一种适应性变化。本试验结果表明,干旱能使根系比例向20~60 cm土层转移,显著增加20~60 cm土层中的RLD、RVD以及RSAD,说明在干旱条件刺激了小麦根系生长,通过增加深层根系密度来吸收土壤深层的水分满足自身的需求[22-23],这可能是新春6号耐旱的原因之一。在T1处理下,耐旱性强品种新春6号在花后7 d较弱抗旱性品种新春22号的RLD、RVD和RSAD高3.38%、4.30%和4.29%,说明耐旱性强小麦的根系更为发达,这与前人研究结果一致[24]。因此,耐旱性强品种在春小麦生开花期轻度干旱后复水可构建良好根系形态,促进干物质向生殖器官运输,达到高产的目的。
3.2 开花期干旱对根系生理特性的影响
开花期干旱胁迫时,植物体内会积累大量渗透调节物质,降低渗透势,有利于从外界吸收水分来抵御旱境[25-26]。本研究中,干旱胁迫下小麦根系均维持较高的SS和Pro含量,0~20、20~40、40~60 cm土层均以T1处理最大,表明根系在适度干旱复水后,其渗透调节物质含量得到了提高,保证了小麦根系在生育后期维持较高的生理代谢功能。但不同耐旱品种之间的补偿效应存在明显的差异,耐旱性强品种新春6号各指标的恢复程度均优于新春22号,在T1处理下,新春6号的SS和Pro含量较新春22号平均高21.84%和10.81%,这可能是其具有耐旱性的另一原因。
根系内源激素在调控植物根系细胞分裂和分化方面扮演着重要角色。干旱胁迫下,植物内源激素含量会呈现出复杂的变化趋势,以调节植物的生长[27]。前人研究表明,干旱胁迫会导致IAA等内源激素含量降低,但对ABA含量存在不同结果,复水后内源激素含量能恢复至正常水平[14,28]。本研究结果表明,开花期不同程度干旱均能引起根系中IAA、GA3、ZT等内源激素的合成受到显著抑制,而促进ABA的合成,这与张海燕[30]、王金强[31]的研究结果一致。复水后,ABA含量下降,IAA、GA3、ZT等含量升高,产生生理补偿效应,而深层根系(40~60 cm)内源激素含量较浅层根系(0~20 cm)高,说明深层根系在复水后可保持较高的生理活性使根系向深层生长来获取所需水分,且不同耐旱性品种、不同内源激素之间恢复程度不同。本研究中,新春6号的IAA、GA3、ZT等内源激素在T1、T2处理后均能产生补偿或超补偿效应,而新春22号仅能在T1处理复水后与CK差异不显著,且在T1处理下,新春6号在花后7 d的各内源激素含量分别较新春22号高5.99%、10.02%、16.05%和3.13%,T2处理复水后不能恢复至对照水平,说明抗旱性弱品种新春22号的根系补偿效应在干旱胁迫超过一定程度后不能表现,其恢复能力较抗旱性强品种新春6号差。作物根系的激素水平是调控根系生长和形态变化的驱动因子。干旱胁迫下,IAA、GA3、ZT、ABA作为信号物质,由根系迅速感知干旱信号,将干旱信息传递到地上部,造成植株代谢活动减弱,以提高自身的抗旱能力,而RLD、RVD、RSAD的下降正是对干旱胁迫的适应,且品种抗旱性越强,根系总体积等下降的幅度越小[32]。根系内源激素与根系形态指标的相关分析结果表明,RLD、RVD、RSAD与IAA、GA3、ZT等内源激素呈极显著正相关,而与ABA含量呈极显著负相关,说明根系可在干旱条件下调节内源激素含量改变根系形态适应干旱。因此,春小麦开花期间轻度干旱后复水,可以充分挖掘根系生物学潜能,在实际生产中合理制定灌溉策略,以提高水分利用效率。
3.3 开花期干旱对干物质及产量的影响
干物质的积累与分配是作物产量形成的物质基础[33]。刘丽平等[34]认为小麦开花期干旱导致花后同化物质向生殖器官转运量减少。本研究发现,开花期干旱后地上部干物质积累量(SDM)显著减小,且穗干物质分配比例(REDM)也下降,说明干旱胁迫使同化物向穗转运量减少,直接导致产量下降。倪胜利等[35]研究表明,中度干旱复水后,小麦的SDM均出现了明显的补偿和超补偿现象。本研究中,T1处理复水后各时期SDM表现出明显的补偿效应,且REDM也显著增加。干旱胁迫对不同抗旱性品种造成的伤害不同,并且不同品种恢复能力与其抗旱性强弱密切相关[36]。本研究表明,耐旱性强品种新春6号的SDM在T1、T2条件下均能发生补偿或超补偿效应,而耐旱性弱品种新春22号仅在T1处理下可恢复至CK水平。干旱胁迫显著影响了小麦产量的高低,且品种间差异显著。本试验中,两品种产量均在T1处理下达到最大值,分别较CK增加1.79%和2.59%。由此可见,春小麦在开花期经受适度的干旱,花后复水不仅没有使光合结构破坏,反而使干物质源源不断地向穗部运输,最终在高效节水的前提下获得较高的产量。因此对春小麦而言,开花期维持60%~65%田间持水量,能显著提高产量补偿效应。
4 结论
开花期轻度干旱后复水(T1,全生育期灌溉量为480 mm)导致根系形态特征、渗透调节物质以及内源激素显著增加,有利于提高地上部生物量。花后干物质积累量与根系的形态、生理指标之间存在显著相关性。品种与水分处理互作对根系生理参数(除ABA)及干物质积累影响显著。新春6号比新春22号在复水后补偿效应更明显,可维持较高的根系形态及生理特征,促进生殖器官生物量积累。
