小麦种子萌发基因TaJAZ1的克隆和功能研究
2023-08-31姚雅鑫刘函西王伟伟张礼宁孙风丽奚亚军
姚雅鑫,刘函西,王伟伟,张礼宁,孙风丽,张 超,奚亚军
(西北农林科技大学农学院/农业农村部西北地区小麦生物学与遗传育种重点实验室,陕西杨凌 712100)
小麦(TriticumaestivumL.)是世界上栽培历史悠久,且分布广泛的三大谷物之一,人类约 21%食物热量和 20%蛋白质都是由小麦提供[1]。小麦主要依靠种子进行有性繁殖,种子的休眠与萌发是其生命周期中的关键过程,也是作物产量的重要性状[2]。小麦生长开始于种子的萌发,种子在适宜条件下萌发对幼苗形成以及后期的营养生殖阶段都具有重要的意义[3-4]。而种子休眠决定了发芽时间[5],休眠在成熟期间建立[6],期间休眠水平逐渐增加,并在新鲜成熟的种子中达到最大值[7]。在随后干燥储存过程中,种子休眠被逐渐解除,直到种子可以通过感知和整合一系列环境信号来决定萌发的时间[8]。若在种子发育成熟期间遇到高温多雨天气,种子强休眠性能避免穗发芽现象发生,从而减少农业生产损失[9-10]。小麦品种铭贤169是占我国小麦种植面积60%以上的黄淮麦区广泛使用的抗条锈病育种诱发材料。有研究表明,铭贤169种子具有较高的抗穗发芽能力,休眠性极强,是研究作物抗穗发芽的理想材料[11-12]。然而,在农业生产上,对于小麦种子播种后需要快速均匀发芽和生长方面来说,种子休眠通常是一种不利特性,因为长时间的休眠会导致小麦出苗率低、萌发不整齐,且易产生秋季田间混杂,对作物产量非常不利[5,13-14]。因此挖掘种子萌发相关基因,对铭贤169的休眠性进行改良,在实际育种和农业生产上都具有非常重要的现实意义。
TIFY家族是植物中一类特异性转录因子,是一组参与茉莉酸(JA)代谢过程的特异性蛋白,含有高度保守的TIF[F/Y]XG氨基酸序列[15]。根据结构域的组成和进化特点,又可分成四个亚家族:TIFY、JAZ、ZML 和 PPD[16-17],其中,JAZ 亚家族属于分布最广泛及数目最多的一个家族[16]。目前已经鉴定JAZ家族在植物的生长发育及胁迫响应等方面发挥着重要作用。在拟南芥中过表达甘蓝型油菜(BrassicanapusL.)BnC08.JAZ1-1基因,可能通过调节参与泛素-蛋白酶体途径和磷脂代谢途径的下游反应基因的表达来调节种子重量,导致种子重量的增加[18]。过表达CmJAZ1的菊花(Chrysanthemummorifolium)植株中,由于Jas 结构域的缺失导致菊花开花时间变晚[19]。在番茄(SolanumlycopersicumL.)中过表达SlJAZ2,可使植株叶片生长更快,降低株高和节间长度,使毛状体减少,侧芽萌发更早,进而使植株花期提前,并且调控开花时间的基因显著上调表达,SlJAZ2加速了从营养生长到生殖生长的转变[20]。拟南芥(Arabidopsisthaliana)中JAZ7的过表达可通过调节光合作用、氧化还原、氨基酸、植物激素以及防御代谢产物来提高植株的耐旱性[21]。OsJAZ1(OsTIFY3)可与OsbHLH148互作,提高水稻(OryzasativaL.)的耐旱性[22]。有研究表明,JAZ家族基因还参与种子萌发过程的调节[23]。拟南芥AtJAZ3通过与AtABI5互作,抑制AtABI5的转录活性参与调节种子萌发,是种子萌发的正向调节因子,负调节ABA信号转导途径。在小麦中过表达TaJAZ1(与拟南芥JAZ3同源性最高)也能促进种子萌发,是小麦穗发芽的正向调节因子,与拟南芥存在相同的互作关系[23]。
本研究通过分析铭贤169小麦萌发种子和休眠种子的转录组数据,筛选获得了差异表达基因TaJAZ1。以铭贤169为试验材料,分离克隆TaJAZ1基因,并通过生物信息学分析、亚细胞定位、表达模式分析以及拟南芥jaz3突变体、过表达TaJAZ1拟南芥和水稻表型分析,进一步验证TaJAZ1参与调节种子萌发的功能,为改良铭贤169等休眠性强的小麦品种提供参考。
1 材料与方法
1.1 供试材料
小麦品种铭贤169、本氏烟草、水稻日本晴、Columbia(Col-0) 野生型拟南芥(均由西北农林科技大学小麦与柳枝稷遗传改良研究团队提供),T-DNA插入突变体jaz3拟南芥(SALK_067825.56.00.x)购自拟南芥生物资源中心(TheArabidopsisBiological Resource Center, ABRC,美国)。
1.2 小麦TaJAZ1基因的克隆
研究基于前期对铭贤169小麦萌发和休眠种子的转录组测序分析(NCBI登录号:PRJNA638000),筛选获得了萌发与休眠的差异表达基因TaJAZ1(TraesCS5A02G204900.1),通过Ensembl Plants(http://plants.ensembl.org/index.html)数据库下载获得其CDS序列。以铭贤169萌发和休眠种子为材料,采用 Trizol试剂盒(江苏,康为世纪)提取材料中的总 RNA,利用PrimeScriptTM II 1st Strand cDNA Synthesis Kit反转录试剂盒(TaKaRa, 大连,中国)反转录成cDNA。利用Primer Premier 5.0设计基因特异引物TaJAZ1-F/R(表1),用高保真酶KOD FX(TaKaRa,京都,日本)扩增编码区全长,PCR 反应体系为:PCR Buffer for KOD FX 25 mL,2 mmol·L-1dNTPs 10 mL,基因上下游混合引物(10 mmol·L-1) 1.5 mL,模板cDNA 1 mL,KOD FX (1.0 U·mL-1) 1 mL,无菌水补充至50 mL。PCR 扩增程序:94 ℃预变性2 min;98 ℃变性10 s,60 ℃退火30 s,68 ℃延伸2 min,32 个循环;68 ℃终延伸5 min。PCR扩增后,用1%琼脂糖凝胶进行电泳检测,产物用DNA纯化回收试剂盒(天根,北京)回收。使用T4DNA连接酶(Thermo, 美国)将目标片段与pMD18-T载体连接,并转化至大肠杆菌感受态细胞DH5α(唯地, 上海)。经PCR检测正确的菌液送杨凌奥科生物公司进行测序,测序正确的提取质粒命名为pMD18-T-TaJAZ1。

表1 试验所用引物Table 1 Primers used in thestudy
1.3 小麦TaJAZ1基因的生物信息学分析
对小麦TaJAZ1基因进行初步生物信息学分析:通过Ensembl Plants(http://plants.ensembl.org/index.html)网站获取基因CDS、蛋白、编码区上游2 000 bp序列;利用ProtParam(https://web.expasy.org/protparam/)和Protscale(https://web.expasy.org/protscale/)在线网站分析TaJAZ1蛋白的理化性质和亲/疏水性;在SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl)在线网站预测TaJAZ1蛋白的二级结构;于NCBI-BLASTP(https://blast.ncbi.nlm.nih.gov)上进行序列比对,获取TaJAZ1在不同物种中的同源蛋白序列,结合DNAMAN8.0软件对TaJAZ1在不同物种中的同源序列进行多重序列比对和同源性分析,用MEGA7.0.14软件绘制系统进化树;在PLANTCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/ html/)在线网站分析基因转录起始位点上游2 000 bp的启动子区顺式作用元件。
1.4 小麦TaJAZ1基因的亚细胞定位
利用Primer Premier 5.0设计引物TaJAZ1-GFP-F/R(表1),以pMD18-T-TaJAZ1质粒为模板进行PCR扩增,并用限制性内切酶BglⅡ(Thermo, 美国)对PCEGFP荧光载体进行单酶切。将回收纯化的PCR产物以及酶切的线性化载体按照DNA 无缝克隆试剂盒 ClonExpress Ⅱ One Step Cloning Kit(Vazyme, 美国)说明书进行同源重组,并转化至大肠杆菌感受态细胞DH5α。检测正确的菌液提取重组质粒pCEGFP-TaJAZ1-GFP。利用冻融法将pCEGFP空载和pCEGFP-TaJAZ1-GFP重组质粒分别转化至农杆菌感受态EHA105(唯地, 上海)中,亚细胞定位参考王蒙蒙等[24]实验方法进行。
1.5 小麦TaJAZ1基因的表达模式分析
选取铭贤169花后10、15、20、25、30、35和40 d大小均匀一致的籽粒,液氮速冻后保存在-80 ℃备用。取完熟期饱满大小均匀一致的铭贤169种子,经消毒后放于培养皿中 ,加入50 μmol·L-1ABA溶液进行处理(25 ℃暗培养箱),分别在0、2、6、12、24和48 h后取样,液氮速冻后保存在-80 ℃备用。用Trizol法提取材料中的总 RNA并反转录为cDNA,以小麦Actin基因为内参,以TaJAZ1-q-F/R为引物(表1),参照TB GreenTMPremix Ex TaqTMⅡ(TliRNaseH Plus)试剂盒(TaKaRa,日本)说明书进行qRT-PCR,反应程序为: 95 ℃ 30 s; 95 ℃ 5 s; 60 ℃ 30 s;40 个循环。每个样品重复3次,采用2-△△CT方法计算相对表达量。
1.6 小麦TaJAZ1基因过表达拟南芥的转化和jaz3突变体的鉴定及表型分析
以pMD18-T-TaJAZ1质粒为模板,利用带有Hind Ⅲ和EcoRⅠ限制性内切酶位点的引物TaJAZ1-OE-F/R进行PCR扩增,并用这两个内切酶(Thermo, 美国)对pGreenⅡ-OE过表达载体双酶切,将二者回收后按照DNA 无缝克隆试剂盒操作说明进行同源重组,后续方法同1.4,最终获得pGreenⅡ-OE-TaJAZ1重组质粒。利用冻融法将其转至农杆菌GV3101(唯地, 上海)中,采用花絮侵染法获得转基因拟南芥。通过喷施草甘膦(4 mg·L-1)筛选阳性苗,并采用超光速Mix(MF848)试剂盒(聚合美生物,北京)获取叶片PCR扩增模板,利用Bar基因引物检测,去除假阳性植株并继续筛选至T3代,得到纯合单拷贝株系。用Trizol法提取材料中的总 RNA并反转录为cDNA,以拟南芥Actin为内参基因,通过半定量检测TaJAZ1能否在过表达拟南芥中正常表达。利用三引物法检测jaz3突变体拟南芥,通过超光速Mix(MF848)试剂盒获取叶片扩增模板,分别用左边界序列(LP)引物 +右边界序列(RP)引物和通用(LBb1.3)引物+ RP引物(表1)进行PCR反应。
将拟南芥种子经消毒处理后点播在含有ABA (0、0.25、0.5和0.75 μmol·L-1)的1/2 MS 培养基上,经4 ℃低温春花后转至光照培养箱培养(23 ℃, 16 h 光照/8 h 黑暗),每天统计一次发芽率并拍照,重复3次,每个株系不少于30粒。
用0.75 μmol·L-1ABA处理拟南芥种子,分别于0、2和6 h后取样,提取RNA,检测ABA信号通路中ABI5基因的相对表达量变化,方法同1.5。
1.7 小麦TaJAZ1基因过表达水稻的获得及鉴定
用1.4相同的方法克隆获得带有酶切位点KpnⅠ和BglⅡ的基因产物,并将其连接到改造后的过表达载体pCAMBIA1302+ubi+NOS上,得到重组质粒pCAMBIA1302+ubi+NOS-TaJAZ1。用冻融法转入农杆菌感受态EHA105中,将PCR检测正确的菌液送至武汉伯远生物有限公司进行水稻日本晴的遗传转化,获得T1代转化植株。用Hyg基因引物检测阳性苗,以水稻Actin为内参基因,检测TaJAZ1在过表达水稻中的表达量。将水稻种子消毒处理后,放入垫有滤纸的培养皿中,在光照培养箱(28 ℃/25 ℃,16 h 光照/8 h 黑暗)做萌发实验,每天统计发芽率并拍照,重复三次,每皿不少于35粒。
用20 μmol·L-1ABA处理水稻种子,分别于处理0、2和6 h后取样,用Trizol法提取材料中的总 RNA,检测 ABA信号通路中ABI5基因的相对表达量变化,方法同1.5。
1.8 数据处理与分析
用Excel软件进行数据统计和分析,用SPSS 软件进行差异显著性分析。
2 结果与分析
2.1 小麦TaJAZ1基因的克隆
以铭贤169休眠与萌发种子总RNA反转录的cDNA为模板,用特异性引物TaJAZ1-F/R进行PCR扩增,克隆TaJAZ1的CDS序列(1 230 bp),结果显示约1 300 bp处有特异性条带(图 1),与预期大小相符,并且测序结果与基因序列完全一致。
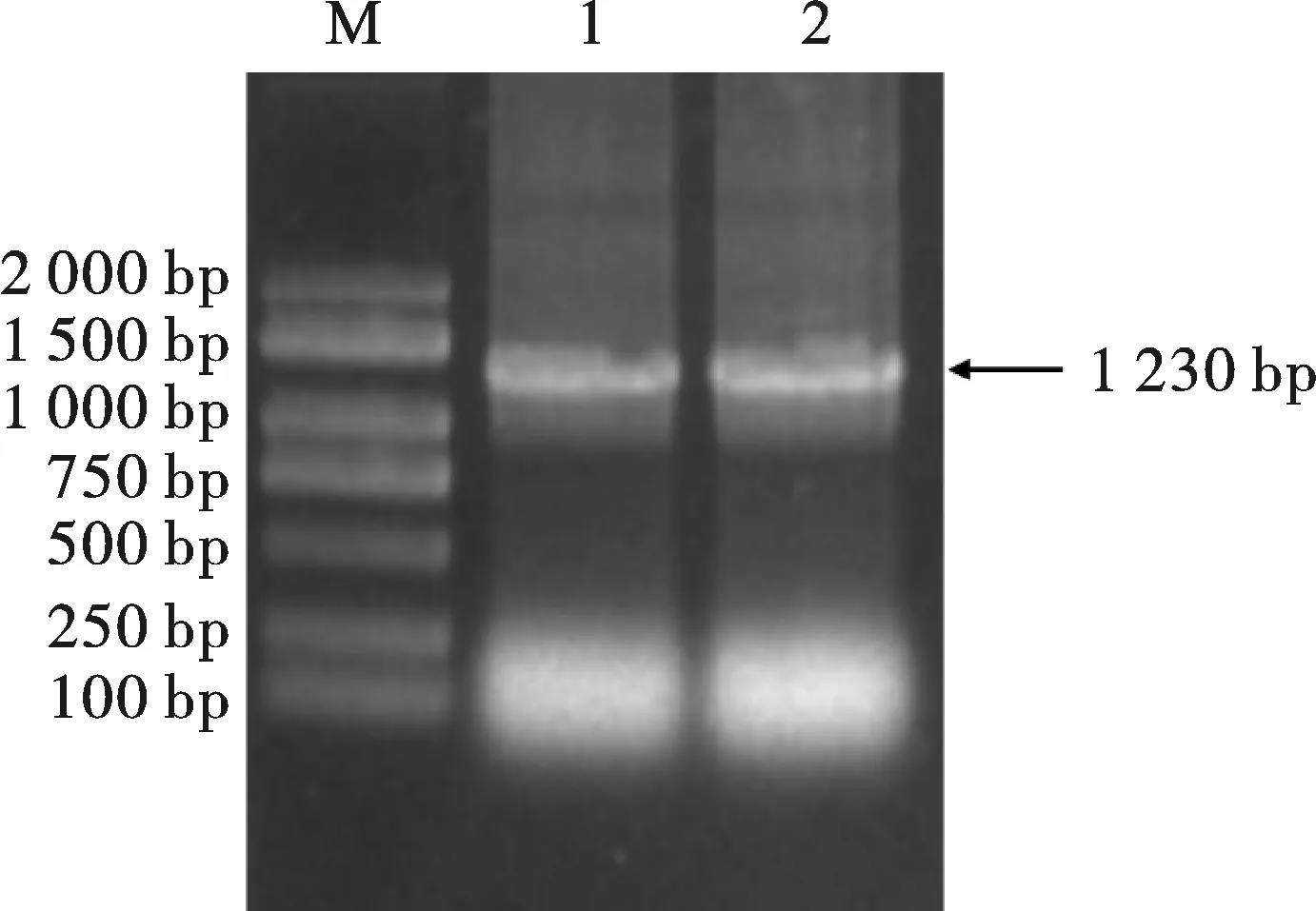
M:DL2000;1~2:TaJAZ1图1 小麦铭贤169TaJAZ1基因CDS扩增 Fig. 1 CDS amplification product of TaJAZ1 gene from Mingxian 169
2.2 TaJAZ1基因生物信息学分析
2.2.1 TaJAZ1蛋白理化性质分析
利用ExPASy-ProtParam对TaJAZ1蛋白序列分析显示,TaJAZ1基因CDS序列长度为1 230 bp,编码409个氨基酸,该蛋白的等电点为10.09,相对分子质量为43 254.63 Da,不稳定系数为67.98,是不稳定蛋白。在组成TaJAZ1蛋白的所有氨基酸中,丙氨酸(Ala)含量最高,占总氨基酸量的13.9%;色氨酸(Trp)含量最低,占比为0.2%;其中,含有26个带负电荷的氨基酸残基(Asp+Glu),43个带正电荷的氨基酸残基残基 (Arg+Lys);脂肪族氨基酸总数为58.14;该蛋白的平均疏水指数为-0.474,是疏水性蛋白(图2A)。二级结构分析发现(图2B),TaJAZ1蛋白含有22.00%α-螺旋,12.96%延伸链,2.93%β-转角和62.10%无规则卷曲。

A:TaJAZ1蛋白亲/疏水性; B:TaJAZ1蛋白二级结构,蓝色代表α-螺旋,红色代表延伸链,绿色代表β-转角,紫色代表无规则卷曲。A: Nucleophilic and hydrophobic of TaJAZ1 protein; B: Secondary structure of TaJAZ1 protein, with α-helix in blue, extended strand in red,β-turn in green, and random coil in purple.图 2 TaJAZ1蛋白亲疏水性及二级结构分析Fig. 2 Analysis of hydrophobicity and secondary structure of TaJAZ1 protein
2.2.2 TaJAZ1蛋白同源性及系统发育分析
利用NCBI-Blast数据库进行同源比对,筛选与TaJAZ1亲缘关系较近的蛋白序列,并利用MEGA7.0构建进化树。结果(图3)显示,TaJAZ1与野生二粒小麦(XP_037434392.1)、水稻(NP_001390678.1)和玉米(NP_001141029.1)等单子叶植物中JAZ蛋白处于一大分支,而双子叶植物拟南芥(NP_566590.1)和大豆(XP_003525246.2)中JAZ蛋白聚为单独的一支。其中TaJAZ1与野生二粒小麦的JAZ蛋白亲缘关系最近,并且麦类作物都聚为一支,说明TaJAZ1蛋白在麦类作物中具有高度的保守性。

图3 TaJAZ1蛋白的系统进化分析Fig. 3 Phylogenetic analysis of TaJAZ1
2.2.3TaJAZ1启动子顺式作用元件分析
为了进一步解析TaJAZ1的转录调控机制,利用在线预测网站PLANTCARE对TaJAZ1基因起始密码子上游约2 000 bp序列进行分析,结果(表2)发现,TaJAZ1的启动子区域除含有TATA-box、CAAT-box两个基础顺式作用元件外,还含有许多光、激素响应元件和逆境响应元件。如茉莉酸甲酯响应元件CGTCA-motif、TGACG-motif,脱落酸响应元件ABRE,水杨酸响应元件TCA-element。此外还有光响应元件G-box、GATA-motif、TCCC-motif、I-box、AE-box、Sp1、ox 4,参与干旱诱导的响应元件MBS,参与昼夜节律控制顺式作用调节元件circadian,低温响应元件LTR,与分生组织表达相关顺式作用元件CAT-box以及参与缺氧特异性诱导的作用元件GC-motif、ARE。启动子分析结果表明,TaJAZ1基因可能受光、多种植物激素及生物和非生物胁迫调控。
2.3 TaJAZ1亚细胞定位
将含有重组载体PCEGFP-TaJAZ1-GFP和空载PCEGFP的菌液分别注射烟草叶片,通过烟草瞬时表达验证该蛋白的具体定位。结果(图 4)表明,空载PCEGFP在细胞膜和细胞核中都具有较强的荧光信号,而含有目的基因的重组载体PCEGFP-TaJAZ1-GFP也在细胞膜和细胞核中均能观察到荧光信号,表明TaJAZ1定位在细胞膜和细胞核中。

图4 TaJAZ1 蛋白的亚细胞定位Fig. 4 Subcellular localization of TaJAZ1 protein
2.4 TaJAZ1表达模式分析
2.4.1TaJAZ1在种子发育不同时期的表达模式
种子发育时期是研究种子休眠与萌发基因功能的关键时期,本研究对花后不同时间的铭贤169种子取样,通过实时荧光定量PCR检测TaJAZ1的表达量。结果(图5A)显示,随着小麦种子的发育,TaJAZ1的表达呈现先升高后下降的趋势。尤其是花后30 d时,该基因的表达量是花后10 d表达量的2倍多,此时随着种子的发育,种子活力最高,淀粉含量增加[25],可能是是穗发芽极易发生的时期。之后随着种子的成熟,该基因的表达量又迅速下降,在花后40 d时,其表达量相较于花后初期下降了五分之四,进一步说明TaJAZ1对种子休眠起负调控作用,是种子萌发的正向调控因子。

A:TaJAZ1在种子发育不同时期的表达模式;B:ABA处理对小麦TaJAZ1的诱导;图柱上无相同字母表示相对表达量在不同时间之间差异达显著水平(P<0.05)。下图同。A: Expression pattern of TaJAZ1 at different stages of seed development; B: Expression level of TaJAZ1 induced by ABA treatment.Different normal letters above the columns indicate significant differences of relative expressions among different stages (P<0.05). The same in the following figures.图5 小麦TaJAZ1基因的表达模式Fig. 5 Expression profiles of wheat TaJAZ1 gene
2.4.2TaJAZ1在ABA处理下的表达模式
在许多物种中,脱落酸ABA是种子休眠诱导和维持的正调控因子,是种子萌发的负调控因子[26]。因此本研究用50 μmol·L-1ABA对铭贤169种子进行处理,通过qRT-PCR分析对TaJAZ1的诱导。在ABA处理下(图5B),该基因受到上调表达,但随时间变化表达量各不相同。TaJAZ1的表达呈先上升后下降的变化趋势,在24 h处理时表达量达到最大,显著高于处理0 h的表达量,处理48 h后表达量有所下降,但仍显著高于0 h的表达量,是0 h表达量的8.9倍,表明ABA能诱导TaJAZ1的表达。
2.5 TaJAZ1过表达拟南芥和jaz3突变体表型分析
2.5.1TaJAZ1过表达拟南芥和jaz3突变体阳性苗鉴定
通过花絮侵染法获得TaJAZ1过表达拟南芥,经筛选共获得5个TaJAZ1过表达T3代阳性株系(图6A)。jaz3突变体利用三引物法检测,结果(图6B)显示,LP+RP引物对只在野生型拟南芥中扩增出条带,而在jaz3突变体中没有带,LBb1.3+RP引物对只在jaz3突变体有条带,表明所获得拟南芥jaz3突变体是纯合突变体。

M:DL2000;1~2:水;3~4:野生型拟南芥(WT); A:TaJAZ1过表达拟南芥PCR检测。 5~9:TaJAZ1过表达拟南芥;B:拟南芥jaz3突变体PCR检测。5~10:jaz3突变体;1、3、5、7、9所用引物为LP+RP,2、4、6、8、和10所用引物为 LBb1.3+RP;C:过表达拟南芥TaJAZ1的表达鉴定. 5~9:TaJAZ1过表达拟南芥。M: DL2000; 1-2: Water; 3-4: Wild type Arabidopsis (WT); A: PCR detection of TaJAZ1 in overexpressed Arabidopsis. 5-9: TaJAZ1 overexpressed Arabidopsis; B: PCR detection of Arabidopsis jaz3 mutant. 5-10: jaz3 mutant; The primers used for 1, 3, 5, 7 and 9 were LP+RP, and the primers used for 2, 4, 6, 8 and 10 were LBb1.3+RP ; C: Expression and identification of TaJAZ1 in overexpressed Arabidopsis. 5-9: TaJAZ1 overexpressed Arabidopsis.图6 TaJAZ1过表达拟南芥和jaz3突变体检测Fig. 6 Detection of TaJAZ1 in overexpression lines of Arabidopsis and jaz3 mutant
2.5.2 RT-PCR检测过表达拟南芥TaJAZ1的表达
通过 RT-PCR 进行半定量分析发现,TaJAZ1在这5个过表达株系中均能正常表达,而在野生型拟南芥中不表达(图 6C)。
2.5.3TaJAZ1过表达拟南芥和jaz3突变体种子萌发表型
为进一步分析TaJAZ1在种子萌发方面的作用,将拟南芥WT、jaz3突变体以及随机选取的两株过表达株系OE-1和OE-2的种子分别置于添加不同浓度ABA的1/2MS培养基上做发芽实验。结果表明,在1/2MS 培养基上,野生型和突变体的萌发率无明显差异,而两个过表达株系的萌发率始终高于野生型和突变体的萌发率,但差异不显著(图7A)。同1/2MS处理下的萌发率相比,在不同浓度ABA处理下(图7),野生型、jaz3突变体和过表达拟南芥的发芽率和发芽势均受到了不同程度的抑制,且随着ABA浓度的升高,抑制程度逐渐加深(图7D),但发芽势始终是TaJAZ1过表达>野生型 >jaz3突变体。这些结果再次证明,TaJAZ1是种子萌发的正向调节因子,对ABA不敏感,可能在ABA信号转导途径中起负调控作用。

A:拟南芥种子在1/2MS上的萌发率;B、C、D分别代表不同浓度ABA 处理下拟南芥种子萌发率;E:不同浓度ABA处理7 d后拟南芥种子的发芽率;WT:野生型拟南芥;jaz3:jaz3突变体;OE-1、OE-2分别代表两个TaJAZ1过表达拟南芥植株;数据为3 次独立生物学重复的平均值±标准差。A: seed germination rate of Arabidopsis on 1/2MS; B, C, D: seed germination rates of Arabidopsis treated with different concentrations of ABA; E: Germination rate of Arabidopsis seeds treated with different concentrations of ABA for 7 days; WT: Wild type Arabidopsis; jaz3: jaz3 mutant Arabidopsis; OE-1 and OE-2 respectively represent two Arabidopsis plants overexpressing TaJAZ1. Data are mean±standard deviation of three biological replicates.图7 拟南芥种子萌发率Fig.7 Seed germination rates of Arabidopsis
2.5.4 qRT-PCR检测拟南芥 ABA信号通路基因ABI5的表达量变化
ABI5(ABA-INSENSITIVE 5)基因编码一种bZIP类转录因子,在ABA信号通路中起核心作用,当种子经ABA等渗透胁迫处理后,能在短时间内被诱导上调表达[27-29]。鉴于在拟南芥种子萌发试验中TaJAZ1对ABA不敏感,可能是ABA信号通路的负调控因子,研究分析了ABA信号通路基因ABI5在拟南芥种子受到ABA处理后的诱导情况。结果表明(图8),在ABA处理后,ABI5基因在各植株中均上调表达,但上调程度各不相同。在过表达TaJAZ1的拟南芥种子中,ABI5受诱导程度明显低于在jaz3突变体中的诱导程度,野生型拟南芥中ABI5诱导程度居中。以上结果进一步验证了TaJAZ1对ABA不敏感,是ABA信号通路的负调控因子。

WT:野生型拟南芥;jaz3:突变体拟南芥;OE:两个TaJAZ1过表达拟南芥植株OE-1和OE-2的混合样。WT: Wild type Arabidopsis; jaz3:Mutant Arabidopsis; OE: A mixed sample of two Arabidopsis plants OE-1 and OE-2 overexpressing TaJAZ1.图8 qRT-PCR分析拟南芥 ABA 响应基因ABI5的表达情况Fig.8 Expression of ABA response gene ABI5 in Arabidopsis analyzed by qRT-PCR
2.6 TaJAZ1过表达水稻表型分析
2.6.1TaJAZ1过表达水稻阳性苗鉴定和表达分析
为进一步验证TaJAZ1的功能,将小麦TaJAZ1通过遗传转化的方法过表达于同为禾本科单子叶作物水稻中进行研究分析。用Hyg基因引物检测TaJAZ1过表达水稻植株,共获得10株阳性苗。随机选取三个过表达阳性植株(OE-2、OE-5、OE-8),通过qRT-PCR分析TaJAZ1在过表达株系中的表达量变化,研究表明,TaJAZ1在过表达株系中均高表达(图9)。

WT:受体水稻日本晴;OE-2、OE-5、OE-8分别代表随机选取的三个TaJAZ1过表达水稻株系。WT: Nipponbare ; OE-2, OE-5, and OE-8 respectively represente three randomly selected rice lines overexpressing TaJAZ1.图9 TaJAZ1过表达水稻qRT-PCR分析 Fig.9 qRT-PCR analysis of TaJAZ1 in the overexpression lines of rice
2.6.2TaJAZ1过表达水稻萌发表型
将日本晴、TaJAZ1过表达水稻分别放入培养皿中做发芽试验,结果显示(图10),在萌发的前3 d 二者差异明显。萌发第一天,日本晴种子萌发率为60%,而TaJAZ1过表达水稻种子萌发率已达到75.2%。以上结果表明,TaJAZ1在同为禾本科单子叶作物的水稻中仍具有促进种子萌发的作用。

WT:受体水稻日本晴;OE:三个TaJAZ1过表达水稻植株OE-2、OE-5和OE-8的混合种子;数据为3 次独立生物学重复的平均值±标准差。WT: Nipponbare; OE: Mixed sample of rice plants OE-2, OE-5, and OE-8 overexpressing TaJAZ1; Data are mean±standard deviation of three biological replicates.图10 TaJAZ1过表达水稻萌发表型Fig.10 Germination phenotype of the rice overexpressing TaJAZ1
2.6.3 qRT-PCR检测水稻 ABA信号通路基因ABI5的表达量变化
在过表达拟南芥中TaJAZ1表现出对ABA敏感降低的表型,为了进一步验证TaJAZ1在禾本科单子叶植物中是否具有相同的作用,本研究在TaJAZ1过表达水稻中同样检测ABA信号通路基因ABI5的表达量变化。结果表明(图11),水稻日本晴受体转化材料在受到ABA处理后ABI5显著上调表达,而TaJAZ1过表达水稻中ABI5诱导程度明显低于在受体日本晴中的诱导。研究结果进一步证明了TaJAZ1负调控ABA信号通路,在种子萌发中起促进作用。
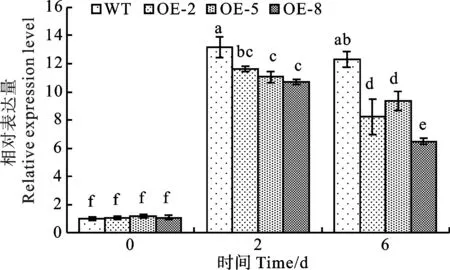
WT:受体水稻日本晴;OE-2、OE-5、OE-8分别代表随机选取的三个TaJAZ1过表达水稻株系。WT: Nipponbare; OE-2, OE-5, and OE-8 respectively represente three randomly selected rice lines overexpressing TaJAZ1.图11 qRT-PCR分析水稻 ABA 响应基因 ABI5的表达情况Fig.11 Expression of ABA response gene ABI5 in rice analyzed by qRT-PCR
3 讨论
休眠时间较长的作物种子可以避免穗发芽现象发生及其带来的产量损失,但又会造成播种后发芽不均匀和出苗不整齐,延迟农业生产[5,14]。因此控制好种子萌发对农业生产具有重要的意义,其中分析研究调节种子萌发相关基因的分子机制至关重要。Ju等[23]将TaJAZ1过表达于小麦品种KN199中,通过一系列试验分析说明TaJAZ1是小麦穗发芽和种子萌发的正向调节因子,负调节ABA信号转导途径。本研究在前人研究基础上,对TaJAZ1基因进行研究,并进一步分析了TaJAZ1在双子叶模式植物拟南芥和单子叶禾本科模式植物水稻中促进萌发的作用。
进化树分析结果显示,JAZ蛋白分为两大类,即单子叶类和双子叶类,TaJAZ1在单子叶植物中与麦类作物聚为一支,说明其在麦类作物中高度保守。TaJAZ1启动子区含有多种激素响应元件如MeJA响应元件、ABA响应元件等,这些元件表明TaJAZ1基因参与茉莉酸信号转导和ABA信号转导途径[23]。除此之外还含有光响应、干旱诱导响应、昼夜节律调控、低温响应等多种顺式作用原件,表明TaJAZ1基因参与植物生长发育,可以响应多种逆境应答。如:TaJAZ1过表达通过促进活性氧积累提高面包小麦对白粉病的抗性[30]。OsJAZ1通过调节水稻中的JA和ABA信号传导来减弱抗旱性[31]。TaJAZ1定位在细胞核和细胞膜中,这为与其他蛋白的互作提供了条件。研究TaJAZ1在种子发育不同时期的表达发现,随着种子的发育,TaJAZ1的表达呈现升高后下降的趋势,在花后30 d时表达量最高,此时小麦种子可溶性蛋白质含量、千粒重达到最大,种子形态和生理发育较完善, 种子活力最高[25],可能是穗发芽高发时期,而之后随着种子逐渐成熟,可能由于体内储藏物质积累逐渐平稳[25],种子进入休眠状态,TaJAZ1的表达量又显著下降。在对作物穗发芽以及种子萌发的机理研究中,发现ABA是影响穗发芽以及种子萌发的重要植物激素之一[26]。对完熟铭贤169种子用ABA处理后检测TaJAZ1的表达,发现ABA能诱导TaJAZ1的表达。
为进一步研究TaJAZ1的功能,本研究将TaJAZ1过表达于双子叶模式植物拟南芥中,因TaJAZ1与AtJAZ3同源性最高[23],并利用jaz3拟南芥T-DNA插入突变体来共同分析研究。无ABA时,TaJAZ1过表达株系的萌发率稍高于野生型和jaz3突变体,但差异不明显。在ABA处理下,拟南芥各株系的萌发率都有所下降,但TaJAZ1过表达拟南芥种子萌发率远高于野生型和jaz3突变体,而后二者差距不大,表明TaJAZ1对ABA不敏感,这与前人研究一致[23,31]。bZIP转录因子ABI5在ABA介导的种子发芽和萌发后生长抑制中起关键作用,ABA能诱导ABI5的高表达和蛋白质积累[27]。TaJAZ1能与TaABI5互作,负调节ABA信号转导途径[23]。本研究在此基础上分析TaJAZ1过表达于拟南芥中是否影响AtABI5的表达,发现经ABA处理后,过表达拟南芥中ABI5基因的诱导程度显著低于野生型拟南芥和jaz3突变体,在jaz3突变体中ABI5的表达量显著增高,进一步证明TaJAZ1对ABA不敏感,负调节ABA信号转导途径。
水稻是单子叶模式植物,并且与小麦同为禾本科作物,将小麦基因转化水稻进行研究具有一定的参考价值。因此本研究将TaJAZ1过表达于水稻日本晴中,进一步分析验证TaJAZ1在单子叶禾本科作物中是否具有相同功能。结果显示,过表达TaJAZ1明显增加了水稻种子萌发率,受体日本晴在ABA处理后ABI5显著上调,而在过表达株系中ABI5诱导程度明显低于日本晴。
综上所述,小麦TaJAZ1能促进种子萌发,对ABA不敏感,并且在双子叶和单子叶中功能保守,这为改良铭贤169等休眠性强而延迟农业生产的作物提供了参考。
