基于Notch信号通路研究白头翁汤对溃疡性结肠炎小鼠肠黏液屏障的保护作用
2023-08-18刘又前蒋翠花张东建方雨夕李寅庆王甜甜健1
刘 伟,刘又前,蒋翠花,张东建,方雨夕,龚 旻,李寅庆,王甜甜,张 健1, , 3*
基于Notch信号通路研究白头翁汤对溃疡性结肠炎小鼠肠黏液屏障的保护作用
刘 伟1, 3,刘又前2,蒋翠花1, 3,张东建1, 3,方雨夕1, 3,龚 旻1, 4,李寅庆5,王甜甜5,张 健1, 2, 3*
1. 南京中医药大学第三临床医学院,江苏 南京 210028 2. 南京市溧水区中医院,江苏 南京 211200 3. 南京中医药大学附属中西医结合医院,江苏 南京 210028 4. 中国药科大学中药学院,江苏 南京 210009 5. 河北御芝林药业有限公司,河北 石家庄 050000
探讨白头翁汤对葡聚糖硫酸钠(dextran sodium sulfate,DSS)诱导的溃疡性结肠炎(ulcerative colitis,UC)小鼠肠黏液屏障的保护作用以及对Notch通路的影响。C57BL/6小鼠随机分为对照组、模型组、美沙拉嗪(50 mg/kg)组和白头翁汤低、高剂量(7.4、14.8 g/kg)组,对照组小鼠自由饮用纯净水,其余各组连续8 d自由饮用2.5% DSS溶液诱导UC模型,造模同时各给药组ig相应药物。每日记录小鼠体质量、粪便稠度以及血便情况;采用苏木素-伊红(HE)染色观察结肠组织病理变化;采用AB-PAS染色观察结肠组织黏蛋白2(mucin 2,MUC2)的分泌情况;ELISA法检测结肠组织中髓过氧化物酶(myeloperoxidase,MPO)活性及促炎因子白细胞介素-6(interleukin-6,IL-6)、IL-1β、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和抗炎因子IL-10的含量;免疫组化法检测结肠组织Ki67的表达情况;免疫荧光法测定结肠组织富含亮氨酸重复序列的G蛋白偶联受体5(leucine-rich repeat-containing G-protein-coupled receptor 5,Lgr5+)肠道干细胞(intestinal stem cells,ISCs)阳性细胞数;Western blotting测定结肠组织Notch-1、Atoh1、Hes1和MUC2蛋白表达。与模型组比较,白头翁汤能够缓解DSS诱导的UC小鼠体质量降低和疾病活动指数(disease activity index,DAI)升高(<0.05、0.01、0.001),缓解结肠组织的缩短、水肿以及病理学损伤(<0.01、0.001),减少炎性细胞浸润、隐窝的破坏与杯状细胞的丢失,降低结肠组织MPO活性和IL-1β、TNF-α水平(<0.05、0.01),升高IL-10水平(<0.05),增加结肠组织Ki67阳性细胞数(<0.01),促进MUC2的分泌和Lgr5+ISCs的阳性细胞数,并下调Notch和Hes-1蛋白表达水平(<0.05、0.001),上调Atoh1和MUC2蛋白表达水平(<0.05、0.01)。白头翁汤能够降低UC小鼠结肠组织促炎细胞因子水平,增加Lgr5+ISCs的增殖和分化,保护隐窝和杯状细胞结构,促进MUC-2分泌,其作用可能与调控Notch-1/Atoh1/ Hes1通路密切相关。
白头翁汤;溃疡性结肠炎;肠道干细胞;黏液屏障;Notch通路;白头翁皂苷B4;黄柏碱;小檗碱;表小檗碱;黄连碱;巴马汀;秦皮甲素;秦皮乙素
溃疡性结肠炎(ulcerative colitis,UC)是一种肠道炎症性疾病,通常从直肠黏膜开始,连续性地延伸至近端结肠,最终累及整个结肠,其临床症状主要为里急后重、腹痛、血性腹泻[1]。在过去的10年中,全球UC的发病率显著上升,同时数据表明长期感染UC的患者更容易患结肠癌的风险[2-5]。目前临床上治疗UC的主要药物为氨基水杨酸盐类和免疫抑制剂,但由于症状容易持续复发,长期的治疗会产生严重的不良反应[6]。因此迫切需要寻找疗效显著、不良反应小的药物用于临床治疗。
目前UC的病因尚未阐明清楚,但诸多证据表明,黏液屏障功能障碍与UC的发生发展密切相关[7-8]。黏液屏障作为抵御肠上皮细胞和肠腔细菌直接接触的第一道屏障,可以有效地将肠上皮细胞与肠腔内容物隔离,保护上皮细胞免受肠道细菌和病原体的侵袭。肠道杯状细胞分泌的黏蛋白2(mucin 2,MUC2)是构成黏液屏障最主要的成分[9-10]。杯状细胞由富含亮氨酸重复序列的G蛋白偶联受体5(leucine-rich repeat-containing G-protein-coupled receptor 5,Lgr5+)肠道干细胞(intestinal stem cells,ISCs)分化而来,Notch信号被报道在调控肠道干细胞的增殖和分化中起重要作用[11]。当Notch过度激活时,会限制Lgr5+肠道干细胞向杯状细胞的分化,削弱黏液屏障[12]。
1 材料
1.1 动物
SPF级雄性C57BL/6J小鼠40只,6~8周龄,体质量18~22 g,购自斯贝福(北京)生物技术有限公司,合格证号SCXK(京)2019-0010。动物在标准的实验室条件下饲养,温度(25±3)℃,相对湿度(53±3)%,12 h明暗光周期,自由进食饮水,适应性饲养7 d后开始实验。动物实验方案符合伦理规定,并经江苏省中医药研究院伦理委员会批准(批准号AEWC-20210810-163)。
1.2 药材
白头翁(江苏亚邦中药饮片有限公司,批号20042901)、黄柏(贵州同德药业有限公司,批号20210302-01)、黄连(亳州市万珍中药饮片厂,批号2104005)、秦皮(江苏同济中药饮片有限公司,批号191210)购自南京中医药大学附属中西医结合医院中药房,并经江苏省中医药研究院钱士辉研究员鉴定分别为毛茛科植物白头翁(Bge.) Regel的干燥根、芸香科植物黄皮树Schneid的干燥树皮、毛茛科植物黄连Franch的干燥根茎以及木犀科植物苦枥白蜡树Hance的干燥枝皮。
1.3 药品与试剂
DSS(相对分子质量36 000~50 000,批号160110)购自美国MP Biomedicals公司;美沙拉嗪肠溶片(批号2021125)购自葵花药业集团;4%多聚甲醛(批号G1101-500ML)购自武汉赛维尔生物科技有限公司;小鼠白细胞介素-1β(interleukin-1β,IL-1β)、IL-6、IL-10、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、髓过氧化物酶(myeloperoxidase,MPO)试剂盒(批号分别为MB-2776A、MB-2899A、MB-2912A、MB-2868A、MB-3074A)购自江苏酶标生物有限公司;β-actin抗体(批号AF5003)、HRP标记的山羊抗兔二抗(批号A0208)、一抗稀释液(批号P0023A)、二抗稀释液(批号P0023D)、10%十二烷基硫酸钠-聚丙烯酰胺凝胶、TEMED、1 mol/L Tris-HCl(pH 8.8)、1 mol/L Tris-HCl(pH 6.8)、30% Acr-Bis(批号分别为ST628、ST728、ST788、ST768、ST003)购自上海碧云天生物科技有限公司;Notch抗体(批号ab52627)购自美国Abcam公司;Atoh1抗体(批号21215-1-AP)、MUC2抗体(批号27675-1-AP)购自美国Proteintech公司;Hes1抗体(批号GTX108356)购自美国Genetex公司;Ki67抗体(批号ab16667)购自英国Abcam公司;Lgr5抗体(批号A10545)购自武汉爱博泰克生物技术有限公司;对照品白头翁皂苷B4(批号111766-202103,质量分数99.8%)、盐酸小檗碱(批号110713-202015,质量分数85.9%)、盐酸黄柏碱(批号111895-201805,质量分数94.9%)、秦皮乙素(批号110741-202109,质量分数99.9%)、秦皮甲素(批号110740-201806,质量分数92.4%)购自中国食品药品检定研究院。
1.4 仪器
MS203DU型电子天平(瑞士Mettler Toledo公司);SynergyH1型酶联免疫检测仪(美国Bio Tek 公司);Hei-VAP Ultimate旋转蒸发仪(德国Heidolp公司);GMBH37081型倒置光学显微镜(德国Carl Zeiss公司);SCIENTZ-48型高通量组织研磨仪(宁波新芝生物科技股份有限公司);SPE10-0111型Western blotting荧光成像仪(美国Azure Biosystem公司);WGH201型超纯水系统(日本Yamato Scientific公司);690BR028786型半干转系统、552BR206289型电泳槽、043BR68680型电泳电源(美国Bio-Rad公司);Heraeus Megafuge 8R型高速冷冻离心机(美国Thermo Fisher Scientific公司);JJ-12J型脱水机、JB-P5型包埋机(武汉俊杰电子有限公司);RM2016型病理切片机(上海徕卡仪器有限公司);KD-P型组织摊片机(浙江省金华市科迪仪器设备有限公司);Alltima C18色谱柱(250 mm×4.6 mm,5 µm)、Waters e2695型高效液相色谱仪(美国Waters公司)。
2 方法
2.1 药物的制备
2.1.1 DSS的配制 用电子天平称取DSS 25 g,溶解于1 L超纯水中,超声配成2.5% DSS溶液。
2.1.2 白头翁汤的制备 白头翁汤由白头翁15 g、黄柏9 g、黄连9 g、秦皮9 g组成,称取白头翁、黄柏、黄连、秦皮药材饮片,第1次加10倍量的纯净水煎煮,第2次8倍量的纯净水煎煮,每次40 min,合并药液并滤去药渣,随后置于旋转蒸发仪中,按给药剂量浓缩至1.48 g/mL,于4 ℃冰箱保存备用。参照美国食品药品监督管理局给出的人体常规用量和小鼠折算系数12.3,按照体表面积进行小鼠等量剂量换算作为低剂量组的治疗剂量,即7.4 g/kg。根据《中国药典》2020年版含量测定的方法,采用高效液相色谱分别测定主要成分的含量,白头翁中白头翁皂苷B4的质量分数为4.72%,黄柏中黄柏碱、小檗碱的质量分数分别为0.38%、4.11%,黄连中小檗碱、表小檗碱、黄连碱、巴马汀的质量分数分别为6.36%、1.04%、1.83%、1.59%,秦皮中秦皮甲素、秦皮乙素的质量分数分别为1.06%、0.17%。
US-FANC技术的核心是病理结果判定。病理科细胞学诊断经验不足一直是制约该项技术开展的主要原因,故US-FANC结果需病理科医师和外科医师共同判断、解读,共同积累诊断经验[12]。
2.2 动物分组、造模和给药
小鼠适应性喂养1周后,随机分为对照组、模型组、美沙拉嗪(50 mg/kg[17-18])组和白头翁汤低、高剂量(7.4、14.8 g/kg)组,每组8只。对照组每天自由饮用纯净水,模型组和各给药组连续8 d自由饮用2.5% DSS溶液,造模同时各给药组ig相应药物。
2.3 样本的收集和处理
给药结束后,于第9天用毛细管玻璃扎入小鼠的眼眶内眦静脉丛,快速旋转进入,采用1.5 mL灭菌的EP管收集血液,室温静置2 h,4000 r/min离心15 min取血清,储存于−80 ℃冰箱中。取血后,立即颈椎脱位处死小鼠,分离盲肠至直肠部位的结肠,对分离后的结肠组织进行拍照,再用预冷的生理盐水冲洗干净后,将收集到的结肠组织分成2部分,剪取1 cm的结肠远端部分别放入4%多聚甲醛和卡诺氏固定溶液[(无水乙醇-氯仿-冰醋酸(6∶3∶1)]中进行固定,用于病理学染色,其余结肠组织转移至−80 ℃的冰箱中储存用于后续实验。
2.4 疾病活动指数(disease activity index,DAI)评分
每日观察小鼠活动状态,称定体质量,观察粪便性状以及有无便血情况,按照表1标准进行DAI评分[19-20]。
表1 DAI评分标准
Table 1 DAI score standard
评分体质量下降率(x)粪便稠度直肠出血 00<x≤1%正常正常 11%<x≤5%松散,半成形糊状隐血呈阳性 25%<x≤10%松散明显,基本不成形隐血呈强阳性 310%<x≤20%稀水样便肉眼血便 4>20%稀便更加明显血便更加明显
2.5 结肠组织苏木素-伊红(HE)和AB-PAS染色
2.5.1 HE染色 取小鼠结肠组织,使用4%多聚甲醛固定,随后进行石蜡包埋、切片、脱蜡、水化后,用HE染色,使用倒置显微镜观察拍照后进行组织病理学观察。
2.5.2 AB-PAS染色 取小鼠结肠组织,使用卡诺氏固定液固定,随后进行石蜡包埋、切片、脱蜡、用AB-PAS染色后,使用倒置显微镜观察拍照后观察杯状细胞的结构和数量、黏液层厚度和分泌情况,中性黏液为红色,酸性黏液呈蓝色,中性和酸性混合黏液呈紫色。
2.6 脾脏指数和结肠长度
DSS诱导的UC小鼠模型表现为结肠长度的缩短,同时过度的炎症反应会导致脾脏质量增大。按照动物伦理相关要求对小鼠处死后,取出肛门至盲肠末端的结肠,PBS冲洗后用直尺测量长度。小心剥离脾脏,滤纸吸去血液后称定质量,记录并计算脾脏指数。
脾脏指数=脾脏湿质量/体质量
2.7 ELISA法检测结肠组织中炎症因子水平
取各组小鼠结肠组织,加入PBS,用匀浆器匀浆,3000 r/min离心20 min,收集上清,按试剂盒说明书测定促炎因子IL-6、IL-1β、TNF-α及抗炎因子IL-10含量和MPO活性。
2.8 免疫组化法检测结肠组织中Ki67蛋白表达
各组小鼠结肠组织石蜡切片脱蜡至水,3%过氧化氢封闭10 min,EDTA抗原修复缓冲液(pH 9.0)微波辐射进行修复,牛血清白蛋白封闭后,滴加Ki67抗体,4 ℃孵育过夜;滴加二抗,37 ℃孵育30 min,加入DAB显色剂,显色完全后,自来水冲洗,苏木素复染,1%盐酸乙醇分化,自来水冲洗,氨水返蓝,流水冲洗,脱水封片。在显微镜下观察,用Image J软件定量分析阳性细胞数。
2.9 免疫荧光法检测结肠组织中Lgr5+ ISCs数
取各组小鼠结肠组织石蜡切片脱蜡至水,加入EDTA抗原修复缓冲液(pH 8.0),于微波炉进行抗原修复,随后加入自发荧光淬灭剂5 min,流水冲洗10 min,加入牛血清白蛋白孵育30 min,滴加Lgr5抗体,4 ℃孵育过夜。洗涤后,滴加二抗,DAPI复染细胞核,封片,在荧光倒置显微镜下观察并拍照。DAPI紫外激发波长330~380 nm,发射波长420 nm,发蓝光;FITC激发波长465~495 nm,发射波长515~555 nm,发绿光。
2.10 Western blotting检测结肠组织中Notch、Atoh1、MUC2和Hes1蛋白表达
取各组小鼠结肠组织,加入含有1% PMSF的预冷的RIPA裂解缓冲液,匀浆后,4 ℃、12 000 r/min离心15 min,收集上清液。用BCA法测定蛋白浓度。蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,用5%脱脂牛奶室温封闭2 h,分别加入一抗(1∶1000),4 ℃孵育过夜;TBST洗膜4次,每次8 min,加入二抗(1∶1000),室温孵育2 h,TBST洗膜后,加入ECL化学发光液显影,用Image J软件进行灰度分析。
2.11 统计学分析

3 结果
3.1 白头翁汤对UC小鼠DAI评分和体质量的影响
对照组小鼠毛发光滑,黑亮光泽明显,饮水饮食正常,体质量呈平稳的上升趋势,活动状态良好,粪便呈紧实棕黄色,无腹泻、血便等。模型组小鼠在自由饮用2.5% DSS 3 d后,出现倦怠懒动、精神萎靡、毛发凌乱、食欲减弱现象,随着时间的增加,DAI评分显著增加(<0.001,图1-A),体质量显著下降(<0.001,图1-B),出现大量稀水样鲜红粪便。给予白头翁汤和美沙拉嗪治疗后,小鼠症状均较模型组有所改善,DAI评分明显降低(<0.01、0.001),体质量明显升高(<0.05、0.01)。
3.2 白头翁汤对UC小鼠脾脏指数和结肠长度的影响
对照组结肠组织肠壁纹理清晰,黏膜光滑,颜泽棕黄,无红色充血溃疡,无黏连。如图2所示,与对照组比较,模型组小鼠结肠长度显著缩短(<0.001),脾脏指数明显升高(<0.001),且结肠色泽呈现黑红色。给予白头翁汤和美沙拉嗪治疗后,小鼠结肠长度显著增加(<0.01、0.001);白头翁汤低剂量组和美沙拉嗪组小鼠脾脏指数均明显降低(<0.05)。
3.3 白头翁汤对UC小鼠结肠组织病理的影响
如图3所示,对照组小鼠结肠黏膜上皮完整、隐窝结构正常、固有层腺体呈整齐且紧密排列,无炎性细胞浸润、充血、水肿和溃疡的形成,为正常结肠黏膜。模型组小鼠结肠组织中杯状细胞严重丢失,黏膜上皮破损,腺体排列紊乱,隐窝结构被严重破坏,并出现大量炎性细胞浸润。各给药组结肠病理情况有所改善,隐窝破坏程度较小,保持较好的结肠组织上皮的完整性,炎症细胞浸润减少,以及腺体排列较为整体。白头翁汤低剂量组结肠组织有少量的淋巴浸润,而白头翁汤高剂量组相比白头翁汤低剂量组结肠中间位置有较多炎性浸润。

与对照组比较:##P<0.01 ###P<0.001;与模型组比较:*P<0.05 **P<0.01 ***P<0.001,下图同

图2 白头翁汤对UC小鼠结肠长度和脾脏指数的影响(, n = 5)
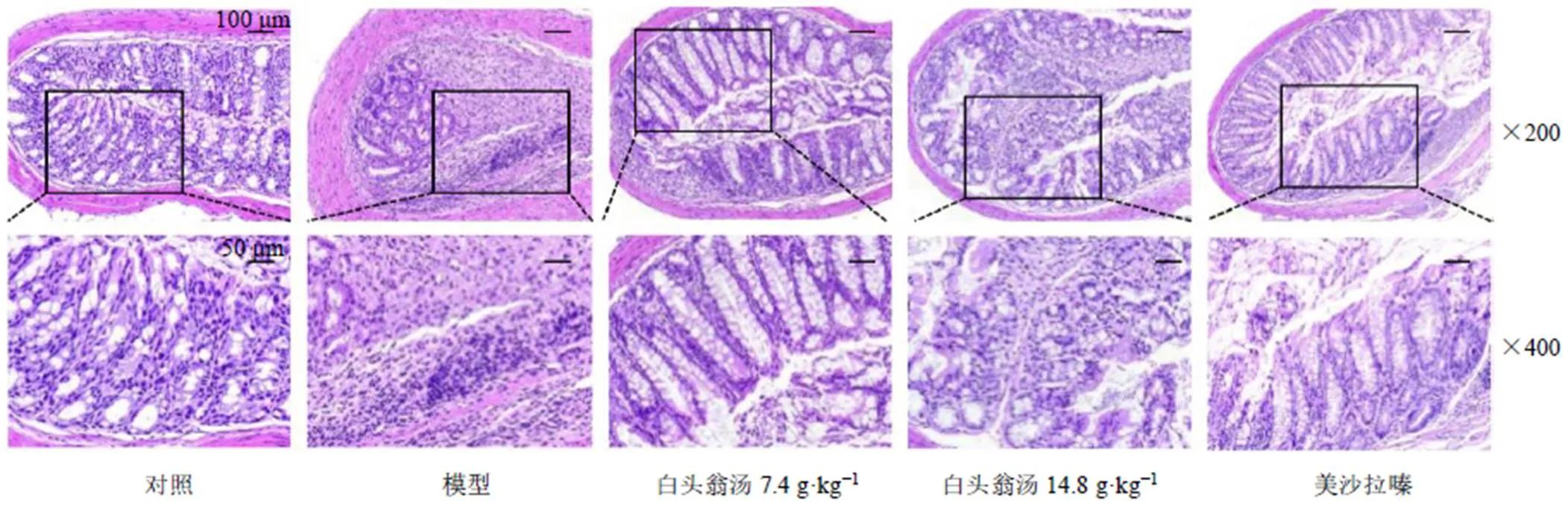
图3 白头翁汤对UC小鼠结肠组织病理变化的影响(HE)
3.4 白头翁汤对UC小鼠结肠黏液屏障的影响
如图4所示,对照组隐窝结构明显,每个隐窝里存在大量的杯状细胞,并有黏蛋白从杯状细胞分泌,结肠上皮细胞覆盖着较厚的黏液层,黏液均连续完整。模型组小鼠的成熟杯状细胞严重缺失,每个隐窝的杯状细胞数量明显减少,黏液层破坏。给予白头翁汤和美沙拉嗪后,显著改善了DSS引起的杯状细胞和黏蛋白的大量消耗。白头翁汤低剂量组对黏液屏障的保护作用较美沙拉嗪更加明显,美沙拉嗪组小鼠黏液蛋白聚集在隐窝内,而没有分泌出去形成连续的黏液层。
3.5 白头翁汤对UC小鼠结肠组织中炎症因子水平的影响
MPO来源于中性粒细胞,是中性粒细胞浸润的标志。如表2所示,与对照组比较,模型组小鼠结肠组织IL-6、TNF-α、IL-1β水平和MPO活性均显著升高(<0.01、0.001),IL-10水平显著降低(<0.01);与模型组比较,各给药组TNF-α、IL-1β水平和MPO活性均显著降低(<0.05、0.01),白头翁汤低剂量组IL-10水平显著升高(<0.05),美沙拉嗪组IL-6水平显著降低(<0.05)。
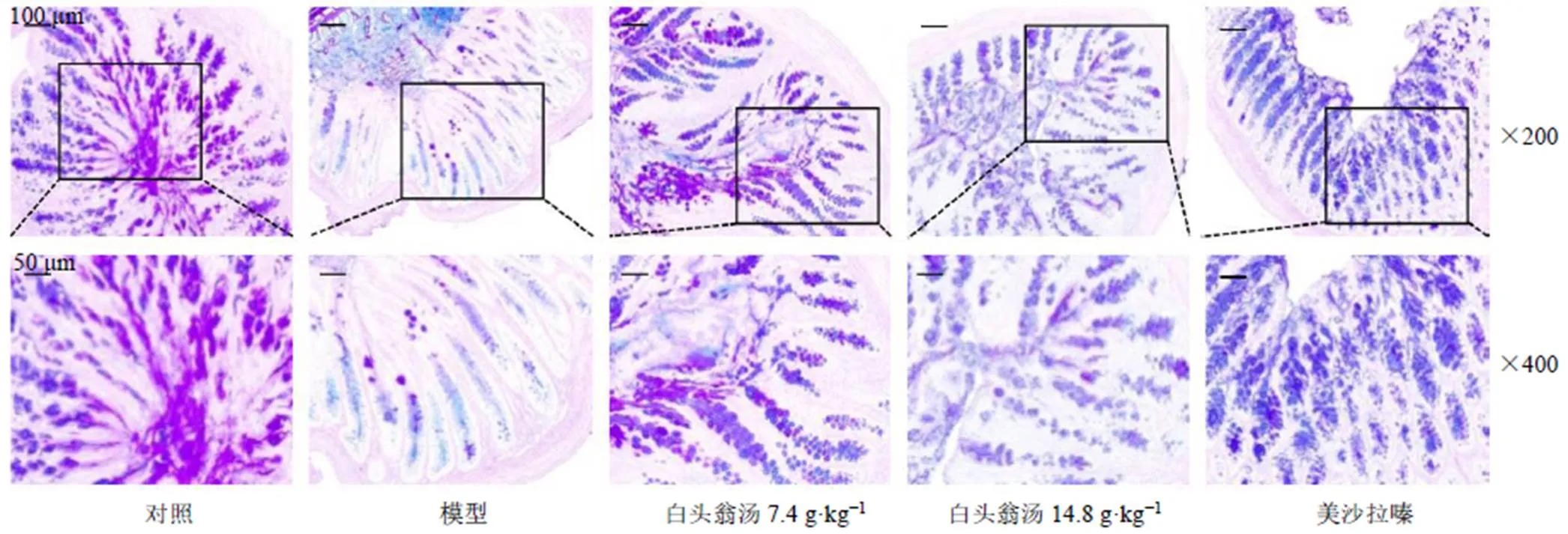
图4 白头翁汤对UC小鼠结肠组织MUC2蛋白表达的影响

表2 白头翁汤对UC小鼠结肠组织炎症因子水平的影响(, n = 5)
与对照组比较:##<0.01###<0.001;与模型组比较:*<0.05**<0.01
##< 0.01###< 0.001control group;*< 0.05**< 0.01model group
3.6 白头翁汤对UC小鼠结肠组织Ki67蛋白表达的影响
如图5所示,与对照组比较,模型组小鼠结肠组织中Ki67阳性细胞(棕黄色)明显减少(<0.001),说明模型组小鼠结肠组织细胞增殖能力较弱;与模型组比较,美沙拉嗪组和白头翁汤低剂量组Ki67阳性细胞显著增加(<0.05、0.01),说明白头翁汤能够改善UC小鼠结肠细胞的增殖能力。
3.7 白头翁汤对UC小鼠结肠组织Lgr5+ ISCs的影响
如图6所示,模型组小鼠结肠组织中Lgr5+ISCs减少,说明模型组ISCs增殖和分化能力降低,分泌型细胞不能得到持续的更新,杯状细胞耗竭;给予美沙拉嗪和白头翁汤治疗后,Lgr5+ISCs的数量减少情况得到缓解,说明白头翁汤保护了UC小鼠ISCs免受破坏。

图5 白头翁汤对UC小鼠结肠组织Ki67蛋白表达的影响(, n = 3)
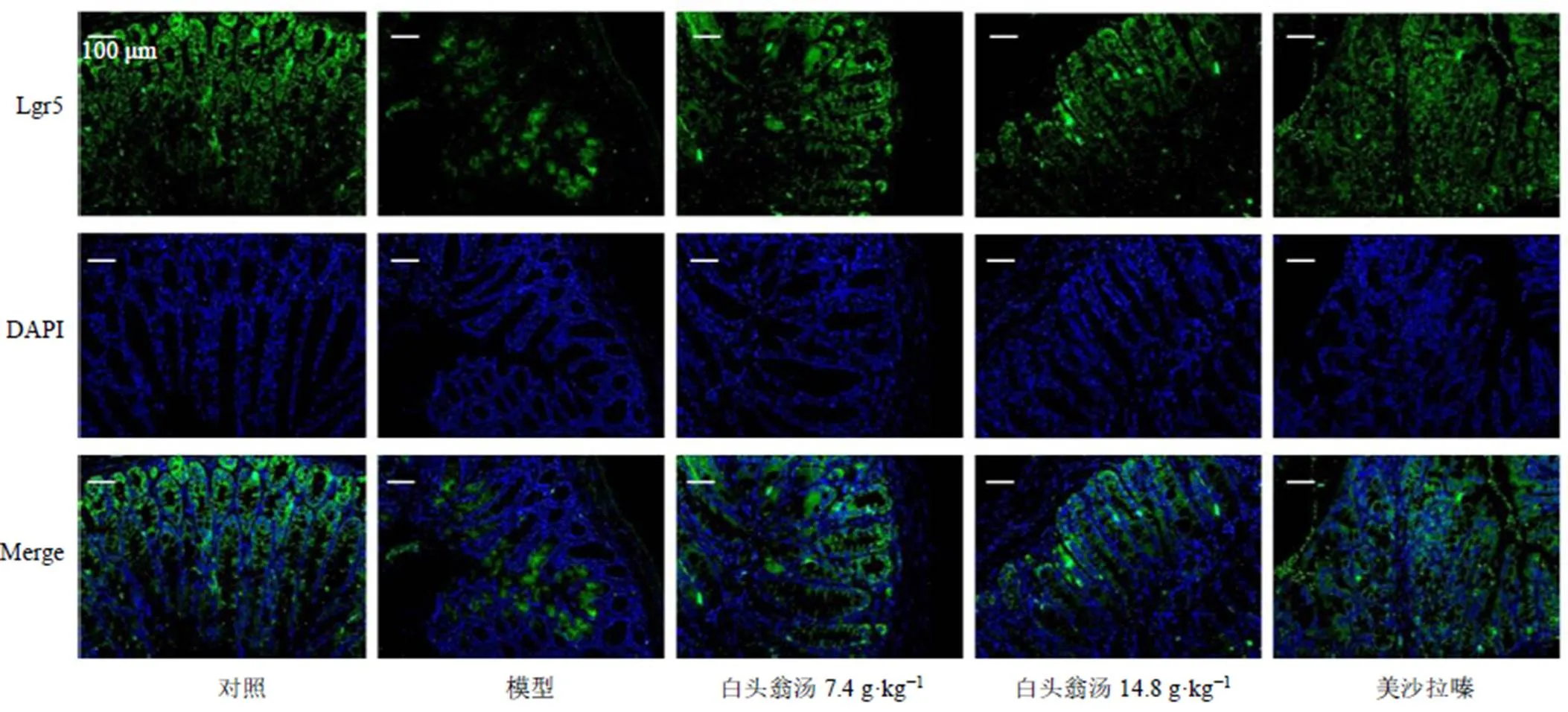
图6 白头翁汤对UC小鼠结肠组织Lgr5+ ISCs表达的影响 (×200)
3.8 白头翁汤对UC小鼠结肠组织Notch、Hes1、Atoh1和MUC2蛋白表达的影响
如图7所示,与对照组比较,模型组结肠组织Notch1和Hes1蛋白表达水平均明显升高(<0.01、0.001),说明DSS诱导的UC小鼠Notch信号通路被激活,而下游Atoh1和MUC2蛋白表达水平显著降低(<0.001);与模型组比较,各给药组Notch1和Hes1蛋白表达水平均明显降低(<0.05、0.001),白头翁汤低剂量组和美沙拉嗪组Atoh1和MUC2蛋白表达水平显著升高(<0.05、0.01)。表明白头翁汤可能通过抑制Notch信号通路来增强黏液屏障的功能。
4 讨论
本研究进一步证实了白头翁汤对UC小鼠的治疗作用,发现白头翁汤可以降低UC小鼠结肠MPO、IL-6、IL-1β和TNF-α水平,促进IL-10的表达抑制炎症。本研究还发现白头翁汤具有改善黏液屏障功能,主要体现在白头翁汤可以增加杯状细胞MUC2的分泌并增厚黏液层,减少由DSS诱导Lgr5+ISCs的损失。白头翁汤影响了Notch-1/Hes1/Atoh1信号通路,该通路的激活可能抑制了ISCs增殖以及向分泌型细胞的分化,进而导致杯状细胞的耗竭(图8,由figdraw绘图)。
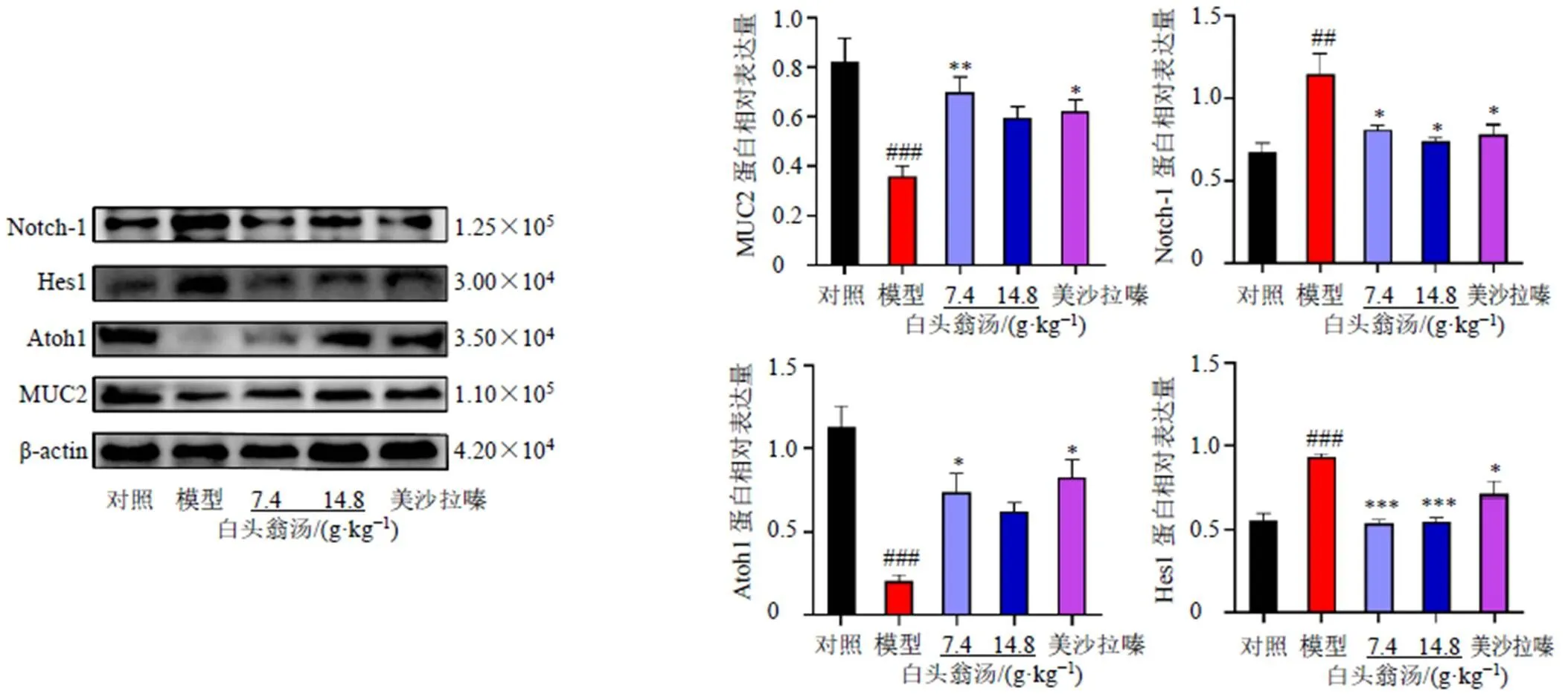
图7 白头翁汤对UC小鼠结肠组织Notch-1信号通路相关蛋白表达的影响(, n = 3)
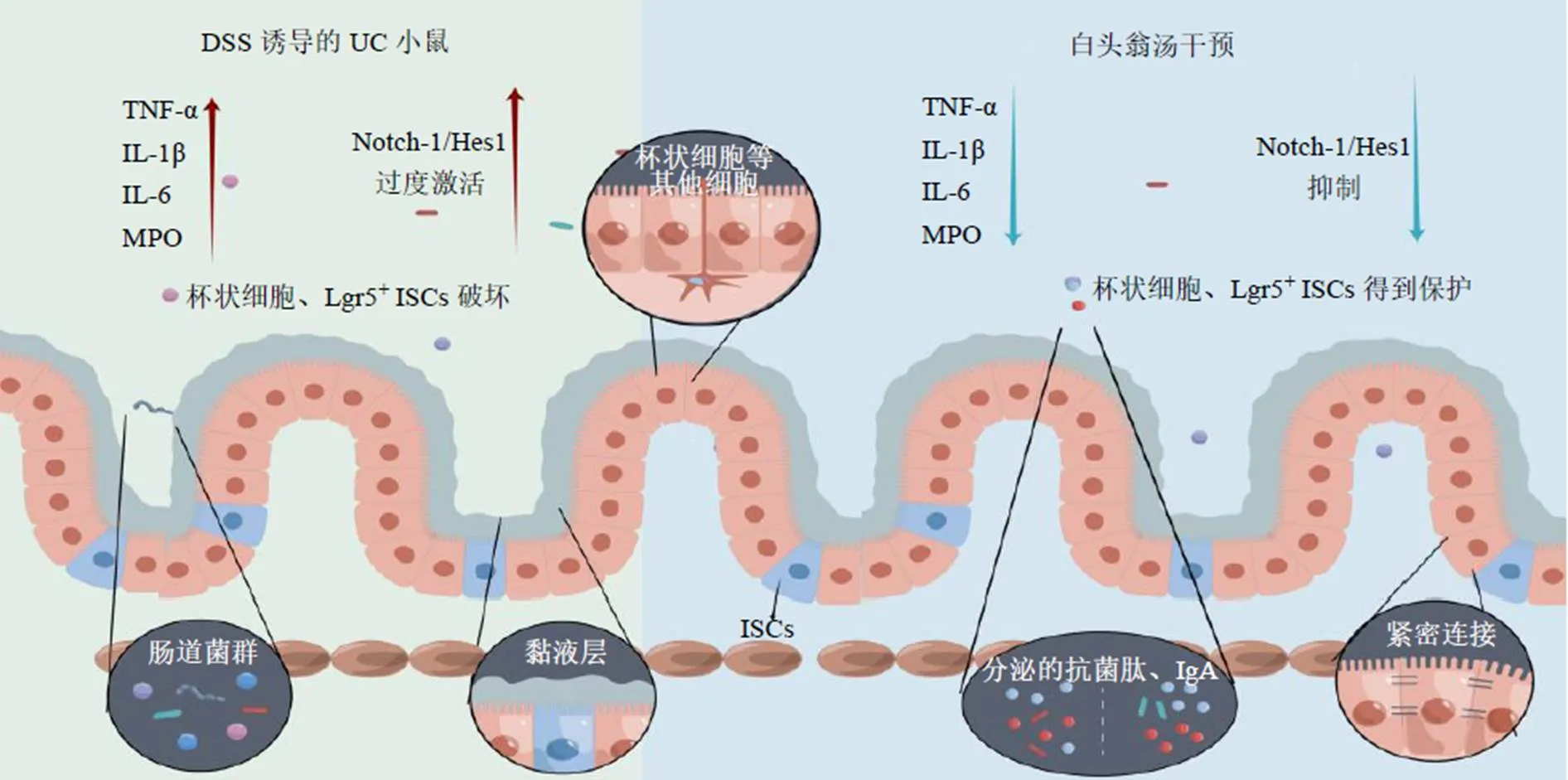
图8 白头翁汤通过调控Notch-1信号通路治疗UC小鼠
完整的肠屏障功能对于肠道稳态至关重要[21-22]。肠屏障主要由以黏液层为主的化学屏障、上皮细胞构成的机械屏障和固有层构成的免疫屏障3部分组成[23]。黏液层是肠道屏障的重要组成部分,保护肠上皮细胞免受肠腔病原体的侵袭。黏液屏障约由30种核心蛋白组成,主要包括黏蛋白、抗菌肽和免疫球蛋白A(immunoglobulin A,IgA),其中杯状细胞合成的MUC2是构成黏蛋白最基本的骨架[24]。在UC患者以及UC小鼠模型中,细菌可以穿透结肠内黏液层[25-26]。另有报道表明基因敲除小鼠由于肠道微生物和肠道上皮细胞直接接触,会自发发生结肠炎[10]。结肠组织AB-PAS染色显示,白头翁汤可以恢复DSS诱导的杯状细胞的破坏以及黏蛋白的耗竭。
Lgr5+ISCs的增殖和分化对于维持黏液层的完整性扮演着重要角色[27-29]。Lgr5+ISCs具有高度的自我更新和高分化潜力。由于UC病情的反复发作,伤及隐窝结构,位于隐窝底部的Lgr5+ISCs则会迁移至伤口处,更新肠道上皮细胞,生成特定的分泌型杯状细胞和潘氏细胞,维持受损肠黏膜上皮细胞的更新、再生和修复[30]。在不同的结肠炎造模方式中,DSS造模能够呈剂量相关性地破坏Lgr5+ISCs[28]。在自发引起结肠炎的敲除小鼠结肠组织中,Lgr5+ISCs异常增殖和分化,分泌谱系细胞丢失[18]。Chen等[12]发现肝脏固醇12α-羟化酶(sterol 12α-hydroxylase,CYP8B1)/胆酸通路通过抑制过氧化物酶体增殖物激活受体α依赖的脂肪酸氧化,抑制Lgr5+ISCs再生,并最终促进结肠炎。Ju等[31]发现葡萄外泌体能够诱导Lgr5+ISCs保护小鼠免受DSS诱导的结肠炎。天然植物产物小檗碱可以调节Wnt通路激活Lgr5+ISCs恢复肠稳态[32]。本研究结果证实了白头翁汤能够调节ISCs增殖分化,促进杯状细胞再生保护黏液屏障。
白头翁汤影响Notch信号通路进而维持ISCs平衡分泌型细胞调节黏液屏障可能是发挥功效的原因之一[27,33]。当Notch激活时,Notch胞内域进入细胞核,随后激活转录因子Hes1的表达,Hes1抑制转录因子Atoh1的表达,从而限制肠道干细胞向杯状细胞的分化,导致黏液屏障减弱[34-36]。在UC患者中,Notch信号过度激活[37]。另有研究表明青白汤可以抑制Notch信号恢复黏液屏障功能来缓解UC[38]。本研究发现白头翁汤可能通过调控Notch信号通路,进而可能影响ISCs的增殖和分化。
利益冲突 所有作者均声明不存在利益冲突
[1] 魏玮. 溃疡性结肠炎中西医结合诊疗专家共识 [J]. 中国中西医结合杂志, 2023, 43(1): 5-11.
[2] Krugliak Cleveland N, Torres J, Rubin D T. What does disease progression look like in ulcerative colitis, and how might it be prevented? [J]., 2022, 162(5): 1396-1408.
[3] Kobayashi T, Siegmund B, Le Berre C,. Ulcerative colitis [J]., 2020, 6(1): 74.
[4] Feuerstein J D, Moss A C, Farraye F A. Ulcerative colitis [J]., 2019, 94(7): 1357-1373.
[5] Du L, Ha C. Epidemiology and pathogenesis of ulcerative colitis [J]., 2020, 49(4): 643-654.
[6] Yoon H, Jangi S, Dulai P S,. Incremental benefit of achieving endoscopic and histologic remission in patients with ulcerative colitis: A systematic review and meta-analysis [J]., 2020, 159(4): 1262-1275.
[7] Morampudi V, Graef F A, Stahl M,. Tricellular tight junction protein tricellulin is targeted by the enteropathogeniceffector EspG1, leading to epithelial barrier disruption [J]., 2017, 85(1): e00700-e00716.
[8] Wang Y R, You K Y, You Y,. Paeoniflorin prevents aberrant proliferation and differentiation of intestinal stem cells by controlling C1q release from macrophages in chronic colitis [J]., 2022, 182: 106309.
[9] Yao D B, Dai W L, Dong M,. MUC2 and related bacterial factors: Therapeutic targets for ulcerative colitis [J]., 2021, 74: 103751.
[10] van der Sluis M, de Koning B A, de Bruijn A C,. Muc2-deficient mice spontaneously develop colitis, indicating that MUC2 is critical for colonic protection [J]., 2006, 131(1): 117-129.
[11] Cheng C W, Biton M, Haber A L,. Ketone body signaling mediates intestinal stem cell homeostasis and adaptation to diet [J]., 2019, 178(5): 1115-1131.
[12] Chen L, Jiao T, Liu W,. Hepatic cytochrome P450 8B1 and cholic acid potentiate intestinal epithelial injury in colitis by suppressing intestinal stem cell renewal [J]., 2022, 29(9): 1366-1381.
[13] 申睿, 刘苗, 朱向东, 等. 中医药治疗溃疡性结肠炎实验研究进展 [J]. 中草药, 2018, 49(7): 1721-1725.
[14] 胡静怡, 朱磊, 连紫宇, 等. 白头翁汤对溃疡性结肠炎模型小鼠肠道菌群及短链脂肪酸的影响 [J]. 南京中医药大学学报, 2021, 37(6): 817-822.
[15] 高颖, 王遥, 安佰平, 等. 白头翁汤对放射性肠炎小鼠的抗炎和抗凋亡作用的实验研究 [J]. 时珍国医国药, 2022, 33(4): 827-830.
[16] 王亚东, 徐志庆, 夏丹, 等. 基于NLRP3炎症小体研究白头翁汤正丁醇提取物对白念珠菌定植下小鼠溃疡性结肠炎的作用机制 [J]. 中草药, 2022, 53(13): 3997-4006.
[17] Tian X L, Peng Z L, Luo S P,. Aesculin protects against DSS-Induced colitis though activating PPARγ and inhibiting NF-кB pathway [J]., 2019, 857: 172453.
[18] Wang Y R, You K Y, You Y,. Paeoniflorin prevents aberrant proliferation and differentiation of intestinal stem cells by controlling C1q release from macrophages in chronic colitis [J]., 2022, 182: 106309.
[19] Andújar I, Ríos J L, Giner R M,. Beneficial effect of shikonin on experimental colitis induced by dextran sulfate sodium in BALB/c mice [J]., 2012, 2012: 271606.
[20] Liang L, Xiong Q Q, Kong J X,. Intraperitoneal supplementation of iron alleviates dextran sodium sulfate-induced colitis by enhancing intestinal barrier function [J]., 2021, 144: 112253.
[21] Chelakkot C, Ghim J, Ryu S H. Mechanisms regulating intestinal barrier integrity and its pathological implications [J]., 2018, 50(8): 1-9.
[22] 谢晶日, 陈善涛, 刘芝伟. 溃疡性结肠炎发病机制研究进展 [J]. 海南医学院学报, 2022, 28(23): 1835-1840.
[23] Dong L J, Xie J W, Wang Y Y,. Mannose ameliorates experimental colitis by protecting intestinal barrier integrity [J]., 2022, 13(1): 4804.
[24] Gustafsson J K, Johansson M E V. The role of goblet cells and mucus in intestinal homeostasis [J]., 2022, 19(12): 785-803.
[25] Fang J, Wang H, Zhou Y P,. Slimy partners: The mucus barrier and gut microbiome in ulcerative colitis [J]., 2021, 53(5): 772-787.
[26] Goyal N, Rana A, Ahlawat A,. Animal models of inflammatory bowel disease: A review [J]., 2014, 22(4): 219-233.
[27] Zheng L, Duan S L, Wen X L,. Molecular regulation after mucosal injury and regeneration in ulcerative colitis [J]., 2022, 9: 996057.
[28] Girish N, Liu C Y, Gadeock S,. Persistence of Lgr5+colonic epithelial stem cells in mouse models of inflammatory bowel disease [J]., 2021, 321(3): G308-G324.
[29] Goto N, Goto S, Imada S,. Lymphatics and fibroblasts support intestinal stem cells in homeostasis and injury [J]., 2022, 29(8): 1246-1261.
[30] 李叶华, 陈晔光. 肠上皮干细胞研究进展 [J]. 中国科学: 生命科学, 2018, 48(7): 713-720.
[31] Ju S W, Mu J Y, Dokland T,. Grape exosome-like nanoparticles induce intestinal stem cells and protect mice from DSS-induced colitis [J]., 2013, 21(7): 1345-1357.
[32] Luo Z C, Li Z H, Liang Z,. Berberine increases stromal production of Wnt molecules and activates Lgr5+stem cells to promote epithelial restitution in experimental colitis [J]., 2022, 20(1): 287.
[33] Ludikhuize M C, Meerlo M, Gallego M P,. Mitochondria define intestinal stem cell differentiation downstream of a FOXO/Notch axis [J]., 2020, 32(5): 889-900.
[34] Shinoda M, Shin-Ya M, Naito Y,. Early-stage blocking of Notch signaling inhibits the depletion of goblet cells in dextran sodium sulfate-induced colitis in mice [J]., 2010, 45(6): 608-617.
[35] Zheng X, Tsuchiya K, Okamoto R,. Suppression of hath1 gene expression directly regulated by hes1 via Notch signaling is associated with goblet cell depletion in ulcerative colitis [J]., 2011, 17(11): 2251-2260.
[36] 夏青松, 徐丽君, 陈广, 等. 信号分子通路网络对肠干细胞增殖和分化的调控 [J]. 生理科学进展, 2020, 51(4): 305-310.
[37] Okamoto R, Tsuchiya K, Nemoto Y,. Requirement of Notch activation during regeneration of the intestinal epithelia [J]., 2009, 296(1): G23-G35.
[38] Lin J C, Wu J Q, Wang F,. QingBai Decoction regulates intestinal permeability of dextran sulphate sodium-induced colitis through the modulation of notch and NF-κB signaling [J]., 2019, 52(2): e12547.
Protective effect of Baitouweng Decoction on intestinal mucus barrier in mice with ulcerative colitis based on Notch signaling pathway
LIU Wei1, 3, LIU You-qian2, JIANG Cui-hua1, 3, ZHANG Dong-jian1, 3, FANG Yu-xi1, 3, GONG Min1, 4, LI Yin-qing5, WANG Tian-tian5, ZHANG Jian1, 2, 3
1. School of Third Clinical Medicine, Nanjing University of Chinese Medicine, Nanjing 210028, China 2. Nanjing Lishui District Hospital of Traditional Chinese Medicine, Nanjing 211200, China 3. Affiliated Hospital of Integrated Traditional Chinese and Western Medicine, Nanjing University of Chinese Medicine, Nanjing 210028, China 4. School of Traditional Chinese Pharmacy, China Pharmaceutical University, Nanjing 210009, China 5. HeBei Yuzhilin Pharmaceutical Co., Ltd., Shijiazhuang 050000, China
To explore the protective effect of Baitouweng Decoction (白头翁汤, BTWD) on intestinal mucus barrier in mice with ulcerative colitis (UC) induced by dextran sodium sulfate (DSS) and its effect on Notch pathway.C57BL/6 mice were randomly divided into control group, model group, mesalazine (50 mg/kg) group and BTWD low-, high-dose (7.4, 14.8 g/kg) groups. The mice in control group were free to drink pure water, and the other groups were free to drink 2.5% DSS solution for 8 d to induce UC model. At the same time, each group was given corresponding drugs. The body weight, fecal consistency and bloody stool of mice were recorded every day. HE staining was used to observe the pathological changes of colon tissue. The secretion of mucin 2 (MUC2) in colon tissue was observed by AB-PAS staining. The activity of myeloperoxidase (MPO) and contents of pro-inflammatory factors interleukin-6 (IL-6), IL-1β, tumor necrosis factor-α (TNF-α) and anti-inflammatory factor IL-10 in colon tissue were detected by ELISA. The expression of Ki67 in colon tissue was detected by immunohistochemistry. The number of positive cells of leucine-rich repeat-containing G-protein-coupled receptor 5 (Lgr5+) intestinal stem cells (ISCs) in colon tissue was determined by immunofluorescence. Western blotting was used to detect Notch-1, Atoh1, Hes1 and MUC2 protein expressions in colon tissue.Compared with model group, BTWD alleviated the decrease of body weight and increase of disease activity index (DAI) in UC mice induced by DSS (< 0.05, 0.01, 0.001), alleviated the shortening, edema and pathological damage of colon tissue (< 0.01, 0.001), reduced the infiltration of inflammatory cells, destruction of crypts and goblet cells, decreased MPO activity and IL-1β, TNF-α levels in colon tissue (< 0.05, 0.01), increased IL-10 level (< 0.05), increased the number of Ki67 positive cells in colon tissue (< 0.01), promoted the secretion of MUC2 and the number of Lgr5+ISCs positive cells, down-regulated Notch and Hes-1 protein expressions (< 0.05, 0.001), up-regulated Atoh1 and MUC2 protein expressions (< 0.05, 0.01).BTWD can reduce the level of pro-inflammatory cytokines in colon tissue of UC mice, increase the proliferation and differentiation of Lgr5+ISCs, protect crypt and goblet cell structure, and promote the secretion of MUC-2, which may be related to the regulation of Notch-1/Atoh1/Hes1 pathway.
Baitouweng Decoction; ulcerative colitis; intestinal stem cells; mucus barrier; Notch signaling pathway; pulchinenoside B4; phellodendrine; berberine; epiberberine; coptidine; palmatine; esculin; esculetin
R285.5
A
0253 - 2670(2023)16 - 5257 - 10
10.7501/j.issn.0253-2670.2023.16.014
2023-03-21
南京市卫生科技发展专项资金项目(YKK22241)
刘 伟(1996—),男,硕士研究生,研究方向为中药药理学。E-mail: lw20201239@163.com
张 健(1973—),男,博士,研究员,硕士生导师,研究方向为中药化学。E-mail: zhangjian@jsatcm.com
[责任编辑 李亚楠]
