补阳还五汤合参芪地黄汤化裁对Ⅲ-Ⅳ期糖尿病肾病的临床疗效及肾小管损伤的保护作用
2023-08-18王月华刘利飞黄家安陈志强
王月华,杨 帆,马 赟,郭 帅,刘利飞,黄家安,陈志强, *
补阳还五汤合参芪地黄汤化裁对Ⅲ-Ⅳ期糖尿病肾病的临床疗效及肾小管损伤的保护作用
王月华1,杨 帆1,马 赟2,郭 帅3,刘利飞1,黄家安1,陈志强1, 2*
1. 河北中医药大学,河北 石家庄 050091 2. 河北省中医院,河北 石家庄 050017 3. 河北医科大学第三医院,河北 石家庄 050051
观察补阳还五汤合参芪地黄汤化裁治疗气阴两虚、络脉瘀阻证糖尿病肾病(diabetic kidney disease,DKD)Ⅲ-Ⅳ期患者临床疗效及对肾小管损伤的保护作用。将132例符合纳入标准的DKD患者分为对照组和中药组,各66例。对照组给予西医基础治疗并联合恩格列净片,中药组在对照组基础上联合补阳还五汤合参芪地黄汤化裁方,两组患者连续用药12周。观察两组患者临床疗效,比较两组患者治疗前后中医证候积分、糖尿病生存质量特异性量表(diabetes specific quality of life scale,DSQL)评分、糖脂代谢指标、肾功能指标、肾小管损伤指标、炎症因子的表达及不良反应的发生率。中药组的总有效率(87.93%)明显高于对照组(75.00%)(<0.05)。治疗后,两组患者的中医证候积分、DSQL评分、糖脂代谢指标、肾小管损伤指标、炎症因子的表达显著降低,血白蛋白(albumin,ALB)明显升高(<0.05),以中药组的中医证候积分、DSQL评分、肾小管损伤指标、炎症因子的表达降低更明显(<0.05)。此外,与治疗前相比,治疗后对照组血尿素氮(urea nitrogen,BUN)、血肌酐(creatinine,Scr)无明显差异(>0.05),而中药组BUN、Scr明显降低(<0.05);治疗后两组比较,BUN、Scr差异有统计学意义(<0.05)。两组不良反应发生率差异无统计学意义(>0.05)。补阳还五汤合参芪地黄汤化裁治疗DKD的疗效确切,可有效地降低患者尿蛋白排泄,调节糖脂代谢紊乱,抑制炎症因子表达,改善肾脏损伤,延缓DKD进展,且安全性良好。
糖尿病肾病;补阳还五汤;参芪地黄汤;临床疗效;肾小管损伤
糖尿病肾病(diabetic kidney disease,DKD)是糖尿病常见而严重的微血管并发症之一[1]。据估计到2040年,全世界范围内将会有6.42亿人罹患糖尿病,其中30%~40%患者将会发展为DKD[2]。DKD起病缓慢,当患者出现临床蛋白尿,其肾脏病理损害将无法逆转,且病情发展迅速,很快进展至终末期肾病,最终行肾脏替代治疗[3]。目前DKD的治疗仍仅以控制血糖、血脂、血压及对症支持治疗为主,虽然近年来几种新型降糖类药物如钠-葡萄糖协同转运蛋白2抑制剂、胰高血糖素样肽1受体激动剂以及内皮素受体拮抗剂显示出一定的肾脏保护作用,但糖尿病患者进展至肾脏疾病的风险仍然很高[4]。
中医药学在防治DKD进展中显示出巨大的优势。临床实践发现补阳还五汤合参芪地黄汤化裁能有效改善早期DKD患者的临床症状。基于此,本研究进一步观察了补阳还五汤合参芪地黄汤化裁治疗早期DKD患者的临床疗效及对DKD患者的糖脂代谢及肾小管损伤标志物等指标的影响,为进一步研究其作用机制提供临床依据。
1 资料与方法
1.1 样本量估算、病例来源及方案设计
按照中药组与对照组比例为1∶1的研究方法,依据样本推算公式[5]预估每组需要病例数55例,考虑研究患者的依从性问题,以20%的失访率计算,每组需要66例患者,共需132例患者。
选取2020年1月—2022年1月于河北医科大学第三医院、河北中医学院、河北省中医院就诊的门诊及住院DKD患者132例。应用分层随机化分组方法将纳入病例随机分为对照组和中药组,各66例。考虑到本研究非注册性临床,不设盲。患者在入组前均向其说明试验方案、目的和过程,并签署知情同意书。本研究已获得河北中医药大学伦理委员会审核批准(伦理编号YXLL202203013),符合医学伦理要求。
1.2 诊断及筛选标准
1.2.1 西医诊断标准 2型糖尿病诊断标准依据《中国2型糖尿病防治指南(2020年版)》[6]。DKD诊断标准依据《糖尿病肾脏疾病临床诊疗中国指南》[7],分期方法依据Mogensen分期制定[8]。
1.2.2 中医辨证标准 依据《消渴病中医分期辨证与疗效评定标准》[9],符合气阴两虚、络脉瘀阻证:倦怠乏力,少气懒言,口渴咽干,自汗,五心烦热,大便干,局部刺痛、固定、夜间加重,或肢体麻木,口唇紫暗,舌质暗红,舌下络脉迂曲,苔薄,脉细。
1.2.3 纳入标准 ①明确诊断为Ⅲ期和Ⅳ期DKD患者;②年龄30~70岁,性别不限;③辨证分型属于气阴两虚、络脉瘀阻证;④自愿参与本研究并签署知情同意书。
1.2.4 排除标准 ①明确诊断为1型糖尿病患者;②合并其他慢性肾脏病者,如免疫球蛋白A(immunoglobulin A,IgA)肾病、膜性肾病、局灶节段性肾小球硬化症等;③反复发作的尿路感染患者;④患有恶性肿瘤及严重心、脑、肺等重要脏器功能障碍者;⑤妊娠及哺乳期女性;⑥正在参与其他临床试验的患者;⑦存在认知功能障碍,无法配合研究者。
1.2.5 脱落及剔除标准 入选病例依从性较差,在治疗期间未按医嘱规律服药,或在治疗过程中同时参与其他临床试验及其他治疗方法者;患者治疗过程中未按要求定期复查,缺乏相应基线资料或复诊资料,无法对病情变化进行评估;病情恶化加重不宜继续接受治疗者。
1.3 干预措施
对照组给予西医基础治疗,主要包括控制血糖、血压,低盐低脂优质蛋白糖尿病饮食,抗血小板聚集,调脂、调节水电解质酸碱平衡等基础治疗,但不予中成类药物。其中降糖治疗在原方案的基础上加用恩格列净片(上海勃林格殷格翰药业有限公司,国药准字J20171073,生产批号C62554),每次10 mg,1次/d,口服;降压药物首选厄贝沙坦片(杭州赛诺菲制药有限公司,国药准字J20130049,生产批号AA329),每次150 mg,1次/d,口服,如血压正常者仍予厄贝沙坦片口服,如血压控制不佳则联合其他类降压药物,连续治疗12周。
中药组在对照组治疗基础上给予阳还五汤合参芪地黄汤化裁治疗。具体药物:生黄芪30 g(批号0093253)、当归10 g(批号0093103)、赤芍10 g(批号0113103)、桃仁10 g(批号0096363)、地龙12 g(批号0106443)、炒僵蚕10 g(批号0090403)、蝉蜕6 g(批号9126463)、太子参15 g(批号0111323)、白术10 g(批号0113073)、茯苓15 g(批号1307013)、泽兰10 g(批号0092583)、熟地黄15 g(批号0101963)、炒山药15 g(批号0090453)、牡丹皮10 g(批号0113783)、山茱萸10 g(批号0102693),1剂/d,分2次冲服,连续口服12周。补阳还五汤合参芪地黄汤化裁颗粒剂由广东一方颗粒药业有限公司生产。中药配方颗粒是以中药饮片为原材料,采用现代工艺经过提取、分离、浓缩、干燥、制粒而成,且符合2021年版《中药配方颗粒质量控制与标准制定技术要求》的规定。
1.4 观察指标
1.4.1 中医证候积分 中医证候积分量表参照《中药新药临床研究指导原则(试行)》制定[10]。根据患者临床症状的轻重程度,按无、轻、中、重分别计0、1、2、3分;根据舌脉的有无分别计0、1分。
1.4.2 实验室生化指标 晨起6:00~7:00时采集肘静脉血5 mL,然后早餐后2 h再次采集肘静脉血5 mL,采用全自动血液生化分析仪检测空腹血糖(fasting blood glucose,FBG)、餐后2 h血糖(2-hour postprandial blood glucose,2hPG)、糖化血红蛋白(glycosylated hemoglobin,HbA1c)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、尿素氮(urea nitrogen,BUN)、肌酐(creatinine,Scr)、血白蛋白(albumin,ALB)水平,并计算患者尿白蛋白排泄率(urinary albumin excretion rate,UAER)。
1.4.3 肾小管损伤指标 晨起6:00~7:00时采集肘静脉血5 mL,静置后分离血清,采用酶联免疫吸附法测定血清肾损伤分子1(kidney injury molecule 1,KIM-1)的含量。晨起6:00~7:00时留取患者中段尿10 mL,采用酶联免疫吸附法测定尿中-乙酰-β--氨基葡萄糖苷酶(-acetyl-β--glucosaminidase,NAG)含量。KIM-1试剂盒(批号H436-1-2)均购自南京建成生物工程研究所。NAG试剂盒(批号JN18281)均购自上海纪宁生物有限公司。
1.4.4 炎症因子指标 晨起6:00~7:00时采集肘静脉血5 mL,静置后分离血清,采用酶联免疫吸附法测定血清白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)、转化生长因子-β1(transforming growth factor-β1,TGF-β1)的含量。试剂盒(批号分别为H007-1-1、H052-1-2、H034-2-2)均购自南京建成生物工程研究所。
1.4.5 生存质量评价 患者生活质量评价依据糖尿病生存质量特异性量表(diabetes specific quality of life scale,DSQL)进行评定。该量表共包含24项内容,每项分值1~5分,分值越低则质量越好[11]。
1.5 临床疗效评价标准
参照《临床疾病诊断与疗效判断标准》[12]。治愈:症状体征基本消退,FBG、HbA1c恢复至正常范围,UAER恢复正常或降低≥1/2,肾功能指标恢复正常;好转:症状体征明显好转,FBG、HbA1c有所降低,UAER降低<1/2,肾功能指标恢复正常;无效:未满足上述指标。
总有效率=(治愈例数+好转例数)/总例数
1.6 不良反应观察
观察发热、恶心、皮疹、低血糖等不良反应发生情况。
1.7 统计学处理
2 结果
2.1 基线资料
对照组和中药组分别脱落7例和8例,均因不能坚持服药或在治疗过程中未按要求定期复查予以剔除,最终完成观察病例数为117例,其中对照组59例,中药组58例。对照组女性28例,男性31例,平均年龄(52.89±10.41)岁,III期患者42例,IV期17例;中药组女性27例,男性31例,平均年龄(53.19±10.13)岁,III期患者40例,IV期18例。经统计,两组入选病例在年龄、性别、分期等基线资料方面差异不显著,具有可比性。
2.2 两组临床疗效比较
治疗后,对照组总有效率75.00%,中药组总有效率87.93%,组间比较差异有统计学意义(<0.05),见表1。
表1 两组患者临床疗效比较
Table 1 Comparison on clinical efficacies between two groups
组别n/例治愈/例好转/例无效/例有效率/% 对照5913311575.00 中药5818337 87.93*
与对照组比较:*<0.05
*< 0.05control group
2.3 两组中医证候积分比较
治疗前两组患者的中医证候积分比较差异无统计学意义(>0.05)。治疗后,两组患者的中医证候积分均较治疗前降低(<0.05),且以中药组下降最为明显(<0.05),见表2。
2.4 两组患者血糖、HbA1c水平比较
治疗前两组患者FBG、2hPG、HbA1c水平差异无统计学意义(>0.05)。治疗后,两组患者FBG、2hPG、HbA1c均较治疗前降低(<0.05),而两组间比较差异无统计学意义(>0.05),见表3。
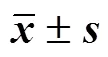
表2 两组患者中医证候积分比较()
与同组治疗前比较:*<0.05;与对照组治疗后比较:#<0.05
*< 0.05same group before treatment;#< 0.05control group after treatment
2.5 两组患者TG、TC、LDL-C比较
治疗前两组患者TG、TC、LDL-C差异无统计学意义(>0.05)。治疗后,两组患者TG、TC、LDL-C均较前降低(<0.05),而两组间比较差异无统计学意义(>0.05),见表4。
2.6 两组患者UAER、ALB、BUN、Scr水平比较
治疗前两组患者UAER、ALB、BUN、Scr差异无统计学意义(>0.05)。与治疗前相比,治疗后两组患者UAER降低,ALB升高(<0.05);与对照组相比,治疗后中药组UAER降低明显(<0.05)。此外,与治疗前相比,治疗后对照组BUN、Scr差异无统计学意义(>0.05),而中药组BUN、Scr明显降低,差异有统计学意义(<0.05);治疗后两组BUN、Scr比较,差异有统计学意义(<0.05),见表5。
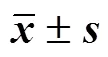
表3 两组患者FBG、2hPG、HbA1c比较()
与同组治疗前比较:*<0.05
*< 0.05same group before treatment
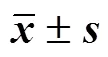
表4 两组患者TG、TC、LDL-C比较()
与同组治疗前比较:*<0.05
*<0.05same group before treatment
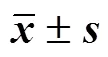
表5 两组患者UAER、ALB、BUN、Scr比较()
与同组治疗前比较:*<0.05;与对照组治疗后比较:#<0.05
*< 0.05same group before treatment;#< 0.05control group after treatment
2.7 两组小管损伤指标比较
治疗前两组患者血清KIM-1、尿NAG差异无统计学意义(>0.05)。治疗后,两组患者血清KIM-1、尿NAG水平均较治疗前降低(<0.05),且中药组肾小管损伤指标下降更明显(<0.05),见表6。
2.8 两组血清炎症因子指标比较
治疗前两组患者血清TNF-α、IL-6、TGF-β1差异无统计学意义(>0.05)。治疗后,两组患者血清TNF-α、IL-6、TGF-β1均较治疗前下降(<0.05),且中药组各项血清炎症因子指标下降更明显(<0.05),见表7。
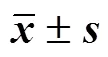
表6 两组患者KIM-1、NAG比较()
与同组治疗前比较:*<0.05;与对照组治疗后比较:#<0.05
*<0.05same group before treatment;#<0.05control group after treatment
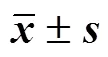
表7 两组患者TNF-α、IL-6、TGF-β1比较()
与同组治疗前比较:*<0.05;与对照组治疗后比较:#<0.05
*< 0.05same group before treatment;#< 0.05control group after treatment
2.9 两组患者生活质量比较
治疗前两组患者DSQL评分差异无统计学意义(>0.05)。治疗后,两组患者的DSQL评分均下降(<0.05),与对照组相比,治疗后中药组DSQL评分降低更明显(<0.05),见表8。
2.10 两组不良反应发生率比较
对照组和中药组的不良反应发生率分别是10.15%和12.06%,差异无统计学意义(>0.05),见表9。
3 讨论
DKD目前已经成为我国中老年人终末期肾病的首要原因[13]。病理变化可表现为肾小球体积变大、基底膜弥漫性增厚、系膜基质及细胞增多,最终出现肾小球硬化及间质纤维化。DKD肾损伤在早期尚处于可逆阶段,然而当出现大量蛋白尿后,患者的肾脏损伤则表现为不可逆的进行性发展。目前的治疗主要以控制血压、血糖,调节血脂,抗血小板聚集等综合治疗为主,但DKD的发病率在过去的20年中并没有下降[14]。中医学认为,糖尿病并发的肾脏损害是由于糖尿病病程日久耗气伤阴,引起瘀血内阻,深入于络所致。因气虚血行迟滞,日久可致血瘀;阴虚津亏血少,脉道不充,血液黏稠不畅,日久亦致血瘀,瘀血不去伏于肾络渐成微小癥积,致使肾体受损,肾用失司,肾失封藏,精微渗漏,导致DKD的发生。鉴于气阴两虚瘀血阻络是DKD的核心病机,因此在治疗上应以益气养阴化瘀通络法为治疗该病的基本方法。补阳还五汤出自《医林改错》,是益气化瘀通络的经典代表方剂,临床研究表明以补阳还五汤为基础的加减方治疗DKD方面疗效显著[15-16]。参芪地黄汤出自《杂病犀烛》为治疗气阴两虚型相关肾脏疾病的常用方剂[17]。以补阳还五合参芪地黄汤化裁治疗DKD正是谨守其气阴两虚络脉瘀阻病机,该方在补阳还五汤和参芪地黄汤基础上,去川芎、红花,加白术、僵蚕、蝉蜕而成。方中以黄芪、太子参、白术、茯苓大补脾胃之元气,令气旺血行,瘀去络通,是为君药;熟地、山药、山萸肉滋阴补肾填精,肾精足肾气生,肾气化则水湿行,为臣药;当归、桃仁甘温质润、养血活血,化瘀而不伤血,同时伍以赤芍、丹皮凉血活血,泽兰活血利水,助丹参、当归活血祛瘀,又可清病邪久留之郁热;久病入络,然络病之瘀多病根深伏,病情顽缠,属沉疴痼疾,非一般草木之品所能取效,必藉以虫类之品搜邪剔络,因虫类之品为血肉之质,又具有动跃攻冲之性,体阴用阳,能深入隧络,直达病所,攻剔痼结之痰瘀,旋转阳动之气,从而使络痹易开,结邪易去。故以地龙、蝉蜕、僵蚕虫类药物逐瘀通络、散结消癥,共为佐使之药。诸药合用补气而不壅滞,活血又不伤正,如此则气旺、瘀消、湿化、络通,诸症向愈。实验研究也表明补阳还五汤合参芪地黄汤化裁可以减轻DKD小鼠的肾组织病理损伤,减轻肾间质纤维化程度[18-19]。
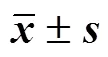
表8 两组患者DSQL评分比较()
与同组治疗前比较:*<0.05;与对照组治疗后比较:#<0.05
*< 0.05same group before treatment;#< 0.05control group after treatment
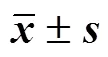
表9 两组不良反应发生率比较()
在DKD发生发展过程中,由于其所处的临床分期不同,其治疗方案也不尽相同,所以DKD临床疗效的评价必须根据其临床分期的不同而进行。本研究的临床疗效评估采用实验室理化指标与中医证候学评价相结合的评定方法,同时进行生活质量评估。研究结果显示,补阳还五汤合参芪地黄汤化裁联合化学药常规治疗对于气阴两虚、络脉瘀阻型Ⅲ-Ⅳ期DKD患者临床疗效显著,并从糖脂代谢指标、肾功能的变化及中医证候积分等方面进行佐证。与治疗前相比,两组DKD患者FBG、2hPG、HbAlc、TG、TC、LDL-C、UAER、DSQL评分、中医证候积分均显著降低,ALB水平升高,但中药组DKD患者UAER、DSQL评分、中医证候积分下降更为显著,同时还可改善患者肾功能,提示补阳还五汤合参芪地黄汤化裁联合化学药常规治疗可有效改善气阴两虚、络脉瘀阻型DKD患者的中医临床症状、糖脂代谢紊乱及肾功能恶化,提高患者生活质量。
既往研究认为,在DKD的发生发展过程中,其主要病理改变主要在肾小球,而肾小管的损伤被认为是继发现象。目前研究则表明,肾小管的病理损伤程度与DKD临床严重程度密切相关,并且肾小管的病变可独立于肾小球的损伤而改变[20],所以有学者也提出肾小管病变是DKD的原动力和关键治疗靶点,肾小管上皮细胞损伤后可导致烟酰胺单核苷酸合成增加,进而引起足细胞损伤,导致肾小球硬化及肾功能下降[21]。KIM-1是位于肾脏近端小管的跨膜蛋白,其在正常肾脏组织中仅微量表达,而在损伤的肾小管上皮细胞中表达明显增强。有研究表明,KIM-1水平的升高可能先于急性肾损伤患者的肾组织的病理学变化,KIM-1水平升高与肾小球滤过率的下降相关。因此,KIM-1可用于肾小管损伤的识别和监测[22]。NAG是一种溶酶体酶,在近端肾小管细胞中以高浓度存在,研究显示尿NAG水平升高反映了肾小管功能障碍,因此NAG水平升高被认为是肾小管损伤的特异性指标[23]。而DKD肾小管损伤与高糖环境刺激、氧化应激、炎症反应等诸多发病机制密切相关[24]。其中炎症正在成为DKD肾小管间质损伤的重要调节剂,从肾小管间质分泌的炎性细胞因子显著加速肾功能衰竭[25]。另外,炎症因子还可促进脂质在肾小管间质中累积,进一步加剧小管间质损伤和DKD进展。本研究结果显示,补阳还五合参芪地黄汤化裁联合化学药常规治疗可显著减低血清KIM-1、尿NAG水平,同时炎症因子TNF-α、IL-6、TGF-β1表达也明显下降。表明补阳还五汤合参芪地黄汤化裁联合化学药常规治疗可以抑制气阴两虚、络脉瘀阻型DKD患者的肾小管损伤进展,延缓肾组织病理损伤的进行性加重。
综上所述,补阳还五合参芪地黄汤化裁联合化学药常规治疗可明显改善Ⅲ期和Ⅳ期DKD气阴两虚、络脉瘀阻证患者的临床症状,调节糖脂代谢紊乱,减少尿蛋白排泄,延缓DKD进展,提高患者的生活质量,与化学药常规治疗比较,疗效更佳,且安全性良好,充分体现了中西医结合治疗的优势。但本研究观察周期较短,且样本病例较少,在未来研究中可延长用药时间同时扩大样本数量,简化中医干预方案,以更好地提高患者的依从性。
利益冲突 所有作者均声明不存在利益冲突
[1] Wei L, Han Y Y, Tu C. Molecular pathways of diabetic kidney disease inferred from proteomics [J]., 2023, 16: 117-128.
[2] Yamazaki T, Mimura I, Tanaka T,. Treatment of diabetic kidney disease: Current and future [J]., 2021, 45(1): 11-26.
[3] Cleveland K H, Schnellmann R G. Pharmacological targeting of mitochondria in diabetic kidney disease [J]., 2023, 75(2): 250-262.
[4] Tuttle K R. The landscape of diabetic kidney disease transformed [J]., 2020, 16(2): 67-68.
[5] 黄悦勤. 临床流行病学 [M]. 第4版. 北京: 人民卫生出版社, 2014: 14.
[6] 陆菊明. 《中国2型糖尿病防治指南(2020年版)》读后感 [J]. 中华糖尿病杂志, 2021, 13(4): 301-304.
[7] 中华医学会肾脏病学分会专家组. 糖尿病肾脏疾病临床诊疗中国指南 [J]. 中华肾脏病杂志, 2021, 37(3): 255-304.
[8] Mogensen C E, Christensen C K, Vittinghus E. The stages in diabetic renal disease. With emphasis on the stage of incipient diabetic nephropathy [J]., 1983, 32(Suppl 2): 64-78.
[9] 吕仁和, 张洁荣, 高彦彬. 消渴病(糖尿病)中医分期辨证与疗效评定标准 [J]. 中国医药学报, 1993, 8(3): 54-56.
[10] 郑筱萸. 中药新药临床研究指导原则: 试行 [M]. 北京: 中国医药科技出版社, 2002: 163-168, 234-237.
[11] 张作记. 行为医学量表手册 [M]. 北京: 中华医学电子音像出版社, 2005: 114.
[12] 湖南省医院协会. 临床疾病诊断与疗效判断标准 [M]. 北京: 科学技术文献出版社, 2010: 253.
[13] Hou J H, Zhu H X, Zhou M L,. Changes in the spectrum of kidney diseases: An analysis of 40, 759 biopsy-proven cases from 2003 to 2014 in China [J]., 2018, 4(1): 10-19.
[14] Sulaiman M K. Diabetic nephropathy: Recent advances in pathophysiology and challenges in dietary management [J]., 2019, 11: 7.
[15] 费佳, 马源, 朱辟疆. 朱辟疆辨治糖尿病肾病经验 [J]. 山东中医药大学学报, 2019, 43(2): 167-170.
[16] 肖遥, 赵进喜. 赵进喜治疗糖尿病肾病经验 [J]. 中华中医药杂志, 2018, 33(1): 159-162.
[17] 邓雨, 于思明. 参芪地黄汤的现代药理研究及肾脏疾病的应用[J/OL]. 辽宁中医杂志. [2023-03-10]. http://kns.cnki.net/kcms/detail/21.1128.R.20230303.1519.020.html.
[18] 郭帅, 白璐, 潘利敏, 等. 补阳还五汤合参芪地黄汤化裁对糖尿病肾病小鼠肾小管间质纤维化的作用及机制研究 [J]. 中草药, 2022, 53(2): 470-477.
[19] 郭帅, 方敬, 郭立芳, 等. 补阳还五汤合参芪地黄汤化裁含药血清对高糖诱导人肾小管上皮细胞株间充质转化的影响及机制研究 [J]. 中国中医基础医学杂志, 2022, 28(8): 1290-1295.
[20] 占志朋, 谢席胜. 肾小管损伤在糖尿病肾病发病机制中的作用研究进展 [J]. 中国中西医结合肾病杂志, 2021, 22(3): 277-279.
[21] Gilbert R E. Proximal tubulopathy: Prime mover and key therapeutic target in diabetic kidney disease [J]., 2017, 66(4): 791-800.
[22] Tanase D M, Gosav E M, Radu S,. The predictive role of the biomarker kidney molecule-1 (KIM-1) in acute kidney injury (AKI) cisplatin-induced nephrotoxicity [J]., 2019, 20(20): 5238.
[23] Allgaier R, Strack C, Wallner S,.-acetyl-b--glucosaminidase: A potential cardiorenal biomarker with a relevant impact on ICD shock therapies and mortality [J]., 2020, 25(12): 888-896.
[24] 郭璇, 张若杰, 张露露, 等. 糖尿病肾病肾小管病变的研究进展 [J]. 临床与病理杂志, 2020, 40(11): 3020-3025.
[25] Hu Z B, Ma K L, Zhang Y,. Inflammation-activated CXCL16 pathway contributes to tubulointerstitial injury in mouse diabetic nephropathy [J]., 2018, 39(6): 1022-1033
Clinical efficacy of Buyang Huanwu Decoction combined with Shenqi Dihuang Decoction in treatment of Ⅲ-Ⅳ stage diabetic kidney disease and its protective effect on renal tubular injury
WANG Yue-hua1, YANG Fan1, MA Yun2, GUO Shuai3, LIU Li-fei1, HUANG Jia-an1, CHEN Zhi-qiang1, 2
1. Hebei University of Chinese Medicine, Shijiazhuang 050091, China 2. Hebei Provincial Hospital of Traditional Chinese Medicine, Shijiazhuang 050017, China 3. The Third Hospital of Hebei Medical University, Shijiazhuang 050051, China
To evaluate the clinical efficacy of Buyang Huanwu Decoction (补阳还五汤) combined with Shenqi Dihuang Decoction (参芪地黄汤) on Ⅲ-Ⅳ stage of diabetic kidney disease (DKD) with-yin deficiency syndrome of collateral blood stasis and its protective effect on renal tubular damage.A total of 132 patients with DKD who met the inclusion criteria were randomly divided into the control group and Chinese medicine group, with 66 cases in each group. The control group was given basic treatment combined with empagliflozin tablets, and the Chinese medicine group was combined with Buyang Huanwu Decoction and Shenqi Dihuang Decoction on the basis of the control group. The patients in the two groups were treated continuously for 12 weeks. The clinical efficacy of the two groups of patients was compared, and the TCM syndrome scores, the diabetes specific quality of life scale (DSQL), glucose and lipid metabolism indexes, renal function indexes, renal tubular injury indexes, the expression of inflammatory factors and the incidence of adverse reactions were observed in the two groups before and after treatment.The total effective rate of the Chinese medicine group (87.93%) was significantly higher than that of the control group (75.00%) (< 0.05). After treatment, the TCM symptom score, DSQL score, glucose and lipid metabolism indexes, renal tubular injury indexes and inflammatory factors in the two groups were significantly decreased, and serum albumin (ALB) was significantly increased (< 0.05). While, the TCM syndrome scores, DSQL scores, renal tubular injury indexes, and inflammatory factors decreased more significantly in the Chinese medicine group (< 0.05). In addition, there was no significant difference in urea nitrogen (BUN) and serum creatinine (Scr) in the control group compared with before treatment, but there were significant differences in BUN and Scr in the Chinese medicine group compared with before treatment (< 0.05).Buyang Huanwu Decoction combined with Shenqi Dihuang Decoction is effective in the treatment of DKD. It can effectively reduce urinary protein excretion, regulate glucose and lipid metabolism disorders, inhibit the expression of inflammatory factors, improve kidney damage, and delay the progression of DKD without increasing adverse drug reactions.
diabetic kidney disease; Buyang Huanwu Decoction; Shenqi Dihuang Decoction; clinical efficacy; renal tubular injury
R285.64
A
0253 - 2670(2023)16 - 5289 - 07
10.7501/j.issn.0253-2670.2023.16.018
2023-03-11
河北省重点研发计划项目(223777150D);河北省教育厅重点项目(ZD2021081);河北省自然科学基金资助项目(H2022423342,H2022423320);河北省中医药管理局科研计划项目(2023119,2023126)
王月华,女,教授,主任医师,主要从事中医药防治肾脏病的基础和临床研究。E-mail: wangyuehua2004@163.com
陈志强,男,教授,主任医师,主要从事中医药防治肾脏病的基础和临床研究。E-mail: chenzhqiang2011@163.com
[责任编辑 潘明佳]
