基于UPLC-Q-TOF/MS技术的大建中汤血清药物化学研究
2023-08-18吴纯洁王家葵
蒋 淼,彭 伟,吴纯洁,王家葵
基于UPLC-Q-TOF/MS技术的大建中汤血清药物化学研究
蒋 淼,彭 伟,吴纯洁*,王家葵*
成都中医药大学药学院,中药标准化教育部重点实验室,西南特色中药资源国家重点实验室,四川 成都 611137
应用血清药物化学方法分析大建中汤入血成分及体外化学成分。采用UPLC-Q-TOF/MS技术快速鉴定大建中汤经大鼠ig给药后吸收入血的原型成分、代谢成分以及体外化学成分,结合UNIFI软件系统分析,根据质谱相对分子质量、裂解规律、文献报道等方法对质谱碎片信息进行分析,表征大建中汤入血成分及体外化学成分。在给药血清中检测出22个入血成分,包括5个原型成分和17个代谢产物,体外分析鉴定得到41个化学成分。UPLC-Q-TOF/MS技术可实现大建中汤体内外化学成分的快速鉴定,且血清中鉴定出的原型成分和代谢产物可能是大建中汤潜在的活性成分,可为其质量控制研究提供依据。
大建中汤;血清药物化学;UPLC-Q-TOF/MS;原型成分;代谢产物;人参皂苷Rg1;羟基-α-山椒素
大建中汤源自张仲景所著《金匮要略》,是中医临床治疗脾胃虚寒证的有效温里剂。大建中汤由蜀椒Maxim.、干姜Rosc.、人参C. A. Meyer、饴糖4味药物组成,具有温中补虚、降逆止痛之功效,主治中阳衰弱、阴寒内盛之脘腹剧痛证。现代研究表明,大建中汤具有改善人体微循环、调节消化系统与脾胃系统等作用,多用于治疗胃肠梗阻性疾病[1-2]。大建中汤是2018年国家中医药管理局公布的《古代经典名方目录(第一批)》100方剂之一,自FDA公布植物药指导后日本开始大量研究,国内医疗机构及研究所也共同进行临床和基础研究,由此可见大建中汤具有较高研究价值[3]。我国目前对大建中汤研究主要集中于临床应用及药理实验研究,对其药效物质基础研究相对薄弱[4]。因此,亟待阐明大建中汤的药效物质基础,为揭示大建中汤临床有效的科学性奠定物质基础。
中药血清药物化学是以鉴别口服中药后血清中原型成分为基础的一种新兴研究方法,在中药药效物质基础研究中得到了广泛的认可与应用。超高效液相色谱联用高分辨飞行时间质谱仪(ultra-high performance liquid chromatography with quadrupole time-of-flight mass spectrometry,UPLC-Q-TOF/MS)具有分离度好、高分辨率、高灵敏度和精确测定相对分子质量等特点,能快速有效的分离及鉴定复杂中药体系中的有效成分,并广泛应用于中药药效物质基础研究领域中。因此,本研究拟应用血清药物化学方法结合UPLC-Q-TOF/MS技术对大建中汤的入血成分进行快速定性分析,为揭示大建中汤药效物质基础提供依据。
1 仪器与材料
1.1 仪器
Acquity UPLC I-class超高效液相色谱仪(美国Waters公司),Xevo G2-XS Q-TOF飞行时间质谱仪(美国Waters公司),Sartorius BSA124S型电子天平(北京赛多利斯科学仪器有限公司),SB5200D型超声清洗仪(宁波新艺超声设备有限公司),TGL-16M型离心机(湖南湘仪离心机仪器有限公司)。
1.2 材料
乙腈(色谱纯,美国Thermo Fisher公司);甲酸(分析纯,美国Thermo Fisher公司);水为屈臣氏蒸馏水;对照品蔗糖(批号MUST-20191001)、鸟苷(批号MUST-20180512)、苯丙氨酸(批号MUST-20191513)、6-姜素(批号MUST-20181311)、绿原酸(批号MUST-20190308)、芦丁(批号MUST-20181219)、水仙苷(批号MUST-20181311)、原花青素B1(批号MUST-20180201)、人参皂苷Rg1(批号MUST-20110810),购于成都曼思特生物科技股份有限公司;羟基-α-山椒素(批号HR1292W2)、槲皮苷(批号HR1106B3)购于宝鸡辰光生物有限公司;所有对照品质量分数均≥95.0%(HPLC-UV检测)。
蜀椒(批号2112121)、干姜(批号2109082)购于四川新荷花中药饮片股份有限公司;人参(批号2012001)购于河北百合健康有限公司;饴糖(批号200401),购于安徽三义堂药业有限公司。经成都中医药大学吴纯洁教授鉴定,均符合《中国药典》相关要求。
1.3 实验动物
清洁级雄性SD大鼠,体质量180~220 g,购于成都达硕实验动物有限公司,合格证号SCXK(川)2015-030,经成都中医药大学实验动物伦理委员会批准(批准号2014 DL-023)。
2 方法
2.1 对照品溶液的制备
各取对照品蔗糖、鸟苷、苯丙氨酸、6-姜素、绿原酸、芦丁、水仙苷、原花青素B1、人参皂苷Rg1、羟基-α-山椒素、槲皮苷以甲醇溶解定容,配制质量浓度约为200 µg/mL的储备液;UPLC-MS检测前以甲醇稀释10倍后,过0.22 µm微孔滤膜过滤,取续滤液,待测。
2.2 大建中汤ig溶液的制备
准确称量蜀椒6 g、干姜12 g、人参6 g置于500 mL纯净水中浸泡30 min,然后煎煮30 min,除去药渣,加入饴糖30 g,浓缩成0.6 g/mL药液,置于4 ℃静置过夜,收集上清层,过0.22 μm滤膜,放置于−80 ℃,以供大鼠ig使用。
2.3 大建中汤体外分析溶液的制备
将“2.3”项下制备的大建中汤汤液,加入400 mL乙醇,置于4 ℃静置过夜,收集上清层,过0.22 μm滤膜,储存至4 ℃冰箱中,以供大建中汤液化学成分分析使用。
2.4 血清样品的制备
雄性SD大鼠,随机分为2组(空白组、大建中汤给药组),并称定体质量,大建中汤给药组按70 mg/kg(按照成人每日剂量换算),5 mL/kg,ig大建中汤溶液,对照组给予相应剂量纯净水。连续给药3 d,在第3天给药4 h后,用1%戊巴比妥钠麻醉,腹主动脉取血置采血管管中,于4 ℃条件下3500 r/min离心10 min分离血清,置−80 ℃冰箱中保存备用。
取大鼠给药血清样品500 µL,以OASIS HLB 3cc固相萃取小柱进行富集净化后,上清液4 ℃下N2吹干,残渣以200 µL甲醇涡旋1 min复溶,经0.22 μm微孔滤膜滤过,续滤液供UPLC-Q-TOF-MS检测分析,空白血清进行同样操作。
2.5 色谱条件
Waters HHS T3色谱柱(100 mm×2.1 mm,1.7 μm),以乙腈(A)-0.1%甲酸水溶液(B)为流动相,梯度洗脱:0~4 min,0~4% A;4~7 min,4%~10% A;7~11 min,10%~25% A;11~16 min,25%~30% A;16~22 min,30%~65% A;22~25 min,65%~90% A;25~27 min,90% A;27~28 min,90% A~100% B;28~32 min,100% B。体积流量0.3 mL/min,柱温35 ℃,进样量1 μL。
2.6 质谱条件
高分辨离子敞度质谱仪采用电喷雾离子化源(ESI),用正离子模式(ESI+)/负离子模式(ESI−)分别进行质谱检测,Lockmass以亮氨酸-脑啡肽标准溶液进行质量锁定;使用高纯N2作为辅助喷雾电离与脱溶剂气体;雾化气体积流量为600 L/h, 脱溶剂气温度为 400 ℃, 锥孔气流量为50 L/h,离子源温度120 ℃,脱溶剂温度400 ℃,脱溶剂气流体积流量1000 L/h,毛细管电压2.5 kV,锥孔电压25 V,扫描范围/100~1200;MSE扫描模式检测,低能通道碰撞电压6 V,高能通道碰撞电压20~40 V,扫描范围/100~1200。
2.7 数据分析
在UNIFI软件中正离子模式设置为加合离子+H、+Na,负离子模式设置为加合离子−H、+HCOO,最后提取色谱峰和碎片信息,确定大建中汤中入血成分及代谢产物。再采用UNIFI软件联机检索外部数据库(Pubchem/Chemspider/Cambridge Structural Database)对大建中汤体外化学成分进行比对,通过文献查阅、人工解析等方法构建大建中汤化合物结构数据库,再将数据导入UNIFI软件系统进行匹配,结合裂解规律、生物合成途径、文献报道的同分异构体、保留时间差异等确定化合物结构。
3 结果
采用“2.5”项下色谱条件及“2.6”项下质谱条件所述优化的UPLC-Q-TOF/MS条件,对大建中汤、大鼠空白血清及给药血清样品进行检测分析(图1),通过比对分析大建中汤和给药血清样品的色谱图,同时存在于大建中汤与给药血清样品中的离子被认为是潜在的以原型形式吸收的药物成分。通过查阅数据库并结合分析质谱裂解规律,在大鼠血清中共检测出22个化学成分,包括5个吸收原型成分(表1)和17个代谢产物(表2),在大建中汤体外醇溶液中鉴定41个化学成分(表3)。

A-大建中汤负离子模式 B-空白血清负离子模式 C-给药血清负离子模式 D-大建中汤正离子模式 E-空白血清正离子模式 F-给药血清正离子模式
表1 大建中汤吸收入血原型成分UPLC-Q-TOF/MS数据
Table 1 UPLC-Q-TOF/MS T data of plasma prototype components of Dajianzhong Decoction
编号化合物分子式tR/min实测值 (m/z)误差(×10−6)碎片离子加合物形式 P1人参皂苷Rg1C42H72O1410.65845.486 63.9637.429 7, 475.381 1[M+COOH]− P2人参皂苷ReC48H82O1810.68991.544 9−0.8799.481 1, 637.429 7[M+COOH]− P3人参皂苷Rb1C54H92O2318.561 107.592 7−2.4945.543 7, 915.528 6[M-H]− P4羟基-α-山椒素C16H25NO219.80264.197 74.5246.186[M+H]+ P5羟基-β-山椒素C16H25NO220.00264.197 74.5246.186[M+H]+
表2 大建中汤中血清代谢成分UPLC-Q-TOF/MS数据
Table 2 UPLC-Q-TOF/MS data of plasma metabolic components of Dajianzhong Decoction
编号化合物分子式tR/min实测值(m/z)误差(×10−6)碎片离子加合物形式 M1羟基-α-山椒素单氧化水合物C16H27NO47.97298.199 8−6.7280.190 1[M+H]+ M2羟基-α-山椒素单氧化水合物异构体C16H27NO48.16298.199 8−6.7280.190 1[M+H]+ M3羟基-α-山椒素单氧化水合物异构体C16H27NO48.43298.199 8−6.7280.190 1[M+H]+ M4羟基-α-山椒素单氧化水合物异构体C16H27NO48.71298.199 8−6.7280.190 1[M+H]+ M5羟基-α-山椒素单氧化水合物C16H27NO49.11298.199 8−6.7280.190 1[M+H]+ M6羟基-α-山椒素单氧化物C16H25NO39.32298.199 8−6.7280.190 1[M+H]+ M7羟基-α-山椒素单氧化物异构体C16H25NO310.27280.190 8−1.8262.178 9[M+H]+ M8羟基-α-山椒素单氧化物异构体C16H25NO310.52280.190 8−1.8262.178 9[M+H]+ M9羟基-α-山椒素单氧化物异构体C16H25NO310.73280.190 8−1.8262.178 9[M+H]+ M10羟基-α-山椒素单氧化物异构体C16H25NO311.01280.190 8−1.8262.178 9[M+H]+ M11羟基-α-山椒素单氧化物异构体C16H25NO311.28280.190 8−1.8262.178 9[M+H]+ M12羟基-α-山椒素单氧化物异构体C16H25NO311.53280.190 8−1.8262.178 9[M+H]+ M13羟基-α-山椒素单氧化物异构体C16H25NO314.38280.190 8−1.8262.178 9[M+H]+ M146-姜酚葡萄糖醛酸结合物C23H34O1015.52488.248 2−2.9277.180 8, 179.080 8[M+NH4]+ M15羟基-α-山椒素单氧化物C16H25NO315.62280.190 8−1.8262.178 9[M+H]+ M16羟基-α-山椒素单氧化物异构体C16H25NO316.12280.190 8−1.8262.178 9[M+H]+ M178-姜酚葡萄糖醛酸结合物C25H38O1019.42516.284 2−4.8323.220 6, 179.070 8[M+NH4]+
表3 大建中汤醇溶液体外化学成分UPLC-Q-TOF/MS分析
Table 3 In vitro components in alcohol solution of Dajianzhong Decoction with UPLC-Q-TOF/MS
序号化合物分子式tR/min实测值(m/z)误差(×10−6)加合物形式离子碎片(m/z)来源文献 1蔗糖*C12H22O110.59341.112 54.1[M-H]−179.058 8C4 2苹果酸C4H6O50.67133.016 32.6[M-H]−115.007 1B5 3柠檬酸C6H8O70.75191.022 02.8[M-H]−155.955 0B5 4酪氨酸C9H11NO30.99180.068 92.8[M-H]−163.042 8B6 5鸟苷*C10H13N5O51.40282.085 63.7[M-H]−150.042 3B7 6苯丙氨酸*C9H11NO22.24164.075 03.8[M-H]−147.048 4B6 7新绿原酸C16H18O94.09353.088 74.2[M-H]−191.029 9A6 8原花青素B1*C30H26O124.85577.135 71.1[M-H]−407.075 7A8 9儿茶素C15H14O65.11289.078 97.7[M-H]−245.082 3A9 10绿原酸*C16H18O95.19353.088 74.2[M-H]−191.029 9A4 11原花青素B2C30H26O125.30577.135 71.1[M-H]−407.075 7, 289.071 9A10 12隐绿原酸C16H18O95.51353.088 74.2[M-H]−191.029 9A11
续表3
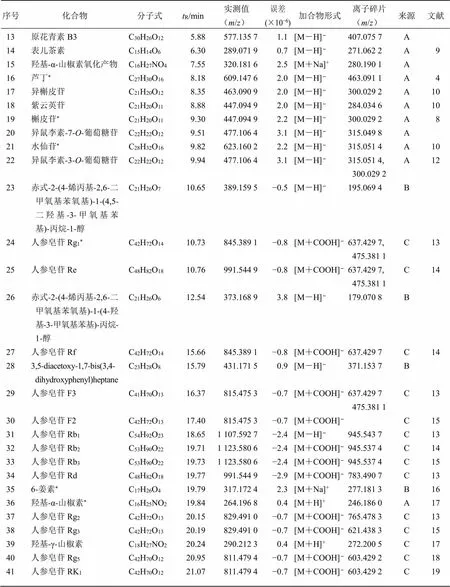
序号化合物分子式tR/min实测值(m/z)误差(×10−6)加合物形式离子碎片(m/z)来源文献 13原花青素B3C30H26O125.88577.135 71.1[M-H]−407.075 7A 14表儿茶素C15H14O66.30289.071 90.7[M-H]−271.062 2A9 15羟基-α-山椒素氧化产物C16H27NO47.55320.181 62.5[M+Na]+280.190 1A 16芦丁*C27H30O168.18609.147 62.0[M-H]−463.091 1A4 17异槲皮苷C21H20O128.35463.090 92.0[M-H]−300.029 2A10 18紫云英苷C21H20O118.88447.094 92.0[M-H]−284.034 6A10 19槲皮苷*C21H20O119.30447.094 92.2[M-H]−300.029 2A8 20异鼠李素-7-O-葡萄糖苷C22H22O129.51477.106 43.1[M-H]−315.049 8A 21水仙苷*C28H32O169.82623.160 22.2[M-H]−315.051 4A10 22异鼠李素-3-O-葡萄糖苷C22H22O129.94477.106 43.1[M-H]−315.051 4, 300.029 2A12 23赤式-2-(4-烯丙基-2,6-二甲氧基苯氧基)-1-(4,5-二羟基-3-甲氧基苯基)-丙烷-1-醇C21H26O710.65389.159 5−0.5[M-H]−195.069 4B 24人参皂苷Rg1*C42H72O1410.73845.389 1−0.8[M+COOH]−637.429 7,475.381 1C13 25人参皂苷ReC48H82O1810.76991.544 9−0.8[M+COOH]−637.429 7,475.381 1C14 26赤式-2-(4-烯丙基-2,6-二甲氧基苯氧基)-1-(4-羟基-3-甲氧基苯基)-丙烷- 1-醇C21H26O612.54373.168 93.8[M-H]−179.070 8B 27人参皂苷RfC42H72O1415.66845.389 1−0.8[M+COOH]−637.429 7C14 283,5-diacetoxy-1,7-bis(3,4- dihydroxyphenyl)heptaneC23H28O815.79431.171 50.9[M-H]−371.153 7B 29人参皂苷F3C41H70O1316.37815.475 3−0.7[M+COOH]−637.429 7475.381 1C13 30人参皂苷F2C42H72O1317.40815.475 3−0.7[M+COOH]− C15 31人参皂苷Rb1C54H92O2318.651 107.592 7−2.4[M-H]−945.543 7C13 32人参皂苷Rb2C53H90O2219.711 123.580 6−2.4[M+COOH]−945.537 4C14 33人参皂苷Rb3C53H90O2219.731 123.580 6−2.4[M+COOH]−945.537 4C15 34人参皂苷RdC48H82O1819.77991.544 9−2.9[M+COOH]−783.490 7C13 356-姜素*C17H26O419.79317.172 42.3[M+Na]+277.181 3B16 36羟基-α-山椒素*C16H25NO219.84264.196 80.4[M+H]+246.186 0A17 37人参皂苷Rg2C42H72O1320.15829.491 0−0.7[M+COOH]−765.478 3C13 38人参皂苷Rg3C42H72O1320.19829.491 0−0.7[M+COOH]−621.438 3C15 39羟基-γ-山椒素C18H27NO220.24290.212 30.4[M+H]+272.200 5C17 40人参皂苷Rg5C42H70O1220.95811.479 4−0.7[M+COOH]−603.429 2C18 41人参皂苷RK1C42H70O1221.07811.479 4−0.7[M+COOH]−603.429 2C19
*表示与对照品比对后确认;A-蜀椒 B-干姜 C-人参
*means confirmed after comparison with the reference substance; A-MaximB-Rosc. C-C. A. Meyer
3.1 原型成分的鉴定
在给予大建中汤的大鼠血清中鉴定出5个原型成分,以化合物P1与P4为例说明推测过程。
在大鼠血清中检测到3个人参皂苷类成分,该类化合物容易连续脱糖,过程中存在丢失1个或多个H2O,最终形成达玛烷型等类型苷元离子。化合物P1给出分子离子[M+COOH]−/845.489 1,对分子离子峰进行裂解分析,给出碎片离子/799.481 1 [M-H]−、/637.429 7、/475.379 9。碎片离子/637.429 7为母离子/845.489 1脱去1分子葡萄糖基[M-H-Glc]−产生的,碎片离子/475.379 9为/637.429 7继续脱去1分子葡萄糖基[M-H-Glc-Glc]−产生的,最后通过与文献报道[20]及对照品比对,确定P1号峰为人参皂苷Rg1,具体裂解途径如图2所示。
在大鼠血清中检测到2个山椒素类成分,该类成分主要来源于蜀椒,如化合物P4一级质谱中给出/264.196 8,对应的元素组成C16H26NO2,为加氢形成的[M+H]+准分子离子,同时可以观察到[M+Na]+的准分子离子286.176 8。二级质谱给出/246.180 6为脱水后的碎片[M+H-H2O]+,同时观测到酰胺键断裂脱去C4H9N片段后形成的碎片/175.113 0,以及进一步脱去CO片段的碎片离子/147.118 1。同时结合参考文献数据[21],确定化合物P4为羟基-α-山椒素,具体裂解途径如图3所示。

图2 人参皂苷Rg1裂解途径
3.2 代谢产物的鉴定
在给予大建中汤的大鼠血清中检测出17个代谢成分,以化合物M14、M17及羟基-α-山椒素氧化还原产物说明推测过程。
在正离子模式下,可以观测到准分子离子/488.248 2,对应的元素组成为C23H38NO10[M+NH4]+,同时可以观察到准分子离子/471.223 6,对应的元素组成为C23H35O10[M+H]+,由此可知M14的分子为C23H34O10。同时看到/295.189 3、/277.180 8、/195.573 6、/177.090 5、/137.060 5等碎片离子,其中/295.189 3为M14脱去葡萄糖醛酸(-C6H8O6,176)后所形成,与6-姜酚的准分子离子一致;/277.180 8、/195.573 6、/177.090 5、/137.060 5也与6-姜酚的碎片离子完全吻合,由此推断M14为6-姜酚葡萄糖醛酸结合物(图4)。
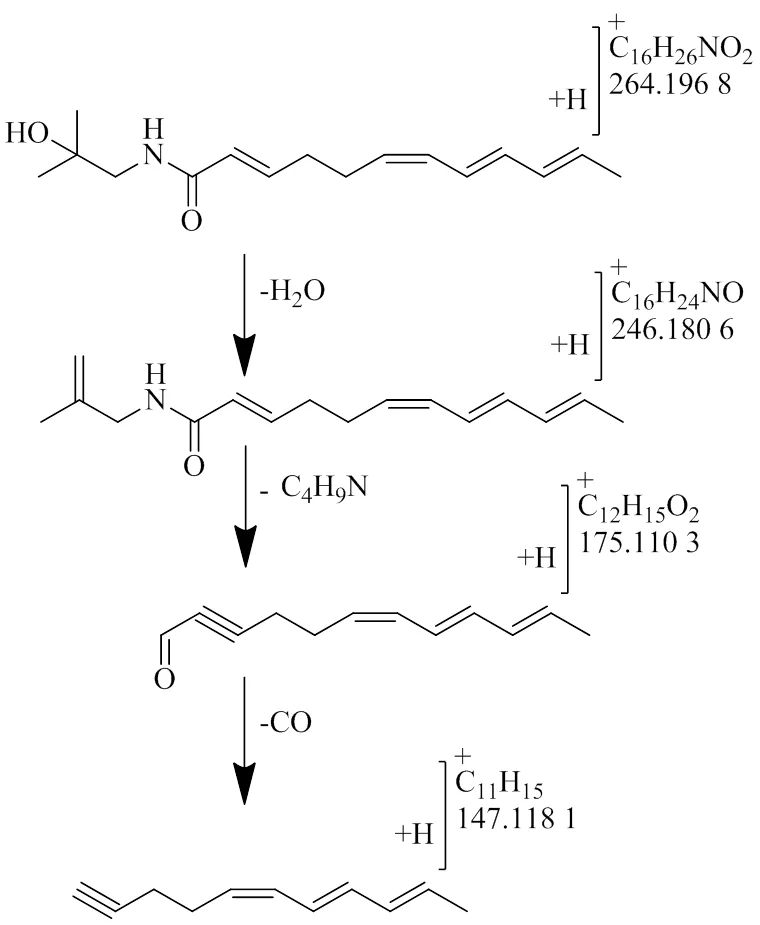
图3 羟基-α-山椒素的质谱裂解途径
在正离子模式下,可以观测到准分子离子/516.284 2,对应的元素组成为C25H42NO10[M+NH4]+,同时可以观察到准分子离子/521.234 7,对应的元素组成为C25H38O10Na [M+Na]+,由此可知M17的分子式为C25H38O10。同时可以看到/323.220 6、/305.210 0、/177.090 5、/137.060 5等碎片离子,其中/323.220 6为M17脱去葡萄糖醛酸(-C6H8O6,176)后所形成,与8-姜酚的加氢准分子离子一致;/305.210 0、/177.090 5、/137.060 5也与8-姜酚的碎片离子完全吻合,由此推断M17为8-姜酚葡萄糖醛酸结合物(图5)。
羟基-α-山椒素主要可能代谢途径为双键环氧化及进一步氧化还原形成邻二醇结构,由于羟基-α-山椒素含有多个双键,所以可以形成多个环氧化位点,也与检测到多个相对分子质量相同的代谢物同分异构体相吻合,具体可能代谢途径见图6。
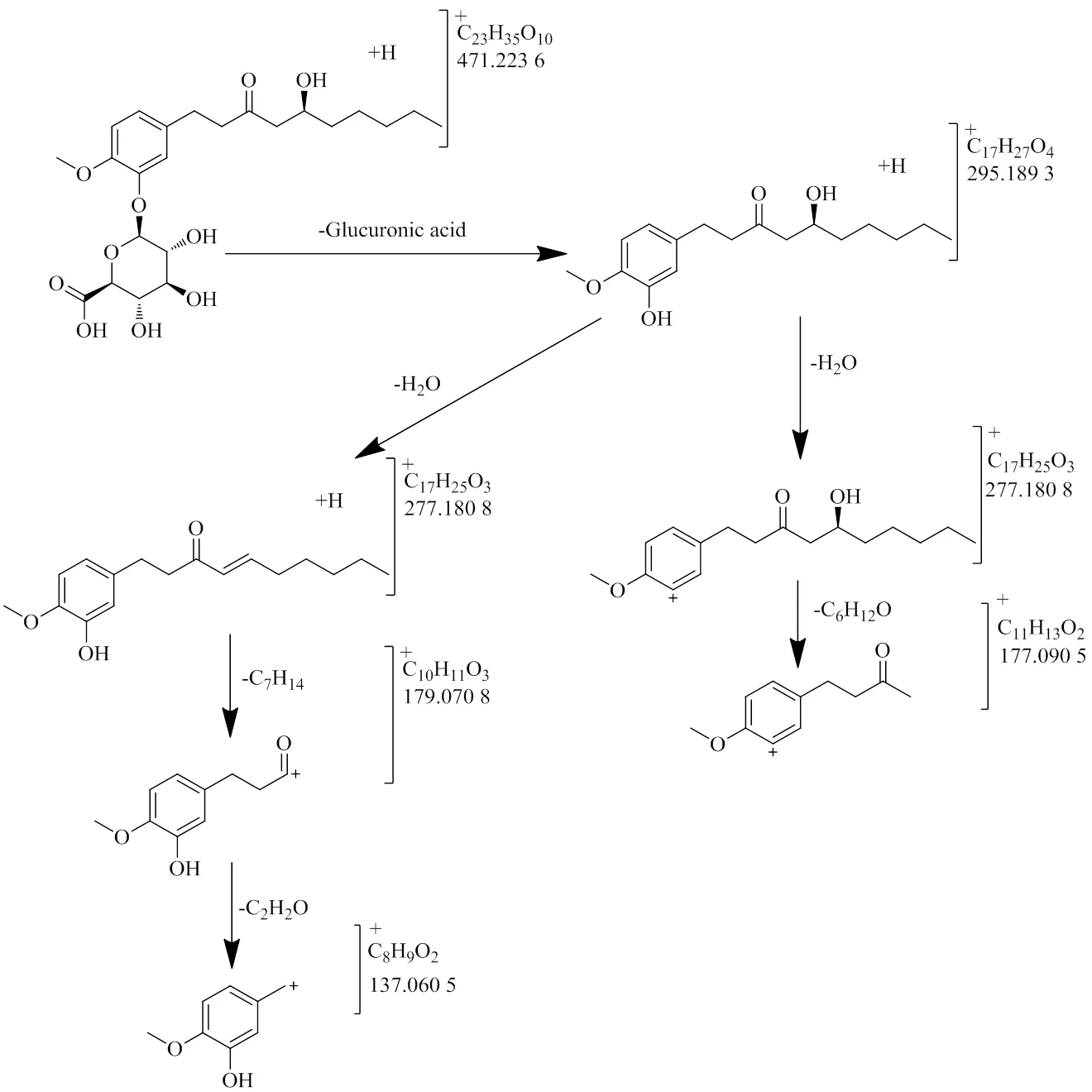
图4 6-姜酚葡萄糖醛酸结合物可能的质谱裂解途径
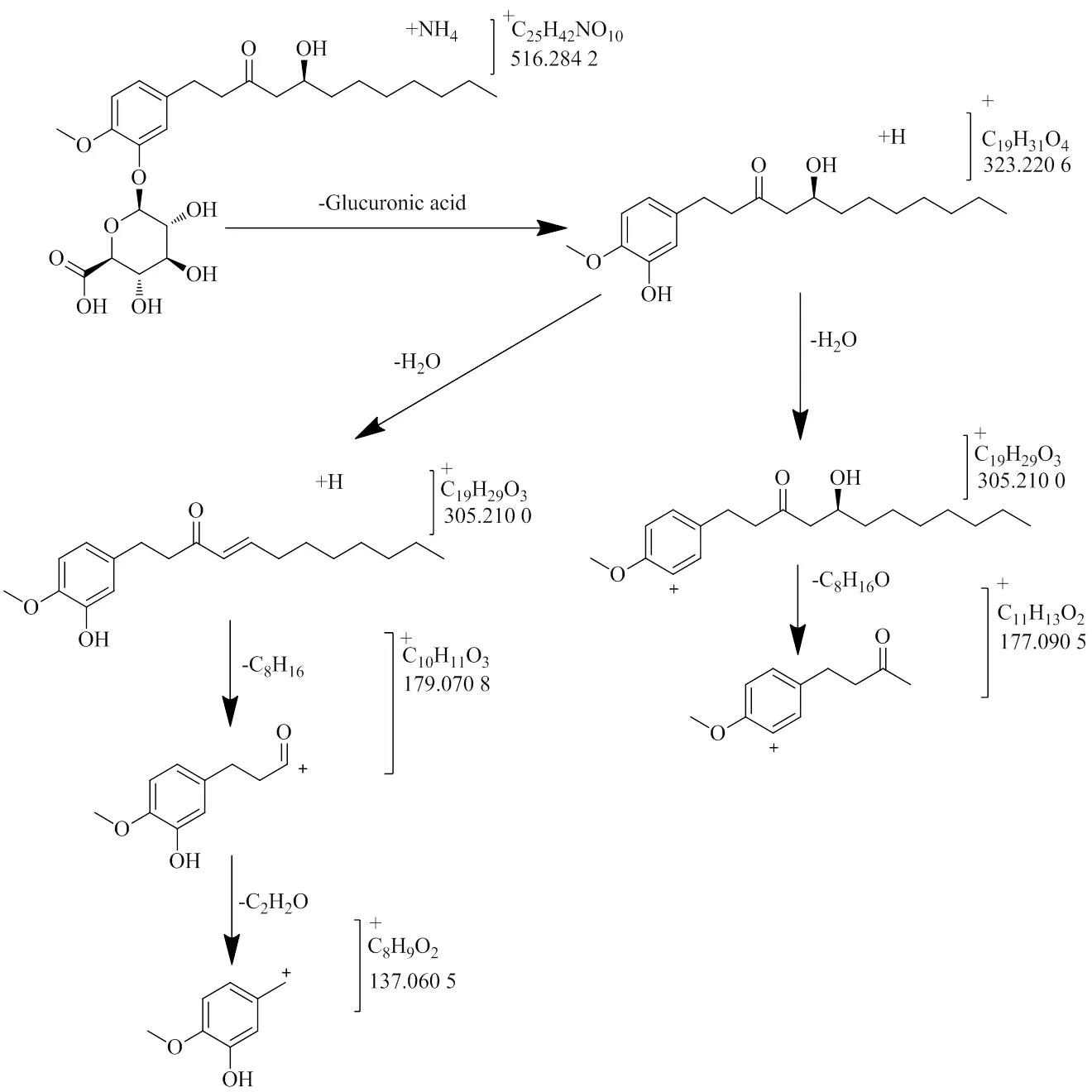
图5 8-姜酚葡萄糖醛酸结合物可能的质谱裂解途径
3.3 大建中汤体外化学成分分析
3.3.1 糖类 在大建中汤中鉴定到的葡萄糖大多为二糖,该类成分主要来源于人参。如化合物1含有/341.112 5 [M-H]−、179.058 8 [M-H]−、 161.047 7 [M-H]−等片段,推测其通过糖苷键断裂失去1分子糖,再通过脱去1分子水形成/161.047 7 [M-H]−片段,结合对照品及文献报道[22],确定化合物1为蔗糖,具体裂解途径如图7所示。
3.3.2 核苷类 该类成分主要来源于干姜,如化合物5具有/282.085 6 [M-H]−、/150.042 3 [M-H]−离子片段,初步判断该化合物为脱去1分子核糖,形成/150.042 3 [M-H]−离子片段,最后结合对照品及参考文献推断该化合物为鸟苷[23],其质谱裂解途径见图8。
3.3.3 原花青素类 该类化合物主要的裂解途径发生逆狄尔斯-阿尔德裂解(RAD),化合物8分子离子为/577.135 7 [M-H]−,裂解后得到碎片离子425.089 4 [M-H-C8H8O3]−,该离子片段进一步脱水后得到碎片离子/407.077 5 [M-H-C8H8O3-H2O]−,同时也有直接脱去1分子儿茶素的碎片/289.072 2 [M-H-Cat]−,将该化合物与文献数据[24]比对,确定该化合物为原花青素B1,具体裂解途径见图9。

图6 羟基-α-山椒素的可能代谢途径
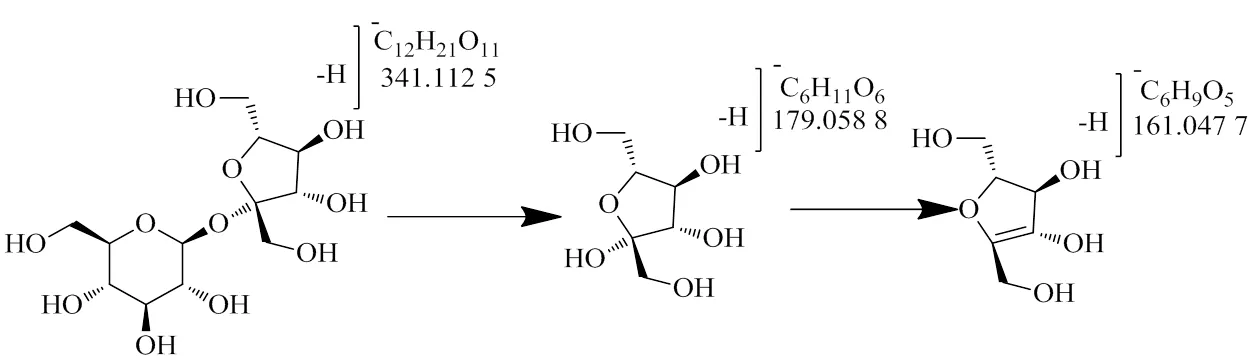
图7 蔗糖的质谱裂解途径
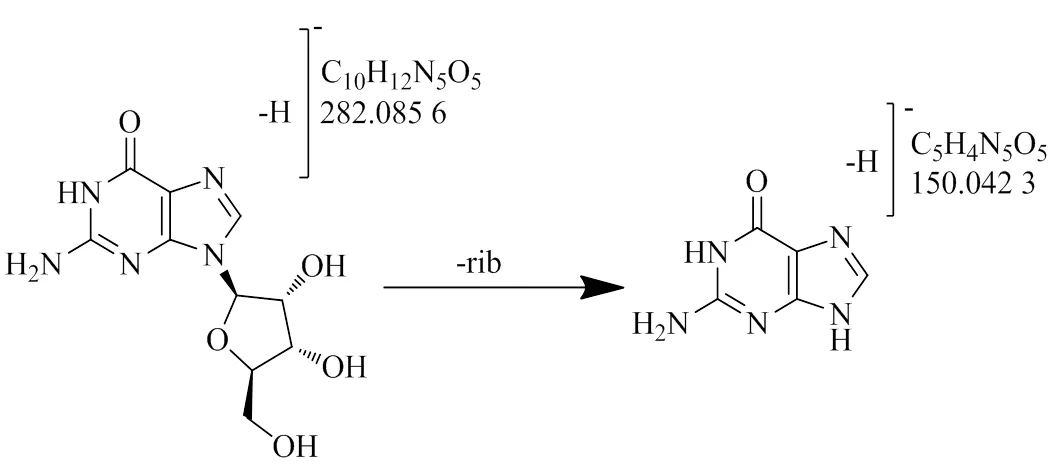
图8 鸟苷的质谱裂解途径
3.3.4 绿原酸类 该类化合物都是咖啡酸与奎宁酸的羟基以酯键连接,因此其质谱裂解主要是以酯键断裂为主,伴随有脱水等次级裂解途径。化合物7、10、12都产生相同的/191.055 6碎片(奎宁酸负离子),通过与对照品比对,结合文献报道[25]确定该类化合物分别为新绿原酸、绿原酸、隐绿原酸,具体裂解途径见图10。
3.3.5 黄酮苷类 该类成分主要来源于蜀椒。如化合物16给出离子碎片/609.147 6 [M-H]−,对分子离子进行解析得到/463.091 1 [M-H]−、/300.029 2,初步判断该化合物分别失去2分子糖基,形成明显的黄酮苷元负离子,通过与参考文献数据[26]及对照品比对,确定该类化合物为芦丁,具体裂解途径如图11所示。化合物21给出/623.160 2 [M-H]−、/477.106 4 [M-H]−、/315.051 4 [M-H]−、/300.029 2 [M-H]−,可判断该化合物分别失去2分子糖基,再脱去甲基自由基形成明显的黄酮苷元负离子,通过文献报道[27]及对照品比对,确定该类化合物为水仙苷,具体裂解途径如图12所示。
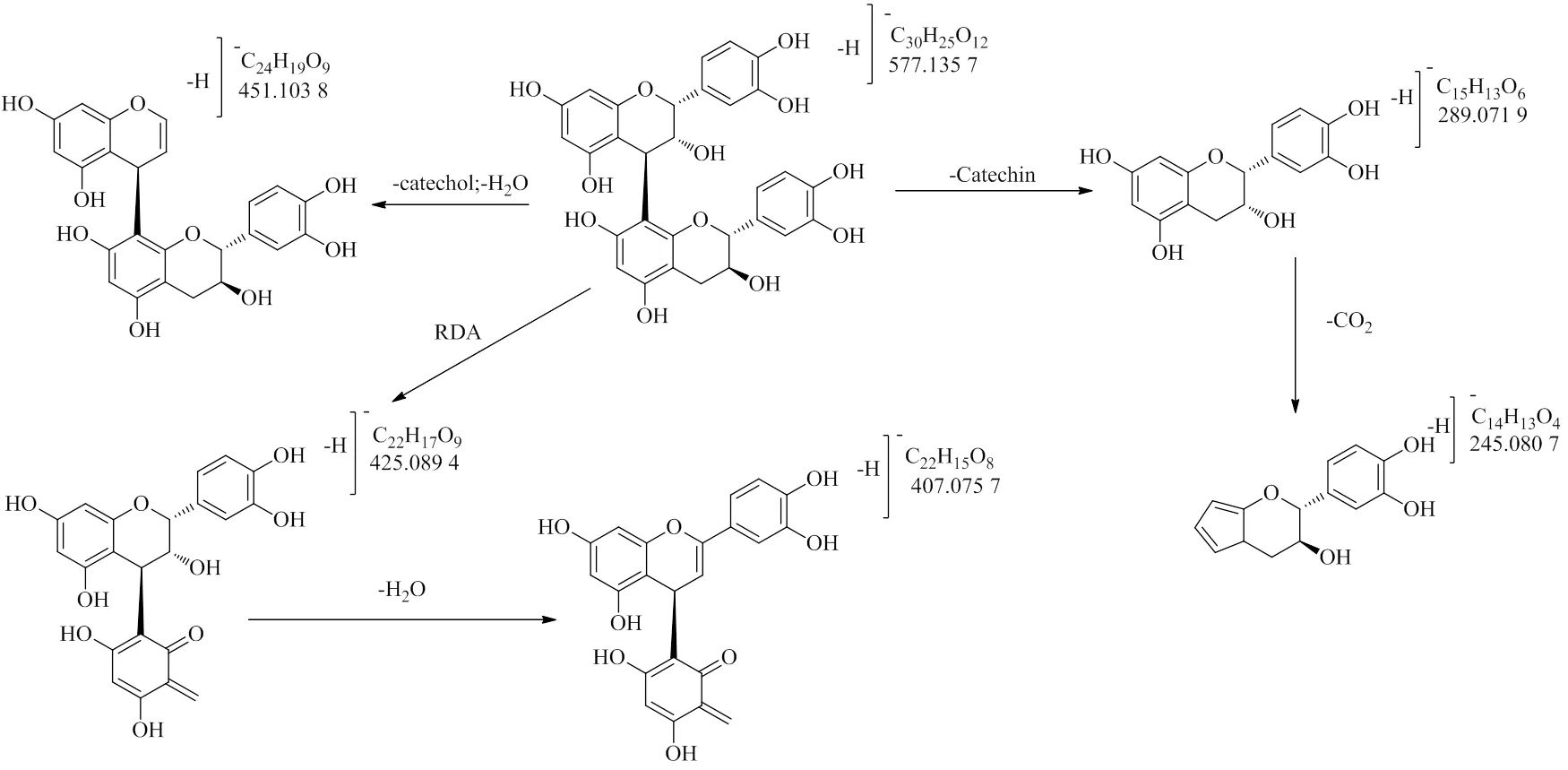
图9 原花青素B1的质谱裂解途径

图10 绿原酸类的质谱裂解途径
3.3.6 其他类成分 在其他类化学成分中包括氨基酸类等。氨基酸类成分的裂解规律较为简单,主要以丢失NH3为主要裂解途径,化合物6的一级质谱给出/164.075 0片段,二级质谱中检测到/147.048 4离子片段,由此推测该化合物失去1个NH3,结合文献数据及对照品比对[6],确定该化合物为苯丙氨酸,具体裂解途径如图13所示。
4 讨论
本研究在优化色谱条件时比较了不同流动相,包括甲醇-水、乙腈-水、乙腈-0.1%甲酸水,考察结果表明乙腈-0.1%甲酸水溶液色谱分离效果较好,因此本研究采用该条件作为流动相。在血清样品处理时考察了甲醇和乙腈沉淀蛋白法,甲醇沉淀法可降低基质的干扰,提高仪器灵敏度,故使用甲醇沉淀法。质谱条件考察时,在正、负离子模式下的质谱响应进行考察,主要以正、负离子模式检测下采集到的数据分别作为解析对象。

图11 芦丁的质谱裂解途径
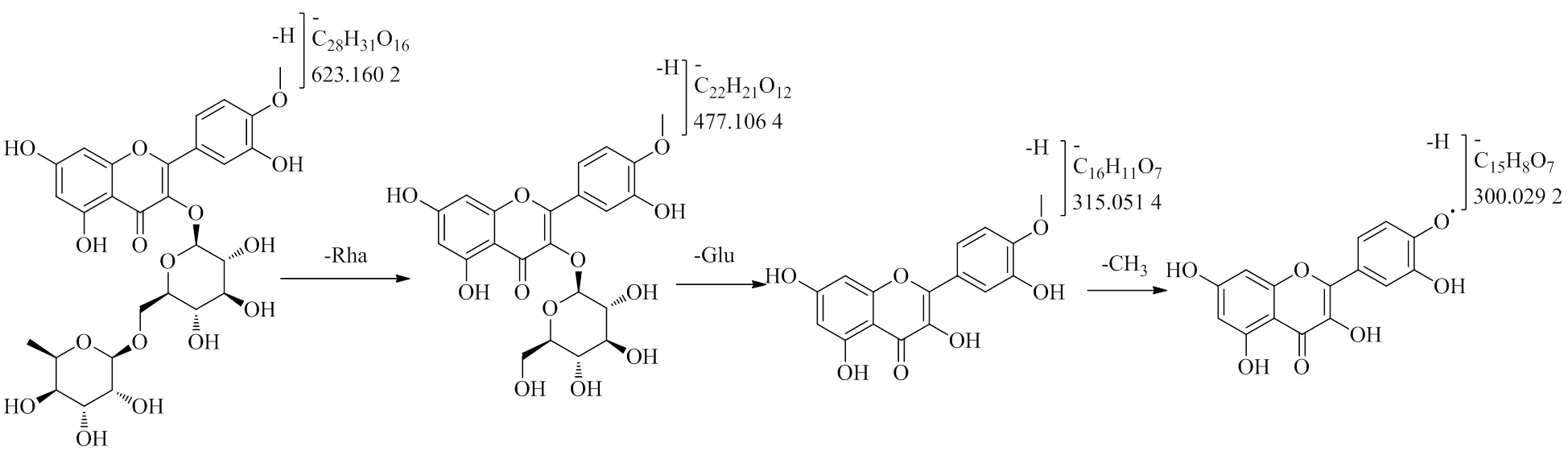
图12 水仙苷的质谱裂解途径
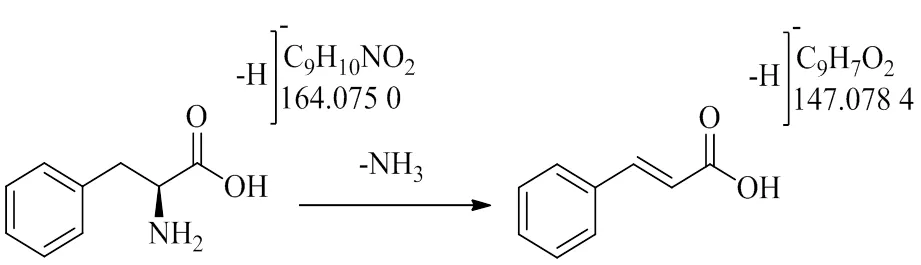
图13 苯丙氨酸的质谱裂解途径
大建中汤由饴糖、蜀椒、干姜和人参组成,具有温中补虚,降逆止痛之功效,具有抗胃肠肿瘤等药理作用[28-29]。本研究采用UPLC-Q-TOF/MS技术对大建中汤入血成分及体外化学成分进行分析,在给药血清中检测到22个入血成分,包括5个原型成分,17个代谢成分,体外醇溶液中鉴定得到41个化学成分。来自人参的人参皂苷Rg1具有抗氧化、抗肿瘤、抗心肌缺血、抗衰老等药理作用[30],人参皂苷Rb1在对中枢神经系统、心血管系统、免疫系统以及抗肿瘤、抗肝脏热缺血再灌注损伤、降血糖等方面均具有作用[31],人参皂苷Re在保护心血管系统和中枢神经系统、降血糖以及抗休克、抗血小板聚集、抗氧化、抗心律失常等方面具有明显作用[32],因此,人参皂苷类成分的生理活性可能是大建中汤发挥补虚功效原因之一。来自于蜀椒的入血成分主要为羟基-α-山椒素及羟基-β-山椒素,具有麻醉镇痛、肠道保护、降血糖等药理作用[33],该类成分的生理活性可能是大建中汤发挥镇痛功效的原因。在代谢产物中发现的羟基-α-山椒素氧化还原产物和6-姜酚葡萄糖醛酸结合物表明,羟基-α-山椒素和6-姜酚吸收入血后可能在体内发生生物转换,进一步推测羟基-α-山椒素和6-姜酚代谢产物也可能是大建中汤的活性成分。因此,大建中汤中入血活性成分及代谢物可能是其发挥药效的物质基础。
本研究采用血清药物化学结合UPLC-Q- TOF/MS技术鉴定大建中汤中入血成分及体外化学成分,该方法具有简单、快捷、高灵敏度、高分辨率分析特点,可用于复杂体系中化学成分快速识别与定性分析[34-35],本研究初步分析得到原型成分和代谢产物可能是大建中汤潜在活性成分,可为大建中汤质量控制研究提供依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 柽坤. 大建中汤提取剂应用状况与剂型的关系 [J]. 国外医学: 中医中药分册, 2004, 26(1): 32-33.
[2] 李天庆. 大建中汤对消化系统疾病的基础与临床研究进展 [J]. 国外医学: 中医中药分册, 2000, 22(4): 222-223.
[3] 国家中医药管理局. 关于发布《古代经典名方目录(第一批)》的通知. [EB/OL]. http://kjs. satcm. gov. cn/ zhengcewenjian/ 2018-04-16/7017. html, 2018-04-16/ 2019-05-20.
[4] 李红军, 王增绘, 李文涛, 等. UPLC-Q-TOF/MS法分析款冬花蜜炙前后的化学成分变化 [J]. 中国药房, 2015, 26(6): 792-794.
[5] 贾晓华, 王维, 高梦园, 等. 基于UPLC-Q-TOF- MS/MS分析藜芦中化学成分 [J]. 天津中医药大学学报, 2021, 40(1): 104-111.
[6] 张雯霞, 冯敏, 苗雨露, 等. 基于UPLC-Q-TOF- MS/MS技术的还贝止咳方化学成分分析 [J]. 中国中药杂志, 2019, 44(14): 3022-3034.
[7] 屠亚茹, 欧阳慧子, 孙梦杰, 等. UPLC-Q-TOF-MS/MS方法鉴定血必净注射液中20种化学成分 [J]. 天津中医药大学学报, 2017, 36(3): 209-213.
[8] 孙崇鲁, 吴浩, 楼天灵, 等. UPLC-Q-TOF-MS法分析三叶青地上部分化学成分 [J]. 中成药, 2018, 40(6): 1424-1429.
[9] 罗媛, 王昌权, 巩仔鹏, 等. UPLC-Q-TOF-MS/MS分析苗药云实皮的化学成分 [J]. 中国药房, 2020, 31(20): 2481-2486.
[10] 肖观林, 江洁怡, 李素梅, 等. 基于UPLC-Q-TOF- MS/MS技术的布渣叶化学成分分析 [J]. 中国实验方剂学杂志, 2021, 27(3): 138-148.
[11] 罗丹丹, 彭华胜, 张元, 等. 基于UPLC-Q-TOF-MS分析比较宽叶山蒿与艾的化学成分 [J]. 中国中药杂志, 2020, 45(17): 4057-4064.
[12] 秦振娴, 张瑜, 齐梦蝶, 等. 中国沙棘和西藏沙棘叶中化学成分的UPLC/Q-TOF-MS快速分析 [J]. 中国中药杂志, 2016, 41(8): 1461-1468.
[13] 王邱, 冯毅凡, 芮雯, 等. UPLC/Q-TOFMS对三七中皂苷类成分的快速化学表征 [J]. 天然产物研究与开发, 2014, 26(8): 1233-1239.
[14] 何家乐, 周思思, 马增春, 等. 基于UPLC-Q-TOF/MS研究参附注射液的物质基础 [J]. 中国药理学通报, 2014, 30(3): 429-433.
[15] 周思思, 马增春, 梁乾德, 等. 基于UPLC-TOF-MS分析人参麦冬配伍后皂苷类成分的变化 [J]. 质谱学报, 2013, 34(2): 88-95.
[16] 许如玲, 范君婷, 董惠敏, 等. 经典名方黄芪桂枝五物汤标准煎液化学成分的UPLC-Q-TOF-MS分析 [J]. 中国中药杂志, 2020, 45(23): 5614-5630.
[17] 司昕蕾, 边甜甜, 牛江涛, 等. 花椒不同提取方法传导麻醉作用及成分鉴定 [J]. 中华中医药杂志, 2020, 35(5): 2311-2315.
[18] 刘静, 陈鹏, 陈林伟, 等. 参芪归芍汤化学成分的UPLC-Q-TOF/MS分析 [J]. 药物分析杂志, 2016, 36(9): 1578-1584.
[19] 赵静, 秦振娴, 彭冰, 等. 基于UPLC-Q-TOF MS技术的三七中皂苷类成分质谱裂解规律研究 [J]. 质谱学报, 2017, 38(1): 97-108.
[20] 史大臻, 赖思含, 刘俊彤, 等. UPLC-Q/TOF-MS结合UNIFI库快速分析西洋参茎叶三醇皂苷 [J]. 特产研究, 2021, 43(4): 72-81.
[21] 张萌萌, 王丹, 魏大能, 等. 基于血清药物化学的花椒温中止痛的质量标志物研究 [J]. 中草药, 2022, 53(9): 2731-2739.
[22] 樊晓荃, 付娟, 胡军华, 等. UPLC-Q-TOF- MS/MS快速分析六味地黄苷糖片化学成分[J]. 中草药, 2021, 52(21): 6473-6484.
[23] 何颖, 涂正伟, 邹爱英, 等. HPLC-QTOF/MS法鉴定甘草泻心汤中化学成分 [J]. 现代药物与临床, 2021, 36(11): 2246-2254.
[24] 刘超, 郝庆秀, 金艳, 等. 基于UPLC-Q-TOF-MS比较雷公藤与昆明山海棠叶片的代谢产物差异 [J]. 中国中药杂志, 2015, 40(9): 1710-1717.
[25] 高天元, 雷雨恬, 唐国琳, 等. 药用鸡矢藤药材化学成分的UPLC-Q-TOF-MS分析 [J]. 中国实验方剂学杂志, 2020, 26(17): 134-141.
[26] 王元成, 韩彬, 李振坚, 等. 基于UPLC-Q-TOF-MS的肿节石斛化学成分研究 [J]. 中国药学杂志, 2021, 56(9): 708-714.
[27] 朱建平, 陈俣祯, 高萌萌, 等. 基于UPLC-Q-TOF/MS法对鲜、干百合地黄汤化学成分的比较研究 [J]. 湖南中医药大学学报, 2021, 41(11): 1698-1704.
[28] Lo S S, Chen J H, Wu C W,. Functional polymorphism of NFKB1promoter may correlate to the susceptibility of gastric cancer in aged patients [J]., 2009, 145(3): 280-285.
[29] Ahn K S, Aggarwal B B. Transcription factor NF-kappaB: A sensor for smoke and stress signals [J]., 2005, 1056: 218-233.
[30] 王浩, 邹茜. 人参皂苷Rg1调节沉默信息调节因子1对抗晶状体上皮细胞衰老的影响[J]. 世界中医药, 2021, 16(7): 1095-1098.
[31] 杨秋娅, 李晓宇, 刘皋林. 人参皂苷Rb1的药理作用研究进展 [J]. 中国药学杂志, 2013, 48(15): 1233-1237.
[32] 韦豪华, 张红玲, 李兴太. 人参皂苷Re的药理作用研究进展 [J]. 大连民族大学学报, 2018, 20(1): 21-26.
[33] 李焰梅, 郝丹, 蒋献. 山椒素药理学研究进展 [J]. 中国药理学通报, 2019, 35(2): 172-175.
[34] 时正媛, 李京峰, 宝丽, 等. 金芪降糖片治疗2型糖尿病大鼠的血清代谢组学研究[J]. 世界中医药, 2022, 2022, 17(8): 1081-1085.
[35] 刘伟, 葛广波, 王永丽, 等. 基于UHPLC-Q-Orbitrap HRMS技术研究清肺排毒汤化学成分及小鼠组织分布 [J]. 中草药, 2020, 51(8): 2035-2045.
Serum pharmacochemistry study of Dajianzhong Decoction based on UPLC-Q-TOF/MS
JIANG Miao, PENG Wei, WU Chun-jie, WANG Jia-kui
Key Laboratory of Standardization of Chinese Herbal Medicine, Ministry of Education, State Key Laboratory of Southwestern Characteristic Chinese Medicine Resources, School of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China
To analyze the blood components andchemical components of Dajianzhong Decoction (大建中汤) by serum pharmacochemistry method.UPLC-Q-TOF/MS technology was used to rapidly identify the prototype components, metabolic components andchemical components absorbed into the blood of Dajianzhong Decoction after oral administration to rats. Combined with UNIFI software, the molecular weight of mass spectrometry, mass spectrometry fragmentation rules, literature reports and other methods were used to analyze the mass spectrometry fragmentation information to characterize the blood components andchemical components of Dajianzhong Decoction.A total of 22 blood components were identified in the administered plasma, including five prototype components and 17 metabolites, and 41 chemical components were identified byanalysis.UPLC-Q-TOF/MS technology can realize the rapid identification of chemical components in Dajianzhong Decoctionand, and the prototype components and metabolites identified in serums may be the potential active components of Dajianzhong Decoction, which can be used for quality control studies.
Dajianzhong Decoction; serum pharmacochemistry; UPLC-Q-TOF/MS; prototype components; metabolites; ginsenoside Rg1; hydroxy-α-sanshool
R284.1
A
0253 - 2670(2023)16 - 5154 - 11
10.7501/j.issn.0253-2670.2023.16.004
2023-02-18
四川省中医药管理局2020年度花椒药用价值研发专项(2020HJZX001);成都市知识产权局专项(202000092)
蒋 淼(1982—),博士,讲师,主要从事中药基础理论及应用研究。E-mail: jiangmiaocc@163.com
吴纯洁(1965—),教授,博士生导师,主要从事中药炮制与制剂方面的研究。E-mail: wucjcdtcm@163.com
王家葵(1966—),博士,教授,主要从事本草文献考证及药理学方面的研究。E-mail: wjkms@163.com
[责任编辑 王文倩]
