磁耦合谐振式无线电能传输磁场对海马齿状回区神经元K+通道的影响*
2023-08-14张冰茜赵毅航王晓轩
赵 军 张冰茜 赵毅航 王晓轩
(1)河北工业大学生命科学与健康工程学院,天津 300130;2)河北省生物电磁与神经工程重点实验室(河北工业大学),天津 300130;3)天津市生物电工与智能健康重点实验室(河北工业大学),天津 300130)
随着现代科技的不断发展以及电气化设备在生活中的应用不断增加,无线电能传输(wireless power transfer,WPT)作为一种借助空间无形软介质(如声波、机械波、磁场、电场等)通过电源端将电能隔空传递至用电设备的新型电能传输方式,具有使用寿命长、安全性和灵活性高的特点[1],经过多年的发展,该技术已应用于机器人、智能家居、交通等工业领域[2-6]。目前,WPT根据传输过程中能量形式的不同主要分为3种方式:a. 基于分离变压器原理的电磁感应式;b. 基于微波辐射的传输方式;c. 磁耦合谐振式。其中,由于磁耦合谐振式无线电能传输(magnetically-coupled resonant wireless power transfer,MCR-WPT)可在数米范围内实现无线供电,具有传输距离较远、电磁干扰小、传输效率高等特点,在工业方面优于其他传输方式而被广泛应用[7-8]。然而,大量研究表明,生物体在一定的电磁环境中生存,生物体的不同部位会产生不同程度的变化,影响生物体的神经系统、生殖系统、免疫系统、内分泌等维持生命活动正常运动的功能变化,导致记忆力障碍、情绪易变、抑郁等行为记忆方面的问题,有的转变甚至是不可逆的[9-11]。为了使MCR-WPT 更好地运用于市场当中,人体在MCR-WPT运行的电磁环境中的安全性是研究的热点之一。
目前有关WPT 电磁环境的安全性研究大多利用软件仿真计算、对比标准限值来得出是否安全的结论,若要将该技术大规模应用于市场,尚缺乏生物实验的数据支撑[12]。在现有有关电磁环境的安全性研究当中,长期接受射频(900 MHz)电磁辐射可导致大鼠的海马结构发生变化,并对大鼠认知能力产生不利影响[13-14]。膜电位是反映细胞功能的重要指标[15],低频电磁场会影响离子的跨膜运动,进而影响细胞膜电位的变化,使神经系统发生改变[16-17]。而脉冲磁场和射频磁场会影响皮层神经元细胞膜上K+通道的激活、失活等特性,从而影响神经元的生理特性[18-20]。
因海马区是人体易受电磁环境影响的敏感区域,其中齿状回(dentate gyrus,DG)区在与学习记忆功能密切相关的三突触回路中扮演着至关重要的角色[21],故本文选用小鼠海马区DG区颗粒神经元作为研究对象。神经元信息系统中的信息传递主要依靠膜电位的发放、频率、峰值来对离子通道进行调控[22],离子通道由跨膜蛋白构成,使Na+、K+和Cl-穿过,改变细胞内部和外部的电位差以此来改变细胞的生理活动。由于膜内无闸门控制的K+通道远多于Na+通道,使得神经元细胞膜对于Na+的渗透性远低于K+,且Na+通道的通道电导在相同强度相同频率磁场中的变化并不明显[23-24],故实验采用膜片钳技术,从离子通道角度研究WPT 电磁环境对颗粒神经细胞K+通道的影响。利用新物体识别实验检测小鼠的学习记忆情况,探究磁场暴露对神经元和学习记忆的影响。
1 材料与方法
1.1 试剂
人工脑脊液(ACSF):NaCl 134 mmol/L,KCl 5 mmol/L, NaH2PO41.5 mmol/L, MgSO42 mmol/L,CaCl22 mmol/L,NaHCO325 mmol/L,葡萄糖10 mmol/L,HEPES 10 mmol/L,pH 7.3,使用前通95% O2+5% CO2混合气饱和。高糖切片液:KCl 2.5 mmol/L,CaCl21 mmol/L,MgCl26 mmol/L, NaH2PO41.625 mmol/L, NaHCO326 mmol/L,葡萄糖11 mmol/L,蔗糖220 mmol/L,pH 7.4,使用前通95% O2+5% CO2混合气饱和。动作电位电极内液:葡萄糖酸钾(K-gluconate)125 mmol/L,NaCl 15 mmol/L,MgCl22 mmol/L,CaCl21 mmol/L, EGTA 11 mmol/L, HEPES 10 mmol/L,Na-ATP 3 mmol/L,Na-GTP 0.3 mmol/L。用KOH 将pH 调至7.2~7.3,分装冷冻前及使用前都要经0.22 μm 滤膜过滤。K+通道记录细胞外液:NaCl 130 mmol/L,KCl 5 mmol/L,CaCl22 mmol/L,MgCl21 mmol/L, 葡萄糖10 mmol/L, HEPES 10 mmol/L,TTX 0.001 mmol/L,CdCl20.2 mmol/L。用NaOH 将pH 调至7.4。K+通道记录电极内液:KCl 140 mmol/L, MgCl22 mmol/L, EGTA 10 mmol/L,HEPES 10 mmol/L,Mg-ATP 2 mmol/L。用KOH 将pH 调至7.2,分装冷冻前及使用前都要经0.22 μm滤膜过滤。
1.2 脑片的制备与孵育
选用24只1月龄健康雄性昆明小鼠作为实验对象,购买于北京华阜生物科技股份有限公司。使用10%浓度的水合氯醛溶液对其进行腹腔注射进行深度麻醉,迅速斩首取脑,剥离出切除额叶前端和小脑后端的大脑部分并浸泡在提前准备好的0~4℃冰水混合状态且含饱和氧气的切片液中,为确保神经细胞的活性,整个过程控制在3 min以内。待大脑在切片液中降温2~3 min后取出,用滤水纸吸干大脑表面溶液,将其断面大口朝下放置涂有502胶水的切片槽中央,倒入含有冰块的切片液,调整切片机刀片进刀角度,后用VT1200S 切片机(德国徕卡)在冰芯切片液中切出300 μm 的脑切片,用吸管选择具有完整海马区域的脑片,并将其置于持续通有95% O2+5% CO2混合气体的人工脑脊液孵育槽中,保持孵育槽温度在28℃的环境中,孵育约1 h 后用于实验。该动物实验全部内容均根据中国相关指南和规定进行,由河北工业大学生物医学伦理委员会审批(编号为HEBUTaCUC2020007),且符合实验动物使用规范。
1.3 磁场装置及实验设计
实验采用小功率MCR-WPT装置,高频电源通过发射线圈传输高频交变电流,然后与接收线圈发生磁耦合谐振,从而实现电能从发射端到接收端的高效无线传输过程,可通过观察发射端与接收端分别带有的功率表调整功率,无线电能传输装置工作频率位于45~60 kHz 之间,实际所采用频率为f=(L为线圈电感,C为补偿电容),发射线圈与接收线圈相距200 mm、发射线圈Pin≈54.2 W,负载接收端控制在(25±0.5)W,发射线圈与接收线圈为边长32 cm的正方形基板,线圈材料为定制的利兹线,实验系统如图1所示。
在小鼠适应环境1周后,将小鼠随机分为4组,A、B、C 组为实验组(A 组辐射5 d、B 组辐射15 d、C 组辐射30 d),D 组对照组,每个组均为6只小鼠。打开无线电能传输试验箱,将实验组的鼠笼每天放置于发射线圈与接受线圈之间的中部暴露5 h。由于两线圈规格大小的关系,两个鼠笼叠加放置,每日开始前交换鼠笼位置(图1c)。对照组在每天相同条件下,但不打开无线电能传输装置。
为明确两线圈之间的磁场分布情况,以线圈为中心做一个垂直于线圈的切面,并计算该切面上线圈电磁场的分布情况(图2)。根据三维电磁辐射分析仪的测量结果统计分析可知,小鼠活动范围的电场强度平均值为316.8 V/m,磁感应强度平均值为272.5 μT,小鼠头部感应电场强度峰值为0.806 49 V/m[25]。

Fig. 1 The electromagnetic exposure experimental platform of WPT
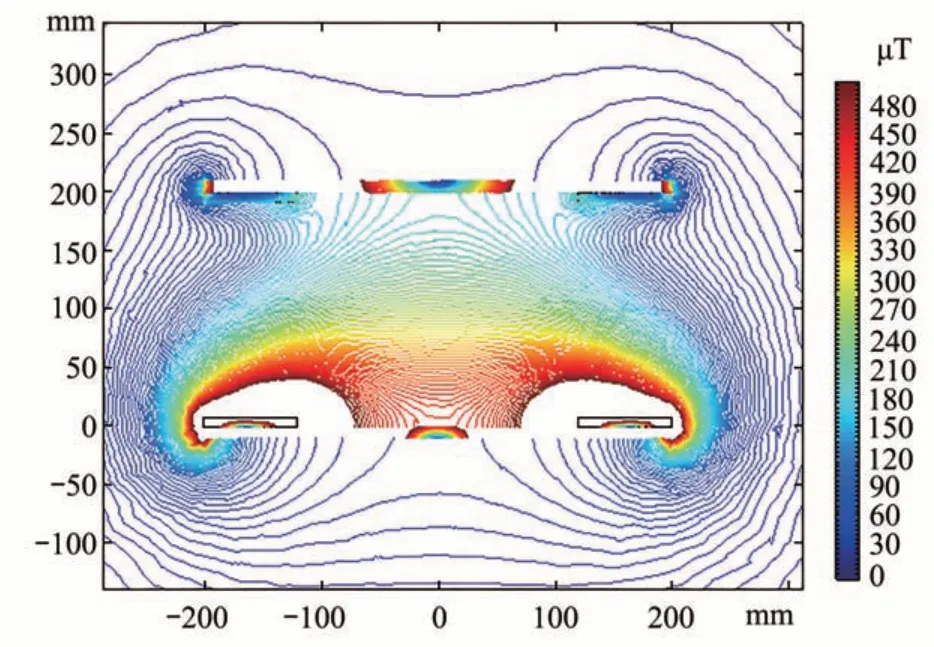
Fig. 2 Distribution of magnetic field
1.4 新物体识别实验
小鼠辐射结束后,依次单独放入新物体识别实验箱(江苏赛昂斯生物科技有限公司)中进行实验,实验包含3 个阶段:熟悉期、测试I 期和测试II期。熟悉期:提前在箱中底部靠近箱体的一侧平行摆放两个完全相同的物体,让小鼠在安静且不被打扰的环境中自由活动5 min后将其取出,放回饲养笼中。测试I 期:待熟悉期结束1 h 后进行,将其中一个物体替换成另一个形状颜色不同但尺寸相当的新物体后,将小鼠放入相同的环境中自由活动5 min后取出,放回饲养笼中。测试II期:测试I期结束24 h后进行,将另一旧物体替换成另一个形状颜色不同但尺寸相当的新物体后,在相同的环境中放入小鼠自由活动5 min 后取出,放回饲养笼中。在实验过程中,配备Any-maze 行为学跟踪软件跟随并记录小鼠的行为轨迹[26-27]。每只小鼠从实验箱被取出后都需用75%的酒精对箱体进行擦拭,防止上一只小鼠遗留的气味对后来的小鼠行动造成影响。计算新物体的认知指数(cognitive index,CI),计算方法为认知指数=探索新物体的时间/(探索新物体的时间+探索旧物体的时间)[28]。通过测试I期与测试II 期获得的认知指数分别记为CI(1 h)与CI(24 h)。
1.5 全细胞膜片钳记录
在20~25℃室温环境内,使用EPC10膜片钳信号放大器(HEKA公司,德国)进行全细胞膜片钳记录,实验采用外径1.5 mm 内径0.86 mm 规格硼硅酸盐材质的玻璃微电极,经P-97 拉制仪(SUTTER 公司,美国)两步拉制获得,往电极中灌注解冻后的电极内液至电极针身1/3处,避免安装电极时内液溢出污染电极夹持器,灌注后可捏住电极尾部轻轻甩动,将电极内的气泡排出。
将灌注好的电极固定在电极夹持器上,用吸管选取孵育完成的脑片平铺在膜片钳操作台上的记录槽中,并用尼龙网固定,在低倍镜下将脑片海马齿状回尖端移至视野中央后切换为高倍镜及红外场,在水镜下锁定海马DG区内的一个颗粒细胞后标记位置上抬镜头,将电极缓慢移入记录槽中可看到阻抗为5~10 MΩ,当电极与细胞膜之间形成高阻封接后(>1 G),给予快电容补偿,然后用注射器给予适量的脉冲式负压进行破膜。破膜成功即可看到阻值跳变至200~300 MΩ左右,此时细胞内液与电极内液相通,待电阻稳定后给予慢电容补偿,之后将记录模式更改为电流钳模式,可用于记录电压信号,膜电流置零记录静息膜电位,给予足够的去极化电流刺激记录诱发动作电位,将记录模式更改为电压钳模式,可用于记录离子通道电流信号。
1.6 数据分析
实验结束后,采用非重复测量的单因素方差(one-way ANOVA)分析方法对数据进行分析,组间的多重比较采用Tukey-test 分析方法,事后分析采用Tukey-test矫正下的成对t检验分析方法。使用GraphPad Prism 6.0 和Origin2017 软件对结果进行统计并以mean±SEM的方式表示,检验水准0.05。
2 结果
2.1 MCR-WPT对小鼠学习记忆的影响
在熟悉期的实验阶段中,对小鼠的运动轨迹进行数据分析。磁场暴露5 d 组和磁场暴露15 d组的运动轨迹密集程度较高,磁场暴露30 d组运动轨迹最为稀疏,运行轨迹如图3所示。为判定小鼠在不同磁场暴露环境下的运动能力,对其在熟悉期的运动轨迹长度进行定性分析(图4),小鼠磁场暴露组与对照组在熟悉期的运动轨迹长度皆无显著差异。

Fig. 3 Motion trajectory during the familiarization period
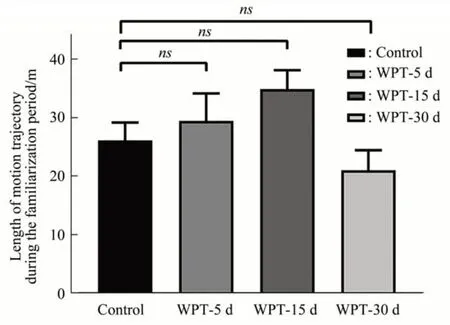
Fig. 4 Length of motion trajectory during the familiarization period
新物体识别实验通过设置颜色及形状各异的两类物体来获得小鼠对新旧物体的喜好程度,分别计算了测试I期和测试II期小鼠探索新旧物体的次数比和认知指数。实验结果表明,30 d辐射组与对照组的新物体识别能力差异最大且CI低于对照组,但无显著性差异(图5)。
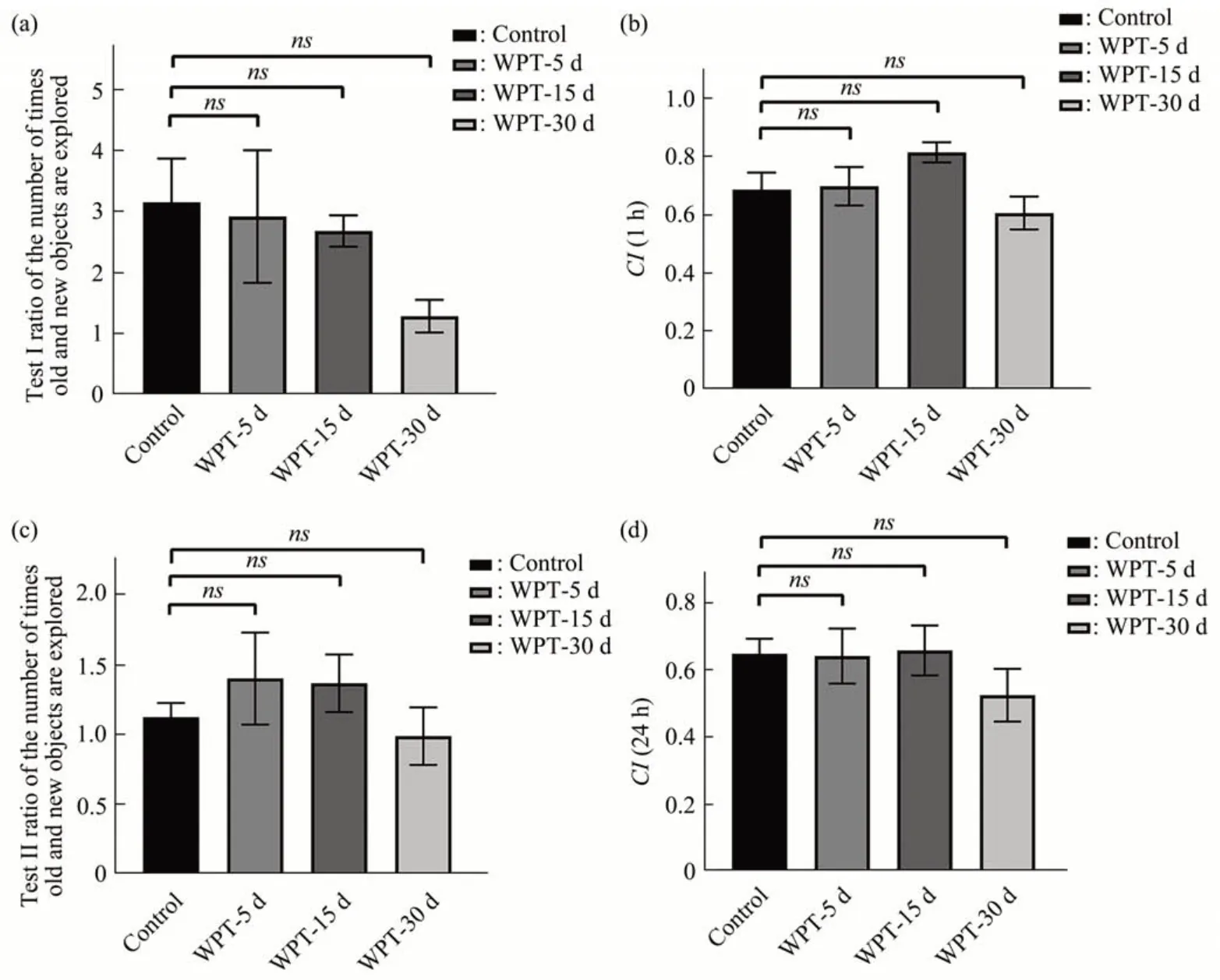
Fig. 5 Test period data analysis
2.2 MCR-WPT对瞬时外向钾通道电流(IA)的影响
本文主要研究对电流-电压(I-V)曲线的影响。使用K+通道电极内液和全细胞外液,并在外液中加入终浓度为25 mmol/L 的TEA-Cl,使用NaOH 调节pH 至7.4。用于阻断神经元上的Ca2+电流、Na+电流和延迟整流K+电流。
a. 在全细胞膜记录模式下,将钳制电位设定为-100 mV,给予细胞-50~+90 mV,步阶10 mV,波宽为200 ms 的去极化脉冲刺激(图6a)后,可得到一组外向电流IA。以膜电位为横轴,该膜电位下激活的IA峰值为纵轴,绘制IA的I-V曲线(图6b)。对同一膜电位下的电流峰值分析,对照组IA电流峰值明显大于磁场暴露组,磁场暴露30 d组的IA最小,磁场暴露5 d组的IA在磁场暴露组中最高,但仍显著小于对照组,且随着去极化电压的变化,磁场暴露时间的增加对IA峰值的抑制作用更为明显。说明MCR-WPT电磁环境可明显抑制瞬时外向钾电流IA,且其影响程度随着暴露天数的增加而增强,具有时间依赖性。
b. 在全细胞膜记录模式下,将钳制电位设定为-100 mV,预先给予-110 mV波宽400 ms的超极化条件刺激,然后给予-50~+90 mV,步阶10 mV,波宽为150 ms 的去极化测试脉冲至+90 mV(图7a),得到一组瞬时外向钾电流,此为IA的稳态激活过程。使用公式G=I∕(Vm-Vr)将瞬时外向钾电流值转换为电导值,其中G为电导,I为不同测试脉冲下的峰值电流,Vm为膜电位,Vr为反转电位。以膜电位为横坐标,G∕Gmax为纵坐标,绘制通道的激活散点图。然后使用Boltzmann 方程对得到的激活散点图进行拟合,其中Vm为膜电位,为半数激活电压,k为斜率因子(图7b)。根据得到的曲线图可以看出对照组与磁场暴露组皆呈S形,且与对照组相比,磁场暴露组曲线皆向右偏移。使用t检验分析方法,可以看出对照组与磁场暴露组IA的半数激活电压V12之间的具有统计学差异,而斜率因子k的统计学差异不明显(表1)。由此可知,MCR-WPT电磁环境不改变其斜率因子,但可使IA的激活特性发生明显改变,令激活曲线向去极化方向移动,提高瞬时外向钾通道蛋白的激活膜电位。

Fig. 6 I-V stimulation procedure (a) and I-V curve (b) of IA

Table 1 The activation parameters of IA
c. 在全细胞膜记录模式下,将钳制电位设定为-100 mV,预先给予-110~+10 mV,步阶10 mV,波宽为80 ms 的阶梯去极化条件脉冲,然后给予+50 mV波宽80 ms的测试脉冲(图8a),得到一组瞬时外向钾电流,此为IA的稳态失活过程。绘制以膜电位为横坐标,电流峰值与电流最大峰值的比值I/Imax为纵坐标的失活散点图。然后使用Boltzmann方程I∕Imax= 1∕{1 + exp [(Vm-V12)∕k]}对得到的失活散点图进行拟合,其中I为每条测试脉冲下的电流峰值,Vm为膜电位,V12为半数失活电压,k为斜率因子(图8b)。由绘制曲线图可以看出对照组与磁场暴露组皆呈反S形,且与对照组相比,磁场暴露组曲线皆向左偏移,其中磁场暴露30 d组的斜率因子k显著小于对照组(表2)。由此可知,长时间处于MCR-WPT电磁环境中可使IA的失活特性发生明显的改变,令失活曲线向去极化方向移动,并改变其斜率因子,缩短瞬时外向钾通道蛋白的开放时间,提高失活速率。

Fig. 8 Deactivation stimulation procedure (a) and deactivation curve (b) of IA
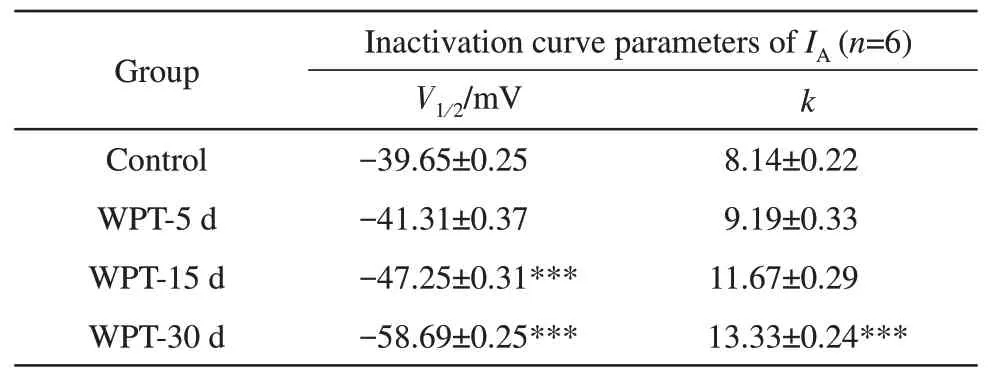
Table 2 The deactivation parameters of IA
d. 在全细胞膜记录模式下,将钳制电位设置为-100 mV,预先给予两个+50 mV波宽80 ms的条件脉冲与测试脉冲,两个脉冲间隔保持钳制电位-100 mV,时间1~256 ms(图9a),得到一组瞬时外向K+电流,即IA的失活再恢复的过程。以间隔时间为横坐标,测试脉冲的峰电流与条件脉冲的峰电流的比值I2/I1为纵坐标绘制恢复散点图。然后利用公式I2∕I1=A+B× exp (-t∕τ)对得到的恢复散点图进行拟合,其中I2为测试脉冲的峰电流,I1为条件脉冲的峰电流,τ为恢复时间常数(图9b)。由绘制曲线图可以看出与对照组相比,磁场暴露组皆向右偏移,其中磁场暴露15 d组和30 d组的IA失活后的恢复时间与对照组相比显著延长(表3)。
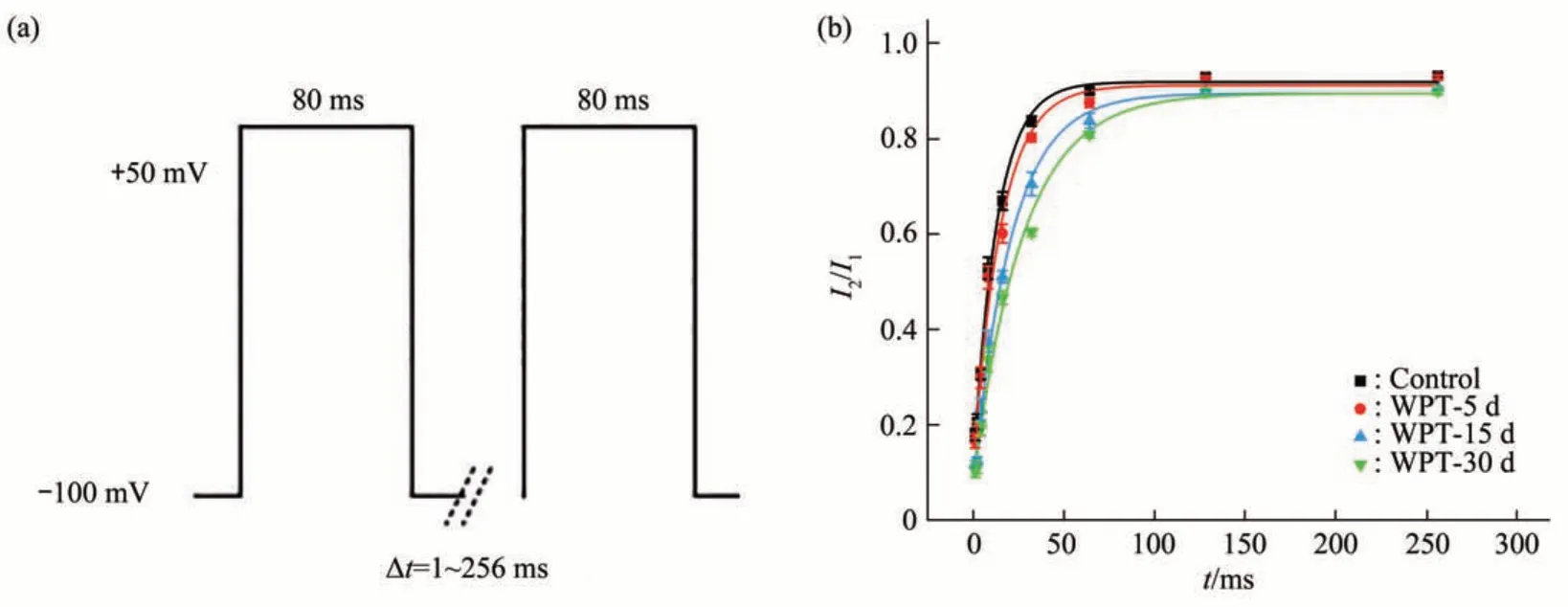
Fig. 9 Resurrection stimulation procedure (a) and resurrection curve (b) of IA

Table 3 The recovery parameters of IA
2.3 MCR-WPT对延迟整流K+通道电流(IK)的影响
本文主要考察对I-V曲线的影响。使用K+通道电极内液和全细胞外液,并在外液中加入终浓度为3 mmol/L的4-氨基吡啶(4-aminopyridine,4-AP),使用NaOH 调节pH 至7.4。用于阻断神经元上的Na+电流、Ca2+电流和瞬时外向K+电流。由于延迟整流K+通道电流的激活过程为延迟激活,具有短时间内不失活,失活速度缓慢的特点,因此在实验中不考虑IK的失活与恢复过程[29]。
a. 在全细胞膜记录模式下,将钳制电位设定为-50 mV,给予-50~+90 mV,步阶10 mV 波宽为300 ms 的去极化脉冲刺激(图10a),得到一组外向电流IK。以膜电位为横轴,同一膜电位下激活的IK峰值为纵轴,绘制IK的I-V曲线(图10b)。对同一膜电位下的电流峰值分析,对照组IK电流峰值明显大于磁场暴露组,磁场暴露30 d组的IK最小,磁场暴露15 d 组与5 d 组的IK相近,但仍与对照组之间存在显著性差异。说明MCR-WPT电磁环境可明显抑制延迟整流钾电流IK,且随着去极化电压的变化,磁场暴露时间的增加对IK峰值的抑制作用更为明显,具有时间依赖特性。

Fig. 10 I-V stimulation procedure (a) and I-V curve (b) of IK
b. 在全细胞膜记录模式下,将钳制电位设定为-50 mV,预先给予-110 mV 波宽为400 ms 的超极化条件刺激,然后给予-50~+90 mV,步阶10 mV,波宽为150 ms 的去极化测试脉冲(图11a),得到一组延迟整流钾电流,此为IK的稳态激活过程。利用公式G=I∕(Vm-Vr)将所得延迟整流钾电流值转换为电导值,其中G为电导,I为不同测试脉冲下的电流峰值,Vm为膜电位,Vr为反转电位,以膜电位为横坐标,G∕Gmax为纵坐标,绘制通道的激活散点图。然后利用Boltzmann 方程G∕Gmax=1∕{1 + exp [(Vm-V12)∕k]}对得到的散点图进行拟合,其中Vm为膜电位,V12为半数激活电压,k为斜率因子(图11b)。由绘制曲线图可以看出对照组与磁场暴露组皆呈S形,且与对照组相比,磁场暴露组曲线皆向右偏移。使用t检验分析方法,可以看出对照组与磁场暴露组IK的半数激活电压V12之间具有统计学差异,而斜率因子k的统计学差异不明显(表4)。由此可知,MCR-WPT电磁环境不改变其斜率因子,但可使IK的激活特性发生明显改变,令激活曲线向去极化方向移动,提高延迟整流钾通道的激活膜电位。
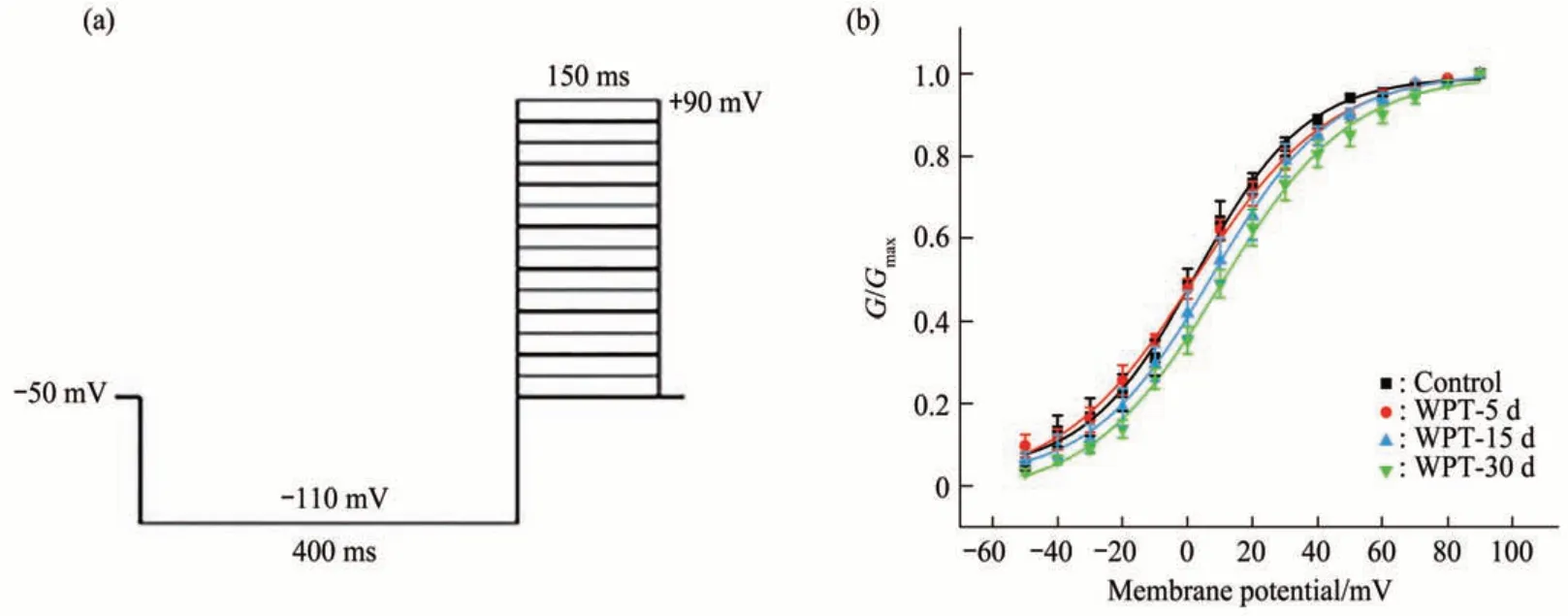
Fig. 11 Activating stimulus program (a) and activation curve (b) of IK

Table 4 The activation parameters of IK
3 讨论
国际上已有大量报告指出,不同频段的电磁波会对生物的神经系统产生影响,引起生物行为和记忆等方面问题[30-32]。本文主要从离子通道的角度利用全细胞膜片钳技术,研究频率为47 KHz 小功率MCR-WPT电磁环境对小鼠海马DG区神经元电压门控膜电流IA和IK的影响。
新物体识别实验通过更改实验箱中物体的形状、颜色观察小鼠的识别记忆能力,基于小鼠对新旧事物的探索偏好来反映小鼠的记忆能力。结果表明,在频率为47 KHz 的小功率MCR-WPT 电磁环境中,每天暴露5 h,连续30 d 暴露,小鼠的识别能力和记忆功能没有受到影响。膜片钳实验结果表明,与对照组相比,磁场暴露组IA与IK的I-V曲线的激活曲线显著降低,且随着暴露时间的增加,受到的抑制作用更明显,使膜的去极化过程延迟,提高了神经元产生动作电位的速度,改变神经元之间的传导速度。磁场暴露组IA与IK的半数激活电压V12在电磁环境的作用下明显增大,激活曲线明显右移,斜率因子无明显改变,可以看出K+通道的激活阈值增大,激活难度增加,但激活速率不变。另外,IA的半数失活电压V12减小,恢复时间显著延长,缩短了激活过程,同时IA恢复时间的显著延长,使电压门控K+通道的开放时间缩短,抑制了细胞膜电位的复极化过程。
根据生物电磁学理论,神经元作为神经系统基本的结构和功能单位,神经兴奋性是神经元在放电状态和静息状态之间转换的动力学机制[33],与K+通道的开放与关闭密切相关。当磁场作用于细胞时,细胞膜表面的极性类脂分子形成的电偶极子会受到电磁场的影响,改变细胞膜通道内离子能量,引起离子跨膜迁移的变化,改变细胞膜的厚度、电导和电容[34]。本文研究结果中,IA与IK的激活过程与IA的失活过程受到抑制,IA的失活过程受到促进,可能是在外加磁场的作用下,改变了K+通道蛋白的开放频率,提高了神经元的敏感性。由于K+在设置静息电位与动作电位下降的过程中起着重要作用,阻碍K+外流,提高了细胞内的电位水平,使细胞持续处于较高的兴奋状态。李刚等[35-36]研究不同强度工频磁场对神经元瞬时外向K+通道和延迟整流K+通道的影响,与本文有着相似的实验结果,工频磁场都对IA与IK产生了抑制作用,改变神经元动作电位的发放频率。
4 结论
本文研究结果表明,短时间内在MCR-WPT电磁环境下生活,会令细胞膜上瞬时外向K+通道的激活过程受到抑制、延迟整流K+通道的激活特性向去极化方向移动,减少细胞内K+的外流,增强神经兴奋性。有相关研究表明,在外加电磁场的作用下,组成K+通道孔洞的重要蛋白质α螺旋蛋白质分子会改变离子跨膜迁移的几率,从而影响离子通道蛋白的开放过程[19],这种改变是否可逆尚不确定。可在下一步实验中开展对海马区细胞形态、通道蛋白或其他区域的研究,完善WPT 电磁场作用机理,为WPT 技术的发展及其合理开发应用提供具有一定参考价值的实验数据和理论依据。
