壳聚糖与细菌细胞膜相互作用的分子动力学研究*
2023-08-14朱景一马振宇王禄山蒋绪恺
朱景一 马振宇 肖 敏 王禄山 蒋绪恺*
(1)山东大学国家糖工程技术研究中心,微生物技术国家重点实验室,青岛 266237;2)山东大学生命科学学院,青岛 266237)
壳聚糖(chitosan,CS)是一种无抗原性、无毒性、具有良好生物相容性的天然生物高分子,其结构由D-氨基葡萄糖(脱乙酰单位)和N-乙酰-D-氨基葡萄糖(乙酰单位)经β-1,4 糖苷键连接而成[1]。脱乙酰壳聚糖具有抗革兰氏阳性菌(如蜡状芽孢杆菌、金黄色葡萄球菌、巨大芽孢杆菌、植物乳杆菌、单核细胞增生性李斯特菌、短乳杆菌和保加利亚乳杆菌)和抗革兰氏阴性菌(如鼠伤寒沙门氏菌、大肠杆菌、铜绿假单胞菌、荧光假单胞菌、副溶血弧菌、产气肠杆菌和霍乱弧菌)的广谱抗菌活性[1],作为一种有巨大开发潜力的医用抗菌材料而受到了广泛关注[2]。
壳聚糖的抗菌活性主要受其分子质量(聚合度)与脱乙酰化程度(DDA)的影响[3-4]。关于蜡状芽孢杆菌、大肠杆菌、金黄色葡萄球菌、绿脓杆菌、肠道沙门氏菌和枯草芽孢杆菌的研究表明,低分子质量的壳聚糖具有更好的抑菌效果[4]。分子质量为470 ku的壳聚糖对革兰氏阴性菌和革兰氏阳性菌均有可观的抑菌效果,而分子质量为1 106 ku的壳聚糖对革兰氏阳性菌的抑制作用明显降低[5]。此外,有研究表明壳聚糖分子质量介于5 ku和305 ku之间时,随着分子质量的增大,壳聚糖对金黄色葡萄球菌的抑制效果逐渐增强,而对大肠杆菌的抑制效果却逐渐减弱[6]。另一方面,壳聚糖的脱乙酰化程度决定了分子正电荷强度,进而影响其抗菌活性。研究表明壳聚糖的抗菌活性可以被N-乙酰化修饰显著抑制[6];膜电负性降低的鼠伤寒沙门氏菌突变体对壳聚糖抗性增加,而膜电负性增加的金黄色葡萄球菌对壳聚糖敏感性增强[7-8];膜表面带有较多正电化学基团的金黄色葡萄球菌突变体,对脱乙酰壳聚糖抗性增加[9]。同时,电镜和生化实验发现壳聚糖在细菌表面发生堆积,导致细胞膜破裂和胞内成分泄露,并最终造成细菌死亡[7,10]。这些研究都说明了壳聚糖与细菌细胞膜的相互作用可能是其发挥抗菌活性的关键机制。
尽管如此,壳聚糖与细菌细胞膜相互作用的分子机制尚不清楚,这主要是受限于传统实验技术的表征能力。一方面,结构生物学方法无法解析得到高分辨率的细胞膜三维结构,这就限制了人们对细菌细胞膜结构性质的准确认识;另一方面,细胞膜的流动性特征导致利用生化检测技术难以追踪化学分子与细胞膜的动态相互作用过程。近年来,随着计算机硬件能力的提高以及分子模拟算法的不断优化[11],分子动力学模拟技术在细胞膜的结构功能研究中得到了广泛应用[12-13]。前期工作中,本课题组建立了基于分子动力学模拟技术的药物-细胞膜互作研究平台,系统阐明了脂肽类分子的抗菌活性机制[14-15]、耐药机制[16]和肾毒性机制[17],并指导设计出一系列具有临床应用前景的新型抗菌药物[18-19]。本文搭建了不同聚合度的壳聚糖(八聚糖(chitosan-8)、十二聚糖(chitosan-12)和十六聚糖(chitosan-16)) 与革兰氏阴性菌外膜(outer membrane, OM) 和革兰氏阳性菌质膜(cytoplasmic membrane,CM)相互作用的全原子分子模拟体系,探究了壳聚糖与不同细胞膜系统相互作用的动态识别、结合与膜插入过程,并比较分析了壳聚糖对OM 和CM 结构性质的差异化影响,为进一步理解壳聚糖的抗菌活性机制提供了新的视角。
1 材料与方法
1.1 体系构建
OM 和CM 的结构模型均使用CHARMM-GUI Membrane Builder 模块搭建。OM 模型内小叶由102 个1-棕榈酰基-2-油酰基磷脂酰乙醇氨分子(POPE)和34 个1-棕榈酰基-2-油酰基磷脂酰甘油分子(POPG)构成,外小叶由43个脂质A(lipid A)分子构成;CM 模型内外小叶均由102 个POPE 和34个POPG构成[20]。OM和CM初始厚度分别约为4.18 nm 和4.30 nm,膜平面与z 轴垂直。模拟体系使用TIP3P水模型进行溶剂化[21],并添加0.1 mol/L NaCl 进行电性中和;此外,OM 体系额外加入0.1 mol/L CaCl2以模拟真实环境并维持细菌外膜系统的稳定。模拟体系初始大小约为9.02 nm×9.02 nm×13.43 nm。利用CHARMM-GUI Glycan Builder工具构建100%脱乙酰并质子化的三种聚合度的壳聚糖分子模型,分别为chitosan-8、chitosan-12和chitosan-16 (图1a), 并使用gmx insertmolecules 工具,通过替换水分子将壳聚糖分子分别置于膜结构的上方,每种聚合度分别插入3个分子(编号为a、b、c),同时删除相应数目的盐离子保持体系电中性,依据壳聚糖分子的聚合度将体系命名为Chitosan-8、Chitosan-12 和Chitosan-16。不加入任何壳聚糖分子的模拟体系作为对照组,并用Chitosan-0 表示。此外,按上述同样的方法构建25%、50%脱乙酰并质子化的和100%脱乙酰非质子化的壳八聚糖分子模型,并将其置入到OM 和CM 体系中,作为补充体系。OM 体系包含约100 400 个原子,CM 体系包含约101 700 个原子。拓扑参数均来自CHARMM36全原子力场[22]。
1.2 模拟参数
分子动力学模拟使用GROMACS 5.1.2 软件包计算[23],采用最陡下降法对体系进行能量优化[24]。通过逐渐减小脂质分子重原子的位置局限,进行了6次连续的体系平衡计算模拟。在平衡过程中,通过Berendsen 温度耦合算法将模拟体系温度维持在313 K,使用Berendsen 和半各项异性耦合算法控制压力维持在1个大气压[25]。平衡完成后,对每组模拟体系进行200 ns的模拟,模拟采用蛙跳算法[26](leapfrog algorithm),积分步长设为2 fs,长程静电相互作用采用PME算法[27]处理,短程邻近列表截断和短程库伦截断半径设定为1.2 nm,使用Nose-Hoover 算法和Parrinello-Rhaman 半各向异性耦合算法控制体系的温度和压力为313 K 和1 个大气压[28-30],温度和压力耦合的时间常数分别为1 ps和5 ps,计算范德华作用的截断半径为1.2 nm。通过LINCS[31]算法约束壳聚糖和脂质分子的键长。
1.3 数据分析
使用gmx trjconv 工具,以10 ns 为间隔捕捉轨迹并输出为pdb 文件,使用PyMOL 软件实现结构可视化。使用gmx make_ndx 工具对壳聚糖的不同官能团进行分组,包括还原端1 位碳连接的羟基C1-OH、2位碳连接的质子化氨基C2-NH3+、3位碳连接的羟基C3-OH、糖苷键、非还原端4位碳连接的羟基C4-OH、连接5 位碳与1 位碳的氧原子C5-O、6 位碳连接的羟基C6-OH(图1a)。使用gmx hbond工具计算不同官能团与膜组分的氢键数目,使用gmx mindist 计算壳聚糖不同官能团与膜组分的接触次数。使用gmx density 工具计算体系各组分沿z轴的质量密度分布。使用gmx order 工具计算膜外小叶脂质分子脂肪酸链各碳原子的序参数。使用gmx rdf工具,在OM体系中以lipid A的1位磷原子为参考点,计算Ca2+、Na+、Cl-的径向分布函数;在CM 体系中以POPG 的磷原子为参考点,计算Na+、Cl-的径向分布函数。使用gmx energy工具计算模拟盒子的边长,平方运算后求得膜表面积,用以计算单分子脂质面积。
2 结果
2.1 壳聚糖与革兰氏阴性菌OM和革兰氏阳性菌CM动态结合分析
经过200 ns的全原子分子动力学模拟,发现不同聚合度的壳聚糖分子均能完全结合到革兰氏阴性菌OM和革兰氏阳性菌CM的极性区域并维持到模拟结束,但结合的动态过程呈现出不同的特征(图1b)。在OM 模拟体系中,chitosan-8 分子在经过40 ns 模拟后实现与OM 极性区域的完全结合,而chitosan-12 和chitosan-16 分子分别经过50 ns 和130 ns模拟后实现与OM极性区域的完全结合。在CM 模拟体系中,chitosan-8 分子在经过10 ns 的模拟后实现与CM极性区域的完全结合,而chitosan-12和chitosan-16 分子经过60 ns 的模拟后实现与CM极性区域的完全结合。由此可见,壳聚糖链长是影响其与细胞膜结合效率的关键因素。
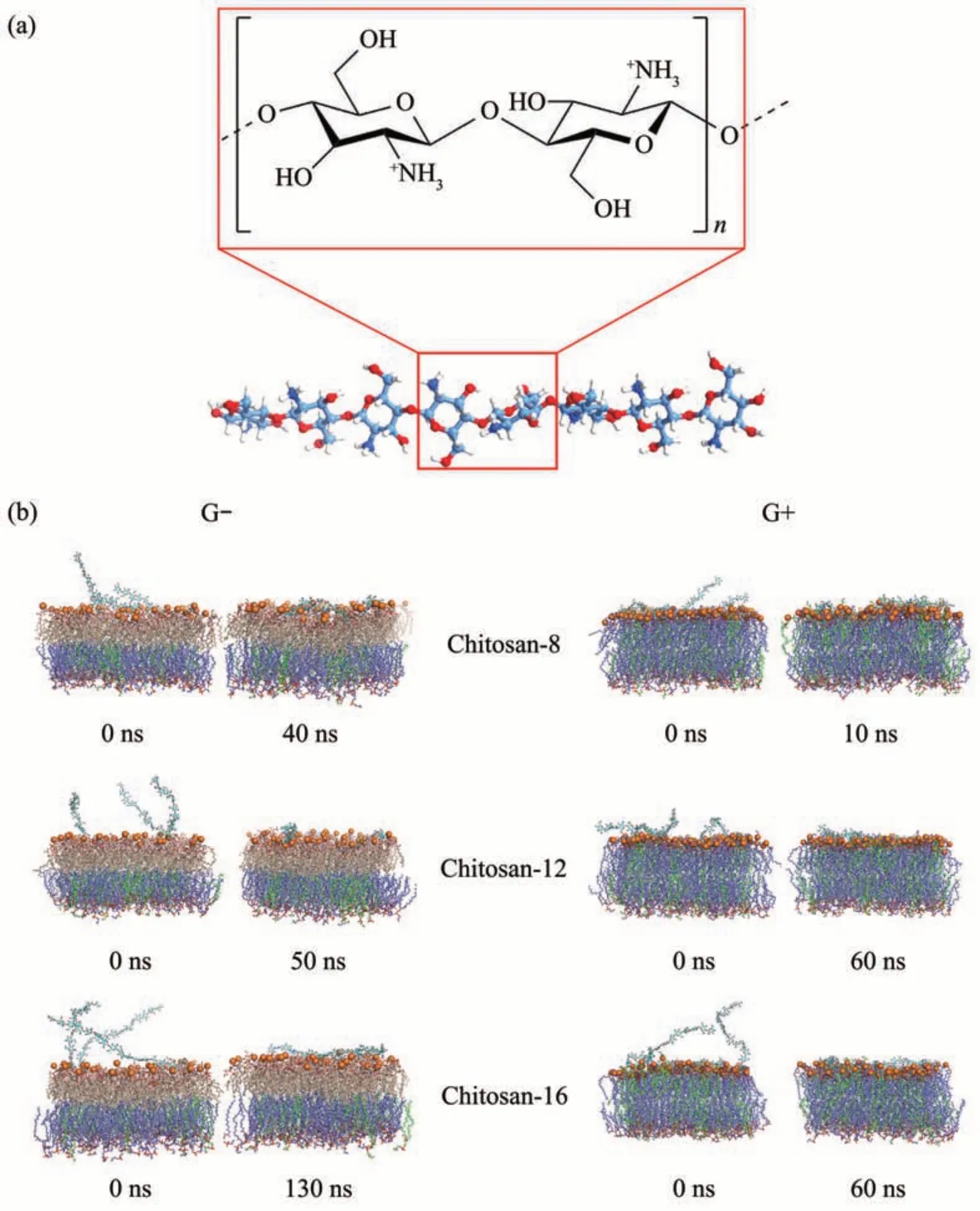
Fig. 1 Snapshots of the interaction between chitosan and bacterial membranes
为了进一步理解壳聚糖与OM和CM相互作用的细节,本文计算了壳聚糖分子中不同官能团与膜脂质形成的接触数(图2a)和氢键数(图2b)。在OM体系中,-NH3+贡献的接触数在chitosan-8、-12和-16 体系中分别为1 507、2 000 和2 042,占总接触数的41%、41%和43%,平均形成氢键1.6 个,C3-OH贡献的接触数分别为689、847和825,占总接触数的19%、17%和18%,平均形成氢键0.5个,C6-OH贡献的接触数分别为739、1 013和970,占总接触数的20%、21%和21%,平均形成氢键0.6个。壳聚糖分子中的其他基团,包括还原端C1-OH、非还原端C4-OH 和糖苷键,贡献的接触数占比总数2%到7%。在CM体系中,-NH3+与CM贡献的接触数在chitosan-8、-12 和-16 体系中分别为1 781、2 567和3 138,占总接触数的43%、45%和45%,平均形成氢键1.9 个,C3-OH 贡献的接触数分别为771、1 083和1 274,占总接触数的19%、18%和18%,平均形成氢键0.5 个,C6-OH 贡献的接触数分别为810、1 082 和1 368,占总接触数的20%、19%和20%,平均形成氢键0.75个。壳聚糖分子中的其他基团,贡献的接触数占比总数2%到6%。上述结果证明了-NH3+主导了壳聚糖与细菌细胞膜的相互结合,而C6-OH 与C3-OH 也发挥了一定程度的辅助作用。
此外,为了进一步验证本文观点,搭建25%、50%脱乙酰质子化和100%脱乙酰非质子化的壳八聚糖与OM和CM的全原子模拟体系并计算壳八聚糖与膜形成的氢键数目(图S1),结果显示,25%、50%和100%脱乙酰质子化壳八聚糖与膜形成的氢键数目分别为(17±4)、(24±4)和(30±5),这说明壳聚糖和膜相互作用强度与氨基质子化程度呈正相关。而非质子化壳八聚糖尽管脱乙酰度为100%,但其与膜形成的氢键数却不足5,约为对应质子化壳八聚糖的1/6。这些结果都说明了-NH3+在介导与膜的结合中起着至关重要的作用。
2.2 壳聚糖插入革兰氏阴性菌OM和革兰氏阳性菌CM的动力学分析
壳聚糖结合到膜表面后,发现其末端糖基单元(还原端或非还原端)部分插入到OM 和CM 中(图3、4)。为探究壳聚糖末端糖基插入膜的稳定性,本文分析了膜脂质磷原子与壳聚糖末端糖基单元原子的运动轨迹(图S2,S3)。结果显示,在OM 体系中,3 个chitosan-8 分子中的1 个还原末端糖基和2 个非还原末端糖基均能稳定地插入OM中,持续的模拟时长分别为50、100 和120 ns,3个chitosan-12分子中1个还原末端糖基稳定地插入OM,持续时长约为180 ns;3个chitosan-16分子中的2 个非还原末端糖基稳定插入OM,持续时长分别为50 和100 ns(图S2)。在CM 体系中,虽然同样观察到壳聚糖分子插入膜内部的现象,但持续时间均不超过20 ns(图S3)。上述结果表明壳聚糖末端糖基倾向于稳定地插入到OM内部区域,而难以稳定地插入CM内部区域。
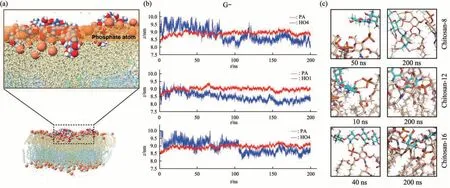
Fig. 3 Chitosan inserts into the outer membrane
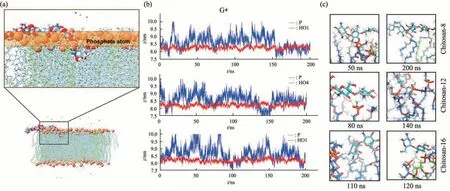
Fig. 4 Chitosan inserts into the cytoplasmic membrane
进一步分析壳聚糖末端糖基在插入前后与膜脂质形成的氢键网络(图3、4),发现壳聚糖末端糖基与脂质的脂肪酸链羰基形成氢键是膜插入的共性特征。在OM 体系中,chitosan-8 非还原末端糖基插入OM前(t=50 ns)仅与膜表面的磷酸基团形成氢键,插入后(t=200 ns),其C4-OH 和-NH3+与lipid A 脂肪酸链的羰基分别形成1 个氢键。chitosan-12 还原末端糖基插入OM 前(t=10 ns)与膜表面的磷酸基团形成3个氢键,与lipid A脂肪酸链的羰基形成1 个氢键,插入后(t=200 ns),其C1-OH、-NH3+和C6-OH 与lipid A 脂肪酸链的羰基形成3 个氢键。chitosan-16 非还原端糖基插入OM前(t=40 ns)仅与膜表面的磷酸基团形成2 个氢键,插入后(t=200 ns),其-NH3+和C3-OH 与lipid A 脂肪酸链的羰基形成3 个氢键。在CM 体系中,同样发现壳聚糖末端糖基在插入后主要与磷脂分子的脂肪酸链上的羰基形成氢键(图4)。上述结果表明,壳聚糖末端糖基与脂质的脂肪酸链羰基形成的氢键作用可能是诱导其插入膜内部的关键因素。
2.3 壳聚糖对细菌细胞膜结构的影响
为进一步探究壳聚糖对细菌细胞膜结构性质的影响,分析各模拟体系的质量密度分布(mass density distribution,Density)、离子径向分布函数(radial distribution function,RDF)、脂质单分子面积(area per lipids,APL)和脂质分子脂肪酸链序参数(order parameters,Scd)。结果显示壳聚糖未对体系中各组分的密度分布和脂质分子脂肪酸链序参数产生明显影响(图S4,S5),但却改变了模拟体系中的离子分布和脂质单分子面积(图5)。这说明壳聚糖结合主要影响了膜脂质分子间的相互作用。
壳聚糖使OM 和CM 极性区的Na+和Ca2+数目明显减少(图5a)。在OM 对照体系中,Ca2+在距离lipid A 的1 位磷原子0.3 至0.7 nm 的范围内大量聚集,RDF峰值为60;而chitosan-8/12体系的RDF峰值减少到20 以下,与对照组相比下降约67%;chitosan-16 的RDF 峰值减少到10 以下,与对照组相比下降约83%。在OM 对照体系中,Na+集中分布于距离lipid A 的1 位磷原子0.3~1.0 nm 的范围内,RDF 峰值为4;而chitosan-8 体系的RDF 峰值降低为3,与对照组相比下降约25%;chitosan-12/16体系的RDF 峰值降低为2,与对照组相比下降约50%。Cl-的分布趋势则与Ca2+和Na+相反,在距离P原子0.5 nm范围内几乎没有Cl-分布,当r>0.5 nm,RDF 值由0 逐渐增大,对照组chitosan-0 体系r=4 nm 时达到峰值;随着壳聚糖分子质量增加,Cl-径向分布的峰值点距 P 原子越近,最为明显的是,chitosan-16 体系的峰值点为r=1.2 nm,与对照组相比缩短2.8 nm。CM 体系中Na+与Cl-的径向分布趋势整体与OM体系类似,但受壳聚糖结合的影响更加显著。上述结果表明,壳聚糖分子改变了膜周围的离子分布微环境,这可能会进一步破坏阳离子介导的脂质间相互作用,从而削弱细菌膜结构的稳定性。
此外,壳聚糖结合稍微降低了OM和CM的脂质单分子面积(图5b)。在OM 体系中,对照组chitosan-0 体系的lipid A 脂质单分子面积集中于1.67 nm2,随着壳聚糖聚合度增大,APL 呈降低趋势,其中chitosan-16 体系APL 值最小,集中于1.64 nm2。在CM体系中,对照组chitosan-0体系的脂质单分子面积集中于0.60 nm2,chitosan-8 和chitosan-12体系APL值集中于0.585 nm2,chitosan-16体系APL值集中于0.59 nm2。这些结果表明壳聚糖结合改变了膜脂质的径向排布,从而影响膜结构的稳定性。
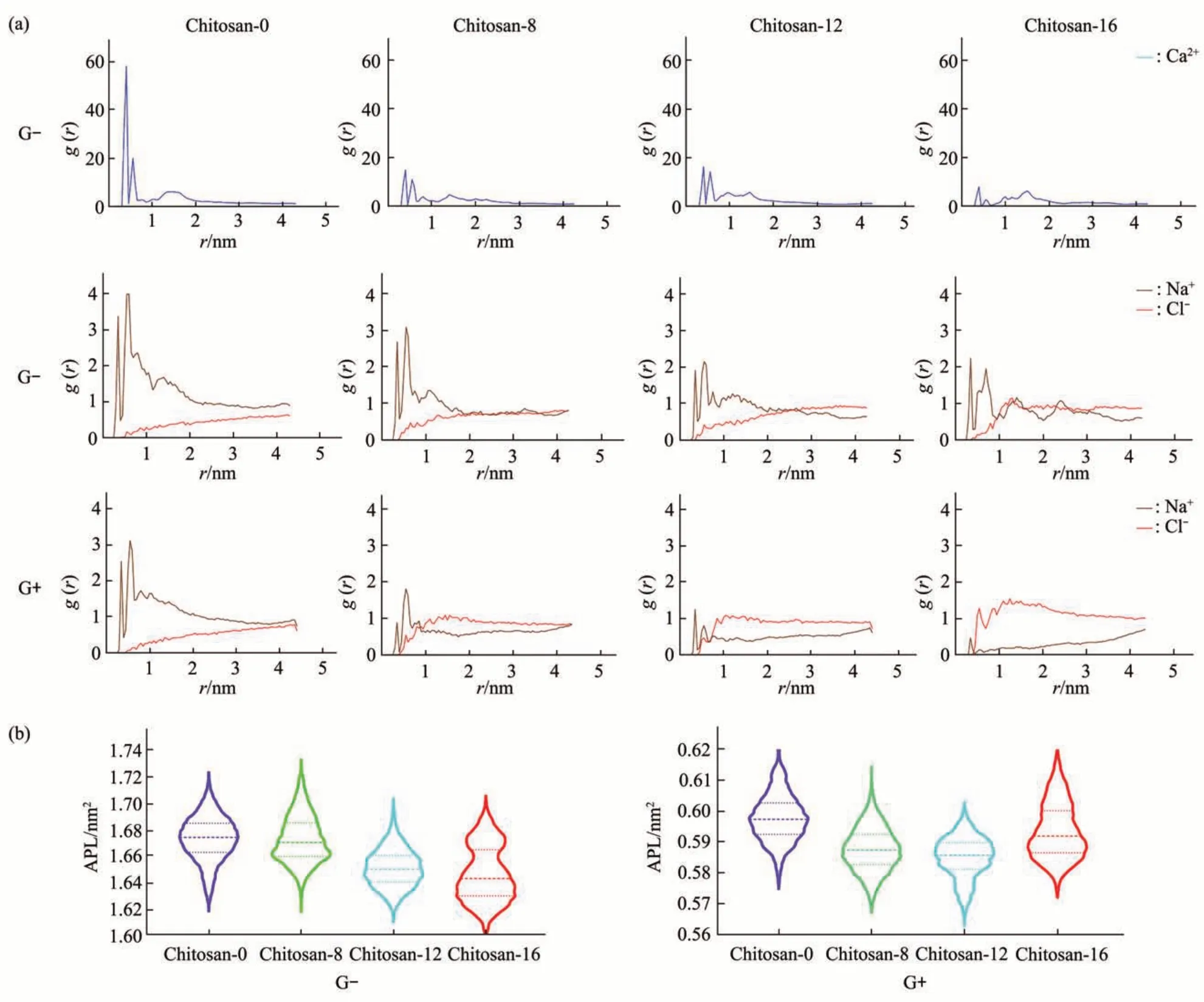
Fig. 5 Effects of chitosan binding on the structural properties of bacterial membranes
3 讨论
近年来壳聚糖作为一种新型的抗菌生物材料,得到了越来越多的关注和研究,然而,其抗菌活性的分子机制仍不清楚。阐明壳聚糖与细菌细胞膜相互作用的分子机制是破解壳聚糖抗菌机理的关键。本文采用全原子分子动力学模拟研究了3种聚合度的脱乙酰壳聚糖与革兰氏阴性菌外膜和革兰氏阳性菌质膜相互作用的动态过程,并系统地分析了其对膜体系离子分布和脂质排列的影响。
壳聚糖与细胞膜的相互作用是其发挥抗菌活性的关键。研究指出,壳聚糖正电强度的降低和膜突变体菌株表面负电基团的减少均使得抗菌活性减弱,从而说明壳聚糖与膜相互作用是抗菌活性的关键机制[7-8,32]。Raafat 等[7]通过电镜观察到壳聚糖吸附到细菌细胞表面,Liu 等[10]使用凝胶渗透色谱(GPC)、傅里叶变换红外光谱等方法研究壳聚糖与人工膜相互作用,指出其相互作用很可能是-NH3+与磷脂酰胆碱中的磷酸基团形成离子键。本研究发现,壳聚糖主要依靠-NH3+稳定结合到细菌细胞膜表面,并从接触数与氢键数两个角度定量表征了-NH3+在介导壳聚糖与膜结合过程的重要作用,与上述实验结果相一致,同时证明了本研究中建立的壳聚糖-细菌细胞膜模拟体系的可靠性。此外,不同脱乙酰质子化程度的壳聚糖与膜的相互作用进一步验证了此观点(图S1),发现壳聚糖的脱乙酰质子化程度与膜相互作用强度成正相关,而非质子化壳聚糖尽管脱乙酰度为100%,但由于-NH2缺少正电荷而无法与膜紧密结合,使其基本不与膜相互作用。这些结果都说明了-NH3+在介导与膜的结合中起着主要的作用。
壳聚糖与膜结合后,相比于CM体系,壳聚糖末端糖基更容易稳定地插入到OM内部,并与脂质脂肪酸链羰基形成氢键。导致这种差异的原因可能有以下两方面。一方面,OM中lipid A分子间的稳定排列高度依赖Ca2+介导的间接相互作用,一旦Ca2+被结合的壳聚糖排斥,这种交联网络即被破坏[33-34],随后壳聚糖分子发生膜插入的现象(图5a)。而CM 结构主要依靠POPE 的-NH3+与POPG的磷酸基团形成直接的氢键和静电相互作用,使得膜脂质堆积更紧密,也降低了对离子介导的间接相互作用的依赖,从而抑制了壳聚糖分子的插入[20]。另一方面,OM中lipid A分子含有两个负电性的磷酸基团供壳聚糖结合,而CM中每个磷脂分子只有1个磷酸基团,同时POPE头部的-NH3+基团可能不利于壳聚糖的结合,壳聚糖与OM更强的亲和能力可能促进其末端糖基单元插入到OM 的内部[34]。值得注意的是,不同分子质量的壳聚糖插入OM的末端糖基数目存在差异。壳聚糖的分子柔性与其分子质量(或链长)具有紧密的相关性,本文的结果表明分子质量越小的壳聚糖分子越容易紧密地结合在OM 表面(图1b),这为后续发生末端糖基插入膜内部提供了更多的机会(图S2,S3),因此推测分子质量差异带来的分子柔性改变可能是导致不同分子质量壳聚糖插入OM内部末端糖基数目不同的主要原因。
壳聚糖对膜结构性质的影响主要涉及离子分布和脂质排列的改变。离子分布的改变表现为Ca2+、Na+被排斥,Cl-被吸引,这会破坏阳离子介导的脂质分子间相互作用[33-34],从而削弱OM和CM的结构稳定性,与之前研究中提出的壳聚糖引起离子稳态受损导致膜破损的观点相一致[9]。此外,Raafat等[7]发现壳聚糖吸附在金黄色葡萄球菌表面后,会导致细胞膜收缩和胞内物质的渗漏,Liu 等[10]通过荧光探针1-N-苯基萘胺 (NPN)处理和胞内半乳糖苷酶活性检测实验证实了壳聚糖破环大肠杆菌OM和金黄色葡萄球菌CM的完整性,模拟结果证明壳聚糖的结合能够降低细胞膜的脂质单分子面积,这可能是实验发现的壳聚糖造成细菌细胞膜损伤的机制之一。
4 结论
壳聚糖与细菌细胞膜的相互作用是其发挥抗菌活性的关键。本研究利用全原子分子动力学模拟技术,探究壳聚糖与革兰氏阴性菌外膜和革兰氏阳性菌质膜的相互作用,发现完全脱乙酰质子化的壳聚糖凭借其高密度正电性,迅速紧密结合到富含负电性磷酸基团的膜表面,通过改变离子分布微环境破坏阳离子介导的脂质间相互作用、改变脂质排列,进而削弱细胞膜结构的稳定性,这可能是壳聚糖引起细菌细胞膜损伤的关键机制,但其末端糖基插入膜的稳定性却因两种膜分子极性及交联网络的不同而存在差异。这些结果为从原子水平上理解壳聚糖的抗菌机制提供了新的见解。
附件见本文网络版(http://www.pibb.ac.cn或http://www.cnki.net):
PIBB_20220451_Figure S1.tif
PIBB_20220451_Figure S2.tif
PIBB_20220451_Figure S3.tif
PIBB_20220451_Figure S4.tif
PIBB_20220451_Figure S5.tif
