有机荧光团及荧光标记细胞的阴极荧光成像研究*
2023-08-14李长硕李硕果李劲涛星张小云韩晓东
李长硕 李硕果 季 刚 王 丽* 李劲涛 王 莉 贾 星张小云 韩晓东* 吉 元* 孙 飞
(1)北京工业大学材料与制造学部,北京 100124;2)中国科学院生物物理研究所蛋白质科学研究平台生物成像中心,北京 100101;3)北京工业大学生命科学与生物工程学院,北京 100124;4)生物岛实验室,广州 510005)
生物成像技术的飞跃发展,为从细胞、亚细胞、单分子及基因的不同层面了解生命过程,研究细胞结构、功能、病理和生理变化,以及与环境之间的信号作用提供了强大的观测手段。传统的荧光光学显微镜(fluorescence light microscope,FLM)可直接观察活细胞,获得细胞结构与功能相关的动力学信息[1-2],但受限于光学衍射极限,光学成像分辨率只能达到~200 nm,无法观察小于百纳米尺度的亚细胞结构及单分子[3-5]。超分辨荧光显微镜突破了光学衍射极限,把光学成像的分辨率提高到了数十纳米[6-10],为细胞生物学研究提供了强有力的技术支持。透射电镜(transmission electron microscope,TEM)的分辨率已达到亚埃级,可解析生物大分子的分子结构[11-17]。扫描电镜(scanning electron microscope,SEM)的分辨率已达到亚纳米级,可识别标记的单一膜蛋白分子[18-19]。光镜电镜关联(correlative light and electron microscopy,CLEM)技术结合了荧光特异标记和电镜高分辨率成像的优势,为原位结构生物学研究提供了强有力的分析手段,但为适配电镜和光镜两种成像模式,CLEM技术流程难以克服样品在不同成像系统之间的传输难题和图像关联匹配精度低等瓶颈,且面临着两种成像模式分辨率不匹配(相差1~2个量级)的挑战。
阴极荧光(cathodoluminescence,CL),是电子束激发固体发光材料发射光子的现象,采用CL成像,可以获得突破光学衍射极限的荧光图像[16,20-21]。相对于传统的FLM技术,CL成像技术的主要优势在于高度局部化的激发[22]:入射电子束被聚焦到~1 nm 尺度,CL 像的分辨率可达到电子像的水平(十几到几十纳米)。近几年来,基于SEM 的阴极荧光与电镜关联(correlative cathodoluminescence and electron microscopy,CCLEM)技术已在无机纳米晶体材料中得到应用[12-14,22]。在SEM-CL 系统中,采用CCLEM 成像,可以同时获得由电子束激发产生的电子像和CL 像,并解决了两种成像模式之间分辨率不匹配的问题。此外,与CLEM 技术比较,CCLEM 技术也不需要为适配两种成像模式引入的样品传输、定位,及图像关联等技术流程。CL 谱仪已广泛用于地质及半导体材料的性能和结构测试,以及纳米光子学及等离子激元物理性能等研究[20,23-24],而生物材料的电子束敏感性则限制了CL技术在生物医学及细胞生物学中的广泛应用[25-26]。研究和发展CL 技术在生物样品中的应用,需要探究电子辐照引起碳基材料的结构损伤、有机基团的降解,及荧光猝灭等问题,还需要研究电子源对有机化合物(荧光染料及荧光蛋白等荧光标签)的激发及发光特性。
本文采用SEM-CL系统,研究电子源对有机物的激发特性,通过改变辐照能量、电子束束流,及辐照剂量,研究了不同成像方式下有机荧光团的CL 发光特性和成像特点,并应用CCLEM 技术,观察了染料分子及荧光蛋白标记的亚细胞结构。Crossing)指系间跨越。
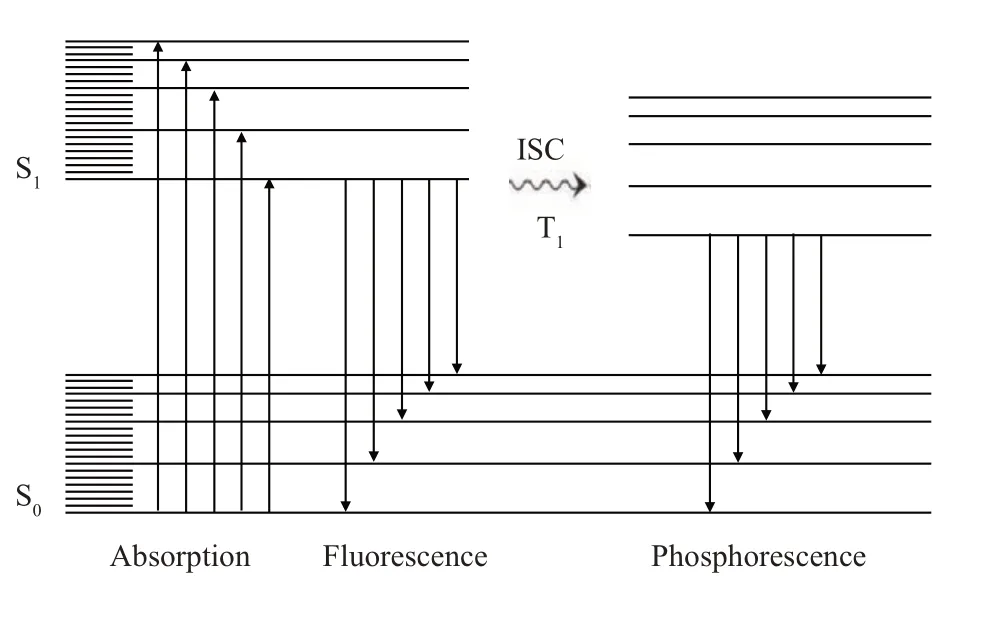
Fig. 1 The principle of the fluorescence-excitationemission of organics
1 材料与方法
1.1 实验原理及方法
实验采用场发射环境扫描电镜(Thermo fisher Quanta 600 FEG ESEM)和阴极荧光谱仪(Gatan Mono3+CL)。图1为有机物的荧光发射原理。阴极荧光是固体发光材料在电子束辐照下产生的弛豫发光[21,25]。在有机材料中,电子在分子轨道中辐射跃迁。处于基态S0的分子吸收电子后,电子从基态S0被激发到单稳激发态Sn,跃迁到单稳激发态S1,再由单稳激发态S1辐射跃迁到基态S0发射荧光;若从单稳激发态S1态跃迁到三稳态T1,再辐射跃迁到基态S0态,则发射磷光。图1 中ISC(InterSystem图2为SEM-CL系统的成像装置及成像原理示意图。图2a 为SEM-CL 系统的装置示意图。二次电子(secondary electrons,SE)信号由SE 探头接收;CL信号由CL谱仪的抛物面接收镜收集,再通过光电倍增管(photomultiplier,PMT)探测器,收集紫外-红外波段的光谱及CL全光像;或通过光谱仪的衍射光栅分光后,再传至PMT 收集光谱及单光像。图2b 为装配了一个自制的薄样品成像装置[27]的SEM-CL 系统,SE 和CL 信号的接收方式同图2a 所示。入射电子束在块样品(图2c)和薄样品(图2d)中的作用范围(R)及激发产生的主要电子和光子信号,分别对应于图2a 和2b 所示的成像装置。在图2b 所示的薄样品成像装置中,薄样品(电子束可穿透的薄膜及细胞等)放置在一个由Si芯片支撑的Si3N4薄窗口(SiN-Si)上,SiN窗口厚度100 nm,面积0.5×0.5 mm2(SG050D,苏州原位芯片科技有限责任公司),薄样品厚度100 nm到几微米。如图2d 所示,入射电子穿透薄样品或样品薄区,以及SiN-Si衬底,产生了部分透射电子(TE),使电子作用范围(R)减小,即减少了形成SE 像的背底信号强度,包括经过多重非弹性散射产生的背散射电子(BSE)及BSE在出射过程中激发产生的SE(SE2),从而增加了低能量二次电子SE(SE1)产额,提高SE 像衬度。同时也减小了CL 信号的散射宽度及作用范围,提高CL 像的分辨率。
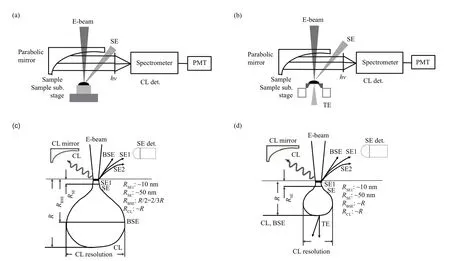
Fig. 2 SEM-CL system and the signals produced by electron beam in the sample
本实验使用的SEM-CL 系统的主要操作参数:加速电压2~30 kV,电子束束流10-11~10-10A,常用束斑尺寸(spot size,SP)为SP3、SP4和SP5,其对应的电流值为,SP3:7.944×10-11A,SP4:2.667 8×10-10A,SP5:8.447 3×10-10A (pA 表实测),电子像的像素1 024×768,驻留时间30 μs,扫描时间27.8 s/帧。CL 谱仪测量精度为0.6 nm,光栅1 200 line/mm,PMT电压600~1 500 V,CL像的像素1 024×1 024,驻留时间100 μs,扫描时间104 s/帧。采用ImageJ 软件,根据CL 像的像素灰度值确定荧光相对发射强度。
1.2 样品
1.2.1荧光微珠及细胞样品
本实验采用荧光聚苯乙烯微珠(赛默飞世尔科技(中国)有限公司,以下简称赛默飞),测定有机荧光团的CL 发射特性及CL 成像效果。荧光基团被聚苯乙烯微珠包覆,可以降低环境对荧光基团发光强度的影响。红色微珠粒径为1 μm(货号F13083)和500 nm(货号F8812),激发和发射波长分别为λex=555 nm 和λem=600 nm;绿色微珠直径为200 nm(货号F8767),λex=488 nm和λem=525 nm;蓝色微珠直径为100 nm(货号F8767),λex=405 nm和λem=445 nm。以上荧光微珠在原液基础上稀释50倍后,滴在铝样品台上,干燥后进行SEM-CL观测。
细胞样品包括食管癌细胞(Eca109)和人肾上皮细胞(293T)(中国疾控中心病毒所,曾毅院士实验室),均采用常规的细胞培养方法制备[19]。
1.2.2荧光标记
荧光标记内容包括:a. 采用DAPI 染料(货号62247,赛默飞公司)对Eca109细胞核染色;b. 采用增强的绿色荧光蛋白(EGFP)转染Eca109细胞(Eca109-EGFP);c. 采用红色荧光蛋白mCherry 标记293T 细胞的膜蛋白ACE2(细胞血管紧张酶转化素)。
1.2.3细胞的衬底材料
细胞样品通过爬片生长或细胞悬液滴片的方式承载到衬底上。本实验采用了3 种衬底:a. ITO 导电薄膜衬底,ITO 薄膜厚度185 nm,电阻率≤6 Ω/sq[28],采用该衬底消除非导电样品的荷电现象(深圳华南湘城科技有限公司);b. SiN-Si衬底,采用该衬底配合薄样品成像装置使用(图2b);c. Si芯片衬底,为SiN-Si薄窗口的Si支撑芯片。
2 结果与讨论
2.1 荧光微珠的SEM-CL观测
2.1.1荧光微珠的CL发射强度及CL成像
采用SEM-CL 系统(图2a),在较低加速电压(4 kV)辐照下,观察不同粒径及不同发光波长的荧光微珠(图3)。图3a,b 为直径1 μm 红色微珠的CL 像和SE 像,图3c,d 为500 nm 红色微珠的CL 像和SE 像。观察结果显示,荧光珠的CL 像具有较高的荧光强度、明亮的衬度,及足够的信噪比(signal to noise ratio,SNR)。图3e,f 为200 nm 绿色微珠的CL 像和SE 像,在CL 像中可分辨单个发光微珠。图3g,h为100 nm蓝色微珠的CL像和SE像,在CL 像中仍可显示出100 nm 微珠的发光中心,估算CL 像的分辨率(d)可达到几十纳米(~30 nm)(图3g 插图)。此外,在CL 像中还测出一些最近邻发光颗粒的间距,分别在30~40 nm 之间。有机物CL像的分辨率与文献报道的20~50 nm有机物的CL像分辨率,及超分辨荧光显微镜的分辨率相当[16,29-30]。通常有机物的CL像分辨率低于无机物的分辨率(15~20 nm)[31],本研究观察结果显示,有机荧光团的CL 像分辨仍远高于光学衍射极限。综上所述,电子源可在较大的能量/波长范围内,激发从紫外到红外光谱的多个跃迁,采用低能量电子激发有机荧光基团,可同时获得电子像(单色,显示电子密度)及CL 像(多色,显示波长),CL 信号具有较高的光量子产额及成像分辨率。

Fig. 3 SEM-CL imaging of fluorescent beads (FL beads),4 kV,SP4
2.1.2电子激发条件对荧光微珠发光强度的影响
电子激发条件包括电子束束流、辐照时间,及辐照剂量。图4 为入射电子能量和束流对CL 发射强度的影响。当改变加速电压(3、5、30 kV)时,在500 nm绿色微珠的CL像中都呈现出较强的荧光强度(图4a~c)。图4d给出了绿色微珠发光强度随加速电压的变化,CL 发射强度由ImageJ 软件提取CL 像的像素灰度值确定。观测结果表明,改变加速电压没有使CL 发光强度发生明显变化。作为连续激发源,入射电子能量可在较大范围内调整,而对有机荧光团发光强度的影响较小。在高能量电子(30 keV)激发下荧光微珠未产生光猝灭;在低能量电子(3 keV)激发下,荧光团仍保持了较高的发光强度。对光子成像,低能量激发减小了CL 产生的体积,提高了CL 像的分辨率(图2d);对电子成像,低能量激发减小了电子作用范围(R),可消除荷电现象,并增加SE产额(δ)(公式(1),E0:入射电子能量),获得更多表面信息[32],提高SE像衬度。
R可通过蒙特卡洛模拟获得(图4e),模拟电子数量为30 000 个;并通过公式(2)[33]计算求出,式中,A:原子质量;Z:原子序数;ρ:密度(g/cm3),碳密度:1.8 g/cm³,R=0.63 μm(5 kV),2.15 μm(10 kV),14.86 μm(30 kV)。
模拟与计算结果相符,特别在5~10 kV 更吻合。模拟和计算结果显示,带有5 keV能量电子的穿透深度(R:~0.6 μm)已超过荧光微珠尺寸(R:100~500 nm),故产生的CL 信号已是整个荧光微珠的平均信号,继续增加电子能量也难以再增加CL光量子产额。此外,调整电子束束流,使束流增加一个量级(从7.944×10-11A到8.447 3×10-10A),相应束斑尺寸从SP3增加到SP5,发光强度也没有明显增加(图4f~h)。综上所述,采用低电压及低束流激发有机荧光团,可获得亮度高、衬度好,及SNR高的CL 像,还有利于减少局部的累积剂量及潜在的辐照损伤[16]。
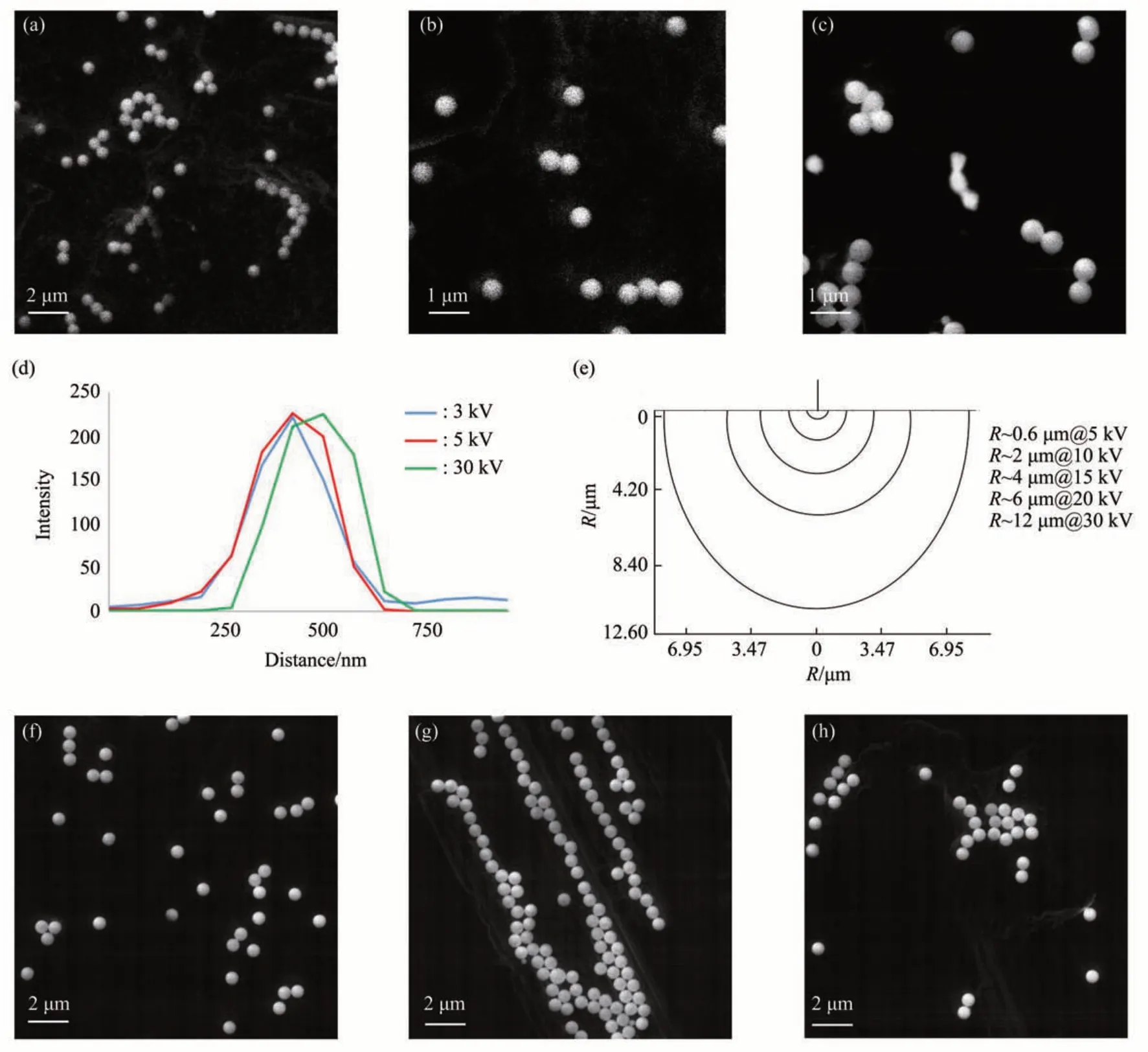
Fig. 4 Effects of incident electron energy and beam current on emission intensity and CL imaging of the 500 nm green FL beads, 20 000×, PMT: 1 400 V
2.1.3荧光微珠CL强度的衰减特性
在低电压(5 kV)及低束流(SP3)辐照下,对500 nm 绿色微珠的同一视场进行连续扫描,记录下26 min内获得的15幅CL像。图5a给出了其中辐照时间为1.7、5.2、8.7、12.0、13.9、15.6、17.3、26.0 min,相对应的第1、3、5、7、8、9、10、15 幅CL 像。CL系列像清楚显示出CL像的亮度及SNR随辐照时间增加而降低的现象。表1列出了单个荧光微珠(图5a 左图中箭头所示)的电子辐照时间、累计辐照量、CL 强度衰减的数据。累计辐照量由电子辐照剂量(q)(公式(3)[34])和辐照时间求出。
电子辐照剂量(q),即每单位面积样品的电子数,决定了电子束对样品的损伤程度,取决于电子束电流、驻留时间、扫描面积,式中,τ:辐照时间,5×10-5s,I:探针电流(A),I=7.94 4×10-11A,e:电子电荷,1 e=1.6×10-19C,d:像素尺寸,d为分辨率,d=30 nm。荧光强度的衰减由ImageJ软件提供的像素灰度/荧光强度的变化确定。图5b给出CL强度衰减随辐照时间的变化曲线。从图5a中的CL成像质量及荧光衰减率可知,从第1幅(1.7 min)到第7 幅(12.0 min)CL 像,CL 强度衰减了~25%,但CL像仍保留了可接受的发光强度及足够的SNR。从第8 幅CL 像(13.9 min)以后,CL 衰减从~27%增加到~52%,出现严重的光猝灭,难以清晰成像。通常认为有机分子在电子束辐射下会迅速漂白[34-35],但本文的观测表明,在较低电压及较低束流作用下,有机荧光团可经受较长时间的电子辐照(~12 min)。
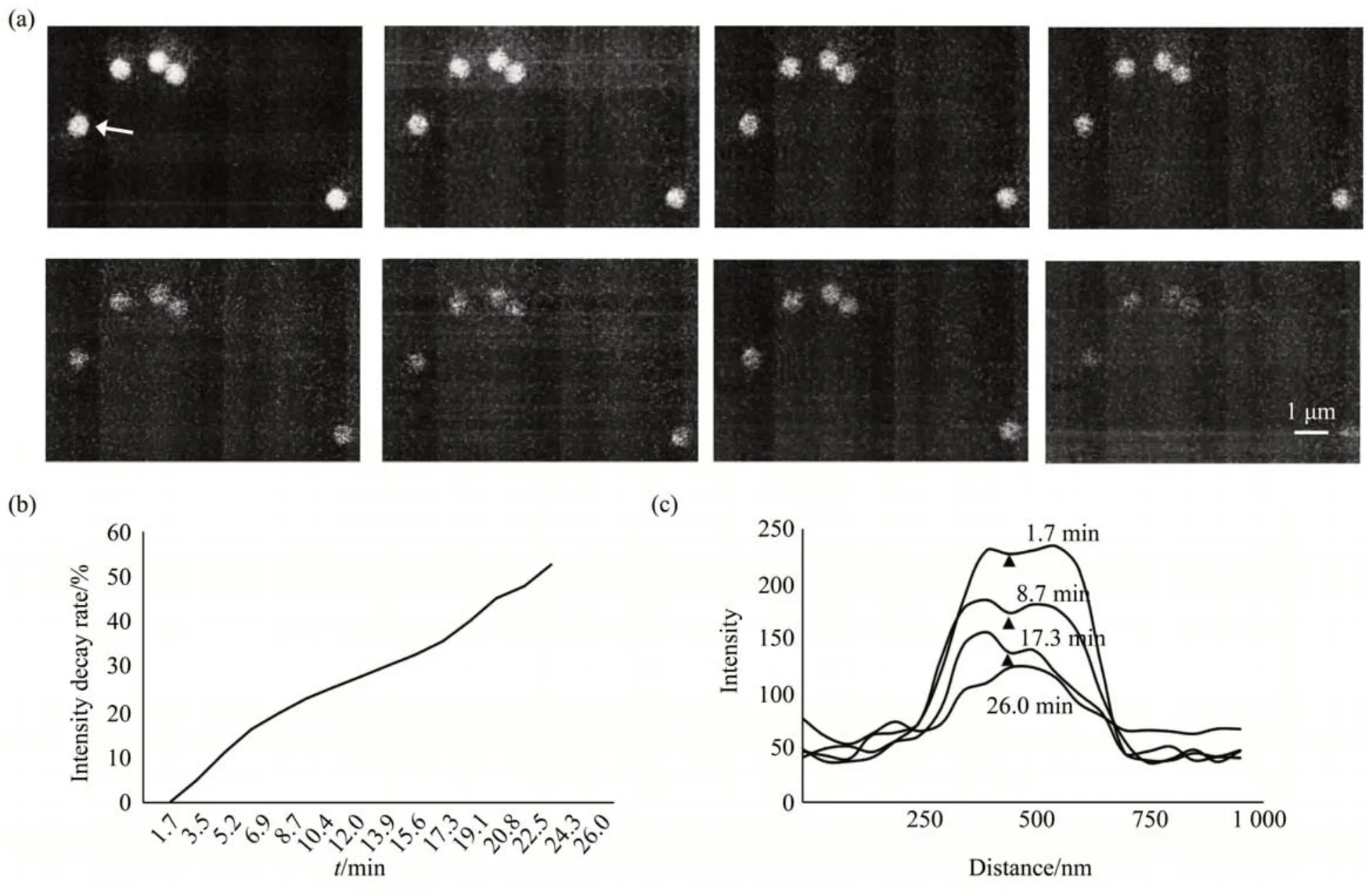
Fig. 5 Effects of the radiation time of e-beam on CL intensity of 500 nm green FL beads
从图5c 看出,随着辐照时间增加,单个荧光微珠(图5a 左图中箭头所示)强度峰下降,同时强度峰的起伏程度也随之加大(三角形标记所示)。这表明,CL 强度的衰减受两方面因素的影响:电子辐照引起荧光强度整体下降,以及电子束诱导的局部损伤或表面缺陷使微区荧光强度降低。在5 kV下,辐照缺陷对500 nm绿色荧光珠的CL发光强度的影响范围约100 nm,与阴极荧光被局域激发的特性相符。
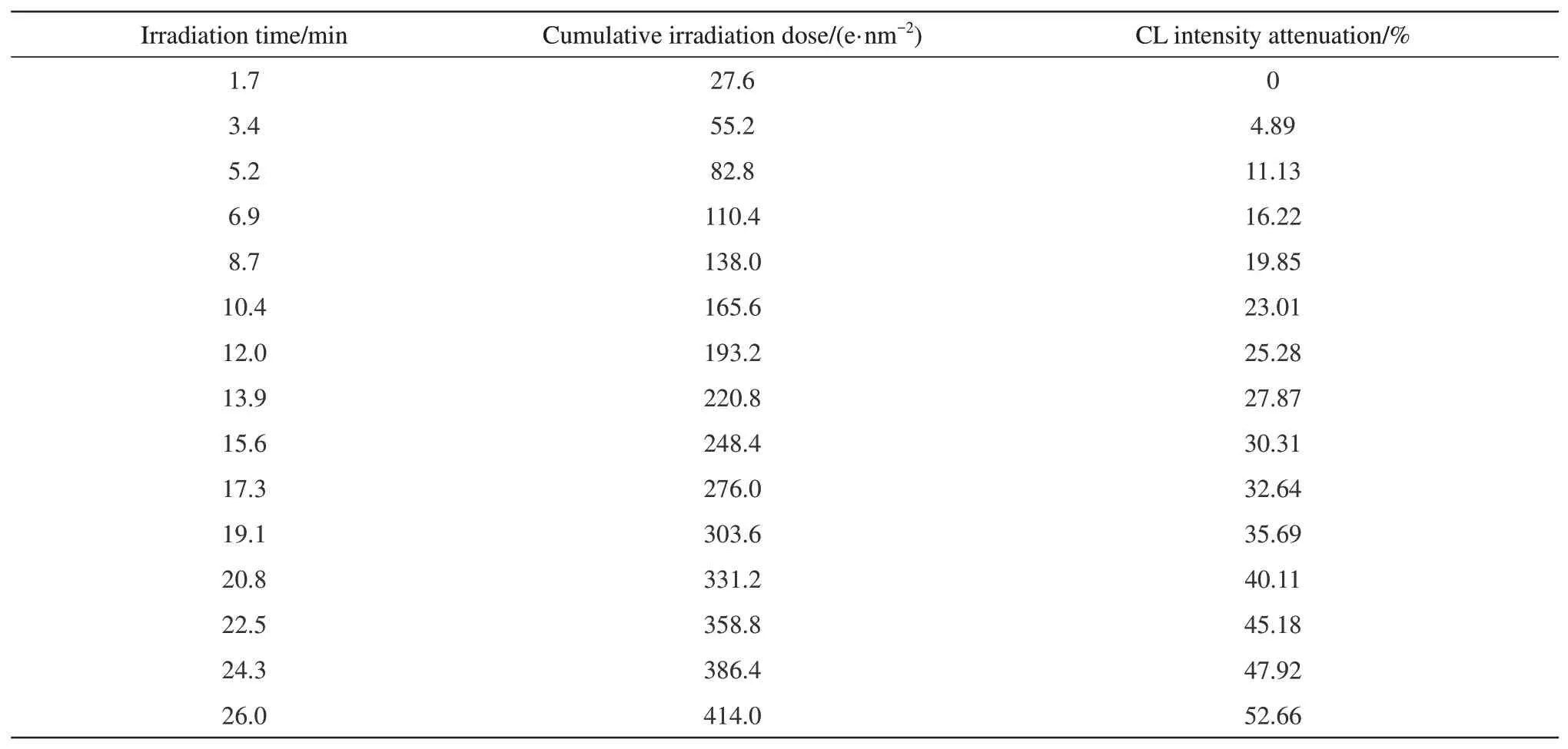
Table 1 Electron irradiation time, cumulative irradiation dose and CL intensity attenuation of green fluorescent microbeads
2.2 亚细胞结构的SEM-CL成像
采用SEM-CL系统,观察了染料及荧光蛋白标记的亚细胞结构,包括细胞核、细胞质和细胞膜(图6)。图6a,b 是DAPI 染色Eca109 细胞核的SE像及CL 像(10 000×),将悬浮细胞液滴在ITO 衬底上,干燥后观察。在图6b的CL像中,显示出由一个细胞核内发出的较强且分布不均匀的荧光信号。受限于电子束的作用深度,发射出的CL信号只能显示出细胞内靠近上表面的染色细胞核的部分结构。不均匀的荧光亮度反映出DAPI标记的靠近核膜部分的异染色质的不均匀分布。由于缺乏重金属染色,难以结合电子像确定荧光标记的细胞核结构,但CL像显示出的非均布的发光中心,体现了电子束高度局部激发的特征[22]。此外,由于CL信号的生成体积远大于SE 信号近表面的生成体积,SE显示出的是细胞的表面形貌,而CL则更多显示出细胞膜下一定深度内的发光结构。成像结果还显示,CL像中的发光位置与SE像中相应位置的表面特征并非一一对应,而是形成了较多的发光中心,说明CL 像主要显示了荧光分子标记的胞内结构。以上结果说明,电子和光子成像模式相结合(CCLEM),可提供从细胞表面到内部一定深度内(取决于入射电子能量及亚细胞结构的特征)的结构信息。
图6c,d 是对增强绿色荧光蛋白(EGFP)转染Eca109细胞(Eca109-EGFP)的观察,采用ITO衬底。CL 像显示EGFP 在细胞质内高表达,形成均匀而明亮的衬度,能清晰地区分发光的细胞质与不发光的细胞核。
图6e,f 为采用SEM-CL 系统(图2a),观察生长在Si衬底上,由红色荧光蛋白mCherry转染的293T 细胞膜蛋白ACE2 (293T-ACE2-mCherry)。在图6f 的CL 像中,细胞整体显示出均匀的亮度。与此相比较,采用自制的薄样品成像装置及SiN薄窗口衬底(SiN-Si)(图2b) 对293T-ACE2-mCherry细胞成像,则显示出明显不同的衬度。在SE 像中,细胞周边形成了明亮的形貌衬度(图6g);在CL 像中,细胞周边也形成了明亮的荧光衬度,体现出ACE2广泛定位于细胞膜上(图6h)。由此可见,薄膜成像方式突出了荧光标记的结构,并使形貌像与荧光像形成了可比较的衬度。对衬度的说明参考图2d,薄样品成像通过产生部分TE(TE 的数量取决于入射电子能量及样品的质量厚度),减小电子作用范围(R)的方式,增加了表面敏感的低能SE(SE1)产额,提高了SE像衬度;同时,通过减小CL 发光中心的横向及纵向扩展,提高了CL像的分辨率。在图6i 薄样品成像原理示意图中,展示了入射电子作用于SiN-Si衬底上的一个荧光标记细胞激发产生的电子(SE和TE)及光子(CL)信号。与电子束扫描细胞内部比较,扫描边缘薄区可产生更多数量的TE,从而提高了SE(SE1)的发射几率及对CL 发光中心的分辨能力,结合形貌和荧光衬度,可更清楚地识别荧光标记的细胞膜蛋白的位置。通过模拟和计算也可知[34],在9~10 kV下,入射电子在细胞中的作用范围(R)约2 μm,大于爬片细胞边缘厚度,可产生一定量的TE。此外,结合293T-ACE2-mCherry 细胞膜蛋白的整体分布信息与免疫金(Au-NPs)特异性标记的293T-ACE2-AuNP 细胞膜蛋白单分子分布信息[28],可以更准确地确定膜蛋白在原生细胞表面的位置、分布及表达量,并支持膜蛋白与细胞的功能研究,及靶向药物的研发。

Fig. 6 SEM-CL observation of fluorescent labeled cells
以上对亚细胞结构的观察表明,采用低能量电子激发(2.5~5 keV),使电子作用体积与亚细胞结构的尺寸相匹配,可在信号强度、分辨率、衬度,及信噪比之间达到较好的权衡,并减少电子辐照损伤。 此外, 常用荧光标签(DAPI、 EGFP、mCherry染料分子及荧光蛋白等)发射出可探测到的光子,表明通过调整电子穿透深度束流辐照剂量等参数,以及选择不同的成像方式,可实现对细胞表面至内部一定深度内的激发及CL信号探测。
3 结论
采用CCLEM的成像技术,观测了有机荧光团和荧光标记的细胞样品。研究了电子激发源对有机样品的激发特性,包括辐照能量、电子束束流、辐照剂量,观测了CL 信号的发射特性、强度衰减、成像方式及成像特点。在SEM-CL系统中,电子激发源束斑和CL信号可被控制在纳米尺度,有机荧光微珠的CL像分辨率可达到~30 nm。采用低能量(2.5~5 keV)及低束流(~10 pA)激发,CL 像呈现出较高的荧光强度和明亮的衬度,允许荧光微珠经过较长时间辐照(~12 min,CL 信号衰减了~25%)仍保留可接受的CL强度及足够的SNR,并可减少对生物样品的辐照损伤。采用低能量和低束流电子激发,及不同的成像方式,获得了从细胞表面及表层下一定深度内的亚细胞结构信息。
4 展望
受限于光学衍射极限,通过荧光成像技术表征纳米尺度的生物结构具有极大的挑战性。基于扫描电镜/环境扫描电镜的CCLEM技术在这方面具有进一步发展的空间和应用潜力,未来可预见的发展方向包括且不限于以下方面:a. 采用SEM-CL模式提高CL像的分辨率,实现对单一膜蛋白分子的荧光定位;b. 采用低温样品制备及低温成像方式,使发射光的能量分布变窄,增强荧光标记的生物样品的发光强度及量子产额,提高CL 像的分辨率;c. 开发高量子产额及高稳定性的有机和无机荧光标记,如量子点、稀土掺杂的纳米荧光团等,允许探测多个位点,并实现单分子荧光定位;d. 开发活细胞CCLEM技术,结合“湿”环境和液体成像[20],及微流控技术,保存活体信息,为活细胞电子显微成像提供可能。总之,CCLEM技术的多模态、跨尺度成像方式,及可调控的成像环境,为细胞结构(表面及内部)及功能研究提供了亚微米~纳米水平分辨率的观测平台。CCLEM 技术可作为CLEM技术的重要补充,并可发展成为一种表征亚细胞结构标记单分子的高分辨生物成像技术。
致谢感谢Gatan Inc.公司赵越经理及陆畅博士的技术支持,感谢北京大学物理学院徐军教授、北京协和医院吴炜教授及华天瑞博士、金竟公司何超博士及王凯博士,以及Delmic 公司任辛博士给予的学术及技术探讨。
数据可用性声明本论文的关联数据(doi:10.577601 sciencedb.09062;CSTR:31253.11.sciencedb.09062) 可在Science Data Bank 数据库(https://www.scidb.cn/s/RfiQN3)中访问获取。
