结合原子力显微镜和光学图像识别的单细胞力学特性快速测量研究*
2023-08-14吕晓龙魏佳佳张志慧
吕晓龙 魏佳佳 张志慧 李 密*
(1)沈阳工业大学人工智能学院,沈阳 110870;2)中国科学院沈阳自动化研究所,机器人学国家重点实验室,沈阳 110016;3)中国科学院机器人与智能制造创新研究院,沈阳 110169;4)中国科学院大学,北京 100049)
细胞力学特性在细胞生命活动过程中起着关键调控作用。越来越多的证据表明,细胞不仅是个生化系统,同时也是个力学系统[1]。细胞处于由细胞外基质(extracellular matrix)、其他细胞(如基质细胞、内皮细胞、免疫细胞等)、组织液、各种生物化学分子(如细胞因子、趋化因子、生长因子、活性氧类等)等共同构成的三维微环境中[2-3]。作为细胞微环境的重要组成成分,细胞外基质不仅为细胞提供物理支架以维持组织的完整性和弹性,同时细胞外基质还提供细胞各种生命活动过程中所需的力学线索[4]。哺乳动物的细胞外基质由约300种蛋白质分子(如胶原蛋白、蛋白聚糖、糖蛋白等)组成[5]。根据细胞外基质所处位置和成分的不同,细胞外基质主要分为间隙基质(interstitial matrix)和基膜(basement membrane)两类[6]。动物体内几乎所有细胞均与细胞外基质蛋白直接接触,如上皮细胞和内皮细胞与基膜接触,结缔组织中的细胞被间隙基质所包围,甚至血液中的细胞也与游离态的细胞外基质蛋白(如纤连蛋白)进行接触[7]。细胞通过机械力传导机制(mechanotransduction)将细胞外基质的机械刺激(如细胞外基质刚度、血液/淋巴液剪切力)转化为化学信号以调节细胞行为和功能(如细胞运动、细胞增殖、细胞分化、细胞凋亡、形态重构以及基因变化等)[8]。细胞与细胞外基质之间的相互作用具有典型的交互性(reciprocal):一方面,细胞在其生命活动过程中会不断生成、降解或重排细胞外基质以改变细胞外基质的某种或多种特性;另一方面,细胞生理活动导致的细胞外基质变化反过来会影响并改变细胞行为[9]。细胞与细胞外基质之间的相互作用会导致细胞力学特性的动态变化,特别是在疾病发生发展过程中(如癌症)通常伴随着细胞力学特性的显著变化[10]。近年来,研究人员开始在多种疾病(如癌症、纤维化和心血管病等)中探索对细胞或细胞外基质力学特性进行干预(如预防、逆转力学特性变化或中断细胞对细胞外基质力学特性的响应等)的治疗方法[11],并已经研发了多种进入临床试验阶段的力学特性干预药物[12],为治疗人类疾病提供了新的可能。因此,开展细胞力学特性研究对于揭示生命活动内在机理、推进新型药物研发、促进疾病诊疗进展等均具有重要的基础意义。
原子力显微镜(atomic force microscopy,AFM)的发明为单细胞力学特性研究提供了重要方法。AFM 利用压电陶瓷管驱动一根末端集成有极细针尖的微悬臂梁对样本表面进行水平方向光栅扫描,同时通过一束照射到悬臂梁背面的激光检测悬臂梁信号(如偏转量、振幅、频率等)变化来感知扫描过程中针尖表面原子与样本表面原子之间的相互作用,并通过信号处理与反馈电路系统控制探针在垂直方向运动以维持针尖与样本之间相互作用力恒定,从而获取反映样本表面形貌起伏的三维图像[13-14]。AFM 的独特优势是可以直接在生理溶液环境下对活体状态生物样本的表面精细结构进行无损高分辨率成像,特别是通过控制AFM 探针在样本表面进行压痕(indentation)实验还可以对样本的力学特性进行精确测量[15]。在压痕实验中,AFM 探针在样本表面垂直方向进行逼近(approach)-回退(retract)往复运动,同时通过记录该过程中探针悬臂梁偏转量变化和压电陶瓷垂直方向的位置变化即得到力曲线(force curve),最后利用理论模型对力曲线进行分析即可得到样本的力学特性(如杨氏模量)。AFM压痕实验方法在细胞力学特性探测方面取得了极大的成功,已成为细胞力学特性表征的重要方法[16-17]。通过将细胞表面特定区域划分为若干个网格,并控制AFM 探针在所有网格内分别进行压痕实验,即可得到反映细胞表面不同位置点力学特性分布的杨氏模量图[18]。特别是近年来出现的基于峰值力轻敲(peak force tapping)模式的AFM 多参数成像方法可以同时获取细胞形貌图和力学特性图[19-22],极大地促进了AFM 在细胞力学特性探测方面的应用。然而需要指出的是,当前基于AFM 的单细胞力学特性测量主要依赖于人工操作,即操作员需要在光学显微镜细胞成像导引下控制AFM 探针移动到目标细胞表面特定位置后进行探测。由于不同细胞间形态的差异,操作员仅凭经验通常难以准确判断并移动AFM 探针至所需位置,往往需要重复多次才能将AFM 探针移动至合适的位置以成功在目标细胞表面进行AFM 压痕实验,导致实验过程耗时费力且效率低下。
针对上述问题,本文将AFM 和细胞光学图像识别相结合,提出了单细胞力学特性快速测量方法。通过神经网络学习算法自动识别出光学图像中的细胞,并利用模板匹配算法识别光学图像中的AFM探针,在此基础上实现了目标细胞和AFM探针空间位置关系的自动快速判断并进而控制AFM探针准确移动至合适位置以对目标细胞进行AFM压痕实验。实验结果表明,所提出的方法不仅适用于常规AFM锥形针尖探针,还适用于AFM球形针尖探针,为AFM 单细胞力学特性自动测量提供了新的思路和方法。
1 材料与方法
1.1 细胞培养
本文选用两种细胞系进行实验,分别为HEK 293(人胚胎肾细胞)和MCF-7(人乳腺癌细胞),细胞均购自中国科学院细胞库(上海)。细胞培养基(DMEM 高糖培养基) 以及磷酸盐缓冲液(PBS)购自上海瑞典生物科技有限公司,胎牛血清购买于美国Thermo Fisher 公司,青霉素-链霉素溶液购买于美国Hyclone公司。细胞在含有10%胎牛血清和1%青霉素-链霉素溶液的DMEM 培养基中培养。HEK 293和MCF-7 均为贴壁生长型细胞,因此直接将细胞接种在60 mm 培养皿(广州洁特生物有限公司)中,在细胞培养箱(美国Thermo Fisher 公司)中进行培养(37℃、5% CO2、95%空气)。
1.2 AFM及球形探针制作
本文采用的AFM 型号为美国Bruker 公司生产的Dimension Icon AFM(图1a)。该型AFM拥有一个安装在AFM 扫描头侧面的光学显微镜,使操作员可以在光学显微视觉导引下控制AFM 探针对基底目标区域进行探测。将生长有细胞(HEK 293或MCF-7)的培养皿置于AFM 样品台后,即可控制AFM 探头浸入培养皿液面对细胞力学特性进行探测。所采用的AFM锥形针尖探针型号为MLCT-C(美国Bruker 公司),该探针的材料为氮化硅,探针悬臂梁(悬臂梁背面有反射金涂层)的弹性系数为0.01 N/m,悬臂梁共振频率为7 kHz,针尖曲率半径为20 nm,针尖高度为2.5~8 μm。此外,在光学显微视觉导引下利用AFM 微操作将单个微球黏附至MLCT-C探针悬臂梁制作得到球形针尖探针(图2)。制作球形探针所需的AB 胶(DP420)购自美国3M 公司,碳酸钡微球(直径20 μm)购自天津市倍思乐色谱技术开发中心。首先将A胶和B胶以1∶1 在载玻片表面一端均匀混合,同时将碳酸钡微球粉末蘸至载玻片表面另一端。随后在光学显微镜视觉导引下控制AFM 探针移动至AB 胶上方并控制探针缓慢接近AB 胶,在悬臂梁接触到AB 胶后立即控制AFM探针回退。紧接着转动AFM样品台,控制AFM 探针移动至单个碳酸钡微球上方(图2aI)并控制探针接近微球(图2aII),在悬臂梁接触到微球后控制探针回退(图2aIII)。将制作好的微球探针置于探针盒中保存12 h待AB胶彻底固化后即可利用微球探针进行细胞力学特性测量实验。对制作完成的微球探针进行的扫描电镜(SEM)成像清晰地显示了修饰到AFM探针悬臂梁的单个微球(图2b)。
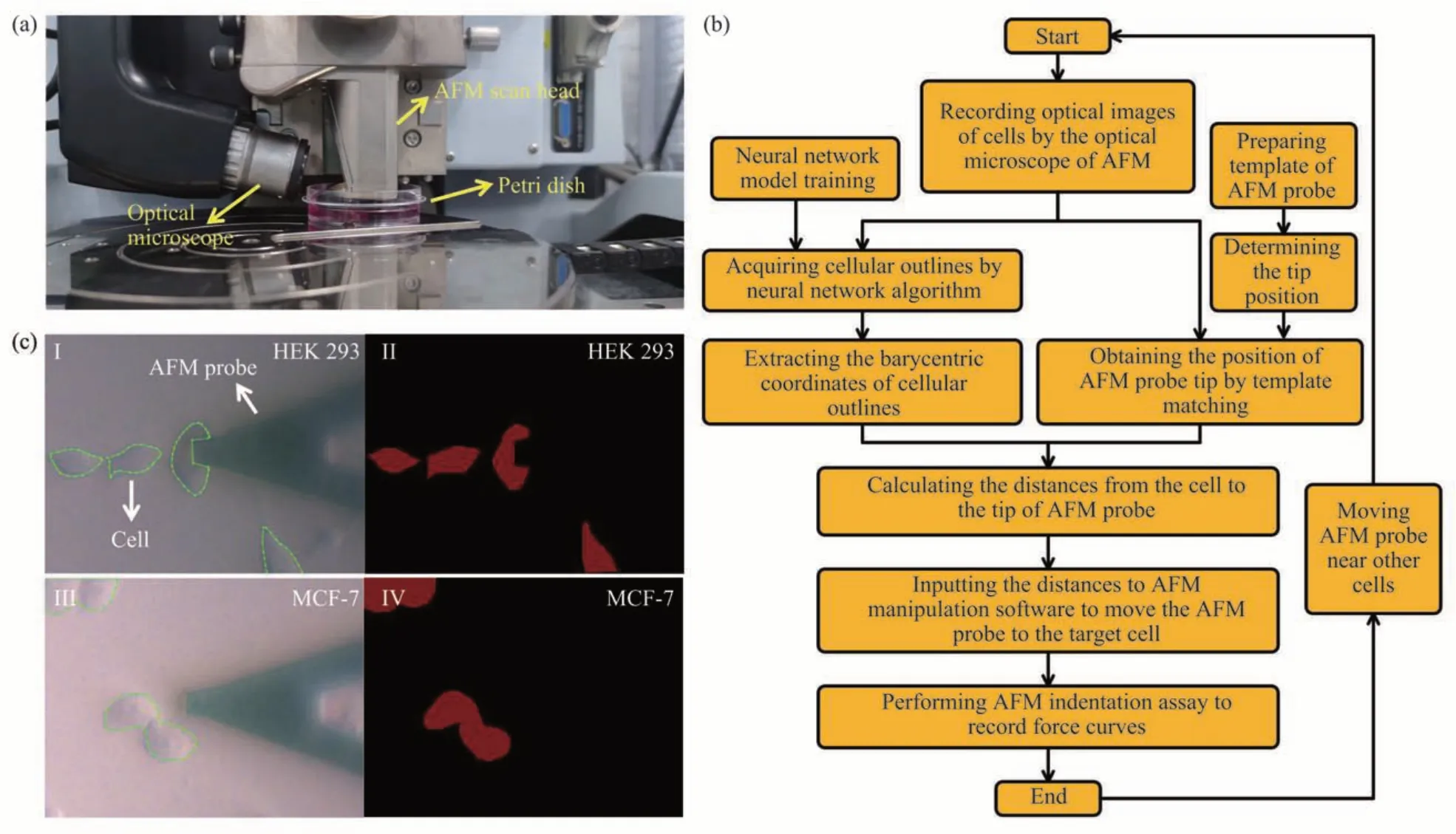
Fig. 1 Combining AFM with optical image recognition for rapid measurements of single-cellular mechanical properties

Fig. 2 Preparation of the AFM probe with a spherical tip
1.3 结合光学图像识别的AFM单细胞力学特性快速测量
光学图像中细胞和AFM 探针自动识别流程如图1b所示。将生长有细胞的培养皿置于AFM样品台,随后控制AFM 探针进入培养皿液面并逼近培养皿基底。随后利用AFM 光学显微镜(图1a)拍摄细胞和AFM探针的光学图像(图1c)。利用神经网络训练模型识别出光学图像中的细胞轮廓并确定细胞轮廓重心坐标,利用图像模板匹配方法识别出光学图像中的AFM 探针位置。其中,为获取探针针尖的位置,利用日本HIROX 公司生产的正置光学显微镜对AFM 探针进行成像,根据正置光学显微镜成像结果得到锥形针尖和球形针尖在探针悬臂梁上的准确位置,从而在后续截取AFM 探针模板图像时使针尖处于模板图像的中间位置。得到细胞重心坐标和AFM 探针针尖坐标后即可确定目标细胞和探针针尖之间的空间位置关系,随后利用所得到的位置关系控制AFM 探针准确移动至目标细胞并进行AFM 力学特性实验。在完成对目标细胞力学特性进行测量后,控制AFM 探针移动至下一个细胞附近,并重复上述基于光学图像自动识别的细胞力学特性快速测量流程。
近年来机器学习领域的快速发展,特别是在深度学习方面的进展,极大地促进了生物医学图像理解分析的进步,深度学习算法已成为生物医学图像分类、检测、分割、配准等的重要研究方法[23]。当前,在生物医学图像分析方面应用得最广泛的深度学习模型是端到端(end-to-end)监督学习的卷积神经网络模型[24]。本文采用UNet++卷积神经网络(图3)识别AFM 光学显微镜采集的光学图像中的细胞。UNet++由不同深度的U-Net 结构(由卷积、下采样、上采样和跳跃连接组成的编码器-解码器网络)组成,这些U-Net结构的解码器通过重新设计的跳跃连接以相同尺寸紧密相连[25]。UNet++网络有以下优点。首先,UNet++结构中嵌入了不同深度的U-Net 结构,这些U-Net 结构共享一个编码器,而这些U-Net结构的解码器则是通过跳跃连接的方式相互交织。利用深度监督训练UNet++网络时,所有U-Net 结构通过共享图像可同时得到训练,这种设计不仅提升了整体的图像分割性能,还可以在推理时对模型进行剪枝。其次,UNet++网络不会受到跳跃连接的阻碍,因为只有来自编码器和解码器的相同比例特征图才可以进行融合。UNet++网络中重新设计的跳跃连接可以提取出不同尺度的特征,允许聚合层将跳跃连接中各个尺度的特征图与解码器的特征图进行融合,因而在图像语义分割和实例分割方面具有更好的性能。
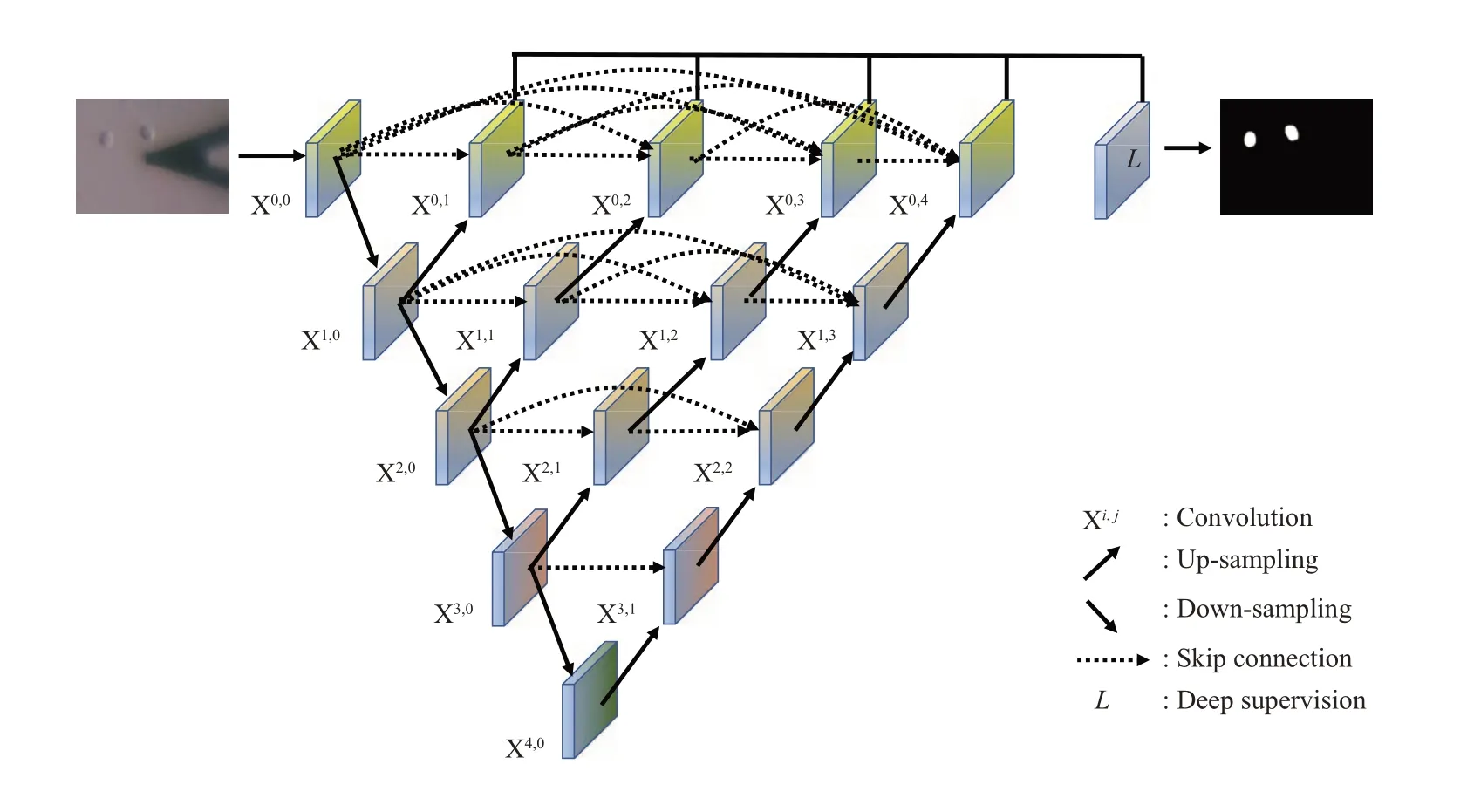
Fig. 3 Schematic illustration of the UNet++ network structure
用于UNet++网络训练的数据集由本文采用的Dimension Icon AFM的光学显微镜(图1a)拍摄得到。图像大小为320×240 像素,经过筛选共得到308 张细胞图像。利用Labelme 软件对图像进行标注(图1c)。图像像素被标注为2 类,分别为细胞(红色表示) 和背景(黑色表示)。随后在Windows 10系统环境下,以PyTorch为框架,使用矩池云人工智能云计算平台(浙江)对数据进行训练。训练集由通过对308张原始细胞及其标注图像进行镜像翻转、旋转等一系列图像操作后得到的1 232张图像组成。迭代次数为60次,经过迭代后得到UNet++训练模型,用于后续对细胞光学图像进行的语义分割。利用C++编写模板匹配程序并采用OpenCV软件库中平方差匹配方法以实现对获取的光学图像AFM探针的定位。考虑到在AFM实验中AFM 探针在探针夹上安装姿态的误差会导致模板图像与待匹配图像之间存在角度偏差,本文在模板匹配算法的基础上添加了模板旋转算法,即对模板从-5°到5°,以1°为步长依次进行旋转并在每次旋转后都会对待匹配图像进行模板匹配,从中选取模板与待匹配图像之间差异最小者作为最终匹配结果。此外,为了对光学图像中像素之间的实际距离进行标定,在空白区域使用AFM 操控软件控制AFM 探针移动一定距离(AFM操控软件可以得到AFM探针移动的准确距离),并利用模板匹配方法获取探针移动前后的坐标,得到光学图像像素与实际距离的对应关系。因此,在利用上述图像分析方法分别得到细胞重心和AFM 探针针尖坐标后,便可自动计算得到细胞与AFM探针之间的位置关系,从而控制AFM 探针准确移动至细胞表面获取力曲线。
1.4 SEM成像
利用美国Thermo Fisher 公司生产的Quattro SEM 环境扫描场发射电镜对制作的微球探针进行高分辨率成像。具体来说,利用导电胶将制作好的微球探针固定在SEM 样品台上,并利用离子溅射仪对样本进行镀金处理。随后在高真空模式下对微球探针样本进行扫描成像。
1.5 细胞杨氏模量计算
利用Hertz-Sneddon 模型(Hertz 模型对应微球针尖探针,Sneddon 模型对应常规锥形针尖探针)对获取的力曲线进行分析以得到细胞杨氏模量[15,26]:
其中F为探针加载力,E为细胞杨氏模量,R为微球针尖半径,δ为压痕深度,θ为锥形针尖半开角,υ为细胞的泊松比(一般认为活细胞为不可压缩材料,因此活细胞的泊松比为0.5[27])。探针加载力F可以根据胡克定律从悬臂梁偏转量x得到:
其中k为探针悬臂梁弹性系数。获取的力曲线记录了AFM 压痕过程中探针悬臂梁偏转量x与压电陶瓷驱动器垂直方向位置变化量d之间的关系。获取的力曲线分为两部分,分别为逼近曲线和回退曲线。通常利用逼近曲线计算样本的杨氏模量[28]。根据逼近曲线上接触点的位置将逼近曲线转化为压痕曲线(压痕深度等于压电陶瓷驱动器垂直方向变化量d与悬臂梁偏转量x之间的差值),随后利用Matlab (美国Mathworks 公司) 编写的Hertz-Sneddon模型拟合程序对压痕曲线进行拟合即得到细胞杨氏模量[13]。
2 结果与讨论
为了验证本文提出方法的有效性,首先利用常规锥形针尖AFM 探针进行了实验。图4 显示了结合AFM 和光学图像识别对单个HEK 293 细胞力学特性进行测量的实验结果。控制AFM 探针到达目标细胞附近后,利用AFM 光学显微镜获取细胞和AFM探针的光学图像(图4a)。随后即可根据预先训练的UNet++网络模型识别出光学图像中的目标细胞轮廓(图4b),同时通过模板匹配方法识别出AFM探针(图4c)。根据锥形针尖高分辨率光学成像结果(图4a插图)可以确保在制备的AFM探针模板图像中针尖位置处于模板中心,因此模板识别结果的中心即为AFM探针针尖(图4c蓝色方框中心)。基于上述识别结果即可确定目标细胞轮廓重心与AFM 针尖之间的位置关系(图4d),得到AFM 探针在水平面内移动至目标细胞所需的距离(Δx和Δy),并将其输入至AFM操控软件,即可实现将AFM 探针准确移动至目标细胞(图4e)并进行AFM压痕实验。利用Hertz-Sneddon模型对压痕实验中获取的力曲线进行分析即得到细胞杨氏模量(图4f)。考虑到不同类型细胞之间的形态差异,利用该方法对MCF-7 细胞进行了实验,实验结果(图5)表明,基于光学图像自动识别可将AFM锥形针尖准确移动至目标MCF-7 细胞重心并在此基础上实现了对MCF-7细胞力学特性的测量。

Fig. 4 Experimental results of utilizing AFM conical probe to rapidly detect the mechanical properties of single living HEK 293 cells under aqueous conditions based on optical image automatic recognition
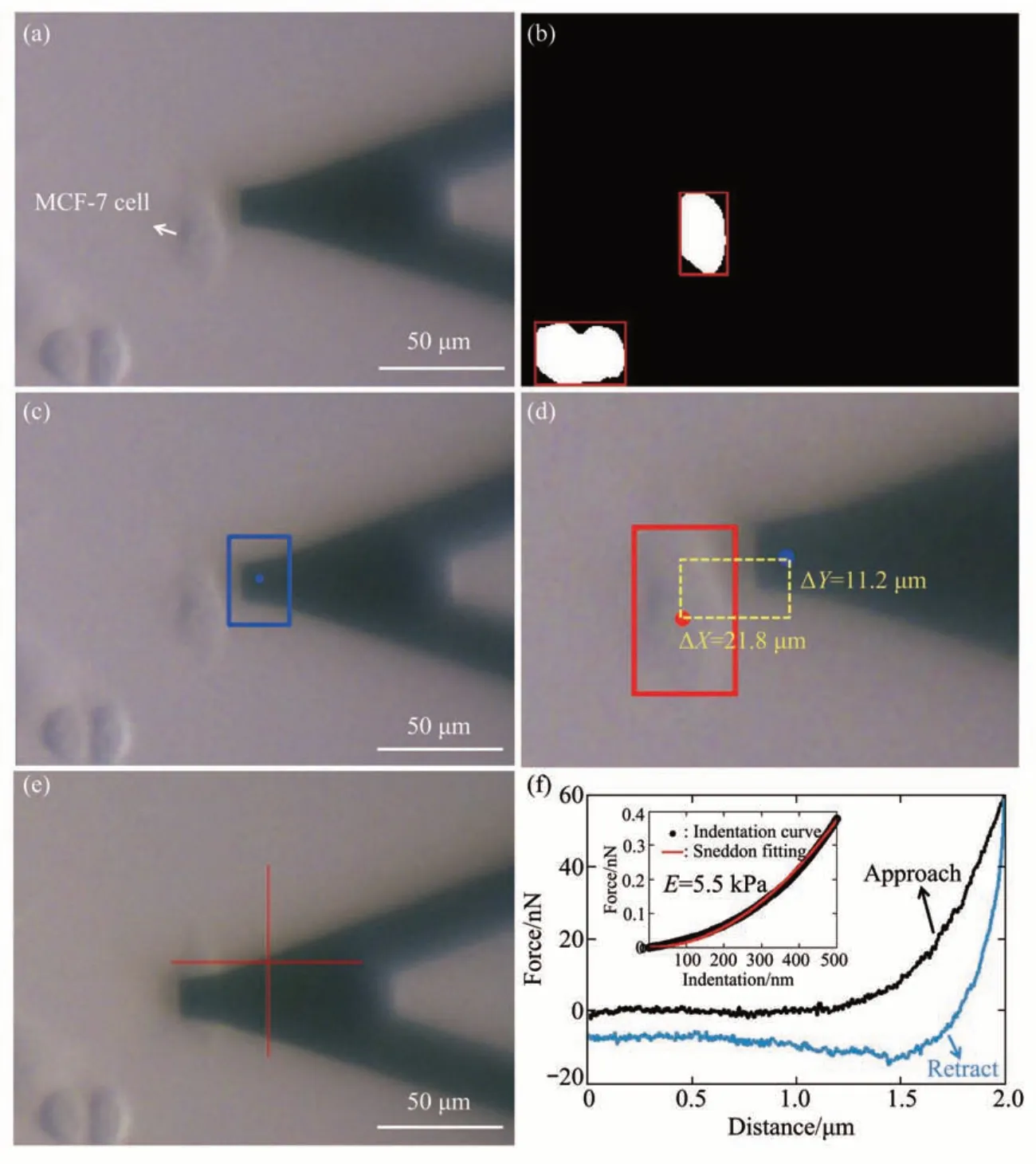
Fig. 5 Experimental results of utilizing AFM conical probe to rapidly detect the mechanical properties of single living MCF-7 cells based on optical image automatic recognition
随后利用AFM 微球探针测试了所建立的方法流程的有效性。图6 为光学图像识别导引下利用AFM 微球探针对单个HEK 293 活细胞力学特性进行探测的实验结果,可以看到基于光学图像识别可将微球探针准确移动至目标细胞表面并进而对细胞力学特性进行测量。图7 为结合光学图像识别和AFM微球探针对MCF-7细胞进行探测的实验结果,同样显示了所提出方法的有效性。为了获取具有统计学意义的结果,利用所建立的方法分别对10 个HEK 293 细胞和10 个MCF-7 细胞的力学特性进行了测量,其中在每个细胞表面获取10 条力曲线,统计结果如图8所示。可以看到细胞杨氏模量测量结果符合正态分布,且球形针尖探针测量得到的细胞杨氏模量要明显小于锥形针尖探针测量得到的杨氏模量,与前人测量结果[29-31]一致。造成这种差异的主要原因是锥形针尖和球形针尖所探测细胞结构部位的不同[32]。锥形针尖由于接触面积小,其主要探测的是细胞表层局部区域内的细胞骨架结构,而球形针尖则由于接触面积大探测的是细胞骨架及细胞质等细胞内部结构。细胞骨架的硬度要明显大于细胞质等细胞内部结构,从而导致锥形针尖测量得到的细胞杨氏模量远大于球形针尖测量得到的细胞杨氏模量。

Fig. 6 Experimental results of utilizing AFM spherical probe to rapidly detect the mechanical properties of single living HEK 293 cells based on optical image automatic recognition
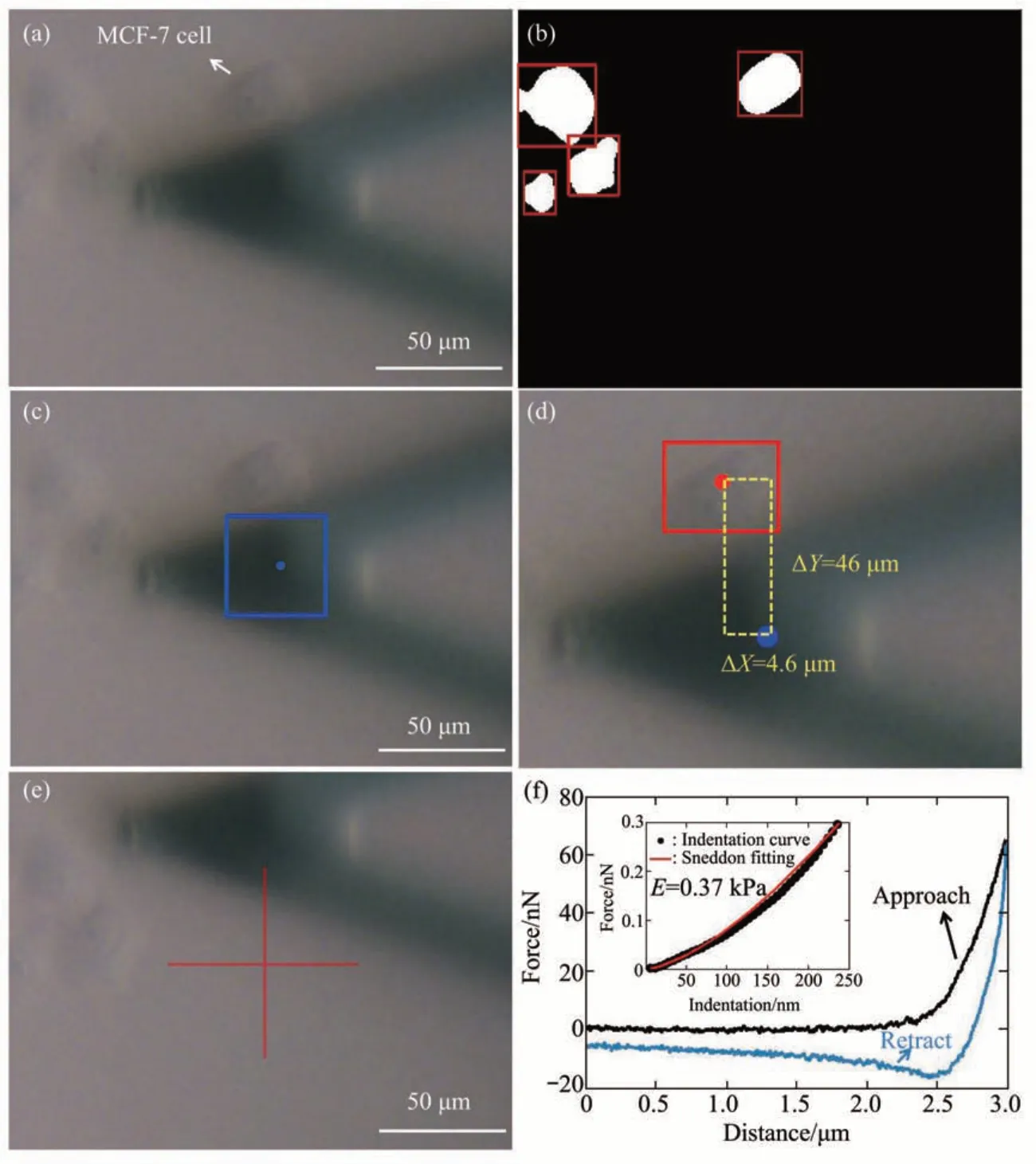
Fig. 7 Experimental results of utilizing AFM spherical probe to rapidly detect the mechanical properties of single living MCF-7 cells based on optical image automatic recognition
本文所提出方法对于AFM 单细胞力学特性研究具有积极意义。AFM 已成为单细胞力学特性研究的重要工具并在生物医学领域得到了广泛应用。然而,现有的AFM 单细胞力学特性测量实验严重依赖于人工,需要操作员根据经验判断AFM 探针和目标细胞之间的空间距离关系并控制探针移动至目标细胞进行压痕实验。本文通过借鉴光学图像分析技术,实现了对光学图像中细胞和AFM 探针位置的自动识别,在此基础上控制AFM 探针准确移动至目标细胞并进而完成压痕实验。本文提出的方法不依赖于操作员的经验,有助于提升AFM 压痕实验效率,为基于AFM 的高通量单细胞力学特性研究提供了新的思路和潜在可行的方法。此外本文提出的方法不仅适用于探测细胞表面局部区域力学特性的常规锥形针尖探针(图4,5),还适用于探测细胞整体力学特性的球形针尖探针(图6,7),对于AFM 细胞力学特性研究具有普遍意义。需要指出的是,本文方法直接控制探针移动到目标细胞表面,因此探测范围取决于所采用AFM 的探针在水平面的运动范围。本文AFM 的水平面探针运动范围为80×80 μm2,因此本文方法的探测范围为以AFM探针针尖为中心的80×80 μm2区域。下一步可以在细胞光学图像识别基础上,通过控制AFM 样品台运动以提升单细胞力学特性自动化探测范围。本文方法目前主要适用于单个孤立细胞,在未来通过借鉴聚团细胞光学图像分割方法[33]以对聚团细胞进行精准分割将显著提升本文方法的适用范围。当前在基于AFM 的细胞力学特性测量研究中,为了最大限度减少基底效应对测量结果的影响,通常在细胞中央区域(细胞核)采集力曲线[34]。基于此,本文基于光学图像自动识别实现了准确移动AFM 探针针尖至细胞中央区域以对细胞力学特性进行测量。研究人员已经提出了去除基底效应的方法以使AFM 可以较准确地测量细胞边缘部位的力学特性[27],因此下一步研究利用光学图像识别算法自动识别出细胞其他部位(如在癌症转移过程中发挥重要调控作用的癌细胞伪足结构[35-36]以及细胞质等),并实现将AFM探针准确移动至细胞表面不同部位,以进行力学特性测量,这对于理解细胞生命活动过程中的内在力学机制具有重要意义。此外,通过将单个细胞连接到AFM 探针悬臂梁制成单细胞探针[37-38],并应用本文提出的方法有望实现对单对细胞间黏附作用的快速自动测量,对于细胞黏附行为研究具有积极意义。
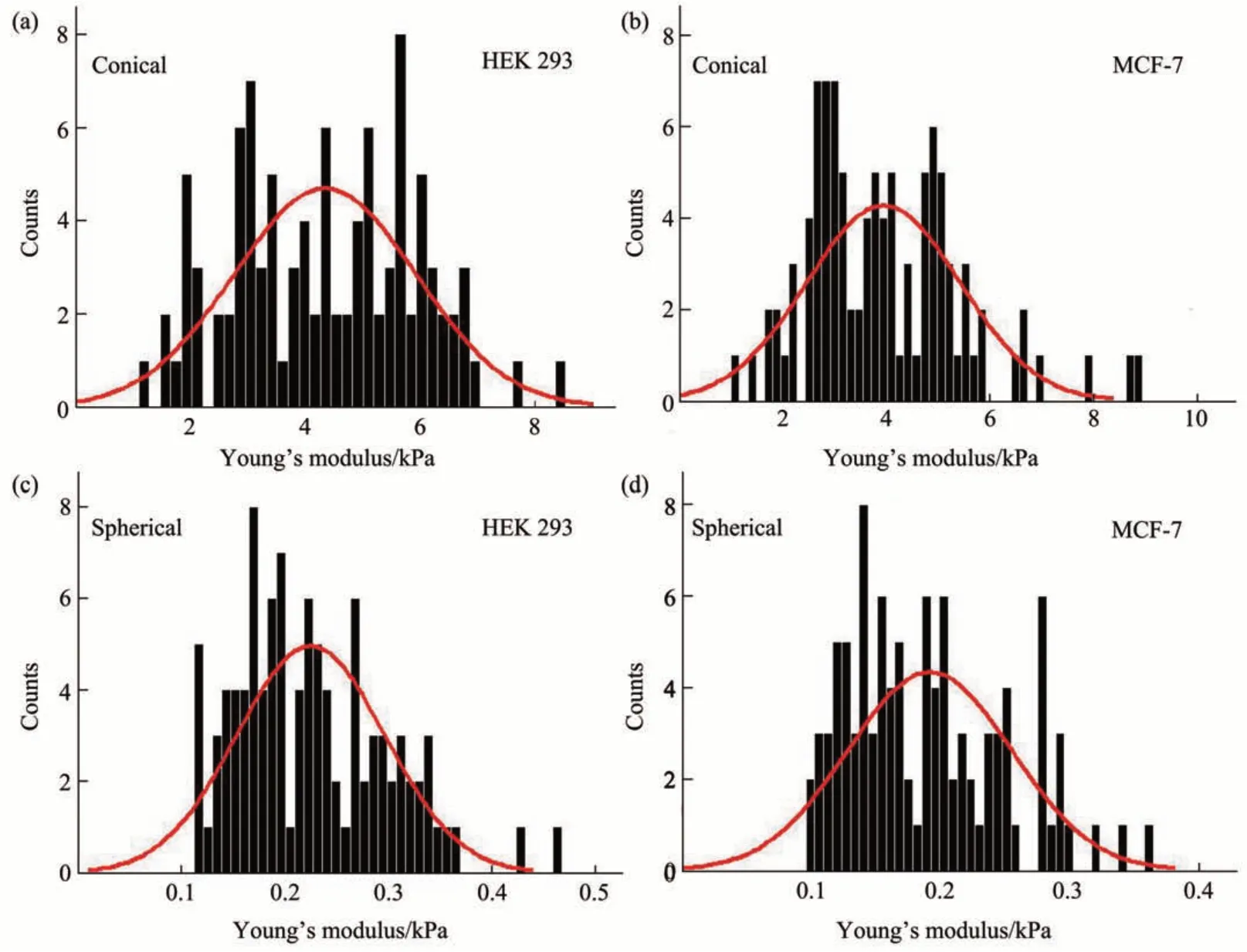
Fig. 8 Statistical histograms of measuring cellular mechanical properties based on the combination of AFM and optical image recognition
3 结论
总结起来,本文结合AFM 和光学图像自动识别技术实现了对单个活细胞力学特性的快速测量,为提升AFM 单细胞分析实验探测效率提供了新的可能,对于单细胞力学特性研究具有重要基础意义。
