纳米二氧化锆对人永生化角质形成细胞组蛋白H3修饰的影响*
2023-08-14赵晓旭姚燕坊侯巧利
赵晓旭 姚燕坊 侯巧利
(1)福建省新型污染物生态毒理效应与控制重点实验室,莆田 351100;2)生态环境及其信息图谱福建省高等学校重点实验室,莆田 351100;3)莆田学院环境与生物工程学院,莆田 351100;4)福州大学环境与安全工程学院,福州 350108)
纳 米 二 氧 化 锆 (zirconium dioxide nanoparticles,ZrO2-NPs)因其具有较高的稳定性、光学性能和机械性能,被广泛应用于牙科种植、生物传感器和癌症治疗等纳米医学领域[1-3]。然而,广泛的应用增加了ZrO2-NPs 对人类健康和环境暴露的风险。部分用于医用导管、敷料、凝胶等医药领域的纳米材料已被证明可以直接与皮肤、血液或淋巴系统等接触并蓄积,产生潜在的生物学毒性[4-5]。因此,研究ZrO2-NPs的生物学毒理效应进而评价其安全性显得尤为重要。
纳米材料因其颗粒尺寸小而产生的特异毒性“纳米毒性”已被广泛认识。纳米毒性取决于多种因素,除了与材料的纯度、尺寸大小、化学结构、团聚状态、剂量大小及所带电荷相关外,还与暴露时间、暴露途径以及纳米材料的表面修饰、表面活性、表面吸附能力等密切相关[6]。不同于传统的材料,纳米材料更容易进入人体细胞,从而在细胞内引起细胞各种功能损伤[7-8]。虽然不同物理化学特性的纳米材料的毒性效应存在差异,但一般情况下,纳米材料粒径越小,越容易进入人体细胞,其潜在毒性越大[9]。研究表明,与纳米二氧化钛和纳米四氧化三铁相比,纳米氧化铜具有更强的毒性,能够诱导DNA 损伤,其中一个主要原因涉及细胞内蓄积量的差异[10]。纳米银也能诱导DNA氧化损伤标志物8-羟基脱氧鸟苷(8-hydroxy-2'-deoxyguanosine,8-OHdG)的形成[11]。
纳米材料引起的细胞毒性也与其诱导的组蛋白修饰(histone modification)变化密切相关[12-14]。组蛋白修饰作为表观遗传学(epigenetics)的重要分支之一,其在控制染色质结构与调控基因转录中发挥着重要作用[15-16]。在各种组蛋白修饰中,组蛋白H3 修饰程度最高,可通过直接影响染色质结构或招募染色质重塑复合物来调节常染色质与异染色质之间的动态转换[17],在相关修饰酶的作用下调节基因激活和沉默的动态转换[16]。此外,组蛋白H3修饰参与调控DNA损伤修复[18-19],在细胞命运决定、细胞生长以及致癌作用的过程中也发挥着重要的作用[20]。研究表明,纳米银被细胞内在化后,诱导了组蛋白H3 第10 位丝氨酸(serine 10,S10)磷酸化(p-H3S10)的持续高表达,导致原癌基因c-jun的表达量增高[21]。纳米金暴露后,人神经母细胞瘤细胞SH-SY5Y 的H3 第4 位赖氨酸(lysine 4,K4)的二甲基化(Me2-H3K4)修饰水平显著降低,Me2-H3K9 修饰水平则显著升高[22]。单壁碳纳米管也可以选择性地诱导表观遗传修饰酶相关基因的上调,从而导致组蛋白H3 的整体脱乙酰化[23]。
近年来,有关纳米材料引起表观遗传效应变化的研究逐年递增。从表观遗传效应角度理解纳米材料诱导的生物毒性可以扩宽纳米毒理学研究内容,为全面评价纳米材料引起的生物效应提供新的视野,为纳米材料的进一步安全应用奠定基础。基于此,本文在利用场发射扫描电子显微镜(scanning electron microscope,SEM)、激光粒度仪、X 射线粉末衍射仪(X-rad-diffraction,XRD)等技术手段对ZrO2-NPs 进行详细表征的基础上,以人永生化角质形成细胞HaCaT 为模型细胞,采用蛋白质免疫印迹法(Western blotting,WB)及流式细胞技术等研究手段,探究了ZrO2-NPs 作用后的细胞生存率、细胞内蓄积量以及组蛋白H3 修饰变化及其潜在的调控机制。
1 材料与方法
1.1 实验材料
HaCaT 细胞(上海传秋生物科技有限公司);ZrO2-NPs(平均粒径<100 nm,美国Sigma-Aldrich公司);聚偏二氟乙烯膜(0.45 μm,美国Millipore公司);3M 滤纸(3 mm,美国Thermo Fisher公司)。
1.2 实验试剂
DMEM 细胞培养基(01863,美国Thermo Fisher 公司);胎牛血清(193254C,美国Thermo Fisher 公司);青链霉素双抗(J170027,美国Thermo Fisher 公司); 2.5% 胰蛋白酶溶液(1911594,美国Thermo Fisher 公司);WB 细胞蛋白质裂解液(P0013,上海碧云天生物技术有限公司); 抗 体 (AF1201、 AF1180、 AF1207、AF5614、AF5704、AF5710、A0208,上海碧云天生物技术有限公司);BCA 蛋白质定量试剂盒(BCA02,北京鼎国昌盛有限公司);WB化学发光试剂盒(TG268245,美国Thermo Fisher公司);彗星法DNA 损伤检测试剂盒(KGA240,南京凯基生物科技发展有限公司)。
1.3 实验仪器
场发射扫描电子显微镜(SU8010,日本Hitachi 公司);激光粒度仪(WINNER803,济南微纳颗粒仪器股份有限公司);比表面积微孔吸附仪(ASPA2460,美国Micromeritics 公司);X 射线粉末衍射仪(XRD-6100,日本Shimadzu 公司);密闭式超声破碎仪(VCX150,美国Sonics 公司);二氧化碳培养箱(3111,美国Thermo Fisher 公司);酶标仪(INFINITE F50,瑞士Tecan 公司);电泳仪(EPS301,美国Thermo Fisher公司);电泳槽(AE-6500,日本Atto 株式会社);转膜仪(TE77,美国Thermo Fisher 公司);化学发光成像系统(AI600,美国Thermo Fisher 公司);流式细胞仪(A00-1-1102,美国Beckman Coulter 公司);电感耦合等离子体质谱仪(7800,美国Agilent Technologies 公司);生物投射电镜(HT7800,日本Hitachi 公司);倒置荧光显微镜(DMi8,德国Leica公司)。
1.4 实验方法
1.4.1细胞培养基
向DMEM 细胞培养基中添加10%胎牛血清(10% DMEM)或0.5%胎牛血清(0.5% DMEM)及1%青链霉素双抗,4℃保存备用。
1.4.2样品前处理
实验当日,称取适量的ZrO2-NPs,用0.5%DMEM 培养基配制成10~50 g/L 的悬浊液。为使ZrO2-NPs 分散,使用密闭式超声破碎仪在60 W 功率下超声1 min。另外,用于X 射线粉末衍射及比表面积微孔表征的ZrO2-NPs及其悬浊液在测试前,经-50℃、24 h 真空冷冻干燥处理后置于干燥器内保存备用。
1.4.3纳米材料表征
场发射扫描电子显微镜表征:将适量待测样品均匀涂抹或滴加于导电胶上,喷金150 s 后上机测试。测试参数为扫描加速电压10~13 kV,加速电流10 μA,显示分辨率70~110 K。
动态光散射表征:ZrO2-NPs 的流体动力学粒径(二次粒径) 及其分布采用动态光散射法(dynamic light scattering,DLS)表征。测试参数为折射角度90°,分散介质折射率1.333,介质黏度0.000 890 4 Pa·s,粒度测试范围为1~10 000 nm,设备延迟单位时间10 μs。
X射线粉末衍射表征:取适量经干燥处理后的待测样品置于样品槽,用玻璃板压片压平待测样品,随后测试。测试参数为仪器铜靶辐射源CuKα(λ=1.540 56 Å),扫描速度为2°/min,扫描角度为4°~90°。
比表面积微孔表征:比表面积微孔表征采用氮气吸附-脱附(Brunauer-Emmett-Teller,BET)表征方法。分别称取0.1~0.2 g 经干燥处理后的待测样品置于BET 试管底部,随后使用真空干燥脱气仪在200℃条件下对待测样品脱气2 h。在相对压力P/P0为0.99 及-195.85℃条件下获得氮气吸附-脱附等温曲线。P/P0在0.05~0.35之间线性拟合。
1.5 传代细胞培养
HaCaT 细胞经0.25%胰蛋白酶溶液消化传代后,接种于含10% DMEM细胞培养基的100 mm细胞培养皿中,置于37℃、5% CO2及饱和湿度的CO2培养箱中静置培养,细胞贴壁面积达到70%~90%之间时传代1次。
1.6 供试细胞准备
取对数生长期的HaCaT 细胞,接种于35 mm细胞培养皿,细胞贴壁面积达到70%~90%之间时,用0.5% DMEM 细胞培养基冲洗细胞2 次后,细胞在0.5% DMEM细胞培养基中继续培养24 h。
1.7 样品暴露
细胞在0.5% DMEM中培养24 h后,弃掉旧培养基,加入含样品的新鲜0.5% DMEM 细胞培养基,使样品最终浓度为0.1~1 000 mg/L后,置于培养箱中静置培养0.5~72 h。每批次实验对照组以未加入样品的细胞为空白对照,每个浓度单次实验中设置3个重复,各组实验独立重复3次。
1.8 细胞生存率检测
至暴露时间点,弃培养基,磷酸盐缓冲液(phosphate buffer saline,PBS) 冲洗细胞2 次,0.25%胰蛋白酶溶液消化并收集细胞,制备单细胞悬液。将细胞悬液与台盼蓝染色液按1∶1 吹打混匀后移至血球计数板。使用倒置显微镜观测细胞数量,并记录数值进行统计。
1.9 蛋白质免疫印记法
至暴露时间点,细胞刮刀剥离细胞并移至离心管,PBS冲洗2次后弃上清液。随后向样品中添加适量WB 细胞蛋白质裂解液,超声破碎1 min 后于4℃静置2 h。样品蛋白质提取后参照BCA 蛋白质定量试剂盒说明书进行蛋白质定量。将定量过的蛋白质样品与蛋白质凝胶电泳上样缓冲液按1∶1 比例充分混合。样品经电泳、转膜、染色、脱色、封闭后,在4℃下一抗孵育12 h。随后,室温下二抗孵育2 h后上机检测。选取不受外界刺激影响的H3含量作为内参,蛋白质条带的影像采用Photoshop 2020软件进行分析统计。
1.10 观察纳米二氧化锆的细胞内分布
利用透射电子显微镜(transmission electron microscope,TEM)观察细胞内ZrO2-NPs的分布情况。不同剂量梯度的ZrO2-NPs(0~1 g/L)暴露1 h后,细胞刮刀剥离细胞并移至离心管,PBS冲洗2次后弃上清液。沿管壁缓慢加入4℃预冷的2.5%戊二醛固定液后于4℃静置24 h。样品经锇酸固定、脱水、渗透、包埋、超薄切片、双染色后上机观察。
1.11 纳米二氧化锆的细胞内蓄积量检测
利用流式细胞仪侧向角(side scattered light,SS)的变化研究细胞内纳米材料的蓄积量[21]。细胞摄入纳米材料颗粒后,细胞内部精细结构和细胞粒度改变,引起SS 增加。至暴露时间点,弃培养基,PBS 冲洗细胞2 次,0.25%胰蛋白酶消化并收集细胞,制备单细胞悬液。将细胞悬液移至新的流式管,使用流式细胞仪检测,每组数据检测10 000个细胞,每组样品检测3次,采用FlowJo 10.7.1软件对所得实验结果进行分析。
利用电感耦合等离子体质谱仪(inductively coupled plasma-mass spectrometry,ICP-MS)验证细胞内ZrO2-NPs 的蓄积量。不同剂量梯度的ZrO2-NPs(0~1 g/L)暴露1 h 后,弃培养基,PBS 冲洗细胞2 次,0.25%胰蛋白酶消化并收集细胞,制备单细胞悬液,然后进行计数。将1×105个细胞移至新的15 ml离心管,随后加入3 ml 65%硝酸及2 ml氢氟酸,室温下震荡24 h后,移至聚四氟乙烯管中180℃除酸2 h,随后用2%硝酸定容至50 ml 上机测试。
1.12 彗星实验
不同剂量梯度的ZrO2-NPs(0~0.1 g/L)暴露1 h后,弃培养基,PBS冲洗细胞2次,0.25%胰蛋白酶消化并收集细胞,制备单细胞悬液后,参照彗星法DNA 损伤检测试剂盒说明书进行实验。样品经裂解、DNA碱解旋、电泳、染色后上机观察。
2 结果
2.1 ZrO2-NPs表征
图1a 为ZrO2-NPs 及经0.5% DMEM 分散处理的ZrO2-NPs 的SEM 图像。与供应商标注信息基本一致,未分散前的ZrO2-NPs(左)呈现较为规则均匀的球形,单个颗粒粒径(一次粒径)约为100 nm,颗粒之间界线分明,呈分散堆叠、松散聚集状态,表明颗粒之间黏性较低。经0.5% DMEM分散处理后的ZrO2-NPs(右)呈现不规则球形,颗粒之间界线模糊,颗粒之间黏性显著升高,出现明显团聚现象,其粒径(二次粒径)介于100~500 nm 之间。为了进一步评估ZrO2-NPs 在0.5%DMEM 中的分散情况,进行DLS 测试分析。经0.5% DMEM 分散处理后,ZrO2-NPs 的分散指数(PI)为0.280 6,粒径分布较为集中,液相分布较为均匀,其粒径分布集中在200~400 nm 之间。经统计分析得出ZrO2-NPs 的DLS 平均粒径(二次粒径)为332.49 nm,与一次粒径(<100 nm)相比,由于团聚其二次粒径增大约3 倍(图1b)。另外,由图1c可知,两种样品的吸附-脱附等温曲线均为IV 型,在相同压力下,ZrO2-NPs 的吸附量大于经0.5% DMEM分散处理后的ZrO2-NPs,其BET比表面积分别为(32.399 7±0.132 6)m2/g 及(16.290 6±0.161 0)m2/g。表明ZrO2-NPs堆积松散,其孔间隙更大,而经分散处理后的ZrO2-NPs 则由于聚集程度高,其孔间隙更小。XRD 分析结果表明,ZrO2-NPs的晶型为单斜晶(monoclinic),粉末衍射文件(powder diffraction file,PDF)卡片号为86-1449,且无论分散(团聚)与否其晶型特征无明显变化,均能保持良好的晶型结构(图1d)。实验结果表明,经0.5% DMEM 分散处理后,由于团聚ZrO2-NPs的比表面积减小、粒径增大。
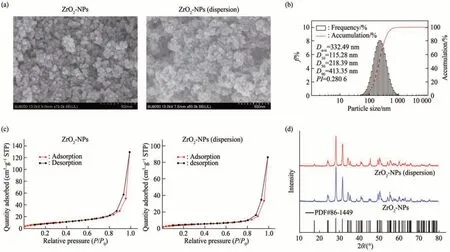
Fig. 1 Physicochemical properties of ZrO2-NPs in dispersion medium
2.2 ZrO2-NPs暴露后细胞生存率的变化
为了确定ZrO2-NPs 对HaCaT 细胞生存率的影响,利用台盼蓝染色法测定ZrO2-NPs 暴露后的细胞生存率(图2)。实验结果表明,不同剂量梯度的ZrO2-NPs(0~1 g/L)暴露24 h 后,HaCaT 细胞生存率略有下降,但不明显。实验最大剂量(1 g/L)作用24 h后,HaCaT细胞生存率仅下降约10%,与对照组生存率(92%)基本一致(图2a)。另外,观察较低剂量的ZrO2-NPs 长时间暴露对HaCaT 细胞生存率的影响。不同时间梯度的实验结果表明,0.1 g/L ZrO2-NPs 长时间暴露后,HaCaT 细胞的生存率无明显变化,但在暴露36 h 后出现下降趋势(图2b)。细胞一旦大量死亡将导致组蛋白修饰不能被有效检测,因此选择36 h作为最大暴露时间进行之后的实验。
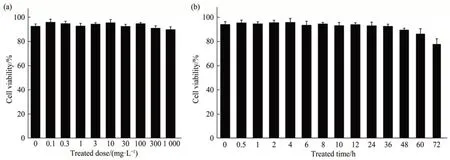
Fig. 2 Cell viability after exposure to ZrO2-NPs
2.3 ZrO2-NPs对组蛋白H3修饰的影响
为了确定ZrO2-NPs对组蛋白H3常见修饰位点的影响,利用蛋白质免疫印迹法观察ZrO2-NPs 暴露后HaCaT 细胞的p-H3S10、组蛋白H3 第9 位赖氨酸(lysine 9,K9) 的乙酰化(Ac-H3K9)、Ac-H3K14、组蛋白H3 第4 位赖氨酸的三甲基化(Me3-H3K4) 及Me3-H3K27 修饰水平变化(图3)。不同剂量ZrO2-NPs(0~1 g/L)暴露1 h 后,p-H3S10修饰水平随着暴露剂量的升高而升高,显示出较为明显的剂量依赖性(图3a)。与p-H3S10的结果相似,Ac-H3K9、Ac-H3K14、Me3-H3K4及Me3-H3K27 修饰水平也随着暴露剂量的升高而升高。另一方面,低剂量0.1 g/L ZrO2-NPs 长时间(~36 h)暴露的结果表明(图3b),ZrO2-NPs 暴露后诱导了p-H3S10 修饰水平的升高并持续长达24 h。同样的,随着暴露时间的增加,观察到Ac-H3K9、Ac-H3K14 及Me3-H3K4 修饰水平明显上调。另外,0.1 g/L ZrO2-NPs 暴露后Me3-H3K27修饰水平上调只持续了2 h。实验结果表明,ZrO2-NPs 暴露后短时间内(1 h)即引起了p-H3S10、Ac-H3K9、Ac-H3K14 及Me3-H3K4 的高表达,并持续长达24 h。另外,Me3-H3K27 修饰的上调在ZrO2-NPs暴露2 h后出现下降。
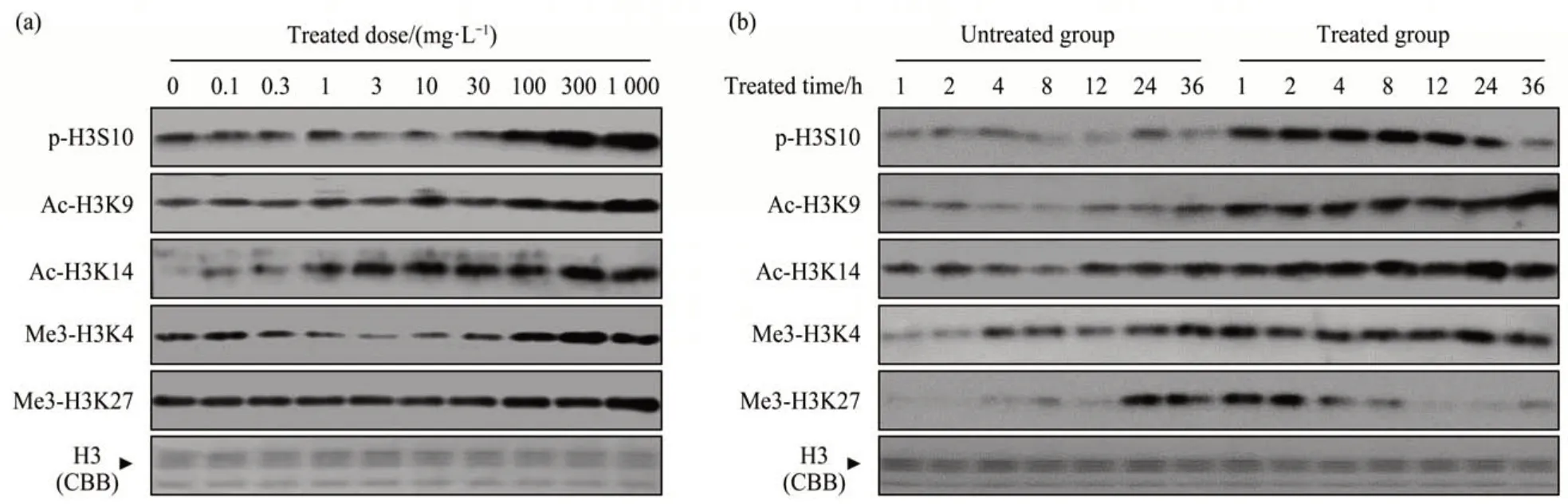
Fig. 3 Histone H3 modification after exposure to ZrO2-NPs
2.4 细胞内ZrO2-NPs的分布及其蓄积量
不同于传统材料,纳米材料更容易进入细胞,从而在细胞内引起各种功能损伤[24-25]。为了探究ZrO2-NPs对组蛋白H3修饰影响的机制,观察ZrO2-NPs 细胞内的分布情况(图4a)。随着ZrO2-NPs 暴露剂量的增加,细胞内可见ZrO2-NPs 颗粒成簇分布于细胞质及细胞器(如线粒体)中,但并未观察到颗粒进入细胞核的现象。另外,利用流式细胞仪的侧向散射光SS 分析检测细胞内ZrO2-NPs 的蓄积量。实验结果表明,ZrO2-NPs(0~1 g/L)暴露1 h后,SS 强度以剂量依赖的方式增加(图4b)。而SS强度并未随着1 g/L ZrO2-NPs暴露时间的增加而增强,各暴露时间点的结果与1 h 时基本一致(图4c)。为了进一步验证细胞内ZrO2-NPs 的蓄积量,使用ICP-MS 定量细胞内总锆的含量。与流式细胞仪的结果一致,随着ZrO2-NPs 暴露剂量的增加,细胞内总锆的含量随之增加,显示了显著的剂量依赖性(图4d)。
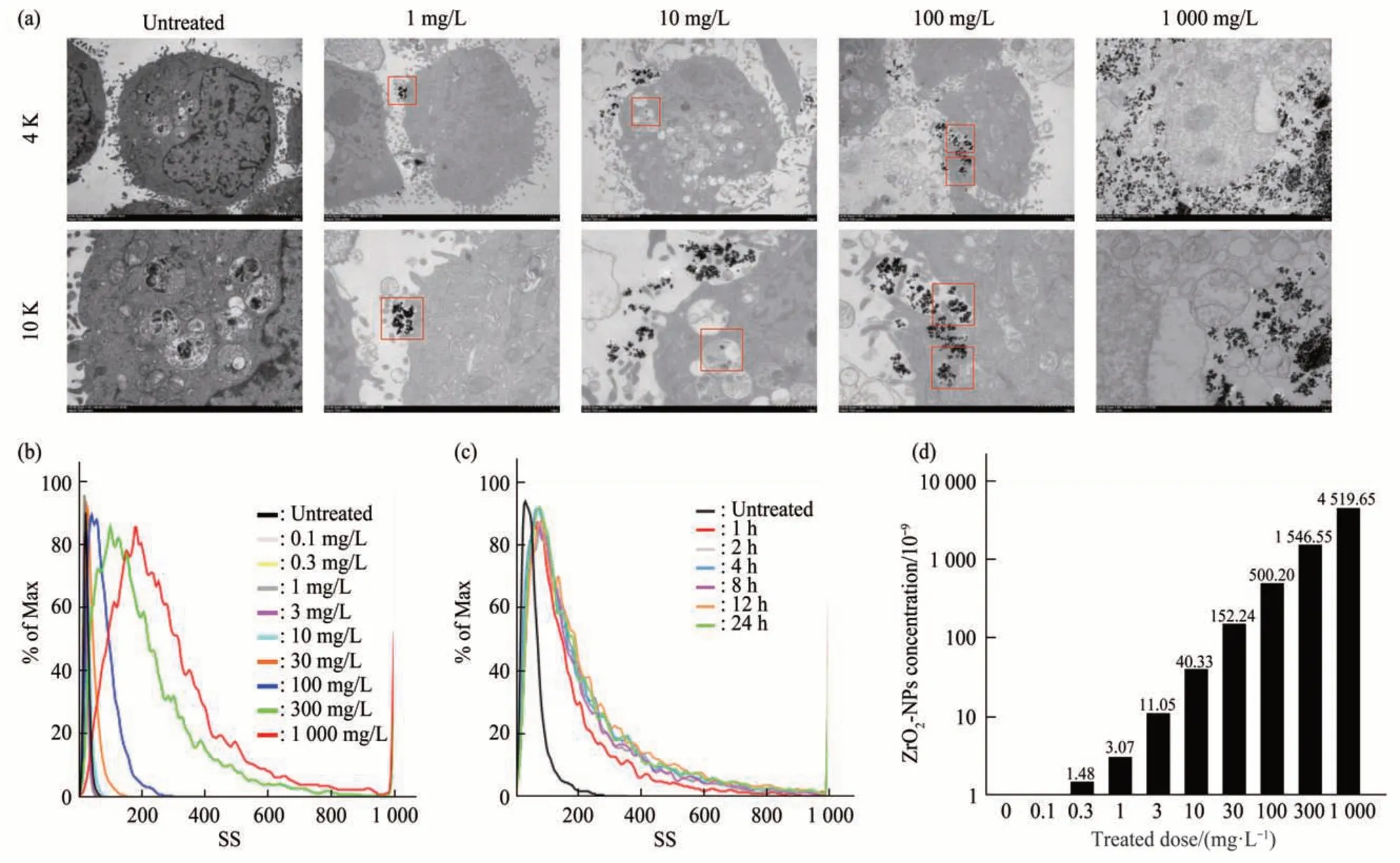
Fig. 4 Intracellular distribution and accumulation after exposure to ZrO2-NPs
为了进一步确定细胞内ZrO2-NPs 的蓄积量与组蛋白修饰之间的关系,使用Photoshop 2020软件定量图3a 中所示的p-H3S10、Ac-H3K9 及Me3-H3K4 条带,并计算了SS 和各组蛋白H3 修饰强度的平均值。随着ZrO2-NPs 的暴露剂量的增加,ZrO2-NPs 的蓄积量(SS 强度) 和p-H3S10、Ac-H3K9 及Me3-H3K4 的强度平行增加(图5)。各自的相关系数为R2=0.818 63、R2=0.881 28 及R2=0.584 59。
2.5 ZrO2-NPs诱导DNA损伤形成
为了确定进入细胞内的ZrO2-NPs 是否引起DNA 损伤,使用图3 相同样本观察ZrO2-NPs 暴露后DNA 损伤标志物组蛋白H2AX 第139 位丝氨酸的磷酸化(γ-H2AX)修饰水平。不同剂量ZrO2-NPs(0~1 g/L)暴露1 h后,γ-H2AX修饰水平随着暴露剂量的升高而升高,显示出明显的剂量依赖性(图6a)。0.1 g/L ZrO2-NPs 长时间(~36 h)暴露后诱导了γ-H2AX 修饰水平的升高并持续长达36 h(图6b)。另外,使用彗星实验进一步验证了ZrO2-NPs诱导的DNA损伤(图6c)。

Fig. 5 Correlation between intracellular accumulation of ZrO2-NPs and histone H3 modification
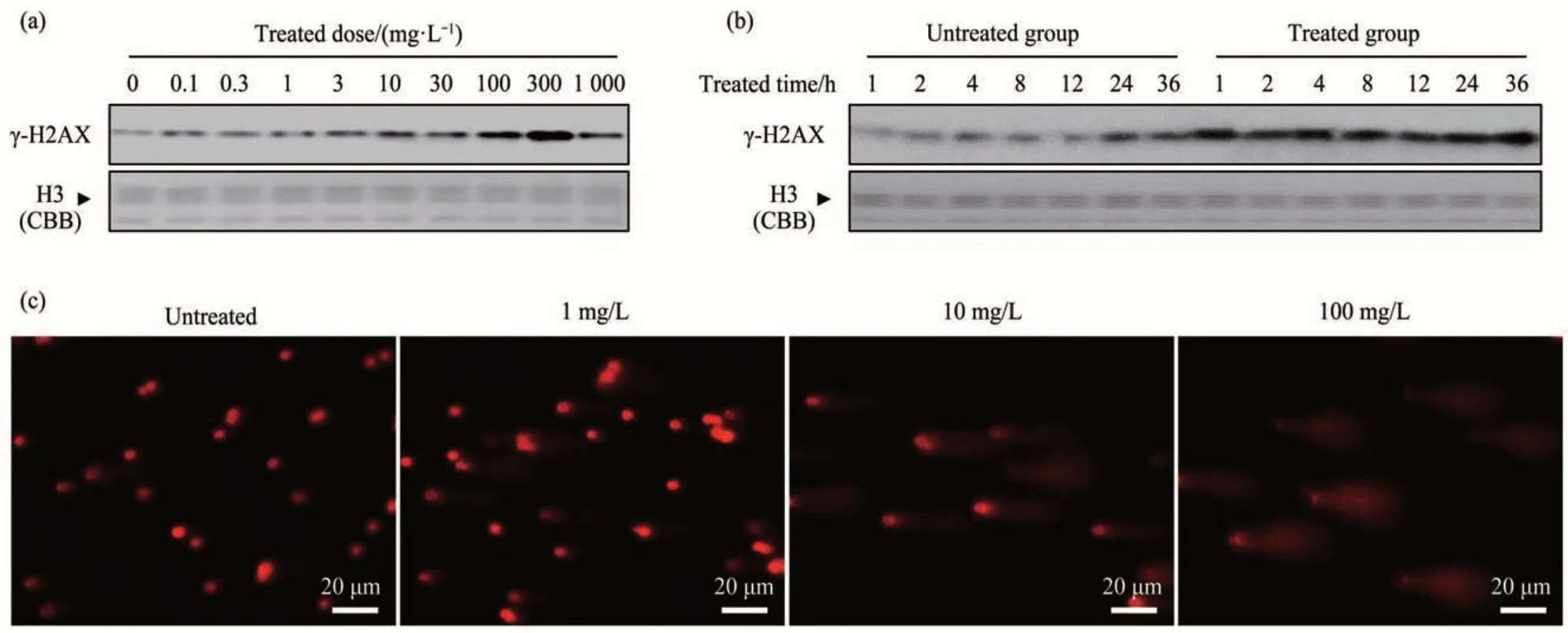
Fig. 6 γ-H2AX modification after exposure to ZrO2-NPs
为了进一步确定细胞内ZrO2-NPs 的蓄积量与DNA 损伤以及DNA 损伤与组蛋白H3 修饰之间的关系,绘制DNA 损伤(γ-H2AX) 与SS 强度、DNA 损伤与p-H3S10、Ac-H3K9、Me3-H3K4 相关性的散点图(图7)。ZrO2-NPs 的细胞内蓄积量与其诱导的DNA损伤呈线性相关(R2=0.680 99)。另外,DNA损伤与p-H3S10、Ac-H3K9及Me3-H3K4的强度平行增加,各自的相关系数为R2=0.726 29、R2=0.912 69和R2=0.599 81。
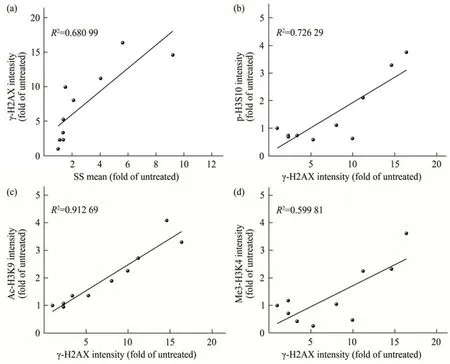
Fig. 7 Correlation between DNA damage and intracellular accumulation,and between DNA damage and histone H3 modification
3 讨论
纳米材料可以通过内吞作用或自由扩散等不同途径被细胞蓄积[26]。本文观察到将ZrO2-NPs 分散在0.5% DMEM 中后,明显出现团聚现象(图1)。DMEM 培养基中带正电荷的离子较多,呈负电性的纳米颗粒分散后,因颗粒间的静电斥力的减弱及颗粒间稳态的失衡,导致颗粒在分散介质中产生团聚现象。此外,含有血清的细胞培养基会在纳米颗粒表面覆盖一层“蛋白冠”[27]。蛋白冠的形成可能进一步促进纳米颗粒相互吸引,并能在液相中维持稳定。一般而言,纳米颗粒的尺寸越小越容易进入细胞[28]。纳米颗粒在分散介质中的团聚明显会影响其进入细胞的能力。然而,也有报道指出“蛋白冠”的形成会为纳米颗粒表面提供新的生物结合位点。在生物系统内,纳米颗粒表面吸附的组分可为免疫系统提供特异性,从而使纳米颗粒顺利进入细胞[29]。多项研究证实,纳米颗粒诱导的组蛋白H3修饰及DNA损伤与其细胞内蓄积量高度相关[30-32]。这与本文观察到的结果一致,随着ZrO2-NPs 暴露剂量的增加,ZrO2-NPs 的细胞内蓄积量及其诱导的组蛋白H3修饰及γ-H2AX显著增加(图3a,4a,6a),进一步分析表明,ZrO2-NPs 的细胞内蓄积量与组蛋白H3 修饰及γ-H2AX 形成高度相关(图5、7a),间接证明了ZrO2-NPs 的细胞内蓄积是引起组蛋白修饰的关键因素之一。另外,ZrO2-NPs 颗粒未能进入细胞核内,其暴露可能是引起了组蛋白H3 修饰相关信号通路的变化,进而间接的导致组蛋白H3修饰变化(图4a)。
组蛋白修饰在控制染色质结构与调控基因转录中发挥着重要作用[15-17]。p-H3S10是有丝分裂起始的关键事件常被用作判断细胞是否处于有丝分裂的标志物[33]。本文实验结果表明,ZrO2-NPs 能诱导p-H3S10 的持续高表达(图3b)。然而,p-H3S10在ZrO2-NPs 暴露后立即被诱导,这与有丝分裂相关的p-H3S10 存在明显差异。p-H3S10 的高表达也是诱导原癌基因表达的关键因素之一[34-36]。一些致癌性金属,如镍、砷等能引起p-H3S10 修饰的改变,从而导致基因表达的改变[35-36]。p-H3S10的增加会促进Ac-H3K14 修饰水平上调[37-38]。Ac-H3K9及Ac-H3K14主要位于启动子区域,其高表达通常与基因激活相关[39]。在相同暴露时间点下观察到p-H3S10 与Ac-H3K9 及Ac-H3K14 存在协同作用(图3b)。另一方面,Me3-H3K4 与组蛋白H3 的乙酰化之间也存在协同作用[40],而Me3-H3K27是异染色质区域的主要标志,其高表达常常被认为是转录抑制的关键[20],这与本文观察到的ZrO2-NPs 诱导组蛋白H3 修饰变化结果高度一致。这些结果强烈表明,ZrO2-NPs诱导的p-H3S10与基因激活高度相关。
组蛋白修饰变化在DNA 损伤修复过程中具有重要作用[41]。DNA一旦发生损伤,细胞会启动组蛋白修饰等相关的DNA损伤修复途径[42]。组蛋白H3乙酰化创造了开放的染色质结构,为募集DNA修复蛋白提供了良好的环境[18]。DNA损伤也可以引起相关修饰酶的变化,进而对组蛋白修饰产生影响。研究表明,甲基转移酶SUV39H1 可被迅速募集到DNA 损伤区域并引起H3K9 甲基化的迅速上调,进而激活DNA损伤信号蛋白[43]。本文的分析结果表明,ZrO2-NPs 引起的DNA 损伤(γ-H2AX)与其诱导的组蛋白H3 修饰变化强度呈线性相关(图7b-d)。这些结果间接证明了ZrO2-NPs 引起的DNA 损伤是其诱导组蛋白H3 修饰变化的原因之一。另外,发现ZrO2-NPs 暴露后Me3-H3K27 修饰水平上调只持续了2 h(图3b),尚不清楚原因,这将是今后工作的重点之一。
组蛋白修饰是表观遗传学领域重要的研究内容之一,参与染色质动态结构的维持和调节、基因激活及沉默、DNA 损伤修复等多种重要的生物学过程,与神经系统疾病、糖尿病和癌症等各类疾病有关[44-45]。对ZrO2-NPs 等金属氧化物纳米材料诱导组蛋白修饰的分子机制的进一步探究,必将为推动纳米安全性评价系统的发展与完善,为评估金属氧化物纳米材料的生物效应和安全性及设计应用于各种领域的金属氧化物纳米材料提供理论基础。
4 结论
分散在DMEM 细胞培养基中的ZrO2-NPs 颗粒明显团聚,比表面积减少,二次粒径增大,且诱导了HaCaT细胞组蛋白H3常见修饰位点的变化。另外,细胞内的蓄积是ZrO2-NPs诱导组蛋白H3修饰变化的关键因素之一,组蛋白H3 修饰的调控机制可能涉及DNA损伤修复途径。
