依加利塞(Eganelisib)的抗炎及其PI3Kγ选择性抑制机制研究*
2023-08-14熊文典蔡燕飞朱景宇
熊文典 贾 磊 蔡燕飞 陈 蕴 金 坚*** 朱景宇***
(1)江南大学生命科学与健康工程学院,无锡 214122;2)江南大学化学与材料工程学院,无锡 214122)
炎症(inflammation),是机体对外界感染、组织损伤等刺激所产生的,以维持机体自身内环境稳定和正常生命活动为根本的一种保护性反应[1]。炎症疾病发病机制复杂,而且常常表现为慢性炎症,治疗困难,从而容易引发其他疾病,如类风湿性关节炎、银屑病、肺纤维化,甚至肿瘤[2]。大量研究已发现炎症反应与胞内多条信号通路的激活相关, 其中磷脂酰肌醇 3 激酶(phosphatidylinositol 3-kinase,PI3K)信号通路备受关注[3-4]。PI3K是一种胞内脂质磷酸激酶,根据其结构和底物的特异性可分为I、II、III型,其中I型PI3K 研究最为广泛[5]。受多种细胞表面受体激活后,I 型PI3K 可磷酸化靶底物磷酸肌醇(PIP2)肌醇环的第3 位,产生脂质第二信使磷脂酰肌醇-3,4,5-三磷酸(PIP3),进而启动广泛的信号转导级联反应[6]。其介导的PI3K/Akt 信号通路调控着一系列细胞生理活动,如细胞存活、迁移、分化和增殖等[7]。I 型PI3K 是由调节亚基(p85)和催化亚基(p110)组成的异源二聚体,根据结构特异性和调控亚基的差异,进一步分为IA类和IB类。IA类包括PI3Kα、PI3Kβ、PI3Kδ,而IB 类仅含有PI3Kγ[8]。作为唯一的亚型结构,PI3Kγ 拥有如下几个显著特征:a. IA 型PI3K 主要由酪氨酸激酶受体(recptor tyrosine kinases,RTKs) 激活,而PI3Kγ 主要受G 蛋白偶联受体(G protein-coupled receptors,GPCRs)激活[9-10];b. PI3Kα 和PI3Kβ在人体组织中普遍表达,而PI3Kγ和PI3Kδ主要分布于造血系统,其中PI3Kγ 主要存在于白细胞中,如中性粒细胞、嗜酸性粒细胞、巨噬细胞、T 细胞、肥大细胞中[11];c. 在受到如GPCR 这些细胞表面受体刺激后,PI3Kγ被大量激活从而可以调控多种免疫细胞功能[12];d. PI3Kγ 缺陷小鼠模型表明,敲除PI3Kγ不会造成胚胎致死,但会严重影响小鼠的免疫功能[11,13]。大量研究表明,PI3Kγ 的激活有助于中性粒细胞在感染和炎症部位聚集,从而释放大量的趋化因子、炎症因子及活性氧(ROS)等[14]。PI3Kγ 在其他免疫细胞及其功能中也发挥着重要作用,例如,趋化单核细胞或巨噬细胞在炎症部位的迁移、激活及发育T 淋巴细胞等[11]。此外,在多种小鼠模型中,抑制PI3Kγ 可以有效地治疗多种炎症疾病,包括关节炎、红斑狼疮、哮喘、肺部炎症和纤维化等[15-17]。因此,PI3Kγ因其在免疫系统中的重要作用而成为一个极具潜力的抗炎药物靶点。
目前已有一些选择性PI3Kγ报道,其中依加利塞(Eganelisib,IPI-549) 已进入临床实验(图1a)[18]。IPI-549 作为一个肿瘤免疫治疗候选化合物,主要用于治疗尿路上皮癌、乳腺癌、卵巢癌等肿瘤疾病,迄今没有IPI-549 用于炎症治疗的报道[19]。目前已有多篇论文综述了PI3Kγ 抑制剂的开发情况,其中用于抗炎作用的PI3Kγ抑制剂报道较少[16,20-21]。因此,开发新型的PI3Kγ抑制剂用于炎症治疗具有广阔的应用前景及临床意义。然而,目前几乎所有的PI3Kγ抑制剂都是围绕其ATP结合口袋进行药物设计[22],即ATP 竞争性抑制剂,由于I型PI3K的高度同源及ATP口袋的保守性,使得开发选择性PI3Kγ 抑制剂具有极大的挑战[23],因此,研究现有抑制剂的选择性机制将有助于选择性PI3Kγ 的开发。本文拟采用IPI-549 作为工具药物,使用体外炎症模型评价其抗炎作用,同时利用整合的计算模拟技术来研究其PI3Kγ的选择性机制,为抗炎PI3Kγ抑制剂的开发提供一定的理论基础。
1 材料与方法
1.1 IPI-549对RAW264.7细胞活性的影响
取对数生长期的小鼠巨噬细胞RAW246.7(购自中科院细胞库),每孔5 000 个细胞接种至96 孔板,置于培养箱中培养(37℃,5% CO2)。待细胞贴壁后,加入不同浓度的IPI-549,设置3 个复孔,同时设置空白组和对照组,作用24 h后使用CCK-8检测细胞活力。
1.2 IPI-549对PI3K信号通路作用评价
将处于对数生长期的RAW264.7 细胞铺于6 孔板,每孔1.5×106个细胞,加入1 ml 无血清的DMEM 培养基后置于培养箱中饥饿过夜处理(37℃,5% CO2)。提前加入不同浓度(0.1、0.5、1.0 μmol/L) 的IPI-549 (0.5% DMSO) 处理30 min后,加入500 µg/L脂多糖(lipopolysaccharide,LPS)作用30 min。随后根据RIPA 裂解液说明书提取蛋白质,使用BCA 试剂盒测定蛋白质浓度并调节至同一浓度水平,加入上样缓冲液(loading buffer)后在水中煮沸5 min使蛋白质充分变性,完成上样液的制备。上样等量的样品,并按照预制胶的说明书进行电泳、转膜、封闭、孵育抗体,其中封闭使用5%脱脂奶粉,一抗为磷酸化Akt(p-Akt-S473,1∶1 000稀释)、总Akt(total-Akt,1∶1 000稀释)抗体,均购置于Cell Signaling Technology公司。最后采用ECL方法显色。
1.3 IPI-549抗炎作用的评价
使用LPS诱导RAW264.7构建炎症模型。将对数生长期的RAW246.7 铺于12 孔板,每孔40 万个细胞,贴壁后,提前30 min 加入不同浓度的IPI-549 (0.1、 0.5、 1.0 μmol/L), 后加入LPS 500 μg/L,共同作用24 h。按照TRIzol (购自Thermo Scientific)的官方操作提取RNA,之后按照PrimeScriptTMRT Master Mix(Takara)官方操作得到相应的cDNA,最后加入已合成的目的基因引物(上海生工),使用SYBRTMSelect Master Mix(Thermo Scientific)按照说明书进行PCR定量,引物序列见表S1。GAPDH作为内参,使用2-ΔΔCt法进行相对定量分析。
1.4 PI3Kγ蛋白及小分子数据集准备
小分子结构均来自Drew 课题组的文献报道[24]。IPI-549/PI3Kγ 复合物晶体结构采自RCSB Protein Data Bank 数据库,PDB ID:6XRL[24]。IPI-549的三维结构直接取自6XRL,其余小分子结构使用Discovery studio 3.5 (DS3.5) 软件中Sketching 工具绘制,共含有41 个小分子结构,其活性数据采用文献报道的IC50值(表S2)。所有小分子使用DS3.5 的Minimize Ligands 工具进行结构优化:赋予CHARMm 力场,采用Smart Minimizer算法进行能量优化。优化后的40 个小分子(除去IPI-549)组成抑制剂数据集(Inhibitors dataset),同时根据抑制剂数据集结构,使用DUD-E在线工具(http://dude.docking.org/)生成含有850个小分子的数据库,作为非抑制剂数据集(Decoys dataset)。
1.5 构建基于分子共同特征的药效团模型
采用 DS3.5 软件中的 Common Feature Pharmacophore Generation 模块构建基于分子共同特征的药效团模型(HipHop)。首先,从上述的41个抑制剂集中挑选活性最高的6个小分子来构建模型(表S2中*标识),设置其Principal值为2,意为有活性的参考分子。根据DS3.5默认推荐药效团特征(Features),选定氢键供体(D)、氢键受体(A)、疏水中心(H)、正电离子中心(PI)、芳香环中心(R)。其他参数设置如下:Conformation Generation 设置为Best;MaxOmitFeat 值设置为0,表示构建的药效团模型所有特征元素都要匹配这6个小分子;其余参数设置为默认。
1.6 构建基于受体-配体复合物的药效团模型
使 用 DS3.5 软 件 中 的 Receptor-ligand Pharmacophore Generation 模块基于IPI-549/PI3Kγ复合物晶体结构6XRL 构建受体-配体复合物药效团模型。首先,采用Prepare Protein 工具进行蛋白质优化:去除水分子;添加氢键及缺失的原子;自动质子化;赋予CHARMm立场。随后,采用优化的复合物结构来构建药效团,复合物蛋白质结构作为Input Receptor,复合物配体小分子作为Input Ligand, 其余参数设置如下: Maximum Pharmacophores 为10; Minimum Features 为3;Maximum Features 为6;模型采用GFA(Genetic Function Approximation)算法进行打分[25]。此外,采用已知活性化合物与非活性化合物对产生的药效团模型进行验证:Validation 设置为True,其中抑制剂数据集(Inhibitors dataset) 设置为Active Ligands,非抑制剂数据集(Decoys dataset)设置为Inactive Ligands。模型采用留一法(Leave-oneout)进行验证,并使用以下指标来进行模型评估:包括敏感性(SE)、特异性(SP)、受试者工作特征曲线(receiver operating characteristic curve,ROC)及对应ROC曲线下面积(AUC)值。
其中TP (true positive) 指真阳性,FN (false negative)指假阴性,TN(true negative)指真阴性,FP(false positive)指假阳性。
1.7 分子动力学模拟
采用6XRL为分子动力学初始构象,首先使用Maestro 中Protein Preparation 模块进行蛋白质结构的准备和优化:去除水分子,加入氢原子;使用OPLS-2005力场进行结构优化至最小化均方根偏差(RMSD)达到最大值0.3 Å。随后,使用Desmond软件进行分子动力学模拟[26],首先使用System Builder 工具构建模拟体系:水盒子设置为orthorhombic,每个方向截断值为10 Å;使用TIP3P 水模型;添加Na+中和体系电荷;添加0.15 mol/L 浓度的NaCl 溶液;赋予OPLS-2005 力场[27]。随后,使用Desmond 软件默认的Relax model 方法对体系进行优化。最后,使用Molecular Dynamics 工具运行动力学模拟:模拟时间设置为200 ns;模拟体系设置为NPT,体系温度为300 K,压力为1 bar。分子动力学模拟完成后,使用Simulation interaction diagram 工具进行结果分析。
2 结果与讨论
2.1 IPI-549具有显著的抗炎作用
首先检测 IPI-549 对RAW264.7 细胞活性的影响,从而筛选出活性实验的安全浓度。使用不同浓度的IPI-549处理RAW264.7细胞,24 h后检测细胞活力。图1b显示即使在药物高浓度10 μmol/L作用下,细胞存活率仍达80%以上,表明细胞存活受到较小的影响,而在小于1.25 μmol/L药物作用下,细胞的存活几乎没有影响,表明了IPI-549 较小的细胞毒性作用。使用LPS作用RAW264.7构建炎症细胞模型,图1c 表明,LPS 可以显著提升RAW264.7中PI3K通路中Akt的磷酸化水平,而使用不同浓度IPI-549 处理后,Akt473 的磷酸化水平(p-Akt-S473)受到显著抑制,并呈现剂量依赖关系。对比空白组发现,0.1 μmol/L的IPI-549即可显著抑制Akt473 的磷酸化,说明IPI-549 可以有效地抑制炎症细胞中的PI3K信号通路。
LPS 刺激RAW264.7 细胞为经典的炎症细胞模型,其特征是LPS的诱导会使得细胞大量释放炎症介质,其中TNF-α、IL-1β 和IL-6 较为典型[28-29]。如图1d~f 所示,随着LPS 的诱导刺激,细胞中TNF-α、IL-1β 和IL-6 的转录水平显著升高。使用不同浓度IPI-549(0.1、0.5、1.0 μmol/L)作用细胞,可以看到IPI-549 显著抑制炎症因子的释放,并且这种抑制呈现浓度依赖关系。上述结果表明,IPI-549 可以通过抑制炎症细胞中的PI3K 通路来有效地抑制炎症细胞中炎症因子的释放,初步验证了IPI-549的抗炎作用。
2.2 基于分子共同特征(HipHop)药效团的分析
HipHop 可以提取系列化合物中具有相似活性但结构不同或结构柔性较大分子的共同化学特征,并探索其中的构效关系[30]。由表1 可知,HipHop共生成10 个药效团模型。其中HipHop_01 药效团得分(Rank score)最高,为84.783。“Direct Hit”及“Partial Hit”表示生成的药效特征与训练集分子匹配情况,1 表示完全匹配,0 表示部分匹配。由表1 可知,HipHop_01 的特征与6 个小分子完全匹配。HipHop_01 拥有6 个药效团特征,包括了4个疏水特征(H)和2 个氢键受体特征(A)(图2a)。其中,氨基吡唑嘧啶基团对应的氢键特征尤其关键,其产生的氢键作用保证了抑制剂与PI3Kγ蛋白的紧密结合(图2b)[31]。

Table 1 Results of HipHop pharmacophore models
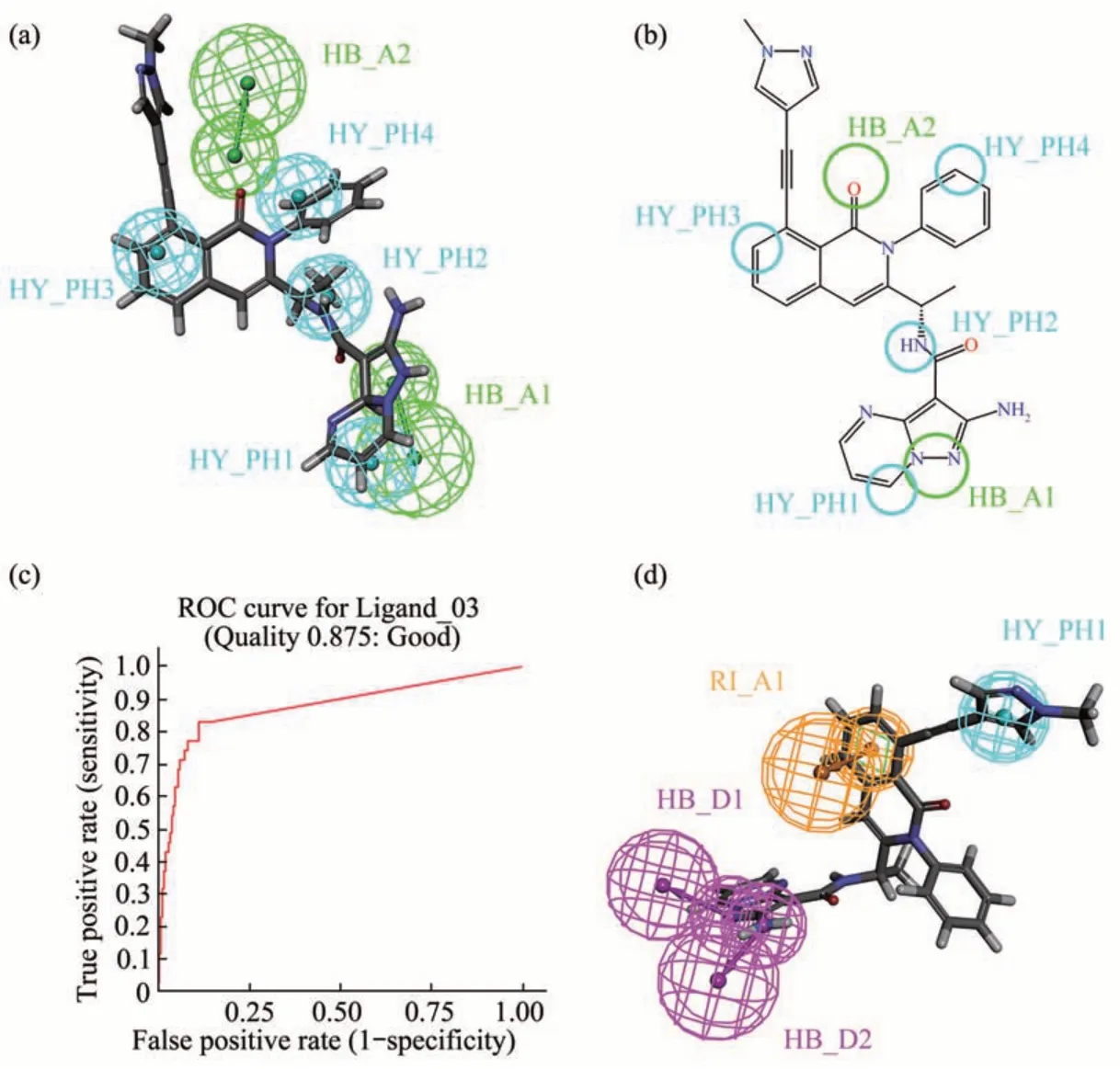
Fig. 2 Assessment of pharmacophore models
2.3 受体-配体复合物药效团模型分析
利用IPI-549/PI3Kγ 复合物晶体结构产生了10个药效团模型,其结果汇总于表2。其中,1号及2号药效团具有较高的选择性分数(selective score),为9.777。两者分别产生了5个药效团特征:1号含有2 个氢键供体特征(D),2 个疏水特征(H)及1 个芳香环中心特征(R);2号含有2 个氢键供体特征(D)及3个疏水特征(H)。其余药效团均含有4 个药效团特征,且基本都包含氢键供体特征(D)及疏水特征(H),表明疏水及氢键为PI3Kγ与小分子结合的重要相互作用。

Table 2 Results of receptor-ligand pharmacophore models
选择性分数通过模型命中DS3.5软件内置化合物库中的drug-like分子数来进行评分,因而无法准确验证药效团模型对PI3Kγ抑制剂的筛选能力。因此,为了进一步考察模型区分抑制剂与非抑制剂的真实能力,使用活性化合物及非活性化合物数据集对模型进行验证(表3)。其中,Sensitivity(SE)代表敏感度,表明模型预测活性化合物的准确性;Specificity(SP)代表特异性,表明模型预测非活性化合物的准确性,两者数值越接近于1表示模型具有较准确的预测能力。从表3可以看出,生成的10 个模型SE和SP值具有显著差距:1号及2号药效团尽管拥有较高的SP值,但是其SE值偏低,原因是这两个模型的TP值较低,表明模型不能有效预测出真实的PI3Kγ活性抑制剂;8~10号药效团均含有较高的SE值,但其SP值较低,原因是其TN值较低,表明这些模型无法区分出非活性化合物;3号及4号药效团具有相对较高的SE及SP值,表明这两个模型可以较为准确的区分PI3Kγ抑制剂及非抑制剂。为了对各模型的区分能力进行全面的评估,计算了各模型的AUC值(表3),一般认为AUC>0.7,代表模型具有较好的预测能力。其中,3号模型的AUC值得分最高,为0.875(图2c),显示较高的预测能力,因此选择3号模型进行进一步分析。根据表2看出该模型共含有4个药效团特征:2 个氢键供体(D),1 个疏水中心(H),1 个芳香环中心(R)。将该模型与IPI-549 结构进行叠合分析(图2d),发现共轭结构连接的碳原子处具有疏水作用(蓝色),表明PI3Kγ 蛋白在此处具有显著的疏水性。IPI-549 的母核喹唑酮结构处对应了芳香环中心特征(黄色),这个母核结构类似于ATP的嘌呤结构,对抑制剂与PI3Kγ的结合发挥重要作用[32]。第三个特征对应于氨基吡唑嘧啶基团,为氢键供体特征(紫色),表明PI3Kγ 在此处易与抑制剂产生氢键相互作用,这个结果与上述HipHop结果吻合。上述结果表明,氢键及疏水是PI3Kγ蛋白与小分子结合的关键药效特征。
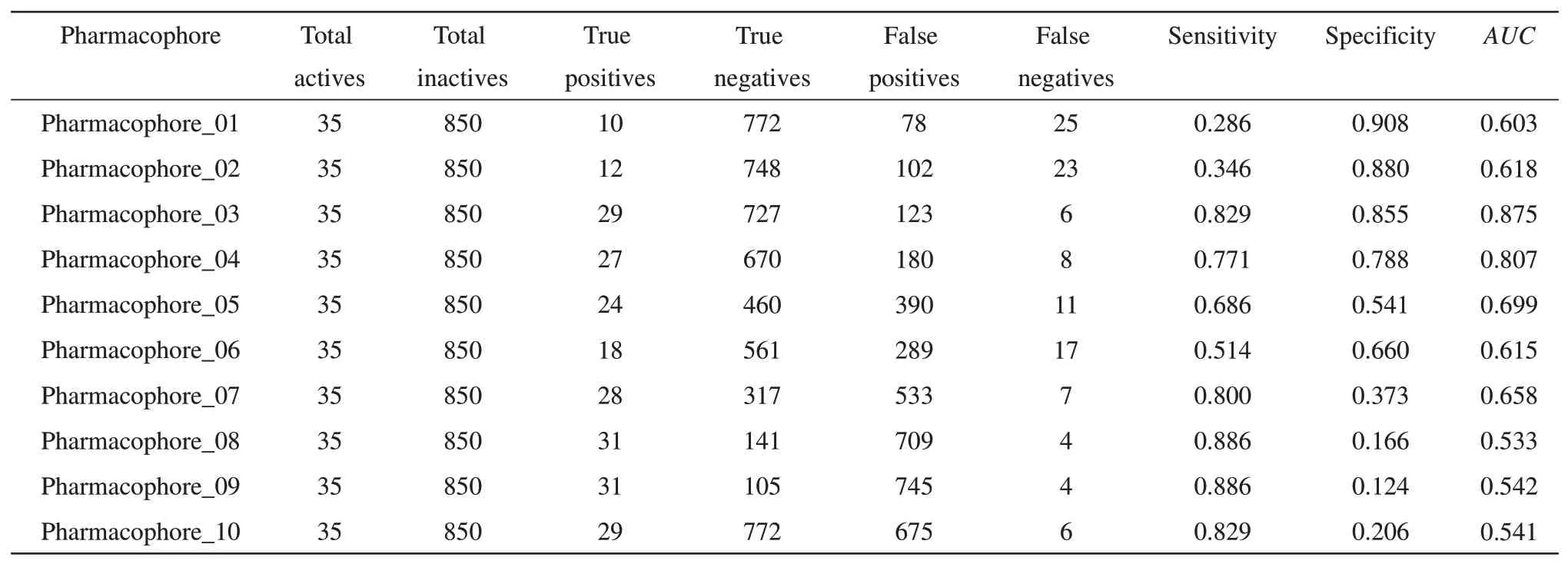
Table 3 Predicted results of receptor-ligand pharmacophore models
2.4 分子动力学模拟结果分析
为了深入分析IPI-549 与PI3Kγ 的动态结合过程并进一步揭示两者的相互作用机制,将IPI-549/PI3Kγ 复合物进行了200 ns 动力学模拟。首先,计算了整个模拟过程中PI3Kγ 蛋白主链C 原子及IPI-549结构的均方根偏差值(RMSD)及主链C原子的均方根涨落(RMSF)。图S1a显示,在体系经过100 ns后,RMSD基本没有显著波动,表明体系经100 ns模拟后已达到平衡。图S1b显示,在ATP结合口袋位置处(氨基酸编号560~720),C原子波动较小,表示IPI-549 与PI3Kγ 蛋白ATP 结合口袋的氨基酸发生紧密的结合。图3a 显示了IPI-549 与PI3Kγ活性口袋结合情况,可以发现IPI-549中吡唑环中的氮原子和氨基上的氮原子与Val882 形成关键的氢键相互作用,这个结果与上述药效团结果对应,说明这个氢键作用在PI3Kγ与抑制剂结合的过程中发挥重要作用。此外,图3b 显示IPI-549 的甲基吡唑基团与母核结构喹唑酮基本呈垂直状态,这个构象进一步稳定了氢键作用。同时甲基吡唑基团由于较长的炔基结构,使其深入PI3Kγ蛋白的“选择性口袋”(图3b),从而进一步增加抑制剂的PI3Kγ选择性。除了这些作用,IPI-549中的两个苯环与TRP812 和THR887 形成显著的π-π 相互作用,进一步增加了抑制剂与蛋白的结合(图3a)。为了进一步定量分析这些相互作用,本文计算了复合物结合过程中重要氨基酸与IPI-549 的结合作用力。如图3c 所示,纵坐标使用“Interaction Fraction”表示,即配体与氨基酸残基非键相互作用力持续时间占总作用时间的比例。若分数大于1,表示配体与该氨基酸残基可能同时具备多个复合作用力。可以看出,Val882 的氢键作用发挥了最大的能量贡献。此外,疏水相互作用也发挥了重要作用,如Met804、Trp812、Ile963等,这个结果与上述药效团结果吻合,也进一步证明了疏水及氢键作用在PI3Kγ选择性结合中发挥了重要作用。
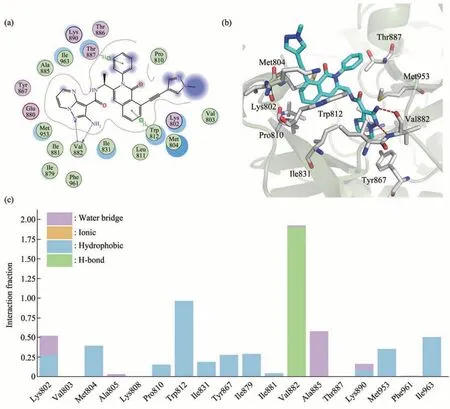
Fig. 3 Molecular dynamics simulation of IPI-549/PI3Kγ complex
3 结论
哮喘、神经退行性疾病、心血管慢性疾病等通常伴随着不同程度的炎症反应,大量研究已经表明PI3K 相关信号通路与免疫细胞的生存和功能实现具有密切关系。随着PI3K 各亚型生物功能研究的深入,发现PI3Kγ在免疫系统中起着重要且独特的作用,从而揭示了PI3Kγ 潜在的炎症治疗成靶性。但是,目前鲜有PI3Kγ 抑制剂用于炎症治疗的研究,从而缺乏PI3Kγ 炎症治疗研究的工具药物。IPI-549是现已进入临床研究的PI3Kγ抑制剂,其具有活性强、选择性高的特点。但是其研究主要集中于肿瘤治疗,目前尚没有抗炎作用的评价。因此,本文采用IPI-549 进行其抗炎作用的初步评价。炎症细胞模型体外实验表明,IPI-549 没有明显的细胞毒性,IPI-549 可以浓度依赖性地抑制炎症细胞中PI3K 信号通路,从而有效地抑制LPS 诱导的巨噬细胞中炎症因子TNF-α、IL-1β、IL-6 的释放。上述实验表明,IPI-549 可以通过抑制炎症细胞中PI3K 信号通路来抑制炎症因子的释放,从而初步验证了PI3Kγ 抑制剂在炎症治疗方面的潜在作用,也证明了IPI-549 可以作为PI3Kγ 抑制剂炎症治疗的有效工具药物。
随后使用计算机模拟技术对IPI-549 的PI3Kγ选择性机制进行进一步研究。通过分别构建基于PI3Kγ小分子抑制剂及PI3Kγ蛋白大分子的药效团,发现疏水及氢键作用在抑制剂与PI3Kγ结合过程中发挥主要作用。动力学模拟的结果进一步验证了药效团特征:Val882产生的氢键作用保证了抑制剂与PI3Kγ 的高效结合;Met804、Trp812、Ile963 等关键氨基酸提供了显著的疏水作用;IPI-549 的甲基吡唑基团可以进一步深入PI3Kγ 的“选择性口袋”位置,从而进一步提高IPI-549 的PI3Kγ 选择性。上述构效关系研究可以为新型PI3Kγ抑制剂的开发提供一定的指导作用。
附件见本文网络版(http://www.pibb.ac.cn或http://www.cnki.net):
PIBB_20220529_ Figure S1.pdf
PIBB_20220529_Table S1.pdf
PIBB_20220529_Table S2.pdf
