光动力联合化疗治疗肺癌致中心气道狭窄的效果*
2023-08-04牛建明赵晨茜张旭宇赵薇张丹李润浦
牛建明, 赵晨茜, 张旭宇, 赵薇, 张丹, 李润浦
保定市第二中心医院呼吸与危重症医学二科(河北保定 072750)
原发性肺癌(简称肺癌)是我国最常见的恶性肿瘤[1]。数据[2]显示,2012—2014年,中国ⅢA~Ⅳ期肺癌的占比为64.6%。晚期肺癌常常累及中心气道,无法手术根治,姑息性治疗是其重要治疗策略[3]。光动力疗法(photodynamic therapy, PDT)属于介入治疗,具有靶向性强、高效低毒、耐受性良好等优势,是治疗肺癌致中心气道狭窄的常用手段[4]。白蛋白结合型紫杉醇是一种新型化疗药物,对肿瘤细胞具有相对靶向杀伤能力,且在用药前无需预处理,是该恶性气道狭窄患者化疗较好的选择[5]。但目前关于两者联合用于治疗该恶性气道狭窄的有效性和安全性方面的文献较少。为此本研究对我院近年来收治的肺癌致中心气道狭窄患者给予白蛋白结合型紫杉醇联合PDT进行治疗。现报告如下。
1 资料与方法
1.1 一般资料 选取2019年1月至2021年1月我院收治的60例肺癌致中心气道狭窄患者,运用随机数字表法将其分成观察组(n=30)和对照组(n=30)。两组基线资料比较差异无统计学意义(P>0.05),具有可比性。见表1。本研究经我院医学伦理委员会批准(批准文号2021042)。
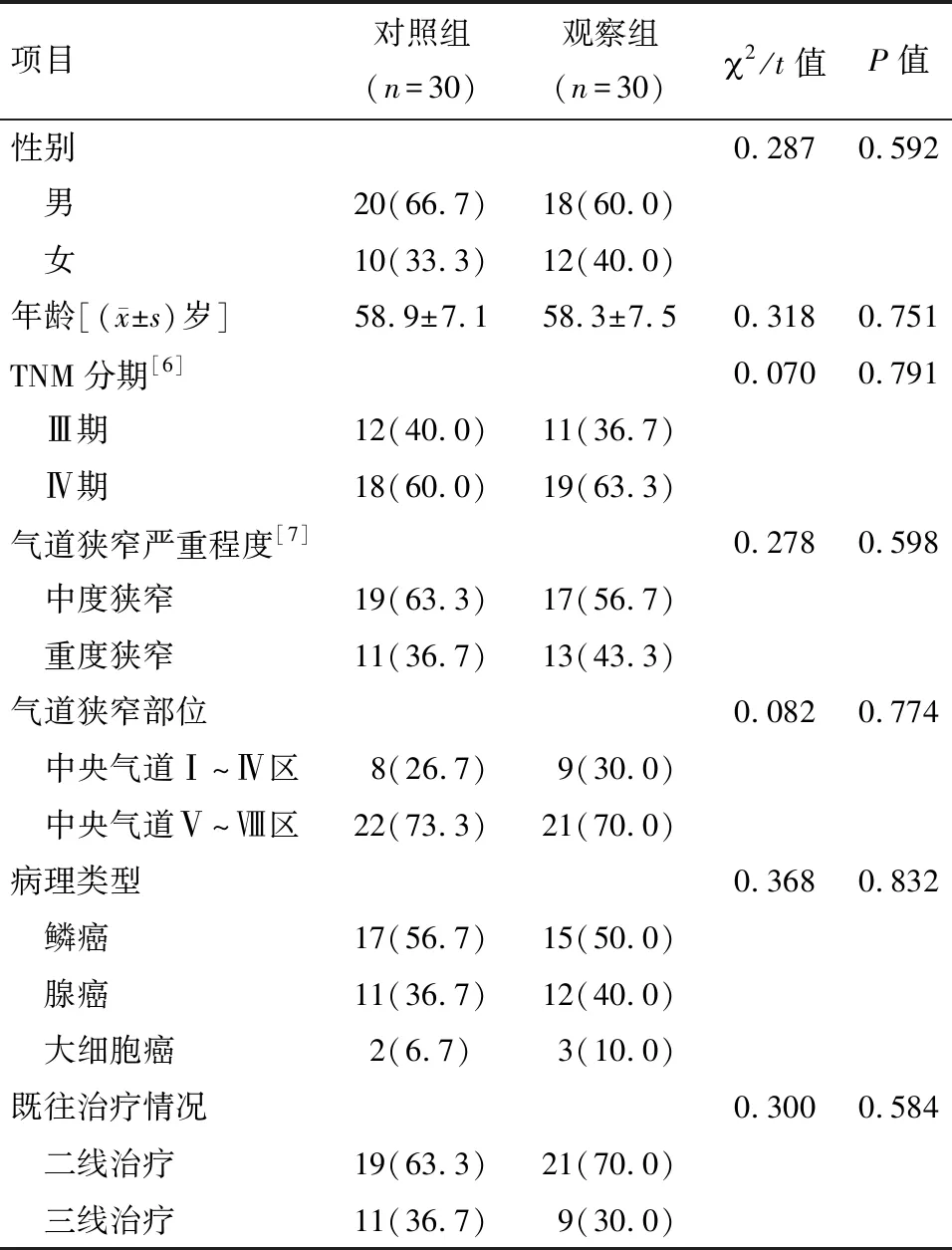
表1 两组一般资料比较 例(%)
1.1.1 西医诊断标准 NSCLC的临床及病理诊断标准均参照《原发性肺癌诊疗规范(2018年版)》制定的标准执行[8]。中心气道狭窄诊断标准参照《恶性中心气道狭窄经支气管镜介入诊疗专家共识》制定的标准执行[7],恶性气道狭窄严重程度的分级通常根据管径的狭窄程度(%)进行分级,而管径的狭窄程度可分为5级,即狭窄程度(%)为≤25、26~50、51~75、76~90、91~100,依次对应1、2、3、4、5级,其中1级为轻度狭窄,2、3级为中度狭窄,4、5级为重度狭窄。
1.1.2 纳入标准 (1)满足NSCLC致中心气道狭窄的诊断标准,均经活检证实,均为腔内型气道狭窄;(2)年龄18~75岁;(3)意识清楚,能自主表达自我感受;(4)患者及家属自愿签订知情同意书;(5)入组前接受过二线或三线治疗,且时间间隔≥3周,并已从此类治疗相关的所有急性毒性反应中恢复;(6)发量正常或由原治疗所致脱发已重新长出;(7)表现出归因于肺癌致中心气道狭窄的咳嗽、咯血、呼吸困难等症状;(8)能耐受支气管镜检查及气道治疗;(9)能耐受全身麻醉;(10)预期生存时间>3个月;(11)无白蛋白紫杉醇过敏史;(12)表皮生长因子受体(EGFR)、间变性淋巴瘤激酶(ALK)无基因突变,程序性死亡分子配体1(PD-L1)表达<1%。
1.1.3 排除标准 (1)因卡氏功能状态量表(KPS)评分<60分或者其他原因不能接受标准化疗或者拒绝接受标准化疗;(2)合并严重疾病,包括严重心脏病、脑血管病、未控制的糖尿病、未控制的高血压等;(3)既往接受过其他光敏剂治疗无效的受试者或入组前6个月内曾接受了光敏剂治疗;(4)合并无法控制的胸腔积液;(5)参加本次试验前1个月内参加任何药物临床试验(作为受试者);(6)患有严重的躯体或精神疾病,可能影响治疗、评估,或对研究方案的依从性差,不愿接受定期随访者;(7)已知对试验药品或相关药品过敏者;(8)入组前4周内使用过其他光敏性药物(如四环素类抗生素、磺胺类、吩噻嗪等);(9)患有损害主干支气管的气管损伤或脊柱病变者;(10)肿瘤累及或侵蚀主要血管者;(11)存在气管食管瘘或气管纵隔瘘者;(12)伴有急性炎症(尤其是腐蚀性炎症)或临床上有明显的活动性感染者;(13)妊娠或哺乳期妇女,以及拒绝在研究期间采取适当避孕措施的育龄受试者(包括男性);(14)处于恶病质状态,或者晚期受试者评估无法耐受光动力治疗;(15)活动性出血或出血体质(凝血机制异常)。
1.2 药物、设备及材料 光敏剂为重庆华鼎现代生物制药产的血卟啉注射液(喜泊分),规格5 mL:25 mg,产品批号20180205、20190103、20200106;石药集团欧意药业产的注射用紫杉醇(白蛋白结合型),规格100 mg/瓶,产品批号B04180304、B04190502、B04200206;深圳雷迈科技公司产的PDT630-A型半导体激光光动力治疗机;日本奥林巴斯内窥镜公司产的1T60型纤维支气管镜(以下简称纤支镜)。
1.3 治疗方法 对照组:采取PDT治疗。具体为:(1)术前准备:先将喜泊分稀释至0.01 mg/mL,0.1 mL皮内注射,做光敏剂皮试;若无红肿硬结,则按2~3 mg/kg剂量抽取喜泊分并充分溶于250 mL生理盐水后避光静脉滴注,给药时间约60 min。(2)激光照射方法:静脉给药后48~72 h,在纤支镜引导下导入柱形激光治疗光纤至病变部位;激光照射参数:治疗激光波长为630 nm,治疗区功率密度、总能量密度分别为100 mV/cm2和150~200 J/cm2,照射时间约为15~20 min;照射时光纤尽量处于腔道正中,使中心照射范围覆盖在肿瘤最狭窄段上下各2 cm内。(3)术后处理:术后72 h内对受试者出现的咳嗽、呼吸困难、低热等不良反应予以对症处理;术后1 d、3 d、5 d于纤支镜下清理治疗部位表面的坏死物,避免管腔堵塞;术后继续避光1个月,若发生光敏反应则给予抗过敏治疗。
观察组:在PDT(方法同对照组)3 d后行注射用紫杉醇(白蛋白结合型)化疗。具体是130 mg/m2静脉滴注,第1、8 d静脉滴注,给药时间>30 min/次,以21 d为1个化疗周期。连续治疗2个周期后对两组近期疗效进行评估。
1.4 观察指标 (1)近期疗效:参照文献[9]拟定以下疗效评定标准。腔内病灶完全清除,功能恢复正常者为“完全有效”;超过50%的狭窄管腔重新开放,功能检查大致正常,主观症状改善者为“部分有效”;狭窄管腔改善不足50%,但经引流,狭窄远端肺部炎症消散者为“轻度有效”;临床无主、客观改善证据者为“无效”。(2)于治疗前和治疗2个周期后采用纤支镜下标尺对所有研究对象气道狭窄段最小直径各测量1次,并计算其气道狭窄程度[即(正常气道管径-气道狭窄段最小直径)/正常气道管径×100%]。(3)气促分级标准:按照美国胸科协会制定的气促分级标准[10]执行,即根据被调查者出现气促的条件不同分为5个等级,即0级(正常)、1级(快步走路时)、2级(平常速度步行时)、3级(平常步速行走时因气促而停止)和4级(轻微活动后);于治疗前和治疗2个周期后对所有患者各评价1次。(4)运用日本CHEST公司产的8900D型肺功能仪于治疗前及治疗2个周期后对所有对象行常规肺功能检查,主要记录肺通气功能指标第1秒用力呼气容积与用力肺活量比值(FEV1/FVC)、呼气峰值流量(PEF)和用力呼出75%肺活量时的瞬间呼气流量(FEF75%)变化。(5)欧洲癌症研究与治疗组织生活质量问卷肺癌特异性模块(EORTC QLQ-LC13)[11]:用于评估患者生活质量状况。该问卷共有13个条目,涵盖10个领域,即气促、咳嗽、咯血、胸痛、脱发、口腔疼痛、吞咽困难、手足刺痛、手或肩部疼痛、其他部位疼痛,将各领域粗分采用线性转换为百分制(0~100分),得分越高则对应的症状越严重,对生活质量的负性影响越大。(6)安全性评价:记录两组PDT相关毒性不良反应(包括光敏反应、咳嗽、呼吸困难、呼吸道黏膜水肿、穿孔等)的发生情况,同时按照美国国立癌症研究所常见不良反应评价标准第4版(NCI-CTCAE 4.0)[12]对观察组2个化疗周期内的毒性不良反应进行评估并记录。(7)远期疗效:自治疗开始后每个月以电话或门诊方式对每位患者进行追踪随访,记录其终点事件,包括无进展生存时间(PFS)和总生存期(OS)。其中PFS为从入组开始到首次PD或任何原因死亡或末次随访时的这段时间。OS为从治疗开始到任何原因死亡或末次随访时的这段时间。
2 结果
2.1 两组近期疗效比较 观察组的近期疗效显著优于对照组(P<0.05)。见表2。
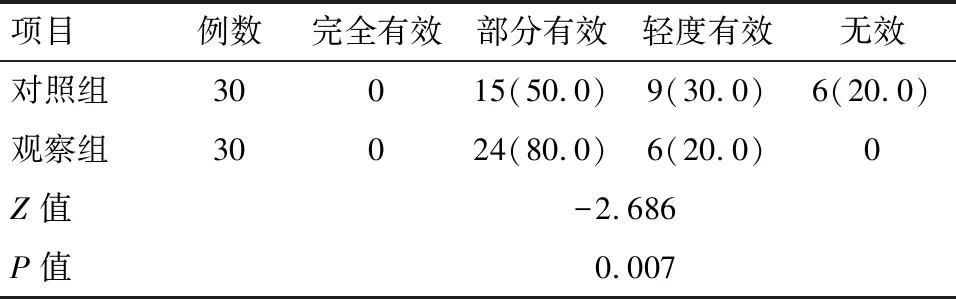
表2 两组近期疗效比较 例(%)
2.2 两组气道狭窄情况比较 与本组治疗前相比,两组治疗后气道狭窄段最小直径均显著扩大(P<0.05),气道狭窄程度均显著缩小(P<0.05);且均以观察组的改善更显著(P<0.05)。观察组治疗前后气道狭窄段最小直径、气道狭窄程度差值均显著大于对照组(P<0.05)。见表3。

表3 两组气道狭窄情况比较
2.3 两组气促分级比较 与本组治疗前对比,两组治疗后气促分级均显著改善(P<0.05);但治疗后,观察组气促分级显著优于同期对照组(P<0.05)。见表4。

表4 两组气促分级比较 例(%)
2.4 两组肺功能指标比较 两组治疗后FEV1/FVC、PEF及FEF75%均显著高于本组治疗前(P<0.05);且治疗后,观察组比对照组FEV1/FVC、PEF及FEF75%的提高更显著(P<0.05)。观察组治疗前后FEV1/FVC、PEF和FEF75%差值均显著大于对照组(P<0.05)。见表5。

表5 两组肺功能指标比较
2.5 两组EORTC QLQ-LC13评分比较 两组治疗后EORTC QLQ-LC13中气促、咳嗽及胸痛评分均显著低于本组治疗前(P<0.05),且均以观察组的下降更显著(P<0.05)。治疗后,观察组脱发评分显著高于本组治疗前及同期对照组(P<0.05);治疗前后脱发评分差值显著大于对照组(P<0.05)。两组其余各领域评分组内治疗前后及组间同期相比,差异均无统计学意义(P>0.05)。观察组治疗前后气促、咳嗽、咯血、胸痛、脱发、吞咽困难及其他部位疼痛评分差值均显著优于对照组(P<0.05)。见表6。
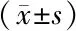
表6 两组EORTC QLQ-LC13评分比较 分
2.6 两组不良反应比较 PDT相关毒性不良反应:全部60例患者治疗后48 h内均有气管和(或)支气管轻度水肿。此外观察组和对照组各30例患者在治疗过程中及治疗后72 h内共分别有2例和3例患者发生咳嗽加剧,3例和4例患者出现轻度呼吸困难;治疗后72 h内,各有2例患者出现低热;治疗后1个月,各有2例患者出现局部皮肤红斑、瘙痒;以上不良反应均相对比较轻微,受试者可耐受,经对症处理后症状均得以控制。所有对象均无呼吸道穿孔、致死性大咯血、光敏剂过敏、瘢痕狭窄、肝肾功损害及治疗相关死亡等严重不良事件发生。
白蛋白结合型紫杉醇化疗相关毒性不良反应:最常见的不良反应(≥20%)为脱发、感觉神经毒性、疲劳/乏力、肌肉痛/关节痛、胃肠道反应、中性粒细胞减少和贫血,所有毒性不良反应均可控制。全部30例患者均无过敏反应、超敏反应及治疗相关死亡发生,整体耐受性良好。见表7。

表7 观察组30例患者化疗相关毒性不良反应发生情况 例(%)
2.7 两组远期疗效比较 末次随访时间为2021年4月31日,全部60例受试者均获得随访,最短3个月,最长20个月,随访率为100%。观察组和对照组的中位PFS(mPFS)分别为5.6个月(95%CI:4.08~7.65)、4.3个月(95%CI:3.63~6.19),组间比较差异有统计学意义(2=4.225,P=0.035)。观察组和对照组的中位OS(mOS)分别为13.1个月(95%CI:10.25~16.21)、10.2个月(95%CI:8.47~13.38),组间比较差异有统计学意义(2=4.128,P=0.042)。
3 讨论
有文献[13]显示,PDT可通过破坏肿瘤组织内的血管(以阻断肿瘤组织血供)、诱导机体产生抗肿瘤免疫效应等途径,来发挥高效、高选择性的抗肿瘤作用。对于晚期肺癌患者,尤其是合并气道狭窄时,PDT能有效减轻肿瘤负荷、重新开放气道、快速缓解症状及大幅提高患者生活质量[14]。本研究PDT是在纤支镜引导下实施的,其优势包括:(1)可在纤支镜直视下对肿瘤细胞进行激光照射;(2)冷光化学反应,不影响外科手术和放化疗等其他手段治疗,并可与其他治疗方法有相辅相成的作用;(3)对肿瘤细胞具有相对选择性和组织特异性;(4)无药物耐受性,毒性低;(5)治疗时间短,起效快。本研究显示对照组患者接受PDT治疗后气道狭窄情况、气促分级及肺通气功能均显著改善,EORTC QLQ-LC13中气促、咳嗽及胸痛评分均显著低于本组治疗前;此外PDT相关毒性不良反应均相对比较轻微,受试者可耐受,经对症处理后症状均可控,未见治疗相关死亡等严重不良事件发生。提示采取PDT治疗肺癌致中心气道狭窄是安全有效的。
白蛋白结合型紫杉醇属于新型紫杉醇制剂,是应用纳米技术将人血清白蛋白载体与疏水性紫杉醇相结合,较溶剂型紫杉醇(即传统的紫杉醇制剂)相比,其在体内更易分解,再借助白蛋白纳米粒的胞吞作用,可使大量紫杉醇有效转运至肿瘤组织,具有相对靶向性,增强了紫杉醇对肿瘤细胞的杀伤能力[15]。此外本品还具有输注时间短(仅需30 min)、临床用药方便(给药前无需给予患者抗过敏药预处理)等优势。一项单臂Ⅱ期临床试验[16]报道了对22例完成二线及三线标准化疗后的晚期NSCLC患者采用白蛋白结合型紫杉醇单药治疗,结果显示ORR和DCR分别为22.7%、81.8%,mPFS和mOS分别为3.4个月(95%CI=2.3~4.1)、7.4个月(95%CI=4.2~10.7),主要的3级以上血液学毒性不良反应为中性粒细胞减少(32%)和贫血(18%),最常见的非血液学毒性不良反应为感觉神经毒性(36.4%)和疲劳/乏力(50%),总体毒性不良反应可耐受。另一项多中心研究[17]白蛋白结合型紫杉醇单药治疗35例接受过一线或二线化疗失败的晚期NSCLC患者的疗效和安全性发现,ORR、DCR分别达31.4%和74.3%,mPFS、mOS分别为3.6个月与11.4个月,主要的3级以上毒性反应为中性粒细胞减少(54.3%)、贫血(11.4%),整体耐受性好。总之,白蛋白结合型紫杉醇是治疗肺癌等实体瘤的低毒高效的化疗药物。
既往研究[18]表明晚期NSCLC合并气道狭窄患者采取PDT+化疗(包括卡铂+替吉奥胶囊、奈达铂+多西紫杉醇、顺铂+多西紫杉醇等标准化疗方案)的联合方案进行姑息性治疗,患者气道阻塞症状和狭窄情况、肺通气功能及生活质量均得到了显著改善,中位生存时间为5.9个月,1年总生存率为30%,化疗毒性不良反应以1~3级为主,两者联用未发现额外的毒性,未发生治疗相关死亡。说明PDT联合化疗治疗晚期NSCLC合并气道狭窄具备较好的近、远期疗效及安全性。但目前尚无评估白蛋白结合型紫杉醇单药化疗联合PDT治疗肺癌致中心气道狭窄的有效性与安全性的相关报道。为此本研究观察组将PDT联合白蛋白结合型紫杉醇用于肺癌致中心气道狭窄的临床治疗中,结果发现,治疗后,观察组近期疗效、气促分级均显著优于对照组;治疗前后气道狭窄段最小直径、气道狭窄程度、肺通气功能指标及EORTC QLQ-LC13中气促、咳嗽、咯血、胸痛、吞咽困难、其他部位疼痛评分差值亦均显著优于对照组;远期生存分析显示,观察组mPFS、mOS分别为5.6个月和13.1个月,较对照组(4.3个月、10.2个月)均显著延长。说明与单用PDT相比,肺癌致中心气道狭窄患者采取白蛋白结合型紫杉醇化疗联合PDT治疗能取得更佳的近期疗效、生活质量等,并可使患者在远期生存方面获益。同时也提示,白蛋白结合型紫杉醇化疗与PDT二者在肺癌致中心气道狭窄治疗中有协同效应,但两者如何起到协同效应及杀伤机制,尚有待进一步深入研究。从安全性方面来看,观察组PDT相关毒性不良反应与对照组基本一致,均表现为不良反应比较轻微且可控,体现了PDT低毒性的优势;化疗相关毒不良反应以脱发、感觉神经毒性、疲劳/乏力、肌肉痛/关节痛、胃肠道反应、中性粒细胞减少和贫血为主;其中脱发1~2级发生率达40.0%,这可能是导致治疗后观察组EORTC QLQ-LC13中脱发(化疗相关症状)评分显著升高的原因;但观察组患者整体耐受良好,无4级不良反应及治疗相关死亡发生。提示白蛋白结合型紫杉醇化疗+PDT可能是治疗肺癌致中心气道狭窄的一种安全有效的方案。
本研究也存在一定的局限性,比如:(1)样本量相对有限,因此在临床工作过程中仍需不断收集、总结及分析临床数据,为求进一步验证本研究结果;(2)后续治疗可能对患者OS有一定影响,后期将进行相关队列研究进一步验证。
综上所述,PDT联合应用白蛋白结合型紫杉醇化疗治疗肺癌致中心气道狭窄的近期疗效确切,可提高患者生活质量,并能给患者带来远期生存获益,且毒不良反应小,耐受性好,为肺癌致中心气道狭窄的治疗提供了新的思路。但本研究结论期待大样本、多中心的前瞻性随机对照研究进一步证实。
利益相关声明:本研究所有作者声明无利益冲突。
作者贡献说明:牛建明:撰写论文、实验设计;赵晨茜、张旭宇:统计学分析、数据研究;赵薇、张丹:搜集数据、文献支持;李润浦:质量控制、资金支持。
