LINC00626通过JAK1/STAT3信号通路对肺鳞状细胞癌增殖、侵袭和转移的影响*
2023-08-04蔡慧芳范林林宋慧琴李丽韦海涛
蔡慧芳, 范林林, 宋慧琴, 李丽△, 韦海涛
河南大学淮河医院 1心血管科, 4胸外科(河南开封 475001); 2河南大学护理与健康学院(河南开封 475004); 3河南大学第一附属医院病理科(河南开封 475001)
非小细胞肺癌(NSCLC)约占全部肺癌病例的85%[1],其中肺鳞癌是NSCLC中最常见的组织类型之一,约占40%[2],肺鳞癌早期就开始侵袭和转移[3],且5年生存率低于30%[4-5]。到目前为止,肺鳞癌癌变的潜在分子机制尚未完全了解,因此,寻找新的分子靶点对肺鳞癌的治疗至关重要。 长链非编码RNA(lnc RNA)是一组长度超过200个核苷酸的异质转录物,已成为人类癌症中的关键调节因子[6-7]。越来越多的研究表明,lncRNA在细胞增殖、凋亡、周期、迁移和侵袭等过程中起着至关重要的作用[8-9]。因此,lncRNA不仅是癌症诊断和预测的生物标志物,也是潜在的治疗靶点[10-11]。研究发现,LINC00626在多种恶性肿瘤中起着至关重要的作用。杨梅等[12]通过qRT-PCR检测老年直肠癌患者血清中的 LINC00626 水平,并分为 LINC00626 高表达组与 LINC00626低表达组,结果LINC00626高表达组患者的3年总生存率为72.2%,明显高于LINC00626低表达组,差异有统计学意义(P<0.01)。Wu等[13]发现LINC00626在胃癌组织中高度上调,功能实验表明,onclncRNA626可以促进胃癌细胞在体外和体内的增殖和转移。Lian等[14]发现LINC00626在膀胱癌组织中高度上调,敲低的LINC00626显著抑制细胞的侵袭能力。但是有关LINC00626在肺鳞癌中的细胞功能和分子机制尚不清楚。因此,2021年1月至2022年6月,本研究对LINC00626进行了深入的实验研究,希望能为肺鳞癌的临床治疗靶点的选择和个体化治疗方案提供新的理论依据。
1 材料与方法
1.1 实验细胞与动物 人正常肺上皮细胞株16HBE和人肺癌细胞株A549、H1975、H1299、H1437购自中国科学院细胞库。雄性 BALB/c 裸鼠购自北京维通利华实验动物技术有限公司。本研究经我校伦理委员会审核通过(河南大学[2020]HUSOM2020-250)。
1.2 实验试剂 TRIzol试剂购自中国赛默飞公司。通用型逆转录酶试剂盒 HiScript Ⅱ 1st Strand cDNA Synthesis Kit购自南京诺唯赞公司。SYBR Green PCR试剂盒、TB Green Premix Ex Taq Ⅱ购自日本Takara公司。1640培养基、DMEM培养基、胎牛血清、青霉素和链霉素购自美国Gibco公司。慢病毒LINC00626和阴性对照购自中国上海Gene Pharma公司。10%甲醛购自中国重庆川东化学工业公司。0.1%结晶紫、RIPA裂解液购自Beyotime Biotechnology有限公司。基质胶购自BD Biosciences公司。PierceTMBCA 蛋白质测定试剂盒购自Thermo Scientific公司。GAPDH抗体、JAK1抗体、STAT3抗体、P-JAK1、二抗购自北京义翘公司。聚偏二氟乙烯膜购自Millipore公司。
1.3 方法
1.3.1 组织收集 收集2021年1—12月在河南大学淮河医院接受微创腔镜手术治疗的144例肺鳞癌患者癌组织和144例癌旁组织(>5 cm)。所有组织样本收集后,立即保存在液氮中。所有患者在手术前未接受任何治疗,且自愿签署知情同意书。
1.3.2 RNA提取、反转录和qPCR 使用TRIzol试剂提取肺鳞癌组织样品和细胞系中的RNA,Nanodrop 2000分光光度计检测RNA的浓度和纯度。根据说明书,使用通用型逆转录酶试剂盒 (HiScript Ⅱ 1st Strand cDNA Synthesis Kit)合成互补DNA (cDNA)。使用SYBR Green PCR试剂盒和TB Green Premix Ex Taq Ⅱ进行PCR和RT-qPCR。使用2-ΔΔCT定量法分析相对表达,GAPDH用作内参基因,引物序列见表1。

表1 RT-qPCR 引物序列
1.3.3 细胞转染及实验分组 A549和H1299细胞培养于含10%胎牛血清和1%青霉素-链霉素的RPMI-1640培养基中。H1975和H1437培养于含10%胎牛血清和1%青霉素-链霉素的DMEM高糖培养基中,放置于37℃含有5%CO2的细胞培养箱中培养。在载体LV3上构建LV3-NC 和LV3(H1/GFP&Puro)-LINC00626-homo-994敲降慢病毒,同时在克隆载体LV6上构建LV6-NC和LV6-LINC00626-homo过表达慢病毒。在六孔板中接种1×105/mL的对数生长期并且生长状态良好的肺癌细胞株H1437和A549,分别加入无双抗的完全培养基DMEM和RPMI-1640至2 mL,放入温度为 37℃,5%CO2的湿润无菌恒温细胞培养箱中进行培养,当细胞生长至70%~80% 以上的密度时,将敲降的LINC00626及敲降对照LV3-NC慢病毒转入H1437细胞中,命名为sh-NC组和sh-LINC00626组。将过表达LINC00626慢病毒以及过表达对照LV6-NC慢病毒转入A549细胞中,命名为Vetor组和LINC00626组。孵育48~72 h后,提取总RNA,通过RT-qPCR评估转染效率。
1.3.4 CCK-8实验 收集细胞并接种到96孔板中(1 000个细胞/孔),将PBS添加到测试样品周围的其他孔中。在0、24、48、72 h,将10 μL CCK-8溶液加入每个孔中,2 h后测量450 nm处的吸光度。
1.3.5 菌落形成实验 转染48 h后,将细胞接种到6孔板中(1 000个细胞/孔),在完全培养基中培养2~3周,直到观察到明显的菌落。随后,用10%甲醛固定30 min,在室温下用0.1%结晶紫染色过夜,并用无菌水仔细洗涤。用ImageJ软件(https://imagej.net/)计数可见菌落数。
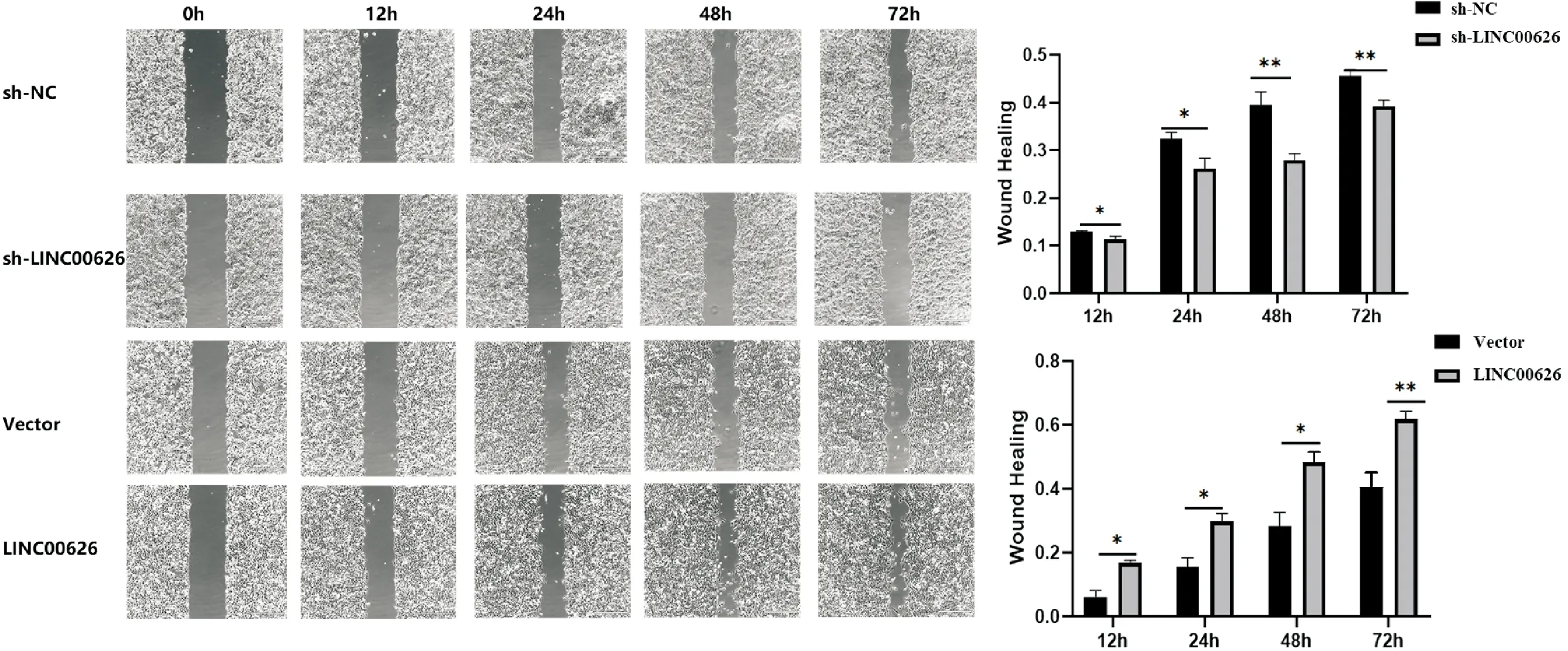
1.3.6 细胞划痕实验 将细胞接种于六孔板中(6×105个/孔),培养24 h或48 h后,用PBS洗涤细胞两次。用200 μL枪头进行划痕,然后置于37℃、5% CO2培养箱中培养。在0 h、12 h、24 h、48 h、72 h通过显微镜拍摄图像。使用Image J软件进行分析。
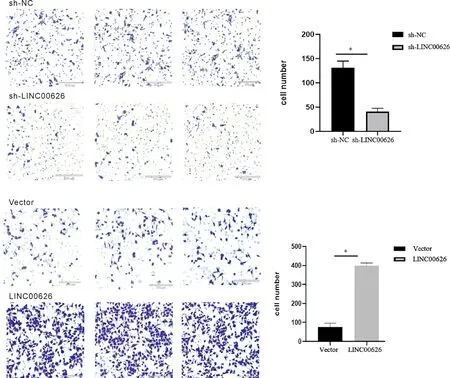
1.3.7 Transwell小室迁移、侵袭实验 取对数生长期的细胞接种于六孔板中(1×106个/孔),培养24 h或48 h后,胰蛋白酶消化收集细胞。使用无血清RPMI-1640培养基和DMEM培养基重悬细胞。侵袭实验,将 100 μL 基质胶置于 Transwell上室中心底部,在 37℃、5% CO2培养箱中培养2 h,然后将上层液体培养基丢弃。上室加入200 μL无血清培养基,下室加入700 μL完全培养基,在37℃,5% CO2培养箱培养24 h或48 h。取出小室,细胞用甲醇固定后结晶紫染色4~6 h。观察细胞并拍照。迁移实验步骤与入侵试验相同,不需要基质胶。
1.3.8 BALB/C裸鼠动物实验 将裸鼠随机分为3组,对照组、LINC00626 敲低组、LINC00626过表达组(n=8或n=10)。将已转染的A549、H1437细胞皮下植入裸鼠体内。每只小鼠每侧皮下注射剂量为5×106/200 μL。每2 d计算肿瘤体积,公式如下:长(L)×宽(W)2/2。 20~30 d后处死裸鼠,取出肿瘤并称重。对于体内肿瘤侵袭试验,将敲低和过表达的细胞(1×106/mL)注射到裸鼠尾静脉中。每3 d称1次体重,到49~63 d处死裸鼠。所有动物研究程序均经河南大学医学院动物实验伦理委员会批准。
1.3.9 Western blot实验 使用 RIPA 裂解液提取总蛋白,BCA进行蛋白定量。将蛋白质在8%凝胶上进行电泳并转移到聚偏二氟乙烯 (PVDF) 膜上。室温封闭1 h,用 TBST 洗涤。然后,将膜与GAPDH、JAK1、STAT3、P-JAK1一抗于 4℃ 下孵育过夜。随后,将与辣根过氧化物酶偶联的相应二抗(1∶1 000)在室温下孵育2 h。最后使用发光液显影。

2 结果
2.1 LINC00626在肺鳞癌组织中表达显著上调并与患者TNM分期和淋巴结转移密切相关 在NCBI数据库中,长链非编码RNA00626的基因ID:ENSG00000225826,属于基因间的非编码RNA,位于q24.2位点,起始区域168786941,终止区域168792888,转录本长度为5 947 bp,具有2个转录本序列,ID记录信息分别为ENST000004420691和NR_024160,和3个外显子。在lnCAR数据库中,发现LINC00626的2个转录本的二级结构。通过144对临床样本分析LINC00626在肺鳞癌组织中的表达。见图1。与癌旁组织相比,LINC00626在肺鳞癌组织中高表达(P<0.001)。见图2。根据LINC00626在144例肺鳞癌组织中的表达量2-ΔΔCt表达值进行分组,数值>中位数值1.222 725视为显著表达上调组(n=72),数值<中位数值1.222 725视为显著表达下调组(n=72),绘制ROC曲线。结果表明LINC00626高表达与肺鳞癌患者淋巴转移和TNM分期呈正相关(P<0.05)。LINC00626的ROC曲线下面积(AUC)=0.712 8(95%CI:0.6541~0.771 6,P<0.000 1)。提示LINC00626在肺鳞癌临床诊断中的诊断价值较好,有望成为一个新的肺鳞癌临床诊断标志物。见图3和表2。

注: A~E:LINC00626 位于q24.2(chr1: 168786941-168792888),有3个外显子

注:*P<0.001

图3 ROC曲线检测LINC00626在肺鳞癌中的诊断价值

表2 LUSC患者LINC00626表达与临床病理特征的相关性 例
2.2 LINC00626促进体外肺鳞癌细胞的增殖、迁移和侵袭 与16HBE细胞相比,LINC00626在H1437和H1975中相对表达较高(P<0.01),在A549和H1299中相对表达较低(P<0.001),选择 H1437和A549细胞系进行后续细胞功能测试。将sh-LINC00626或LINC00626稳定转染到H1437或A549中(表3、图4)。CCK-8实验显示在培养72h后,敲低LINC00626抑制H1437的细胞增殖,过表达LINC00626促进A549的细胞增殖(P<0.001)。菌落形成实验显示,敲低LINC00626抑制H1437细胞菌落形成能力,过表达LINC00626促进A549细胞的菌落形成能力(P<0.05,P<0.01)。见图5。划痕实验显示,与对照组相比,LINC00626 敲低抑制了 H1437 迁移能力,LINC00626 过表达促进了 A549 迁移能力(P<0.01)。见图6。同时,Transwell小室检测结果显示,与对照组相比,LINC00626敲低抑制了H1437细胞的侵袭和迁移,LINC00626过表达促进了A549细胞的增殖、侵袭和转移(P<0.001)。见图7、8,表3~4。
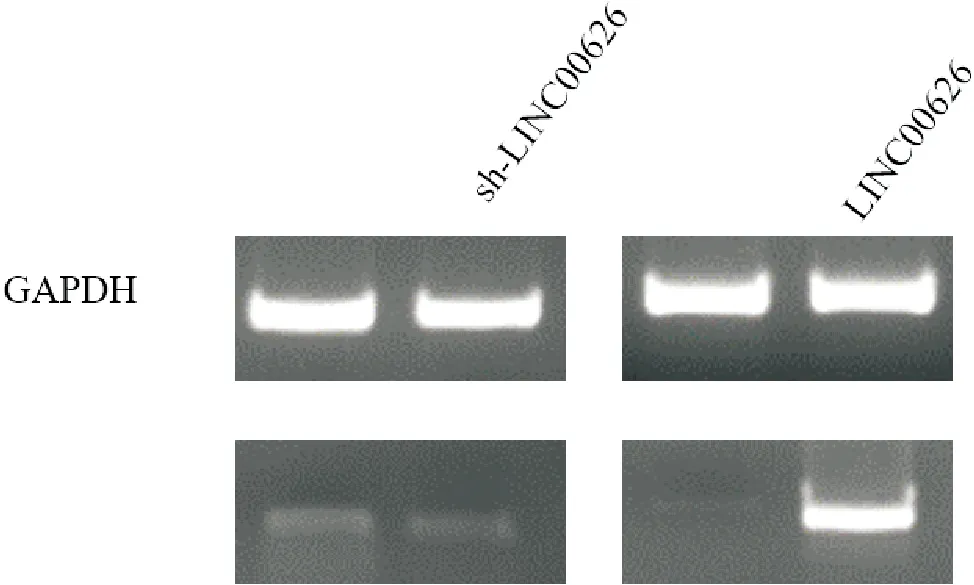
图4 慢病毒转染效率

图5 敲低或过表达LINC00626组对细胞菌落形成能力的影响
注:*P<0.05,**P<0.01
注:*P<0.001

注:*P<0.01, **P<0.001

表3 肺癌细胞 LINC00626 mRNA表达水平比较

表4 敲低或过表达LINC00626对细胞增殖能力比较
2.3 LINC00626在活体动物体内促进肺鳞癌的细胞增殖、侵袭和转移 构建裸鼠皮下荷瘤和肺转移模型。每只裸鼠皮下注射5×106/200 μL细胞。每2~3 d观察1次,第20~30天处死,见图9-A、B。

注:A:LINC00626敲低组;B:LINC00626过表达组
与对照组相比,LINC00626 敲低组和LINC00626过表达组中肿瘤体积的生长速率和肿瘤重量差异有统计学意义(P<0.05),见图10、11。每只裸鼠尾静脉注射1×106/200 μL细胞,每2 d观察1次,第49~63天处死小鼠。与对照组相比,LINC00626敲低组和LINC00626过表达组的肺转移结节差异有统计学意义(P<0.05),见图12、13。
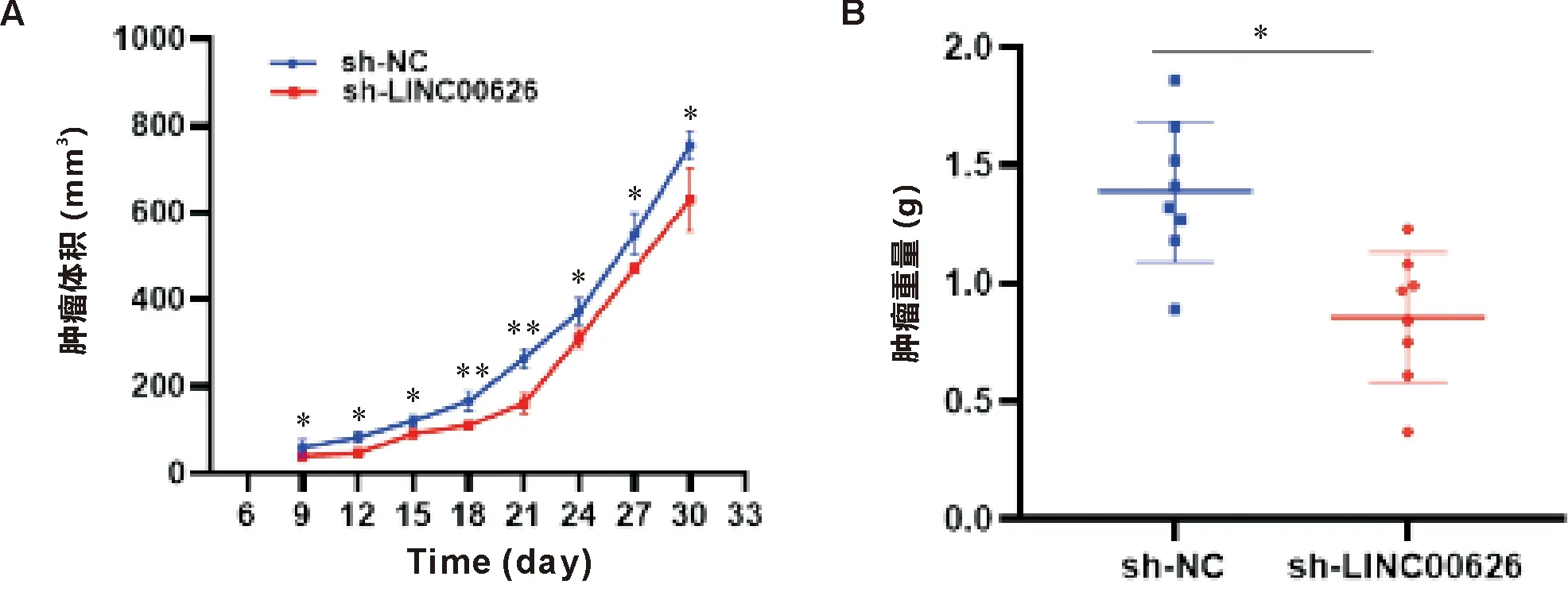
注:A:肿瘤体积;B:肿瘤重量

注:A:肿瘤体积;B:肿瘤重量;*P<0.01, **P<0.001

注:A:sh-NC组及sh-LINC00626组;B:Vector组及LINC00626组
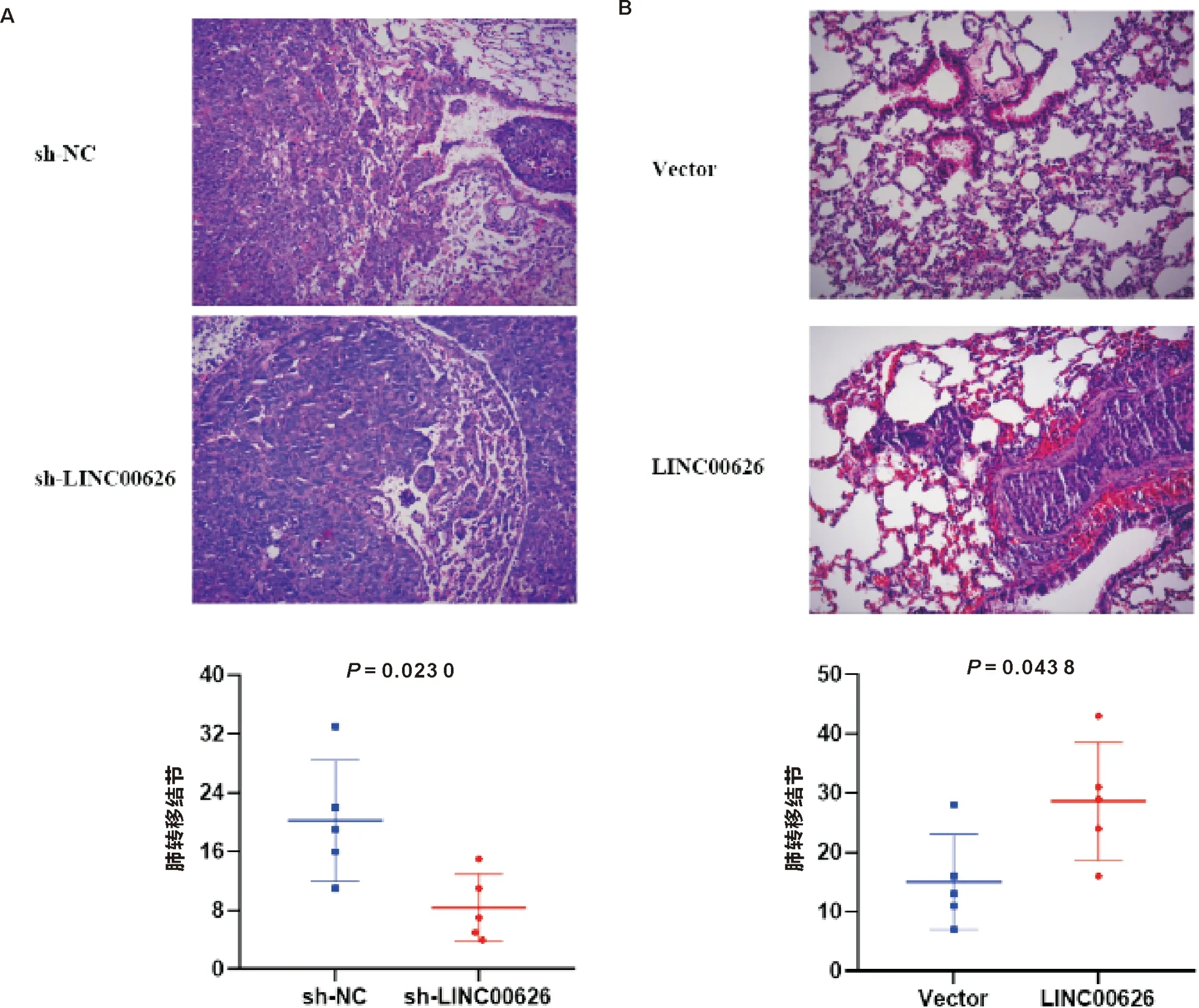
注:A:sh-NC组及sh-LINC00626组;B:Vector组及LINC00626组
2.4 LINC00626对 JAK/STAT信号通路mRNA水平的影响 JAK/STAT信号通路是非小细胞肺癌的一个关键中介。STAT家族种包括STAT1、STAT2、STAT3、STAT4、STAT5A、STAT5B及STAT6等7个成员。通过前期大量验证,最终选择STAT1、STAT3、STAT5进行后续实验。与sh-NC组相比,sh-LINC00626组中JAK2、STAT1、STAT5的mRNA表达未见明显改变,p-JAK1/JAK1、STAT3的mRNA水平显著下降;与Vector组相比,LINC00626组中JAK2、STAT1、STAT5的mRNA表达未见明显改变,p-JAK1/JAK1、STAT3的mRNA水平显著增加(P<0.01,P<0.05),见表5。
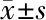
表5 敲低或过表达LINC00626对 JAK/STAT信号通路 mRNA水平的影响
2.5 LINC00626对 JAK/STAT信号通路蛋白水平的影响 与sh-NC组相比,sh-LINC00626组中JAK2、STAT1、STAT5的蛋白表达未见明显改变,p-JAK1/JAK1、STAT3的蛋白表达显著下降;与Vector组相比,LINC00626组中JAK2、STAT1、STAT5的蛋白水平未见明显改变,p-JAK1/JAK1、STAT3的蛋白水平显著增加(P<0.001)。见图14、15。
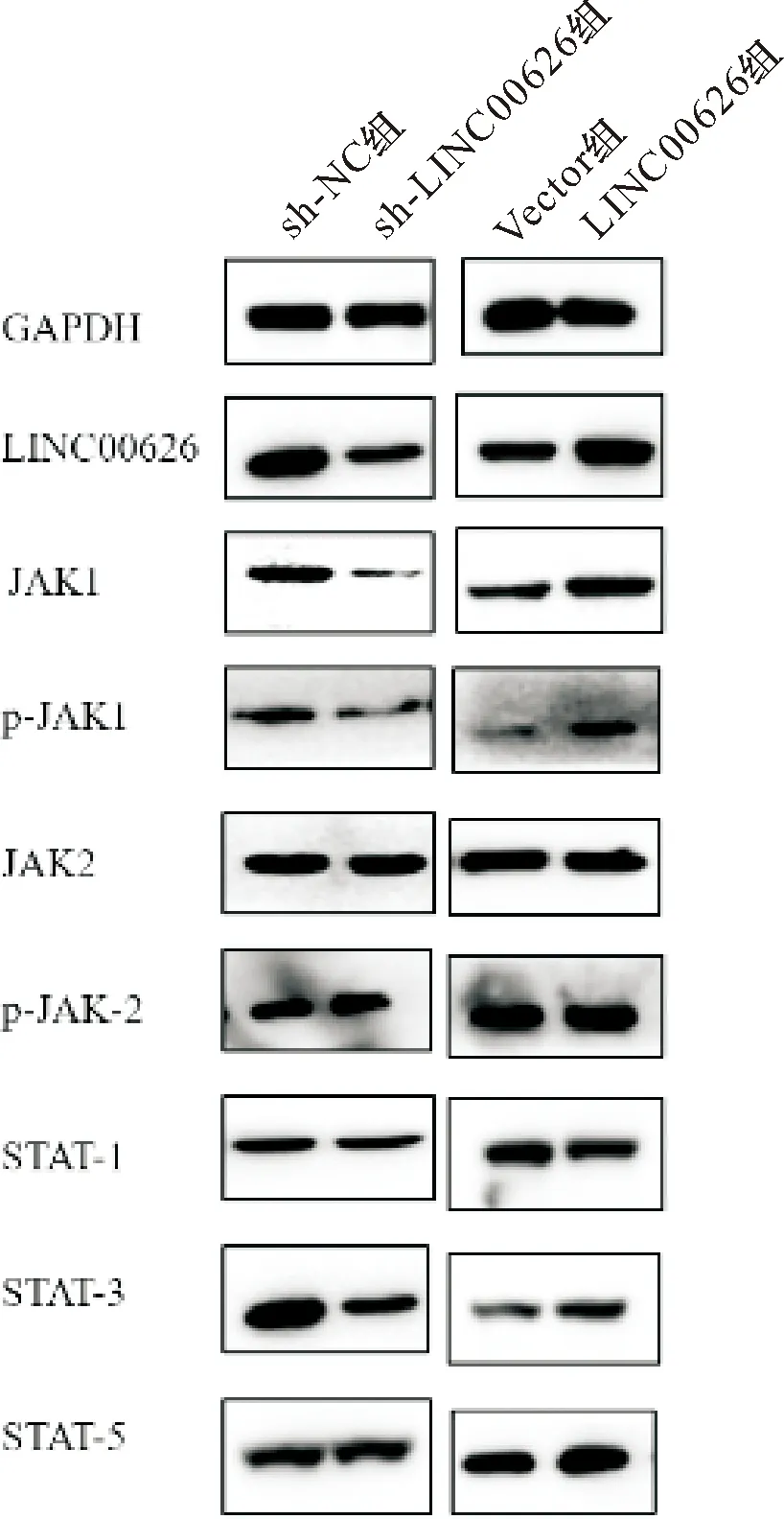
图14 JAK/STAT在各组的蛋白表达

*P<0.01, **P<0.001
3 讨论
肺鳞癌的典型特征是5年生存率低,因此研究肺鳞癌进展中的新诊断生物标志物势在必行[15]。越来越多的 lncRNA 已被证实在肺鳞癌细胞增殖、凋亡、细胞周期、迁移和侵袭中发挥关键作用[16]。本研究结果表明,与邻近的癌旁组织相比,肺鳞癌组织中 LINC00626 的表达显著增加。我们还观察到LINC00626的上调与晚期TNM分期、肺鳞癌患者的淋巴转移密切相关,这表明LINC00626可能是肺鳞癌的潜在诊断标志物。体外细胞功能实验表明,敲低LINC00626抑制了肺鳞癌的增殖、侵袭和迁移。而过表达呈现相反的效果。裸鼠实验结果显示在体内敲低或过表达LINC00626也显著影响肺鳞癌的增殖、侵袭和迁移。
Janus激酶/信号转导与转录激活子(JAK/STAT)信号通路是众多细胞因子信号转导的共同途径作用[17-18],广泛参与细胞增殖、分化、凋亡以及炎症等过程[19-20],可以通过负调节因子与其他信号通路相互作用、STATS共价修饰等多种途径进行调节。JAK/STAT通路的激活促进各种疾病的发生、发展,包括各种炎症性疾病、淋巴瘤、白血病以及实体肿瘤等疾病,针对JAK/STAT信号通路的靶向治疗是近年的研究热点。JAK/STAT通路相关受体的共同特点是受体本身不具有激酶活性,而是通过胞内结构域与酪氨酸激酶JAK结合。通过JAK的活化来磷酸化各种靶蛋白的酪氨酸残基以实现信号从胞外到胞内的转递。这与受体酪氨酸激酶的信号传导方式非常不同。JAK/STAT通路将细胞外信号迅速转导入细胞核,对肿瘤细胞恶性进程发挥重要调控作用。目前有多种lncRNA通过JAK/STAT信号通路调控非小细胞肺癌的恶性进展[21-24]。He等[25]提示LncRNA BRCAT54 通过与RPS9结合转录调控JAK/STAT 和钙离子通路基因,抑制NSCLC的发生。Ou等[26]发现LINC00152通过 YAP1/FSCN1信号轴阻止结直肠癌的发生、发展。Zhang等[27]提示LncRNA PSMB8-AS1 通过 miR-382-3p/STAT1/PD-L1轴,参与调控胰腺癌的恶性进展。Zhu等[28]提示Long noncoding RNA PART1通过激活JAK/STAT 信号通路促进NSCLC细胞恶性进程。Ding等[29]发现Long non-coding RNA MAFG-AS1 敲除可通过MAFG-AS1/miR-3196/TFAP2A轴灭活JAK2/STAT3 信号通路。Wang等[30]提示SNHG1 通过隔离IFNGR1上调 miR-320b激活JAK/STAT signaling。Jiang等[31]提示Long non-coding RNA RP11-468E2.5通过靶向STAT5 和STAT6的 JAK/STAT信号通路抑制结直肠癌的细胞增殖刺激凋亡。
JAK/STAT信号通路已被确定参与癌症进展和转移过程。JAK/STAT信号通路是人们了解的细胞因子受体信号转导的必要通路,在正常和恶性细胞中都发挥重要调控作用[17-18]。本实验证实 LINC00626 可能参与调节 肺鳞癌 中的JAK1/STAT3信号通路。 LINC00626可以通过JAK1/STAT3信号通路介导肺鳞癌的侵袭和转移,提示它可能作为一种诊断肺鳞癌的新分子标志物。阐明肺鳞癌的分子机制也为研究LINC00626在其他癌症中的作用提供了有价值的参考。
遗憾的是,我们对LINC00626的验证仅停留在体外细胞功能水平和体内裸鼠水平。后续我们将针对JAK/STAT信号通路结合目的基因LINC00626进一步筛选小分子靶向药物,并验证LINC00626/JAK1/STAT3轴在不同层次上的上下游调控机制,为肺鳞癌临床个体化治疗的选择提供新思路。
综上所述,LINC00626 是肺鳞癌中的肿瘤促进剂,LINC00626与肺鳞癌患者TNM分期、淋巴结转移密切相关(均P<0.05)。 LINC00626 可以通过JAK1/STAT3信号通路促进肺鳞癌的恶性进展,LINC00626 可能是 肺鳞癌 的新型潜在诊断标志物。我们将在未来进一步增加组织样本量,以再次证明 LINC00626 在肺鳞癌组织中确实上调。
利益相关声明:所有作者均声明不存在任何利益冲突。
作者贡献说明:蔡慧芳负责实验设计、论文撰写,范林林负责实验;宋慧琴负责数据分析;李丽,韦海涛负责项目构思、指导、论文修改、经费支持。全体作者都阅读并同意最终的文本。
