小儿肝移植术后急性肺损伤与血管内皮糖萼的关系*
2023-08-04秦鋆建梁胜凤朱馥如陶春辉周斌先蓝雨雁
秦鋆建, 梁胜凤, 朱馥如, 陶春辉, 周斌先, 蓝雨雁△
1广西医科大学第一附属医院麻醉科(广西南宁 530021); 2广西壮族自治区人民医院麻醉科(广西南宁 530021)
急性肺损伤是肝移植术后的一种严重的早期并发症,发病率4.1%~40%[1-3],由于设计方法、研究人群的差异,不同研究之间差异较大。不可否认的是我国每年有1 000余肝病患儿接受肝移植手术[4],术后急性肺损伤是值得认真对待的问题。肺损伤的诊断标准:在已知的临床损害1周内出现的低氧血症,氧合指数≤300 mmHg,肺动脉楔压≤18 mmHg,胸片提示双肺致密影,不能完全由胸腔积液和肺叶、肺萎陷或结节解释,也不能完全由心力衰竭或体液超负荷解释[3,5]。糖萼位于血管内皮细胞的表面,与内皮细胞一起构成血管壁的选择性通透屏障,高血容量症、缺血-再灌注和其他促炎刺激等都可能破坏糖萼的完整性,导致血管通透性增加[6]。多配体蛋白聚糖-1(syndecan-1,sdc-1)可作为糖萼脱落的标志物[7]。并且sdc-1是一种敏感的标志物,有动物试验表明温暖状态下离体的豚鼠心脏20 min无血流,再灌注后sdc-1明显升高,内皮糖萼大量降解[8]。目前对肝移植前的因素(高肝病模型评分、高胆红素、肾功能不全)[2]和术中因素(大量输血、大剂量血管活性药)[1,3]用于预测移植后的急性肺损伤的研究较多,内皮糖萼作为血管内皮的选择性通透屏障,与急性肺损伤之间的联系还没有被研究,本研究旨在探讨小儿肝移植术中血管内皮糖萼脱落标志物sdc-1与术后急性肺损伤的相关性。
1 资料与方法
1.1 一般资料 本研究经过医院医学伦理委员会批准[NO.2022-KY-E-(229)],选择2019年9月至2021年10月行肝移植手术的患儿51例。病例纳入标准:(1)年龄<15岁;(2)首次肝移植;(3)ASA分级Ⅲ或Ⅳ级;(4)心功能分级Ⅱ或Ⅲ级;(5)肝功能 Child-Pugh分级B或C级。病例排除标准:(1)术前氧合指数≤300 mmHg;(2)二次肝移植;(3)患儿家属拒绝;(4)研究资料不完整等。
1.2 麻醉方法 术前禁食8 h、禁饮4 h。入室前静脉注射咪达唑仑0.15 mg/kg,入室后监测心电图(ECG)、血压(BP)、血氧饱和度(SpO2)等。麻醉诱导:静脉注射丙泊酚3.0 mg/kg、芬太尼2 μg/kg、顺式阿曲库铵0.2 mg/kg。予机械通气,呼吸机模式设定为容量控制通气模式,VT6~8 mL/kg,PEEP 5 cmH2O,根据术中血气分析及气道压等调整麻醉机参数,维持PETCO235~45 mmHg。麻醉维持:持续吸入1%~2%七氟醚,持续静脉泵注瑞芬太尼0.1~0.2 μg/(kg·min)、丙泊酚3~8 mg/(kg·h)、顺式阿曲库铵1~3 μg/(kg·min)。采用目标导向液体治疗,使用PICCO连续监测心排量,控制每搏量变异(stroke volume variation,SVV)<15%,用钠钾镁钙葡萄糖注射液维持输液,选择性输注白蛋白、红细胞、血浆,维持血红蛋白(Hb)70~90 g/L,必要时输注血小板、冷沉淀。若术中血压下降幅度超过术前20%,予多巴胺1~5 μg/(kg·min)或去甲肾上腺素0.03~0.1 μg/(kg·min)持续输注维持血流动力学稳定。术毕带气管导管送患儿至ICU继续治疗。
1.3 观察指标 使用ELISA法检测切皮前(T0)、门静脉阻断前10 min(T1)、无肝期30 min(T2)、新肝期30 min(T3)、新肝期2 h(T4)、手术结束(T5)的sdc-1的浓度。记录术中无肝期时间、冷缺血时间、总输液量、输血量、失血量、尿量、手术时间、麻醉时间。检测并记录术后3 d的肝功能和血气分析结果、ICU治疗时间及气管导管拔管时间以及肺部感染情况。根据术后是否发生急性肺损伤分为两组:术后发生急性肺损伤为肺损伤组(S组,n=15)和术后未发生急性肺损伤为对照组(D组,n=36)。
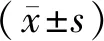
2 结果
2.1 两组一般情况及术中情况比较 本研究初始纳入患儿53例,因术后二次开腹剔除2例,最终纳入51例,其中S组15例,D组36例。两组患儿的性别、年龄、身高、体重、ASA分级差异无统计学意义(P>0.05)。见表1。与D组比较,S组术中冷缺血时间明显延长(P<0.05),出血量、尿量、红细胞输注量明显增多(P<0.05)。见表2。
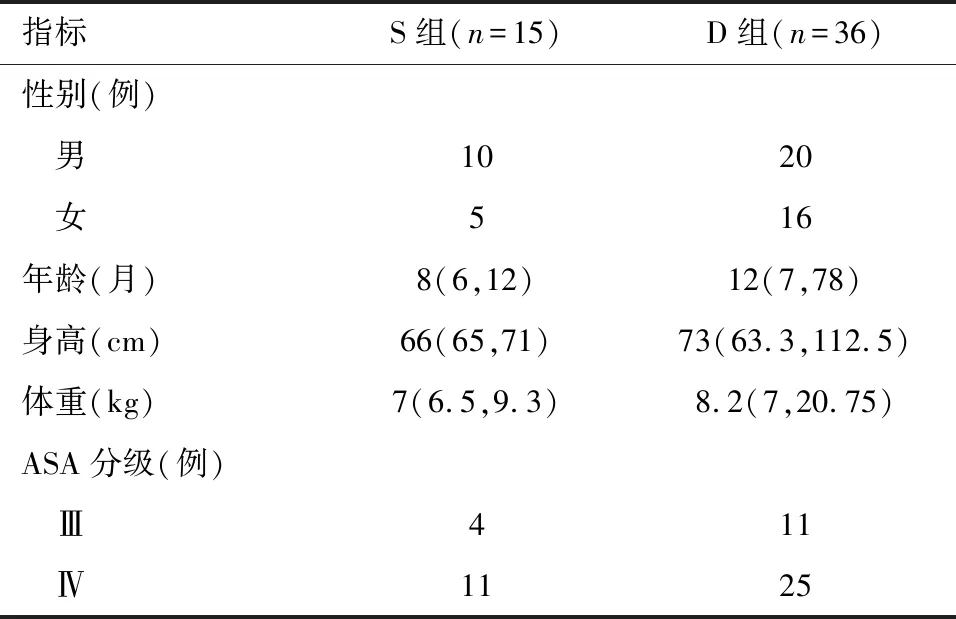
表1 两组患儿一般情况的比较 M(P25,P75)

表2 两组患儿术中情况的比较 M(P25,P75)
与D组比较,T3~T5时S组sdc-1浓度明显升高(P<0.05)。S组sdc-1在T2~T5时高于T0,在T3、T4时高于T1,T5时低于T3;D组sdc-1在T3~T5高于T0,在T3、T4时高于T1、T5(P<0.05),见表3。

表3 两组患儿不同时点sdc-1浓度比较
2.2 肝移植患儿术后急性肺损伤的危险因素分析 将术中变量因素全部单独进行二元单因素logistic回归,分析结果显示冷缺血时间、出血量、尿量、sdc-1差异有统计学意义(P<0.1),见表4。将上述4项差异有统计学意义的变量纳入二元多因素logistic回归,分析结果显示冷缺血时间、尿量、sdc-1是小儿肝移植术后急性肺损伤的独立危险因素(P<0.05),见表5。
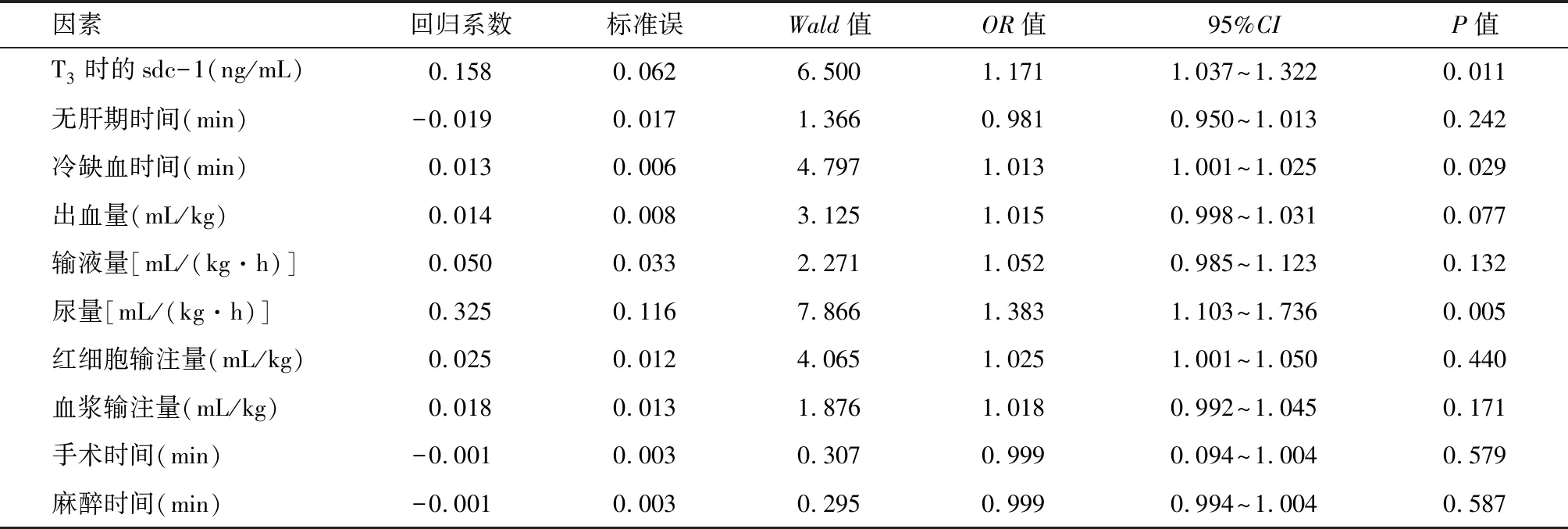
表4 肝移植患儿术后急性肺损伤危险因素的二元单因素logistic回归分析
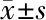
表5 肝移植患儿术后急性肺损伤危险因素的二元多因素logistic回归分析
2.3 sdc-1对术后急性肺损伤的预测效能 ROC曲线分析显示,T3时sdc-1对术后急性肺损伤的预测能力较高(AUC=0.772)(图1)。计算得出sdc-1截断值为38.32 ng/mL。根据术中sdc-1浓度最大值(T3时)与截断值比较,将患儿重新分为两组比较术后情况:术中sdc-1最大值高于38.32 ng/mL为高sdc-1组(H组,n=32),低于38.32 ng/mL为低sdc-1组(L组,n=19)。
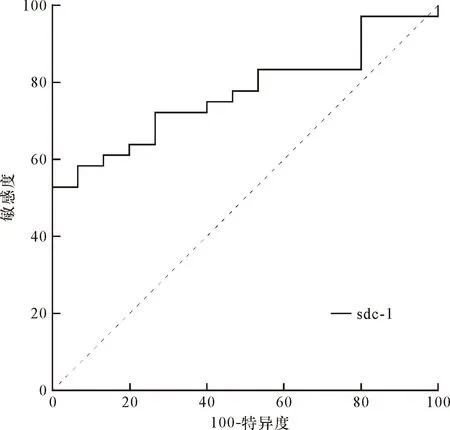
图1 sdc-1对术后急性肺损伤患儿预测能力的ROC曲线
2.4 H组和L组术后血气分析、气管导管拔管时间、肝功能等比较 术后1 d,H组氧合指数低于L组(P<0.05),见表6。与L组比较,H组术后气管导管拔管时间延长以及肺部感染、急性肺损伤发生率增加(P<0.05),见表7。术后1、3和6个月两组的AST、ALT、Tbil和ALB差异无统计学意义(P>0.05),见表8。
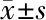
表6 两组患儿术后血气分析的比较
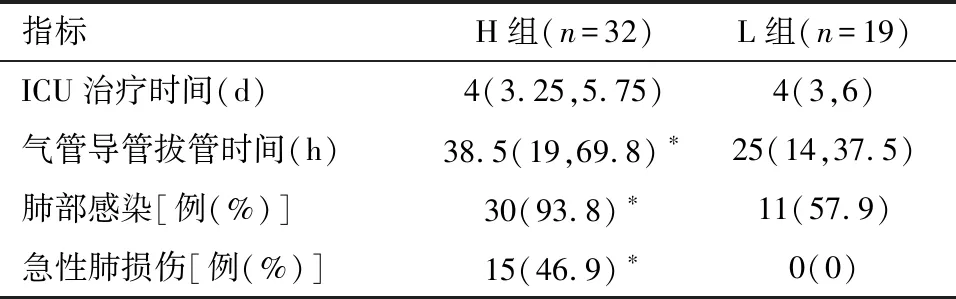
表7 术后气管导管拔管时间和ICU治疗时间以及术后并发症的比较 M(P25,P75)
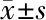
表8 两组患儿术后肝功能的比较
3 讨论
小儿肝移植是终末期肝病的最佳治疗手段。资料表明成人肝移植术后肺部并发症如肺部感染、肺不张、胸腔积液等发生率高于80%[9]。与成人相比,婴幼儿的生理特点更容易出现呼吸系统问题,年龄越小其风险越高。加强术中管理,减少小儿肝移植术后肺部并发症的发生,可改善患儿远期预后。本研究显示sdc-1升高是小儿肝移植术后急性肺损伤的独立危险因素,并对术后急性肺损伤的预测能力较高。
缺血再灌注损伤、氧化应激、血容量过多和全身炎症反应等是围手术期内皮糖萼降解的主要原因[6,10]。肝移植术中冷缺血-再灌注后可能通过快速活化肺内核因子-κB(nuclear factor-κB,NF-κB),并激活单核巨噬细胞,释放肿瘤坏死因子(tumor necrosis factor,TNF)、白细胞介素(IL)-1、IL-6和IL-8等以及血小板活化因子等[11],促进中性粒细胞(polymorphonuclear leukocyte, PMNs)趋化因子释放,导致PMNs聚集并释放多种炎症介质、氧自由基、促凝血因子等加重内皮细胞损伤[12],进一步增加肺泡-毛细血管的通透性[13]。Chappell等[8]研究表明,对豚鼠心脏离体处理,并维持37℃,20 min后再灌注会导致心脏的内皮糖萼大量降解,与PMNs聚集以及炎症因子大量释放导致内皮糖萼受损脱落有关。我们认为本研究中的患儿由于手术刺激引发炎症因子释放,术中大量失血、输血、缺血再灌注以及供肝冷缺血时间过长导致肺血管内皮糖萼屏障被破坏,使肺毛细血管和肺泡上皮细胞受损,肺泡毛细血管通透性增加,允许蛋白质以及PMNs渗出血管外到肺间质中并进入肺泡[14],导致严重的组织缺氧、水肿,增加肺泡-毛细血管膜的厚度,造成氧气弥散功能障碍,进而发生急性肺损伤[15]。本研究也发现患儿新肝期的sdc-1浓度明显高于无肝前期,表明缺血-再灌注导致血管内皮糖萼损伤,且同期急性肺损伤组患儿的升高程度更高于对照组患儿;肺损伤组患儿的供肝冷缺血时间长于对照组患儿,与蔡俊刚等[3]研究结果一致,表明供肝冷缺血时间过长是肝移植术后急性肺损伤的危险因素。
终末期肝病患儿术前常合并低蛋白血症,营养情况差,血浆胶体渗透压降低易导致部分液体扩散到组织间隙,引起组织水肿。资料表明术中大量输血、术后补液量过多是肝移植术后肺部并发症的独立危险因素[16]。因为容量超负荷导致心房钠尿肽释放增加,可诱导基质金属蛋白酶对内皮细胞糖萼降解[17-18]。破坏内皮细胞屏障,使肺毛细血管通透性增加,液体及大分子物质聚集在肺泡及肺间质内,引起肺水肿[19]。本研究结果显示,急性肺损伤组患儿术中的红细胞输注量、出血量、尿量明显高于对照组患儿,且尿量与发生急性肺损伤具有明显相关性,与张四梅等[16]研究相符。
本研究中高sdc-1组患儿术后1 d的氧合指数明显低于低sdc-1组的患儿,且高sdc-1组患儿的气管导管拔管时间延长,术后肺部感染和急性肺损伤发生率增加,表明内皮糖萼受损明显影响肺部氧合功能,使得肺部损伤加重。
本研究存在一定局限性。首先,本研究主要对小儿肝移植术后急性肺损伤与内皮细胞糖萼相关性进行分析,但样本量偏少,可能存在混杂偏倚和选择偏倚,期待有更多的大样本,多中心的实验验证;其次本研究通过PICCO监测心排量,设计目标为SVV<15%的导向液体治疗,未分组设计控制容量的目标,不能直接表明容量负荷对术后急性肺损伤的影响,如何设定目标进行液体导向治疗降低急性肺损伤发生有待于后续研究。
综上所述,在术后急性肺损伤的患儿中,术中血管内皮糖萼损伤程度比未发生急性肺损伤的患儿高。内皮糖萼受损可导致术后拔气管导管时间延长以及肺部感染、急性肺损伤发生率增加,且sdc-1升高对术后急性肺损伤有一定的预测价值。
利益相关声明:所有作者均不存在利益冲突。
作者贡献说明:秦鋆建参与论文选题、设计实验、实施研究过程、论文写作;梁胜凤和朱馥如参与研究过程、收集数据、分析数据;陶春辉和周斌先参与收集数据、统计分析;蓝雨雁指导研究、论文总体修改。
