KIF4A在肺腺癌中的预后意义及与免疫浸润的关系*
2023-08-04杨文静刘岩朱萌萌李灿阿迪拉艾沙张园
杨文静, 刘岩, 朱萌萌, 李灿, 阿迪拉·艾沙, 张园
1新疆医科大学第三临床医学院(新疆乌鲁木齐830011); 2新疆医科大学第三临床医学院(附属肿瘤医院) 医学检验中心(新疆乌鲁木齐 830011)
肺癌(lung cancer)是最常见的恶性肿瘤之一,已成为全球范围内恶性肿瘤致死的首要原因[1-2]。非小细胞肺癌癌(non-small-cell lung carcinoma,NSCLC) 约占所有肺癌病例的 85%,其中肺腺癌占NSCLC中的70%左右[3]。超过一半的肺腺癌患者在最初诊断时即显示出局部或远处转移,其中位生存期仅为10个月[4-6]。尽管手术、化疗、放疗、靶向治疗、免疫治疗等多种治疗方法不断发展,肺腺癌患者的总体5年生存率仍低至 25%[7],伴有远处器官转移仅接受化疗的患者总体5年生存率为 6%[8]。因此,筛选出具有高度组织特异度和敏感度的肺腺癌肿瘤标记物,对肺腺癌的早期诊断、预后判断和精确治疗有着重要的意义。驱动蛋白家族4A(kinesin family member 4A,KIF4A)是驱动蛋白超家族(KIFs)的成员之一,发挥着重要的生物学功能,在细胞有丝分裂过程中调控染色体的凝聚及分离[9]。已有研究报道,KIF4A 的异常表达会导致纺锤体异常分离,并和非整倍体子的形成有密切联系[10]。既往研究表明,KIF4A在不同肿瘤中发挥不同的作用,在多种肿瘤中KIF4A表达异常升高,发挥原癌基因的作用,如胶质母细胞瘤、卵巢癌、乳腺癌等,在部分肿瘤中发挥抑癌基因的作用,如胃癌[11-12]。在肺腺癌中,KIF4A显著升高,沉默KIF4A的表达可抑制肺腺癌细胞系的增殖、迁移和促进凋亡[13]。然而,KIF4A的异常表达是否与肺腺癌危险因素、肿瘤免疫细胞浸润、患者疾病特异性生存相关尚不完全清楚。因此,在2022年1月至2022年5月我们利用生物信息学方法结合免疫组织化学染色法分析KIF4A在肺腺癌中的表达差异性,研究KIF4A表达水平与肺腺癌患者临床病理特征的关系,探讨KIF4A表达与免疫浸润的关系。
1 资料与方法
1.1 材料 兔多抗KIF4A,山羊抗兔IgG H&L, abcam,美国。
1.2 临床组织样本 收集肺腺癌组织标本73例,取手术切除或穿刺的肺腺癌组织及远端正常组织标本,全部病例均通过临床、影像学、病理诊断,术前未进行辅助治疗,临床随访资料齐全。获取标本前告知患者并签署知情同意书。本研究己获得新疆医科大学附属肿瘤医院伦理委员会审查批准(K-2021021)。
1.3 数据获取及方法 从TCGA数据库的Pan-Cancer Project中下载RNA序列数据(Level 3 HTseq-FPKM)。另外,从TCGA数据库中下载肺腺癌RNA序列数据,对配对(57对)和非配对(535个肺腺癌组织和59个相邻正常肺组织)进行KIF4A差异分析。
1.4 免疫组织化学染色 切片常规脱蜡水化,加3%H2O2室温处理10 min,在枸橼酸盐缓冲液(pH=6.0)中微波加热10 min(92~98 ℃)进行抗原修复,冷却后5%小牛血清室温处理10 min,分别滴加1∶100稀释的KIF4A一抗抗体,4 ℃孵育过夜,再分别滴加1∶200稀释的二抗,室温处理30 min,再加SP(1∶100)工作液室温处理30 min,DAB显色,苏木素复染,脱水,透明,封片后光镜下观察并摄片。
1.5 预后分析 从TCGA数据库中提取临床资料。FIGO分期、年龄、性别、残余肿瘤为临床特征;生存数据包括总生存期(OS)、疾病特异性生存期(DSS)和无进展时间间隔(PFI)。我们测定了肺腺癌患者中KIF4A的中位表达,并利用该值创建了“高KIF4A”和“低KIF4A”组。Kaplan-Meier生存分析及log-rank检验提示两组生存结局(OS、DSS、PFI)存在差异。此外,使用单因素和多因素Cox回归分析来确定独立预后变量。利用R软件包“RNA”生成nomogram KIF4A预后价值可视化图。采用ROC曲线和校正曲线来检验两者的区别和校正。
1.6 免疫细胞浸润分析 使用R包gsa(3.6版)和肿瘤免疫评估资源(TIMER)数据库(http://timer.cistrome.org/)中的单样本GSEA (ssGSEA)方法全面研究宫颈癌中肿瘤免疫相互作用的分子特征。在文献中,我们利用基因表达谱数据研究了KIF4A表达对免疫细胞浸润的影响。为探讨KIF4A表达与肿瘤浸润免疫细胞丰度的相关性,采用Wilcoxon秩和Spearman秩相关检验计算P值。
1.7 统计学方法 分别用Wilcoxon秩和检验和Spearman秩和检验两组表达差异和相关性。采用Log-rank检验,Kaplan-Meier生存曲线分析生存结局。采用Cox比例风险回归模型计算风险比(HR)。采用GraphPad Prism8和R version 3.6.3软件进行统计分析。P<0.05为差异有统计学意义。
2 结果
2.1 KIF4A在泛癌和肺腺癌组织中的表达 首先,我们确定了KIF4A在各类肿瘤中的mRNA表达情况,并着重研究了肺腺癌。研究结果表明KIF4A在泛癌患者中的表达存在显著差异(31/33,P<0.05,图1-A)。此外,通过结合TCGA数据库中的正常组织样本和肺腺癌组织对KIF4A的表达进行研究,发现KIF4A在肺腺癌组织中表达升高(P<0.001)(图1-B)。同时,在配对样本中也观察到KIF4A在肺腺癌组织中显著上调(图1-C)。进一步收集临床标本,对KIF4A进行蛋白免疫组化染色,结果显示肺腺癌组织中KIF4A的蛋白表达水平较高(图2-A),正常样本中KIF4A蛋白表达较低(图2-B)。这些数据表明KIF4A基因表达在肺腺癌中异常高表达。
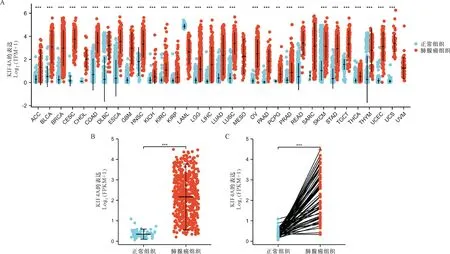
注:A:KIF4A在泛癌组织中的表达;B:TCGA数据库KIF4A非配对样本的差异表达;C:TCGA数据库KIF4A配对样本的差异表达。*与正常组织比较P<0.001
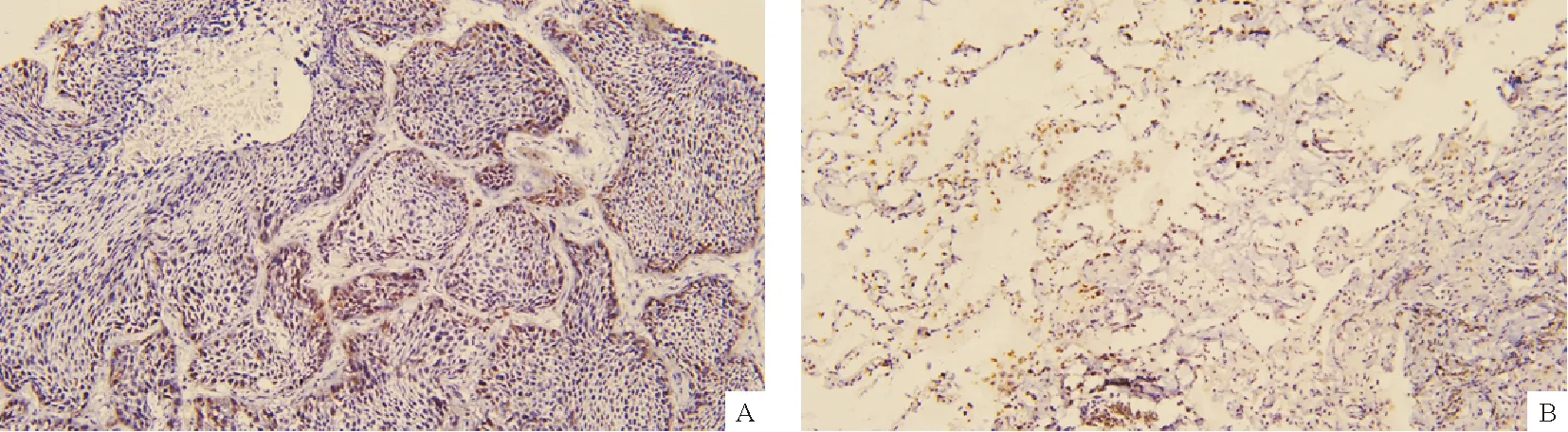
注:A:肺腺癌组织;B:正常组织
2.2 KIF4A表达与临床特征相关性的鉴定 将KIF4A表达与相应临床特征进行相关性分析。结果表明,KIF4A与 TNM分期(图3-A~C)、年龄(图3-D)、病理分期(图3-E)、性别(图3-F)、烟龄(图3-G)、残余肿瘤(图3-H)显著相关(P<0.05)。同时,以KIF4A表达中位数为因变量,logistic回归分析显示,高表达的KIF4A与T分期(晚期分期与早期,P<0.05)、N分期(N0vs. N1~3,P<0.05)、年龄(>65岁和≤65岁,P<0.05)、病理分期(Ⅰ期和Ⅱ~Ⅳ期,P<0.05)、性别(男与女,P<0.05)、烟龄(≥40年和<40年,P<0.05)相关。见表1。
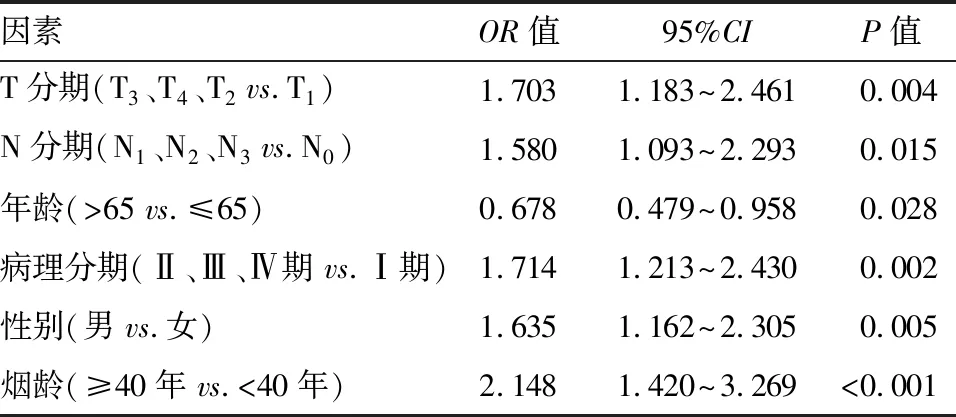
表1 KIF4A表达与临床特征的logistic回归分析

注:A:T分期;B:N分期;C:M分期;D:年龄;E:病理分期;F:性别;G:烟龄;H:残余肿瘤。*P<0.05,**P<0.01,***P<0.001,ns P>0.05
2.3 KIF4A对肺腺癌患者的生存预后价值 对肺腺癌患者的总生存期(OS)进行单因素和多因素Cox分析。单因素Cox分析结果显示,T分期(P=0.002)、N期(P<0.001)、病理分期(P<0.001)、KIF4A表达(P=0.007)与肺腺癌患者的OS相关。在多变量Cox模型中,我们发现病理分期(P<0.05)和KIF4A表达(P=0.044)仍与预后差有关(表2)。并通过结合显著性因素进行多变量分析,构建列线图(图4-E)。为了进一步探讨KIF4A的预后价值,我们对临床亚组进行了生存分析。根据KIF4A表达的中位数,并以此选择“高KIF4A”组和“低KIF4A”组,采用Kaplan-Meier生存分析和log-rank检验提示两组患者的生存(OS、DSS、PFI)差异。根据KM图,KIF4A mRNA表达高的患者的存活时间明显低于KIF4A mRNA低表达组(OS,P=0.007,图4-A;DSS,P=0.008,图4-B;PFI,P=0.044,图4-C)。此外,我们还分析了KIF4A在状态(肿瘤或正常)中的预测价值,ROC曲线结果显示,KIF4A具有很好的预测性能(AUC:0.983,图4-D)。同时根据时间变化评估KIF4A预测肺腺癌的预后敏感度和特异度,结果显示ROC曲线1、3、5年的 OS 的曲线下面积 (area under curve,AUC) 分别为 0.619、 0.605、0.601 (图4-F),提示 KIF4A 预测肺腺癌患者预后的敏感度和特异度较高。因此,KIF4A可能成为肺腺癌患者预后的一个潜在生物标志物。
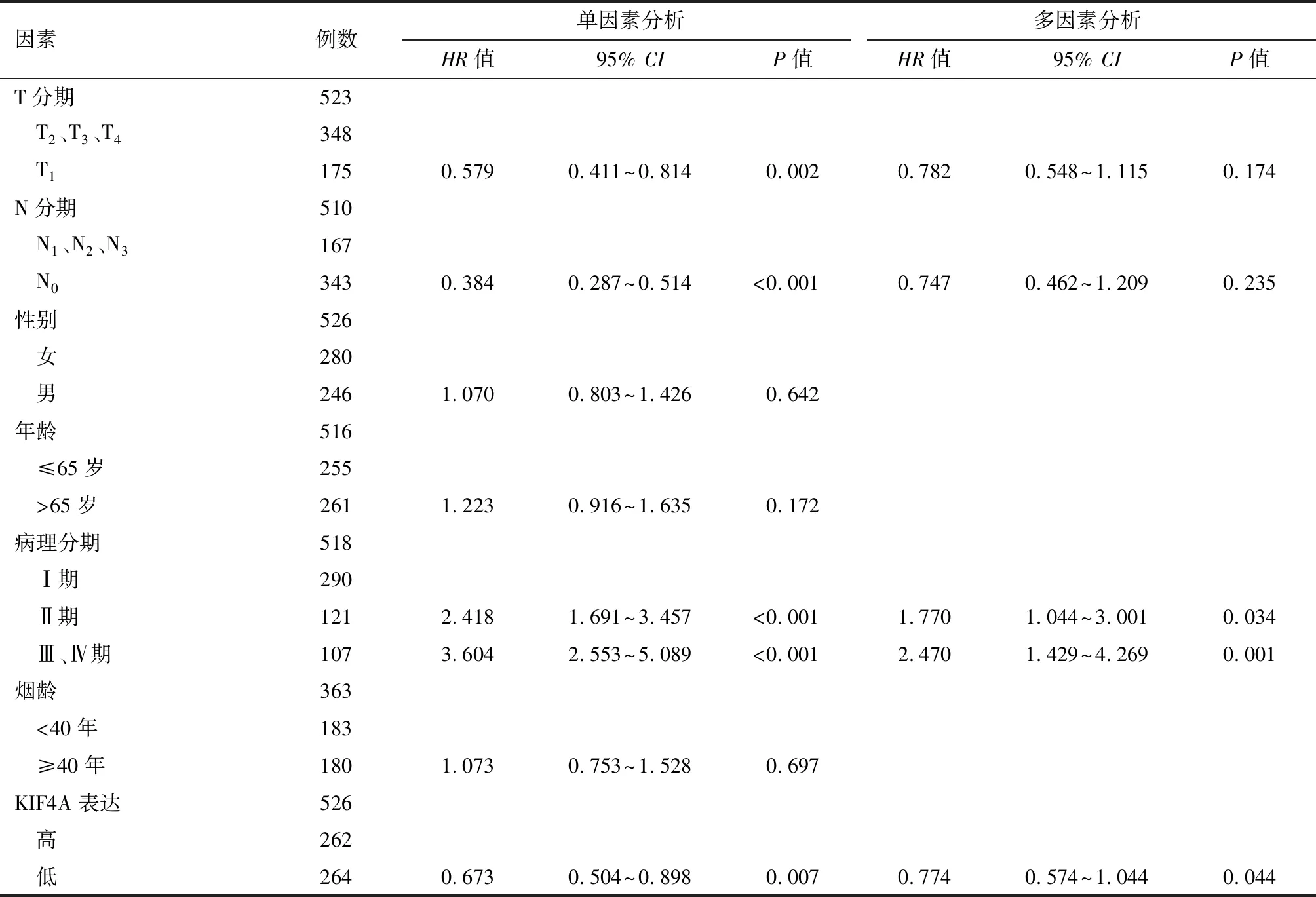
表2 肺腺癌预后因素的单因素和多因素Cox分析
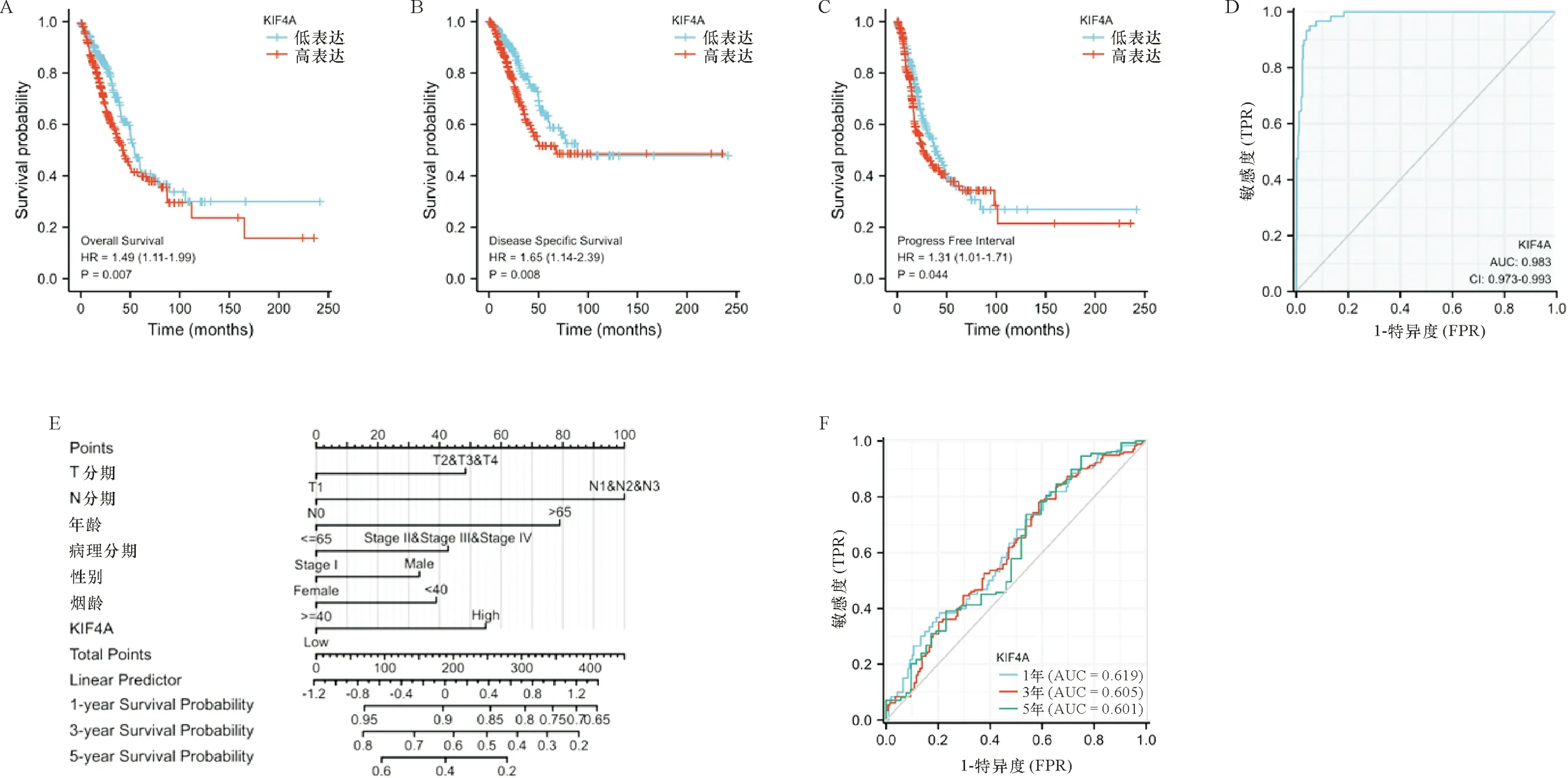
注:Kaplan-Meier生存分析(A:OS;B:DSS;C:PFI);D:状态(肿瘤或正常)的ROC曲线分析;E:列线图;F:时间变化的ROC曲线分析
2.4 KIF4A与肺腺癌免疫浸润的关系 免疫细胞浸润是肺腺癌患者生存的独立预测因素。因此,我们通过R语言包中的ssGSEA算法和Spearman′s来研究KIF4A表达水平与24种免疫细胞之间的潜在联系。结果显示,除了Th1细胞、Tcm细胞、Cytotoxic细胞、Neutrophils细胞和Tem细胞外,与其他细胞具有显著相关性(图5-A)。进一步根据KIF4A的中位表达值将所有肺腺癌患者分为高表达组和低表达组,结果显示除Th1细胞、Tem细胞、Neutrophils细胞、Treg细胞、T细胞、B细胞、Cytotoxic细胞、Tcm细胞、NK CD56dim细胞外,其余细胞组间差异均显著,P<0.05 (图5-B~D)。此外,ESTIMATE分析显示,低KIF4A组比高KIF4A组有更高的免疫和基质评分(图5-E)。
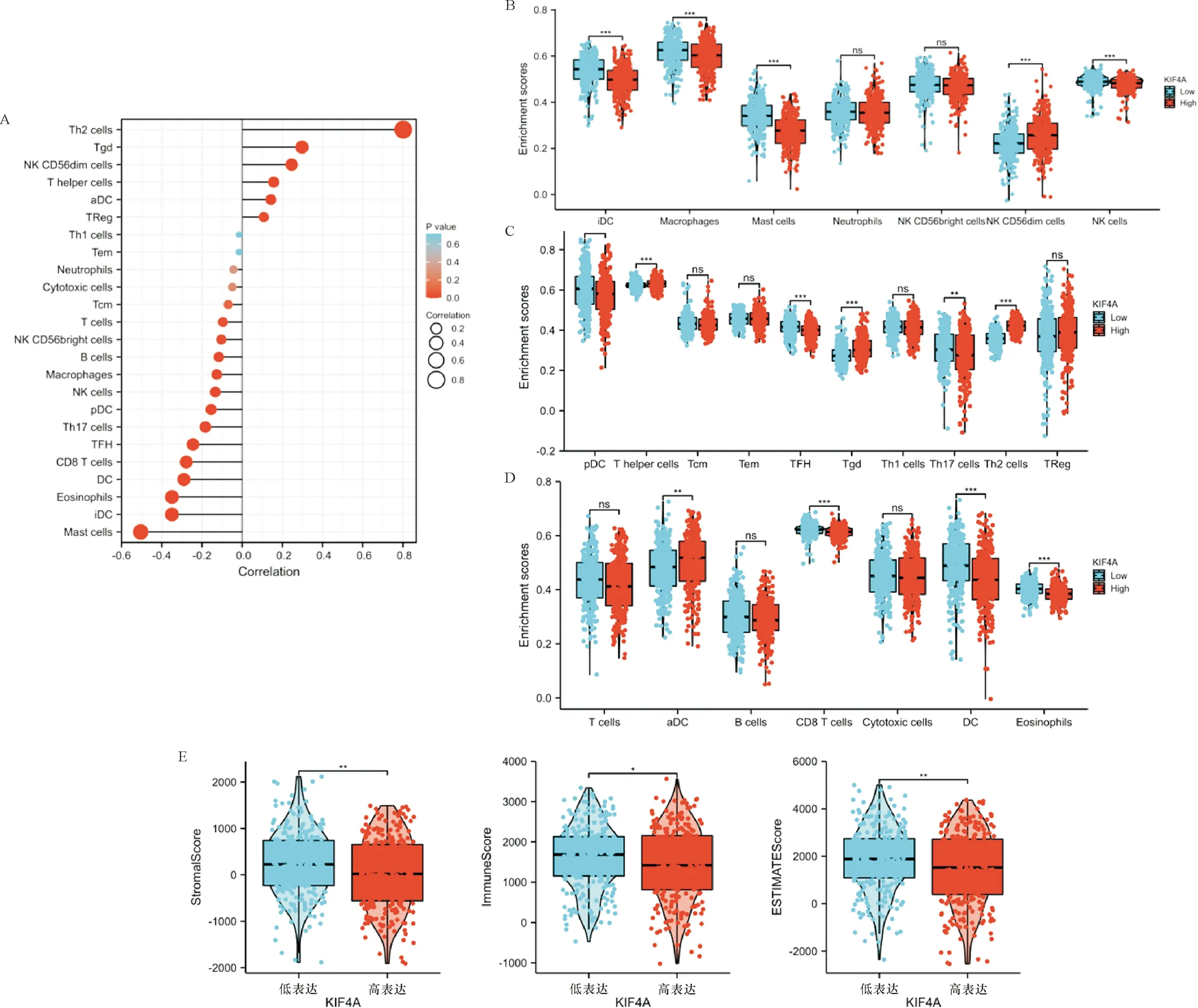
注:A:对24个免疫细胞和KIF4A表达进行Spearman分析;B~D:KIF4A不同表达与24个免疫细胞的差异表达分析;E:比较基于ESTIMATE工具的基质评分、免疫评分和ESTIMATE评分。*P<0.05,**P<0.01,***P<0.001, ns P>0.05
3 讨论
近年来,随着高通量测序和生物信息学的发展,形成了一种新的研究模式[14]。科研人员根据自己感兴趣的领域对相关的测序数据进行分类和下载[15]。同时,研究人员进一步整合和比较不同实验室的类似实验数据,挖掘出潜在的有用数据。
肺腺癌是一种恶性程度高、预后差的肺癌,其特征是发生胸部、肝脏、骨骼甚至颅内转移的可能性增加[16]。目前,大多数肺腺癌患者被诊断为晚期,由于存在远处转移,无法进行手术治疗,尽管放化疗可以改善症状,但不良反应是显著的[17]。因此,有必要在早期发现更准确的生物标志物并监测疾病进展,高通量基因测序和生物信息学可能为肺腺癌发病机制的研究提供新的途径。在本研究中,我们分析了KIF4A在肺腺癌中的表达及其预后价值以及KIF4A的表达与肿瘤浸润免疫细胞的关系,试图探索KIF4A促作为分子生物标志物的可行性。
根据之前的研究,KIF4A参与了多种细胞过程,如细胞中的运输功能和细胞分裂功能[18]。越来越多的证据表明,KIF4A是多种恶性肿瘤的致癌基因。例如,KIF4A可以诱导p21介导的细胞周期进程,从而促进结直肠癌细胞的增殖[19]。在肝细胞癌中,KIF4A通过促进肿瘤细胞的增殖和侵袭发挥致癌作用[20]。此外,KIF4A在前列腺癌中表达上调,与临床预后不良相关[21]。在本研究中,我们分析了KIF4A在泛癌中的表达情况,发现KIF4A mRNA的表达水平在大多数癌症类型中上调,通过免疫组织化学法检测发现与相应的癌旁正常组织比较,肺腺癌组织中KIF4A蛋白的表达水平显著升高,进一步验证了KIF4A对肺腺癌发生、发展过程中的致癌作用,与多数研究研究结果一致。
本研究采用logistic回归分析方法探讨KIF4A表达水平与肺腺癌临床病理特征的关系,发现KIF4A表达与T分期、N分期、年龄、病理分期、性别、烟龄显著相关。此外,单因素Cox分析显示T分期、N期、病理分期和KIF4A表达与肺腺癌患者的OS相关。在多变量Cox分析中,我们发现病理分期和KIF4A表达是影响肺腺癌患者预后的独立危险因素。并通过结合显著性因素进行多变量分析,构建列线图有助于更加直观地了解 KIF4A 表达水平在肺腺癌预后预测方面的重要性。同时通过分析KIF4A 高表达和低表达患者的生存预后,结果显示 KIF4A 高表达组患者的OS、DSS、PFI的生存时间短于低表达组患者。Taniwaki等[22]研究表明,KIF4A 是影响非小细胞肺癌患者预后的独立危险因素。Song等[13]研究发现,KIF4A高表达患者在LUAD中的生存周期较低表达患者显著降低,本研究结果与其一致。上述研究结果和ROC曲线分析表明,KIF4A 高表达提示肺腺癌患者预后差,有可能成为肺腺癌患者预后预测的潜在分子标志物。
肿瘤微环境(tumor microenvironment, TME)由多种类型的免疫细胞组成,在肿瘤进展、转移和治疗耐药性中发挥重要作用[23]。值得注意的是,现有数据表明,一些驱动蛋白家族成员,如KIF18A和KIF20A,已有研究报道表明参与调节肿瘤微环境中的免疫浸润[24],而关于KIF4A在免疫浸润方面的作用尚不完全清楚。肿瘤浸润免疫细胞的组成对肿瘤微环境和肿瘤的行为有重要影响。先天免疫细胞包括NK细胞、肥大细胞、中性粒细胞、巨噬细胞和DC细胞,在抑制和监测肿瘤中起着关键作用,适应性免疫细胞包括B细胞、细胞毒性T细胞、T辅助细胞和T记忆细胞,对抗癌免疫治疗很重要[25]。在本研究中,我们分析了KIF4A的表达是否与肺腺癌的免疫浸润水平有关,研究结果显示,KIF4A表达与来自先天和适应性免疫系统的6个免疫效应细胞的肿瘤浸润呈正相关,13个免疫效应细胞的肿瘤浸润呈负相关。这些结果提示,肺腺癌微环境中KIF4A的高表达可能伴随免疫监测降低,发生免疫逃逸,从而促进癌症进展。
综上所述,KIF4A在肺腺癌组织中高表达,与肺腺癌患者不良临床特征和预后显著相关,可能与肿瘤免疫微环境中免疫细胞浸润水平与肿瘤免疫逃逸存在一定相关性。因此,KIF4A可作为肺腺癌患者预后的生物学标记物,为肺腺癌的预后评估及治疗策略提供了一定的依据。
利益相关声明:所有作者声明无利益冲突。
作者贡献说明:杨文静、张园:确定选题、设计实验、实施研究、论文撰写;刘岩、朱萌萌、阿迪拉·艾沙:数据采集、数据分析、统计学处理;张园:论文审核、项目经费资助。
